2-3-3手性无机含氧酸分子的酸性
- 格式:ppt
- 大小:1.31 MB
- 文档页数:50

第2课时溶解性、手性、无机含氧酸分子的酸性学业要求素养对接1.知道物质的溶解性与分子结构的关系,了解“相似相溶”规律。
2.结合实例初步认识分子的手性对其性质的影响。
3.会判断常见无机含氧酸酸性强弱。
微观探析:键的极性和分子的极性。
模型认知:运用“相似相溶”规律判断物质的溶解性、运用无机含氧酸酸性强弱理论判断无机含氧酸酸性的强弱。
[知识梳理]一、溶解性1.相似相溶规律非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
如蔗糖和氨易溶于水,难溶于四氯化碳。
萘和碘易溶于四氯化碳,难溶于水。
2.影响物质溶解性的因素(1)外界因素:主要有温度、压强等。
(2)氢键:溶剂和溶质之间的氢键作用力越大,溶解性越好(填“好”或“差”)。
(3)分子结构的相似性:溶质和溶剂的分子结构相似程度越大,其溶解性越大。
如乙醇与水互溶,而戊醇在水中的溶解度明显较小。
(4)溶质是否与水反应:溶质与水发生反应,溶质的溶解度会增大。
如SO2与水反应生成的H2SO3可溶于水,故SO2的溶解度增大。
【自主思考】1.有机溶剂都是非极性溶剂吗?提示有机溶剂大多数是非极性溶剂,如CCl4、C6H6等,但也有少数的极性溶剂,如酒精。
二、手性1.手性异构体具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。
2.手性分子有手性异构体的分子叫做手性分子。
如乳酸()分子。
三、无机含氧酸分子的酸性1.对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。
2.含氧酸的通式可写成(HO)m RO n,若成酸元素R相同,则n值越大,酸性越强。
【自主思考】2.强酸的水溶液酸性一定比弱酸的水溶液酸性强吗?提示不一定,如很稀的稀硫酸的酸性没有饱和亚硫酸溶液的酸性强,溶液的酸性强弱除与酸的强弱有关外,还与酸溶液浓度大小有关。
[自我检测]1.判断正误,正确的打“√”;错误的打“×”。
(1)卤化氢易溶于水,不易溶于四氯化碳。





无机含氧酸的酸性与分子结构已知元素有不同化合价的多种含氧酸,从理论上讲,几乎没有什么指导性原理能帮助我们理解这些含氧酸的相对强度。
但是,如果把所有的含氧酸用通式(HO)mXOn来表示,则很快就可以看到一些规律性,式中m和n取决于中心原子的化合价。
例如,氯的含氧酸,即HClO、HClO2 、HClO3 、HClO4可以表示為(OH)Cl、(OH)ClO、(OH)ClO2、(OH)ClO3。
在这个系列中,m 是常数,n从0增加到3,这反映了氯的化合价从+1增加到+7。
当n值从0增加到3时,含氧酸酸性逐渐变强。
在考虑这些含氧酸的酸强度时,OH基团的数目也有一定的影响,但在酸性的强弱方面不起决定性的作用。
含氧酸电离时形成的阴离子的相对稳定性也是影响含氧酸的酸性的重要因素。
含氧酸所形成阴离子上的电荷可以分散到这个非羟基的氧原子上。
因此,非羟基氧原子的数目越大(n值越大),电荷越容易分散。
根据上述理论和已知磷酸(H3PO4)、亚磷酸(H3PO3)均为中强酸,亚砷酸(H3AsO3)是一个极弱酸。
试写出H3PO3、H3PO4、H3AsO3的结构式________、________、________;并指出它们各是几元酸________、________、________。
解析:这道概念、理论、元素综合试题的特点是:理论是大纲和教材里没有的,是试题题干中提供的,要求考生通过自学理解给出的理论知识;亚磷酸、亚砷酸的结构和性质,对于考生而言是全新的。
对于本题而言,理解含氧酸的有关规律至关重要。
写出HC1O、H2SO3、H2SO4、HCIO4的结构式有助于理解和运用理论。
HC1O的结构式为H——O——Cl,其分子中有一个——OH,是一元酸,非羟基氧原子数是0,HC1O是极弱酸;H2SO3的结构简式为,在H2SO3分子中有2个——OH,所以H2SO3是二元酸,H2SO3分子中有一个非羟基氧原子,H2SO3是一个中强酸;H2SO4的结构式为:,在H2SO4分子中有2个——OH,所以,是二元酸。

无机含氧酸的酸性及氧化性的比较与影响因素1 无机含氧酸的酸性无机含氧酸可以的分子式为HmROn,其通式可以写成Hl-Rm--〔O-H〕n,〔其中l,m可以为0,n≥0〕,也可写成ROm-nOHn,其中R称为成酸元素,.无机含氧酸在水溶液中的酸强度取决于酸分子中羟基-O-H的电离程度,也可以用Pka值来衡量。
酸分子羟基中的质子在电离过程中脱离氧原子,转移到水分子中的孤对电子对上,其转移的难易程度取决于成酸元素R吸引羟基氧原子电子的能力。
如果成酸无素R的电负性越大,R周围的非羟基氧原子数目越多,则其酸性越强。
原因是成酸元素R的电负性越大,则其偏移O的电子越少,从而减小了O原子周围的电子密度增大的趋势,使得其对质子的吸引减弱,有利于质子的转移;非羟基氧原子越多,则分子周围越易形成离域π键,这种键将成酸R原子及O原子包裹在其中,一方面增强了羟基-O-H键的极性,有利于质子的转移,其次使得整个酸基团周围的空间减小,阻碍了质子与O原子上孤对电子的结合,从而使得酸性增强。
含氧酸的酸性一般存在如下规律[1]:(1) 同一成酸元素若能形成几种不同氧化态的含氧酸,其酸性依氧化数递增而递增;如HClO4>HClO3>HClO2>HClO〔原因:从HClO 到HClO4非羟基氧原子逐渐增多,羟基-O-H键的极性增强,质子转移程度增强,故酸性增强〕(2) 在同一主族中,处于相同氧化态的成酸元素,其含氧酸的酸性随原子序数递增,自上而下减弱。
如H ClO>HBrO>HIO,HClO2>HBrO2>HIO2、HClO3>HBrO3>键HIO3、HClO4>HBrO4>HIO4〔原因:同主族元素自上而下,成酸元素的电负性逐渐减小,原子半径增大,吸引羟基氧原子的能力依次减小,羟基-O-H键的极性依次减小,所以酸性依次减弱。
〕(3) 在同一周期中,处于最高氧化态的成酸元素,其含氧酸的酸性随原子序数递增,自左至右增强。
如HClO4>H2SO4>H3PO4〔原因:同一周期中,从左至右元素的非金属性逐渐增强,成酸元素的电负性逐渐增大,吸引电子对的能力逐渐减小,电子偏向成酸元素R一方的程度增大,含氧酸分子中的氢原子的极化程度增大,所以酸性增强.〕查阅相关资料可知此类酸的酸性强弱可以有鲍林规则来初步判断,具体规则如下:鲍林规则[2]:规则Ⅰ:多元酸的逐级电离常数Ka1、Ka2、Ka3…其数值之比为1∶1×10-5∶1×10-10…如:H3PO4 Ka1=7.6×10-3 Ka2=6.3×10-8 Ka3= 4.4×10-13在P区元素中,其它含氧酸如H2SO3,H2CO3,H3AsO4等均符合规则Ⅰ,其它如H5IO6、H6TeO6、H2SiO3不符合规则Ⅰ。
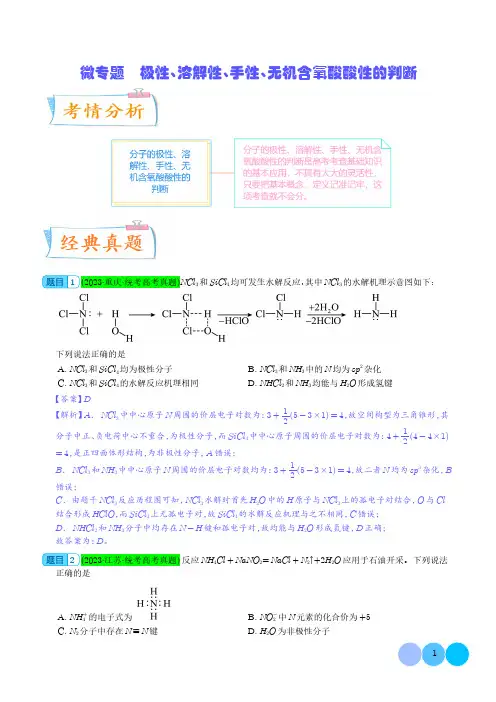
微专题 极性、溶解性、手性、无机含氧酸酸性的判断1(2023·重庆·统考高考真题)NCl 3和SiCl 4均可发生水解反应,其中NCl 3的水解机理示意图如下:下列说法正确的是A.NCl 3和SiCl 4均为极性分子B.NCl 3和NH 3中的N 均为sp 2杂化C.NCl 3和SiCl 4的水解反应机理相同D.NHCl 2和NH 3均能与H 2O 形成氢键【答案】D【解析】A .NCl 3中中心原子N 周围的价层电子对数为:3+12(5-3×1)=4,故空间构型为三角锥形,其分子中正、负电荷中心不重合,为极性分子,而SiCl 4中中心原子周围的价层电子对数为:4+12(4-4×1)=4,是正四面体形结构,为非极性分子,A 错误;B .NCl 3和NH 3中中心原子N 周围的价层电子对数均为:3+12(5-3×1)=4,故二者N 均为sp 3杂化,B错误;C .由题干NCl 3反应历程图可知,NCl 3水解时首先H 2O 中的H 原子与NCl 3上的孤电子对结合,O 与Cl 结合形成HClO ,而SiCl 4上无孤电子对,故SiCl 4的水解反应机理与之不相同,C 错误;D .NHCl 2和NH 3分子中均存在N -H 键和孤电子对,故均能与H 2O 形成氢键,D 正确;故答案为:D 。
2(2023·江苏·统考高考真题)反应NH 4Cl +NaNO 2=NaCl +N 2↑+2H 2O 应用于石油开采。
下列说法正确的是A.NH +4的电子式为B.NO -2中N 元素的化合价为+5C.N2分子中存在N ≡N 键D.H 2O 为非极性分子【答案】C【解析】A.NH+4的电子式为 ,A错误;B.NO-2中N元素的化合价为+3,B错误;C.N2分子中存在N≡N键,C正确;D.H2O为V形分子,分子中正负电荷中心未重合,为极性分子,D错误。

分子的性质【考点归纳】1.分子间作用力(1)定义:物质分子之间普遍存在的相互作用力,称为分子间作用力。
分子间作用力最常见的是范德华力和氢键,氢键不属于化学键,其强度比化学键弱得多,但它比范德华力稍强。
(2)范德华力:范德华力主要影响物质的熔点、沸点、硬度等物理性质。
范德华力越强,物质的熔点、沸点越高,硬度越大。
一般来说组成和结构相似的物质,随着相对分子质量的增加,范德华力逐渐增大,如F2<Cl2<Br2<I2,CF4<CCl4<CBr4;同分异构体中,支链越多,范德华力越小;相对分子质量相近的分子,极性越大,范德华力越大。
(3)氢键:已经与电负性很强的原子形成共价键的氢原子(该氢原子几乎为裸露的质子)与另一个分子中电负性很强的原子之间的作用力,称为氢键。
常用A—H…B表示氢键,A、B的电负性越大,B原子的半径越小,氢键的键能越大。
氢键具有一定的方向性和饱和性,氢键包括分子内氢键和分子间氢键两种,分子间氢键的作用,形成的“缔合分子”增大了分子间作用力,使得物质的熔沸点升高(如水)、溶解度增大(如氨)、电离度降低(如氢氟酸为弱酸)等,由于分子内的氢键作用,形成具有“环状结构”的物质,减小了分子间的作用力,使物质的熔沸点降低、溶解度减小等。
[易错提醒]“几乎裸露的质子(H)”与“氮、氧、氟”原子之间才可能形成氢键,其他原子与氢原子不能形成氢键,例如乙醇(CH3CH2OH)甲基(—CH3)上的氢原子与水中的氧原子之间不能形成氢键。
有氢键的分子间也有范德华力,但有范德华力的分子间不一定有氢键;一个氢原子只能形成一个氢键,这就是氢键的饱和性;氢键主要影响物质的物理性质。
2.分子极性的判断(1)根据键的类型及分子的立体构型判断,非极性分子、极性分子的判断,首先看键是否有极性,然后再看各键的空间排列状况。
键无极性,分子必无极性(O3除外);键有极性,各键空间排列均匀,使键的极性相互抵消,分子无极性;键有极性,各键空间排列不均匀,不能使键的极性相互抵消,分子有极性。
![高中化学优质教案 溶解性手性无机含氧酸分子的酸性 教学设计[选修]1](https://uimg.taocdn.com/3199407ef12d2af90242e6dd.webp)

无机含氧酸得酸性及氧化性得比较1无机含氧酸得酸性无机含氧酸可以得分子式为HmROn,其通式可以写成Hl-Rm--〔O—H〕n,〔其中l,m可以为0,n≥0〕,也可写成ROm—nOHn,其中R称为成酸元素,、无机含氧酸在水溶液中得酸强度取决于酸分子中羟基—O-H得电离程度,也可以用Pka值来衡量。
酸分子羟基中得质子在电离过程中脱离氧原子,转移到水分子中得孤对电子对上,其转移得难易程度取决于成酸元素R吸引羟基氧原子电子得能力。
如果成酸无素R得电负性越大,R周围得非羟基氧原子数目越多,则其酸性越强。
原因就是成酸元素R得电负性越大,则其偏移O得电子越少,从而减小了O原子周围得电子密度增大得趋势,使得其对质子得吸引减弱,有利于质子得转移;非羟基氧原子越多,则分子周围越易形成离域π键,这种键将成酸R原子及O原子包裹在其中,一方面增强了羟基—O—H键得极性,有利于质子得转移,其次使得整个酸基团周围得空间减小,阻碍了质子与O原子上孤对电子得结合,从而使得酸性增强。
含氧酸得酸性一般存在如下规律[1]:(1)同一成酸元素若能形成几种不同氧化态得含氧酸,其酸性依氧化数递增而递增;如HC lO4>HClO3>HClO2>HClO〔原因:从HClO到HClO4非羟基氧原子逐渐增多,羟基-O-H键得极性增强,质子转移程度增强,故酸性增强〕(2)在同一主族中,处于相同氧化态得成酸元素,其含氧酸得酸性随原子序数递增,自上而下减弱。
如H ClO〉HBrO>HIO,HClO2>HBrO2>HIO2、HClO3〉HBrO3>键HIO3、HClO4>HBrO4>HIO4〔原因:同主族元素自上而下,成酸元素得电负性逐渐减小,原子半径增大,吸引羟基氧原子得能力依次减小,羟基—O—H键得极性依次减小,所以酸性依次减弱。
〕ﻫ(3) 在同一周期中,处于最高氧化态得成酸元素,其含氧酸得酸性随原子序数递增,自左至右增强。
第二课时溶解性手性无机含氧酸分子的酸性课时演练·促提升A组1.下列现象不能用“相似相溶”规律解释的是( )A.氯化氢易溶于水B.氯气易溶于NaOH溶液C.碘易溶于CCl4D.碘难溶于水解析:因为HCl为极性分子,水分子也为极性分子,故根据“相似相溶”,氯化氢易溶于水,A项正确;碘分子为非极性分子,易溶于非极性溶剂,如苯、CCl4等,而难溶于水等极性溶剂,故C、D 两项均正确;氯气易溶于NaOH溶液,因二者发生了化学反应:Cl2+2NaOH NaCl+NaClO+H2O,而不单纯是溶解过程,故选B。
答案:B2.微波炉加热时,电炉内的微波场以极高的频率改变电场的方向,使水分子迅速摆动而产生热效应。
在高频改变方向的电场中水分子会迅速摆动的原因是( )1A.水分子具有极性共价键B.水分子中有共用电子对C.水由氢、氧两种元素组成D.水分子是极性分子解析:在外加电场的作用下,水分子会发生迅速摆动的原因是水是极性分子,这样才能受到外加电场的影响,选项D符合题意。
答案:D3.下列说法中不正确的是( )A.互为手性异构体的分子互为镜像B.利用手性催化剂合成可主要得到一种手性分子C.互为手性异构体的分子组成相同D.互为手性异构体的分子性质相同解析:互为手性异构体的分子的性质是有差别的。
答案:D4.下列叙述中正确的是( )A.能电离出H+的化合物除水外都是酸,分子中含有几个氢原子它就是几元酸2B.无机含氧酸分子中含有几个羟基,它就属于几元酸C.同一元素的含氧酸,该元素的化合价越高,其酸性越强,氧化性也越强D.H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸解析:由NaHSO4、CH3COOH、H3BO3等示例可判断A、B项错误;由HClO的酸性很弱而氧化性很强可判断C项错误;D项中H3PO4和H2CO3的非羟基氧原子数均为1,但H2CO3的酸性比H3PO4弱很多,这是因为溶于水的CO2只有很少的一部分(约几百分之一)与水结合成碳酸的缘故。
无机含氧酸酸性的判断【方法和规律】1、含氧酸的结构:无机含氧酸分子之所以显示酸性,是因为其分子中含有—OH,而—OH 上的O—H 键在水分子的作用下发生断裂而能够解离出H+而显示一定的酸性。
在含氧酸中,氢离子是和酸根上的一个氧相连接的2、比较无机含氧酸的酸性强弱规律(1)对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强如:HClO<HClO2<HClO3<HClO4;HNO2<HNO3;H2SO3<H2SO4解释:无机含氧酸的通式可写成(HO)m RO n,如果成酸元素R 相同,R 的正电性越高,导致R—O—H 中O 的电子向R 偏移的程度越大,在水分子的作用下越容易电离出H+,酸性越强(2)含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数增大而增大,即:(HO)m RO n中,n值越大,酸性越强含氧酸酸性强弱与非羟基氧原子数的关系(3)①同一主族,自上而下,非金属元素最高价含氧酸酸性逐渐减弱②同一周期,从左向右,非金属元素最高价含氧酸酸性逐渐增强1、N 元素可以形成两种含氧酸HNO2和HNO3,酸性是HNO3________HNO2(填“强于”或“弱于”),原因是_______________________________________________________________________________________________ ____________________________________________________________________________________________ 2、H3AsO4和H3AsO3是砷的两种含氧酸,请根据物质结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因____________________________________________________________________________________________ ____________________________________________________________________________________________ 3、S 有两种常见的含氧酸,较高价的酸性比较低价的酸性________,理由是________________________________________________________________________________________________________________________________ 4、锰的含氧酸有HMnO4(高锰酸)、H2MnO3(亚锰酸),高锰酸的酸性比亚锰酸强,理由是___________________________________________________________________________________________________________________5、H2SeO3的K1和K2分别为2.7×10-3和 2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:①H2SeO3和H2SeO4溶液中第一步电离程度均大于第二步电离的原因_____________________________________________________________________________________________________________②H2SeO4比H2SeO3酸性强的原因____________________________________________________________________________________________________________________________________________6、NaBrO、NaBrO2、NaBrO3、NaBrO4四种钠盐中,Br 的杂化方式均为______杂化,阴离子空间构型为三角锥形的是______ (填化学式)。