化学必修二化学键
- 格式:ppt
- 大小:2.07 MB
- 文档页数:76

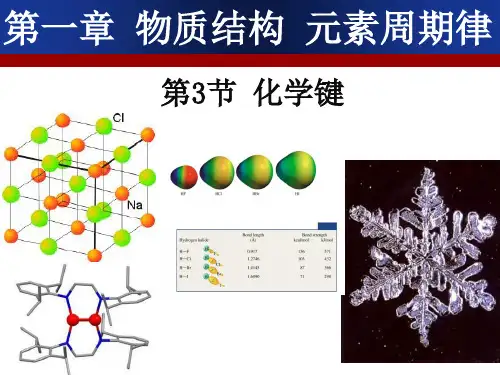




化学键水加热分解需1 000 ℃以上的高温,破坏O-H需463 kJ/mol。
加热使氢分子分成氢原子,即使2 000 ℃以上,分解率也不到1%,破坏H-H需436 kJ/mol。
所以,分子中原子之间存在相互作用。
此作用不仅存在于相邻的原子之间,而且也存在于分子内不直接相邻的原子之间。
一、化学键1、概念:化学键是指使离子或原子之间结合的作用。
或者说,相邻的原子或原子团强烈的相互作用叫化学键。
注意:不是所有的物质都是通过化学键结合而成。
惰性气体就不存在化学键。
2、分类:金属键、离子键、共价键。
3、意义:①解释绝大部分单质和化合物的形成:绝大部分单质和化合物都是离子或者原子通过化学键的作用形成的。
②解释化学变化的本质:化学变化的本质就是反应物化学键的断裂和生成物化学键的形成过程。
原子重新组合就是通过反应物原子间化学键的断裂,然后又重新形成新的化学键的过程。
二、离子键:带相反电荷离子间的相互作用称为离子键。
1、概念:使阴阳离子结合成化合物的静电作用,叫做离子键。
2、成键微粒:阴阳离子3、本质:静电作用4、成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
5、成键条件:活泼金属(IA IIA)与活泼非金属(VIA VIIA)之间的化合物。
6、结果:形成离子化合物。
离子化合物就是阴阳离子通过离子键而形成的化合物。
离子晶体就是阴阳离子通过离子键而形成的晶体。
化学键的表示方法——电子式:在元素符号周围用小黑点· (或×)来表示原子的最外层电子的式子。
1、原子的电子式:离子的电子式:(1)阳离子(直接用离子符号表示)(2)阴离子用电子式表示离子化合物的形成过程:氯化钠的形成过程可如下表示 [副板书] Na ×+→Na +[]1.下列数值表示有关元素的原子序数,各原子能以离子键相互结合成稳定的化合物的是( )A .10与19B .6与16C .11与17D .14与8 2.下列性质中,可以证明某化合物内一定存在离子键的是( )A .水溶液能导电B .由金属和非金属元素的原子组成C .熔融状态能导电D .可以溶于水3.某元素最高正价与最低负价的代数和为4,该元素的离子与跟其核外电子排布相同的离子形成的化合物是( )。

高中化学必修2化学键教案
教学内容:高中化学必修2- 化学键
教学目标:
1. 理解化学键的概念和作用;
2. 掌握共价键、离子键和金属键的特点和形成规律;
3. 能够运用化学键的相关知识解释物质的性质和变化。
教学步骤:
1.引入(5分钟)
介绍化学键的概念,让学生了解化学键在化学反应中的作用,并引起学生对化学键的探索
和思考。
2.授课(15分钟)
a. 共价键的特点和形成规律:共价键是由两个非金属原子之间的电子共享所形成的化学键,要求电负性相近的原子才能形成共价键。
b. 离子键的特点和形成规律:离子键是由金属与非金属原子之间的电子转移而形成的化学键,金属原子失去电子成为正离子,非金属原子获得电子成为负离子。
c. 金属键的特点和形成规律:金属键是由金属原子之间的电子海洋相互作用所形成的化学键,金属原子失去部分外层电子而形成正离子核,自由电子形成电子海洋。
3.示例分析(10分钟)
通过举例分析水分子的共价键、氯化钠的离子键和铜的金属键的形成规律,让学生更加深
入地理解不同类型的化学键。
4.练习与讨论(15分钟)
让学生参与练习题目,巩固所学知识,并讨论不同类型的化学键在解释物质性质和变化时
的应用。
5.总结与作业布置(5分钟)
总结本节课的内容,强调化学键在化学反应中的作用,布置相关课外阅读和习题作业。
教学反思:
通过本节课的教学,学生能够全面理解化学键的概念和作用,掌握不同类型化学键的特点和形成规律,并能够应用所学知识解释化学反应中的现象。
通过练习和讨论,学生也可以加深对化学键的理解。
在教学中要注重培养学生的分析和解决问题的能力,引导学生主动思考和探索。
第三节化学键一.离子键1.离子键:阴阳离子之间猛烈的相互作用叫做离子键。
相互作用:静电作用(包含吸引和排斥)注:(1)成键微粒:阴阳离子间(2)成键本质:阴、阳离子间的静性作用(3)成键缘由:电子得失(4)形成规律:活泼金属和活泼非金属化合时形成离子键离子化合物:像NaCl这种由离子构成的化合物叫做离子化合物。
(1)活泼金属与活泼非金属形成的化合物。
如NaCl、Na2O、K2S等(2)强碱:如NaOH、KOH、Ba(OH)2、Ca(OH)2等(3)大多数盐:如Na2CO3、BaSO4(4)铵盐:如NH4Cl小结:一般含金属元素的物质(化合物)+铵盐。
(一般规律)留意:(1)酸不是离子化合物。
(2)离子键只存在离子化合物中,离子化合物中确定含有离子键。
2、电子式电子式:在元素符号四周用小黑点(或×)来表示原子的最外层电子(价电子)的式子叫电子式。
用电子式表示离子化合物形成过程:(1)离子须标明电荷数;(2)相同的原子可以合并写,相同的离子要单个写;(3)阴离子要用方括号括起;(4)不能把“→”写成“=”;(5)用箭头标明电子转移方向(也可不标)。
二.共价键1.共价键:原子间通过共用电子对所形成的相互作用叫做共价键。
用电子式表示HCl的形成过程:注:(1)成键微粒:原子(2)成键实质:静电作用(3)成键缘由:共用电子对(4)形成规律:非金属元素形成的单质或化合物形成共价键2.共价化合物:以共用电子对形成分子的化合物叫做共价化合物。
化合物离子化合物共价化合物化合物中不是离子化合物就是共价化合物3.共价键的存在:非金属单质:H2、X2、N2等(稀有气体除外)共价化合物:H2O、CO2、SiO2、H2S等困难离子化合物:强碱、铵盐、含氧酸盐4.共价键的分类:非极性键:在同种元素..的原子间形成的共价键为非极性键。
共用电子对不发生偏移。
极性键:在不同种元素..的原子间形成的共价键为极性键。
共用电子对偏向吸引实力强的一方。
化学键____________________________________________________________________________________________________________________________________________________________________1.理解离子键、共价键的概念,能用电子式表示离子化合物和共价化合物的形成。
2.了解化学键的概念和化学反应的本质。
知识点一.化学键一.化学键:化合物中,使离子相结合或原子相结合的作用力。
1.离子键(1).概念:带有相反电荷的阴、阳离子之间的强烈的相互作用(2).成键粒子:阴、阳离子。
(3).成键实质:静电作用。
(4).形成条件:通常是活泼金属与活泼非金属元素的原子相结合。
(5).离子化合物:由离子键构成的化合物叫做离子化合物。
(6).常见的离子化合物:强碱、绝大多数盐、活泼金属的氧化物等。
2.共价键(1).概念:原子间通过共用电子对形成的相互作用。
(2).成键粒子:原子。
(3).成键实质:共用电子对。
(4).形成条件:通常是非金属元素的原子相结合。
二.电子式(1).概念:在元素符号周围用“·”或“×”来代表原子的最外层电子(价电子)的式子。
(2).电子式书写注意事项:①.原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。
②.阳离子的电子式:不要求画出离子最外层电子数,只要在元素、符号右上角标出“n+”电荷字样。
③.阴离子的电子式:不但要画出最外层电子数,而且还应用中括号“[ ]”括起来,并在右上角标出“n-”电荷字样。
(3).离子键的表示方法:①.用电子式表示离子化合物的形成过程Na2S:CaCl2:②.写出下列物质的电子式MgCl2:Na2O2:NaOH:NH4Cl:(4).共价键的表示方法①.用电子式表示共价化合物的形成过程CH4:CO2:②.写出下列物质的电子式Cl2:N2:H2O2:CO2:HClO:CCl4:③.写出下列物质的结构式形成共价键的每一对共用电子对用“-”表示,并且略去未成键的电子的式子。
第三节化学键(第1课时)一、化学键1. 概念:相邻..的相互作用称为化学键。
..的原子之间强烈2. 离子键化学键极性键共价键非极性键3. 化学反应的本质:旧化学键的断裂和新化学键形成过程。
二、离子键1. 钠在氯气中燃烧的现象:化学方程式:2. NaCl的形成3. 离子键(1)概念: 使形成化合物的叫做离子键①成键微粒②键的本质(吸引和排斥)③成键条件:活泼金属(或铵根离子)和活泼非金属(或含氧酸根离子)化合。
4. 离子化合物:由构成的化合物叫做离子化合物。
5. 存在及实例:强碱、大多数盐以及典型的金属氧化物如NaOH;NaCl、Na2CO3、NH4Cl;Na2O。
三、共价键1.HCl的形成2.共价键:(1)概念:原子间通过所形成的相互作用,叫做共价键。
①成键微粒: 非金属原子(相同或不相同)②键的本质: 原子间通过共用电子对产生的强烈作用(共用电子对与两核间的相互作用)(2)共价化合物:以形成分子的化合物叫做共价化合物3.存在及实例:大多数非金属单质、某些离子化合物、共价化合物。
如H2、Cl2;NaOH、NH4Cl、Na2O2;HCl、H2O、等。
四、电子式在元素符号周围用小黑点(或×)来表示原子的最外层电子的式子叫电子式。
1、原子H Na Mg Al N O Cl2、离子(1)简单阳离子= 离子符号①Na+②Mg2+(2)复杂阳离子①NH4+②H3O+(3)阴离子: “二标” ①Cl—②S2- ③OH—④O 22即标“[ ]”和“电荷数”3、化合物(1)离子化合物①NaCl ②MgO ③MgCl2 ④K2S ⑤Mg3N2‖阴阳离子电子式组合(每个离子单独写)⑥NaOH ⑦Mg (OH)2⑧Na2O2 ⑨NH4Cl(2)共价型分子①H2 ②Cl2 ③N2 ④HCl‖原子电子式组合⑤CH4 ⑥CO2⑦H2O⑧H2O2⑨NH3 ⑩CCl4 (11)HClO五、结构式用一根短线表示一对共用电子对的式子(其余电子省略)这样的式子叫结构式六、用电子式表示化合物形成过程1、离子化合物的形成过程2、共价分子的形成过程(1)NaCl (1)Cl2(2)MgCl2 (2) N2(3)K2S (3)HCl(4)H2SCO(5)2第三节化学键(第1课时)1.下列叙述中正确的是()A.化学键只存在于分子之间B.化学键只存在于离子之间C.化学键是相邻原子之间的强烈的相互作用D.化学键是相邻分子之间的强烈的相互作用2.下列说法正确的是()A. 离子键就是阴、阳离子间的静电引力B.所有金属元素与所有非金属元素间都能形成离子键C. 钠原子与氯原子结合成氯化钠后体系能量降低D.在离子化合物CaCl2中,两个氯离子间也存在离子键3.( 全国高考)关于化学键的叙述正确的是()A.离子化合物可以含有共价键B.共价化合物可能含离子键C.离子化合物中只含有离子键D.共价化合物中不含离子键4.( 07年广东卷)下列物质中含离子键的是()A.Cl2B.CO2C.NaCl D.CH45.( 10年海南卷) 下列原子序数所对应的元素组中,两者可形成离子键的是()A.1和17 B.12和9 C.14和6 D.15和86.下列物质中,属于共价化合物的是()A.氧化钙 B.氮气C.硫化钠D.硫化氢7.下列化合物中,只存在离子键的是A. NaOHB. CO2C. NaClD. HCl8.下列化合物分子中只有共价键的是()A.BaCl2 B. NaOH C. (NH4)2SO4 D. H2SO49.下列微粒中,既含有离子键又含有共价键的是()A.Ca(OH)2B.H2O2C.Na2O D.MgCl210.下列各组元素,两两组合形成的化合物既有以离子键相结合的,又有以共价键相结合的是()A. H、O、KB. Mg、K、ClC. C、H、OD. Mg、N、He11. 下列各组物质中,化学键类型都相同的是A. HCl与NaOHB. H2S与MgSC. H2O和CO2D. H2SO4和NaNO312. 下列物质的电子式书写正确的是( )13.(02年上海高考)下列分子的电子式书写正确的是( )A 氨B 四氯化碳C 氮D 二氧化碳14.下列物质的电子式书写正确的是( )A.NaCl B.H2S C.NaH D.NH4I15. (09江西)化学需要借助化学专用语言描述,下列有关化学用语正确的是()A.CO2的电子式B.Cl-的结构示意图C.N2的结构式D.质量数为40的钙原子2040Ca16.下列物质的电子式书写正确的是()A.Na2OB.H2S C.H2O2D.N217.离子化合物AB2的阴、阳离子的电子层结构相同,1molAB2中含有54mol电子,且有下列反应:①H2+B 2C;②B2+X Y+AB2+H2O;③Y+C AB2+Z,Z有漂白作用,根据上述条件回答下列问题:(1)写出下列物质的化学式:X ,Y ,Z ,AB2。
①共价键可存在于单质分子、共价化合物分子和离子化合物中。
②共价化合物中只有共价键,离子化合物中一定含有离子键。
如H2O(共价化合物)
H-O –O-H (由共价键形成),NaOH(离子化合物),(由共价键和离子键形成)。
③.单质分子中的化学键均为非极性键,化合物分子中可有非极键,离子化合物中
可存在极性键和非极性键。
如N N(N N叁键为非极键)H—O—O—H(H—O键为
极性键,O—O键为非极性键),Na+ O O2-Na (O—O键为非极性键,Na+与O2-间为离子键)
④非金属元素的原子间可形成离子化合物。
如:NH4Cl、NH4NO3、NH4HCO3等。
1、非极性共价键:由同种元素的原子间通过共用电子对形成的共价键,又称为非极性键。
存在于非金属单质中。
某些共价化合物分子中也有非极性键,如:H2O2中的O-O键,C2H6中的C-C键等。
少数离子化合物中也有非极性键,如:Na2O2中的O-O键,CaC2中的碳碳三键等。
2、极性共价键:不同种元素的原子形成分子时共用电子对偏向吸引电子能力强的原子而形成的共价键,又称为极性键。
所有的共价化合物分子中都存在极性键,离子化合物的原子团中也存在极性键。
化学必修二:化学键复习题在化学必修二的学习中,化学键是一个非常重要的概念。
它不仅是理解物质结构和性质的关键,也是进一步学习化学反应原理的基础。
下面,让我们通过一系列的复习题来巩固和深化对化学键的理解。
一、选择题1、下列物质中,只含有离子键的是()A HClB NaOHC NaClD H₂O答案:C解析:HCl 和H₂O 只含共价键;NaOH 中既有离子键又有共价键;NaCl 只含离子键。
2、下列关于化学键的叙述中,正确的是()A 离子化合物中一定含有离子键B 单质分子中均不存在化学键C 含有极性键的分子一定是极性分子D 含有共价键的化合物一定是共价化合物答案:A解析:离子化合物一定含有离子键,A 正确;单质分子如 H₂、O₂等存在共价键,B 错误;含有极性键的分子不一定是极性分子,如CO₂,C 错误;含有共价键的化合物不一定是共价化合物,如NaOH,D 错误。
3、下列物质的变化过程中,需克服共价键的是()A 碘升华B 氯化钠熔化C 氯化氢溶于水D 干冰升华答案:C解析:碘升华克服的是分子间作用力;氯化钠熔化克服的是离子键;氯化氢溶于水,在水分子的作用下,共价键断裂;干冰升华克服的是分子间作用力。
4、下列物质中,既含有离子键又含有非极性共价键的是()A Na₂O₂B KOHC CaCl₂D CO₂答案:A解析:Na₂O₂中钠离子和过氧根离子之间是离子键,过氧根离子内部是非极性共价键;KOH 中钾离子和氢氧根离子之间是离子键,氢氧根离子内部是极性共价键;CaCl₂只含离子键;CO₂只含共价键。
二、填空题1、用电子式表示下列物质的形成过程:(1)NaCl:____________________(2)H₂O:____________________2、写出下列物质的电子式:(1)MgCl₂:____________________(2)N₂:____________________3、写出下列物质的结构式:(1)CO₂:____________________(2)H₂O₂:____________________三、简答题1、请简述离子键和共价键的本质区别。