熵与熵增原理
- 格式:doc
- 大小:232.00 KB
- 文档页数:4

第5节初_识_熵一、对熵的认识1.方向性不可逆过程总是系统从有差异的状态向无差异的均匀状态过渡,从有规则向无规则过渡,从集中向分散过渡。
2.有序、无序把系统的有差异的不均匀、有规则、集中说成有序,把系统的无差异的均匀、无规则、分散说成无序。
3.熵代表系统的无序性程度。
无序性大,熵大;无序性小,熵小。
二、熵增原理1.内容孤立系统的熵总是增加的,或者孤立系统的熵总不减少。
2.公式(1)ΔS表示过程中熵的变化,则熵增原理可以表示为:ΔS≥0。
(2)ΔS=0表示系统处于平衡态,ΔS>0表示孤立系统的任何一个过程熵总是增加的。
3.适用条件孤立系统。
1.判断:(1)热传递的后果总是使得系统的温度分布趋于均匀化。
()(2)同一种物质在不同的状态下熵值一样。
()(3)孤立系统中的气体与外界无能量交换。
()答案:(1)√(2)×(3)√2.思考:刚买的扑克牌按花色及大小规则排列,我们打牌时要洗牌,让其混乱,哪种情况熵更小一些?提示:新牌熵小些,因为按花色及大小有序、有规则排列,故新牌的熵更小些。
1.有序与无序所谓有序,是指事物内部的要素或事物之间有规则的联系和运动转化;无序是指事物内部各种要素或事物之间混乱而无规则的组合和运动变化。
2.扩散、热传递的微观解释(1)扩散:扩散过程中气体分子完全打破了原来的有序分布,变得较为无序。
即从微观角度看,扩散现象实质上是系统向无序程度增加的方向进行的过程。
(2)热传递:高温物体中的分子平均动能大,低温物体中分子平均动能小。
两物体接触前,这些分子有序地按平均动能大小分居两处。
让两物体接触经一段时间后,高温物体温度降低,分子平均动能减小,低温物体的温度升高,分子平均动能增大,最后达到同一温度。
两物体的分子平均动能也变成一个中间值,运动较快的分子不再同运动较慢的分子隔开,分子的运动变得较为无序。
可见,热传递实质上也是向无序程度增加的方向进行的过程。
3.热力学第二定律的微观本质一切不可逆过程总是沿着大量分子热运动无序程度增大的方向进行。


热力学中的熵与熵增的定义与应用热力学是研究能量转化和物质变化的自然科学分支,而熵则是热力学中的一个重要概念。
它也被称为系统的混乱程度或无序程度,是描述系统能量状态分布均匀程度的物理量。
在热力学中,熵的增加被视为一个自然趋势,它与能量转化、化学反应、流体力学等众多领域有着密切的联系与应用。
首先,我们来了解一下熵的定义。
熵是一个统计力学概念,对于一个封闭系统来说,熵的定义可以用数学表达式ΔS = Q/T来表示。
其中,ΔS表示熵的增量,Q 表示系统吸收或放出的热量,T表示温度。
这个公式表明,熵的增加与系统吸热和温度有关,同时也与能量的转化有着密切的联系。
熵的增加代表了一个系统趋于无序和混乱的过程。
物理学家卡罗·鲍尔兹曼将熵定义为“一个系统的无序状态的数量”,这个定义清晰地描述了熵的本质。
我们可以将一个封闭系统看作是由微观粒子组成的,而这些粒子的状态是随机的,它们之间的相互作用会导致系统的熵增加。
熵增在热力学中有着广泛的应用。
首先,熵增原理是热力学第二定律的重要内容之一。
它指出一个孤立系统的熵在一个可逆过程中不会减少,而在一个不可逆过程中则会增加。
这个原理使得我们能够判断一个过程是否可逆,从而确定系统的熵变化。
例如,在一个可逆过程中,熵的增加为零,而在一个不可逆过程中,熵的增加则大于零。
其次,熵增原理也与化学反应有着密切的联系。
化学反应也是系统能量转化的一种方式,而熵的增加则是在化学反应中不可避免的。
在化学反应中,物质的自由度会增加,粒子之间的相互作用会发生改变,导致系统的熵增加。
例如,在一个放热反应中,系统释放的热量会增加系统的熵,而在一个吸热反应中,系统吸收的热量则会减少系统的熵。
此外,熵增也在流体力学中有着重要的应用。
在流体力学中,熵被广泛应用于研究流体的不可逆性和湍流运动。
湍流运动是流体中的一种混乱和无序的运动形式,它对应着系统的熵增加。
熵增原理使得我们能够理解湍流运动的本质以及流体中能量转化的规律。

热力学中的熵增原理与熵减原理熵增原理与熵减原理在热力学中是至关重要的概念,它们帮助我们理解热力学系统的演化方向。
本文将对熵增原理与熵减原理进行详细讨论,并探索它们在热力学领域中的应用。
1. 熵的概念与定义在深入探讨熵增原理与熵减原理之前,我们先来了解一下熵的概念与定义。
熵是热力学中一个非常重要的状态函数,通常用符号S表示。
熵的概念最初由克劳修斯于1850年提出,它用来描述系统的无序程度或混乱程度。
2. 熵增原理的表述熵增原理是热力学中最基本的原理之一,它也被称为热力学第二定律。
熵增原理的表述可以简单理解为:孤立系统中的熵总是自发增加的,即孤立系统的无序程度会越来越高。
3. 熵增原理的解释熵增原理的背后是热力学中的微观原子或分子行为。
根据玻尔兹曼-符号耳曼熵公式S=klnW,其中S为熵,k为玻尔兹曼常数,W为微观状态的数量。
根据这个公式,当系统的微观状态数量增加时,系统的熵也会增加。
4. 熵增原理的应用熵增原理在热力学中有着广泛的应用。
其中一个重要的应用是在化学反应中。
根据熵增原理,当化学反应的产物的微观状态数量大于反应物时,反应会自发进行,从而使系统的熵增加。
5. 熵减原理的概念除了熵增原理,还有一个与之相对应的概念,那就是熵减原理。
熵减原理表明,在一些特定的条件下,系统的熵会减少,系统的有序程度会增加。
6. 熵减原理的解释熵减原理也可以通过微观粒子的行为来解释。
当系统的微观状态数量减少时,系统的熵也会减少。
这通常发生在一些非常有序的系统中,例如晶体的结晶过程。
7. 热力学中的局限性尽管熵增原理和熵减原理在热力学中有着广泛的应用,但它们并不能解释一些特殊情况,例如热力学系统的临界点和相变点的行为。
8. 熵增原理与熵减原理的统一最后,需要指出的是熵增原理和熵减原理并不是相互矛盾的。
它们可以统一在一个更为普遍的原理下,即耗散结构理论,该理论描述了复杂系统的演化方向和自组织过程。
通过对熵增原理与熵减原理的讨论,我们可以更好地理解热力学系统的演化规律。

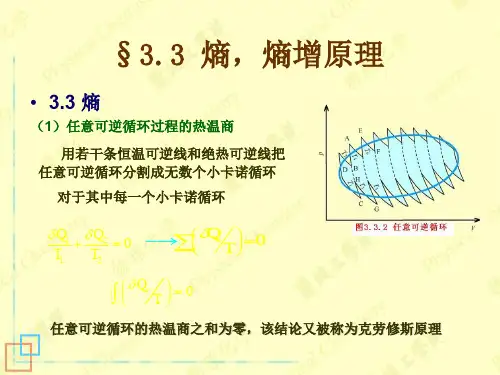


2.2 熵的概念与熵增原理2.2.1 循环过程的热温商 TQ据卡诺定理知: 卡诺循环中热温商的代数和为:0=+HHL L T Q T Q 对应于无限小的循环,则有: 0=+HH LL T Q T Q δδ对任意可逆循环过程,可用足够多且绝热线相互恰好重叠的小卡诺循环逼近.对每一个卡诺可逆循环,均有:0,,,,=+jH jH jL jL T Q T Q δδ对整个过程,则有:0)()(,,,,==+∑∑jR jjjH jH jL jL jT Q T Q T Q δδδ由于各卡诺循环的绝热线恰好重叠,方向相反,正好抵销.在极限情况下,由足够多的小卡诺循环组成的封闭曲线可以代替任意可逆循环。
故任意可逆循环过程热温商可表示为:⎰=0)(R TQδ即在任意可逆循环过程中,工作物质在各温度所吸的热(Q )与该温度之比的总和等于零。
据积分定理可知: 若沿封闭曲线的环积分为,则被积变量具有全微分的性质,是状态函数。
2.2.2 熵的定义——可逆过程中的热温商在可逆循环过程,在该过程曲线中任取两点A 和B,则可逆曲线被分为两条,每条曲线所代表的过程均为可逆过程.对这两个过程,有: 0)()(=+⎰⎰BA AB R R baTQ T Q δδ整理得: ⎰⎰=BABAR R b a TQTQ)()(δδ这表明,从状态A 到状态B,经由不同的可逆过程,它们各自的热温商的总和相等.由于所选的可逆循环及曲线上的点A 和B 均是任意的,故上列结论也适合于其它任意可逆循环过程.可逆过程中,由于⎰BAR TQ)(δ的值与状态点A 、B 之间的可逆途径无关,仅由始末态决定,具有状态函数的性质。
同时,已证明,任意可逆循环过程中rT Q ⎪⎭⎫⎝⎛δ沿封闭路径积分一周为pVp0,由数学分析知, rT Q ⎪⎭⎫⎝⎛δ必是某个函数的全微分,具有状态函数特征。
故克劳修斯据此定义它为一个新的热力学函数熵,用符号S 表示.若令S A 和S B 分别代表始态和末态的熵,则上式可写为:⎰=∆=-BA R AB TQS S S )(δ 对微小的变化过程,有: R TQ dS )(δ=上列两式均为熵变的定义式.内能和焓都是状态函数,是体系自身的性质.熵也是状态函数,只取决于体系的始末态,其值用可逆过程的热温商来计算,单位为1-⋅K J ,1mol 物质的熵称摩尔熵,单位11--⋅⋅K mol J .熵变定义:等温过程中:熵变的定义是计算熵变的原始依据。

热力学熵与熵增热力学熵指的是热力学系统的无序程度或混乱程度。
它是描述热力学系统微观状态的物理量,与系统的能量分布相关。
熵增则指的是熵的增加过程,即热力学系统向更高的无序状态发展的趋势。
热力学熵的概念最早由德国物理学家鲁道夫·克劳修斯提出。
他在19世纪中叶研究蒸汽机的过程中发现,当蒸汽从热源流向冷源时,整个系统的无序程度会不断增加。
后来,克劳修斯将这种无序程度定义为熵,并引入了熵的概念来描述热力学系统的状态。
熵的数学表达式为S=klnW,其中S表示熵,k为玻尔兹曼常数,W 为系统的微观状态数。
由此可见,熵与系统的无序程度成正比。
当系统的微观状态数越多时,熵的值就越大,系统的无序程度也就越高。
根据热力学第二定律,熵在自然界中总是趋于增加的。
这可以通过熵增原理来解释。
熵增原理指出,孤立系统的熵总是趋于增加,而不会减少。
孤立系统指的是与外界不进行物质和能量交换的系统。
熵增原理可以用来解释自然界中的很多现象,如热传导、能量转化等。
在热力学的观点下,自然界中的各种过程都是为了追求更高的无序状态。
例如,在热传导过程中,热量会从热源流向冷源,这是因为冷源的熵较低,通过热传导,熵会增加,系统的无序程度也会相应增加。
除了孤立系统外,对于开放系统和闭合系统,熵增原理也适用。
开放系统指的是与外界进行物质交换但不进行能量交换的系统,闭合系统指的是与外界既进行物质交换又进行能量交换的系统。
在这些系统中,熵的增加与系统与外界的物质和能量交换有关。
总之,热力学熵是描述热力学系统无序程度的物理量,与系统的能量分布有关。
熵增原理指出,在自然界中,熵总是趋于增加的。
熵增原理在热力学中有着广泛的应用,可以解释很多现象。
熵的增加代表着系统朝着更高的无序状态发展,与自然界的整体趋势相一致。

热力学熵增原理与热熵关系熵增原理是热力学中的基本原理之一,它揭示了自然界中的一个重要规律:宇宙的熵总是趋于增加。
熵增原理不仅对热力学体系的演化和宏观性质有着重要影响,而且还深刻地影响了现代物理学、化学和生物学等学科的发展。
那么,热力学熵增原理与热熵的关系是什么呢?首先,我们来了解一下热力学熵的概念。
热力学熵是描述系统无序程度的物理量,通常记作S。
热力学第二定律指出,孤立系的熵永远不会减少,而是不断增加,即熵增。
孤立系是指与外界没有能量和物质交换的系统。
熵增意味着系统的无序性增加,也就是系统的熵增加。
热力学熵与无序程度有关,当系统的无序程度增加时,熵增加,而当系统的有序程度增加时,熵减少。
通过熵的改变可以判断过程的方向性和可逆性。
其次,熵增原理和热力学第二定律之间有着密切的联系。
熵增原理是热力学第二定律的基本表述之一,它告诉我们自然界中存在着一个统计规律,即宇宙的熵总是趋于增加。
熵增原理是基于统计力学的理论推导得出的,它可以解释为何通过宏观过程中能量从高温物体转移到低温物体。
熵增原理也解释了为什么自发过程是单向性的,为什么自组织结构在自然界中是相当普遍的现象。
进一步地,熵增原理的应用不仅限于热力学系统,还可以应用于其他物理、化学和生物学领域。
例如,熵增原理可以解释为什么混合物会趋向于均匀分布,为什么自发反应的产物熵(无序度)会比反应物高。
在化学反应中,熵增原理常常用于判断反应的方向性和可逆性。
在生物学中,熵增原理可以解释为什么生物体必须对外界进行能量输入,以维持自身的有序状态。
除了熵增原理,热熵与信息熵的关系也是热力学重要的研究内容之一。
熵在信息论中是描述信息无序程度的物理量,通常记作H。
热熵与信息熵有着相似的数学形式和物理意义,它们都是描述无序程度的量度。
热力学和信息论的交叉研究表明,熵增原理不仅适用于热力学系统,也适用于信息系统。
热力学第二定律和信息论中的第二定律可以看作是同一个概念在不同领域中的表述。

第5节初_识_熵一、对熵的认识1.方向性不可逆过程总是系统从有差异的状态向无差异的均匀状态过渡,从有规则向无规则过渡,从集中向分散过渡。
2.有序、无序把系统的有差异的不均匀、有规则、集中说成有序,把系统的无差异的均匀、无规则、分散说成无序。
3.熵代表系统的无序性程度。
无序性大,熵大;无序性小,熵小。
二、熵增原理1.内容孤立系统的熵总是增加的,或者孤立系统的熵总不减少。
2.公式(1)ΔS表示过程中熵的变化,则熵增原理可以表示为:ΔS≥0。
(2)ΔS=0表示系统处于平衡态,ΔS>0表示孤立系统的任何一个过程熵总是增加的。
3.适用条件孤立系统。
1.判断:(1)热传递的后果总是使得系统的温度分布趋于均匀化。
()(2)同一种物质在不同的状态下熵值一样。
()(3)孤立系统中的气体与外界无能量交换。
()答案:(1)√(2)×(3)√2.思考:刚买的扑克牌按花色及大小规则排列,我们打牌时要洗牌,让其混乱,哪种情况熵更小一些?提示:新牌熵小些,因为按花色及大小有序、有规则排列,故新牌的熵更小些。
1.有序与无序所谓有序,是指事物内部的要素或事物之间有规则的联系和运动转化;无序是指事物内部各种要素或事物之间混乱而无规则的组合和运动变化。
2.扩散、热传递的微观解释(1)扩散:扩散过程中气体分子完全打破了原来的有序分布,变得较为无序。
即从微观角度看,扩散现象实质上是系统向无序程度增加的方向进行的过程。
(2)热传递:高温物体中的分子平均动能大,低温物体中分子平均动能小。
两物体接触前,这些分子有序地按平均动能大小分居两处。
让两物体接触经一段时间后,高温物体温度降低,分子平均动能减小,低温物体的温度升高,分子平均动能增大,最后达到同一温度。
两物体的分子平均动能也变成一个中间值,运动较快的分子不再同运动较慢的分子隔开,分子的运动变得较为无序。
可见,热传递实质上也是向无序程度增加的方向进行的过程。
3.热力学第二定律的微观本质一切不可逆过程总是沿着大量分子热运动无序程度增大的方向进行。
热力学熵探讨熵的概念与熵增原理熵是热力学中一个重要的概念,用于描述系统的无序程度或混乱程度。
在热力学中,熵是一个有助于我们理解自然界中现象的概念,同时也与热力学第二定律密切相关。
本文将探讨熵的概念,并详细介绍熵增原理。
1. 熵的概念熵通常用符号S表示,它与系统的微观状态有关。
热力学熵的概念最初由克劳修斯和开尔文提出,他们通过观察热力学系统中能量自发转化的过程,提出了熵的概念。
熵可以理解为系统的无序程度或混乱程度的度量。
当系统的微观状态有很多不同的可能性时(即无序状态),系统的熵较高。
相反,当系统的微观状态有较少的可能性时(即有序状态),系统的熵较低。
2. 熵增原理熵增原理是热力学第二定律的重要内容之一,它指出在孤立系统中,熵总是不断增加的。
这意味着孤立系统趋向于更加无序或更加混乱的状态。
熵增原理可以通过以下方式理解:对于一个能够与外界交换能量和物质的孤立系统,系统内部的微观状态在任意一瞬间都可以处于不同的状态。
根据统计力学的观点,系统具有更多的无序状态(高熵状态)的微观状态数要远远大于有序状态(低熵状态)的微观状态数。
因此,系统从低熵状态转变为高熵状态的过程是不可逆的。
3. 熵的计算根据熵的定义,可以将系统的熵表示为:S = k ln W其中,k是玻尔兹曼常数,ln是自然对数,W是系统的微观状态数。
从这个公式可以看出,当系统的微观状态数增加时,系统的熵也会增加。
由此可以得出,系统的熵增加原则与热力学第二定律完全一致。
4. 熵在自然界中的应用熵不仅仅在热力学领域有着广泛的应用,它也在其他科学领域中被广泛运用。
在物理化学中,熵常被用来描述化学反应的平衡状态。
在这种情况下,系统的熵增加被认为是化学反应的驱动力。
在信息论中,熵被用来描述信息的无序程度。
信息论中的熵与热力学中的熵有着类似的概念,都是区分有序和无序状态的度量。
总结:熵是热力学中一个重要的概念,用来描述系统的无序程度或混乱程度。
熵增原理指出孤立系统中熵的总是不断增加的,这与热力学第二定律是一致的。
卡诺定理克劳修斯公式熵熵增原理卡诺定理和克劳修斯公式是热力学中的两个重要定理,而熵和熵增原理则是与热力学系统的状态变化和熵的变化相关的概念。
卡诺定理是由法国物理学家卡诺在19世纪初提出的,它主要用来描述理想热机的效率与工作物质所工作的热源之间的关系。
卡诺定理的表述为:在给定温度的两个热源之间工作的理想热机,其效率不会超过卡诺循环的效率。
卡诺循环是一个由两个等温过程和两个绝热过程组成的循环过程,它被认为是工作在给定两个热源温度之间的最有效热机。
克劳修斯公式是由克劳修斯在19世纪初提出的,它是热力学中能量转换和熵变化的一个重要定律。
克劳修斯公式的表述为:任何热力学系统和环境之间的能量转换过程,总是使得系统的熵增加。
也就是说,自然界中的能量转换总是不可逆的,并且熵总是朝着增加的方向发展。
熵是热力学中一个非常重要的概念,它描述了系统的无序程度。
熵的定义为:对于一个热力学系统,在其状态变化中,熵的变化等于传热过程中吸收的热量与系统温度的比值。
换句话说,熵是一个衡量热力学系统状态无序程度的物理量。
当一个系统处于有序状态时,熵较低,而当系统处于无序状态时,熵较高。
熵增原理是热力学中的一个基本原理,它描述了孤立系统熵的增加趋势。
熵增原理的表述为:一个孤立系统的熵永远不会减少,而只会增加或保持不变。
这个原理可以通过考虑系统与外界的能量转换过程来理解。
由于克劳修斯公式的存在,能量转换总是使得系统的熵增加,这导致了热力学系统中熵增的行为。
熵增原理在热力学领域中具有广泛的应用,例如在热力学循环和热力学平衡等问题中都需要用到。
总结起来,卡诺定理和克劳修斯公式主要用来描述热力学系统中的能量转换和效率问题,而熵和熵增原理则是衡量系统无序程度和描述孤立系统热力学特性的重要概念和原理。
这些概念和原理对于热力学领域的理论研究和实际应用都具有重要的意义。
热力学中的熵与熵增的计算热力学是一门研究物质能量转化和宏观性质的学科,而熵则是热力学的核心概念之一。
熵可以被理解为系统的无序程度或混乱程度,是描述系统微观构型的一种量度。
熵的计算是热力学的重要内容之一,对于了解和预测系统的行为至关重要。
在热力学中,熵被定义为系统的状态函数,它与系统的微观构型有关。
一个具有N个微观构型的系统,它的熵S可以计算为:S = k * lnΩ其中,k是玻尔兹曼常数,Ω是系统的微观构型数。
熵的单位是焦耳/开尔文。
对于一个封闭系统,其内部的微观构型数Ω与系统所有粒子的能级分布有关。
如果系统的所有粒子处于同一能级,那么Ω为1,熵也为0。
这是一个完全有序的情况。
而当粒子能量分布越来越分散,系统的无序程度增加,Ω也会变得更大,熵也随之增大。
熵在热力学中具有一条重要的性质,即熵增原理。
熵增原理指出,在一个孤立系统中,熵不会减少,而只会增加或保持不变。
换句话说,自然界的趋势是朝着更大的熵增长。
这个原理反映了宏观世界向着无序状态发展的趋势。
熵增可以通过热力学第二定律来解释。
热力学第二定律表明,自发过程中系统的总熵必然增加,而非减少。
根据熵增原理,可以推导出一个有用的关系式:ΔS = Q / T其中,ΔS是系统的熵增量,Q是系统吸收的热量,T是吸收热量的温度。
这个关系表明,在热力学平衡下,一个系统吸收的热量越多,温度越高,熵增越大。
熵增也可以通过熵增定理来计算。
熵增定理表明,在一个孤立系统中,系统的熵增等于外部对系统做功的熵流。
根据这个定理,熵增可以通过对系统进行能量守恒和热流计算来确定。
在实际问题中,计算熵增可以采用不同的方法。
一种方法是使用经典热力学理论来分析系统的状态,预测系统熵的变化。
这种方法适用于简单系统和平衡态下的系统。
另一种方法是采用统计热力学理论,通过对系统的微观构型进行计数和统计,来计算系统的熵和熵的增量。
这种方法适用于复杂系统和非平衡态下的系统。
总而言之,熵是热力学中的重要概念,它描述了系统的无序程度或混乱程度。
2.2 熵的概念与熵增原理
2.2.1 循环过程的热温商 T
Q
据卡诺定理知: 卡诺循环中热温商的代数和为:0=+H
H
L L T Q T Q 对应于无限小的循环,则有: 0=+H
H L
L T Q T Q δδ
对任意可逆循环过程,可用足够多且绝热线相互恰好重叠的小卡诺循环逼近.对每一个卡诺可逆循环,均有:
0,,,,=+
j
H j
H j
L j
L T Q T Q δδ
对整个过程,则有:
0)(
)(
,,,,==+
∑∑j
R j
j
j
H j
H j
L j
L j
T Q T Q T Q δδδ
由于各卡诺循环的绝热线恰好重叠,方向相反,正好抵销.在极限情况下,由足够多的小卡诺循环组成的封闭曲线可以代替任意可逆循环。
故任意可逆循环过程热温商可表示为:
⎰=0)(
R T
Q
δ
即在任意可逆循环过程中,工作物质在各温度所吸的热(Q )与该温度之比的总和等于零。
据积分定理可知: 若沿封闭曲线的环积分为,则被积变量具有全微分的性质,是状态函数。
2.2.2 熵的定义——可逆过程中的热温商
在可逆循环过程,在该过程曲线中任取两点A 和B,则可逆曲线被分为两条,每条曲线所代表的过程均为可逆过程.对这两个过程,有: 0)()(=+⎰⎰B
A A
B R R b
a
T
Q T Q δδ
整理得: ⎰⎰=B
A
B
A
R R b a T
Q
T
Q
)(
)(
δδ
这表明,从状态A 到状态B,经由不同的可逆过程,它们各自的热温商的总和相等.由于所选的可逆循环及曲线上的点A 和B 均是任意的,故上列结论也适合于其它任意可逆循环过程.
可逆过程中,由于⎰B
A
R T
Q
)(
δ的值与状态点A 、B 之间的可逆途径无关,仅由始末态决定,
具有状态函数的性质。
同时,已证明,任意可逆循环过程中r
T Q ⎪⎭⎫
⎝⎛δ
沿封闭路径积分一周为
p
V
p
0,由数学分析知, r
T Q ⎪⎭⎫
⎝⎛δ必是某个函数的全微分,具有状态函数特征。
故克劳修斯据此定义它为一个新的热力学函数熵,用符号S 表示.
若令S A 和S B 分别代表始态和末态的熵,则上式可写为:
⎰=∆=-B
A R A
B T
Q
S S S )(
δ 对微小的变化过程,有: R T
Q dS )(δ=
上列两式均为熵变的定义式.
内能和焓都是状态函数,是体系自身的性质.熵也是状态函数,只取决于体系的始末态,其值用可逆过程的热温商来计算,单位为1-⋅K J ,1mol 物质的熵称摩尔熵,单位11--⋅⋅K mol J .
熵变定义:
等温过程中:
熵变的定义是计算熵变的原始依据。
2.2.
3. 克劳修斯不等式
——初末态相同时,可逆过程热温商与不可逆过程热温商的关系
设有一不可逆循环,它是由可逆和不可逆两部分构成,如下图。
由上节式(12)知
r A
B ir B
A T Q T Q T
Q
⎰⎰⎰⎪⎭⎫
⎝
⎛+⎪⎪⎭⎫ ⎝⎛=δδδ环环
<0
即
T
Q S rev
d δ=
T
Q
S rev
=∆
ir B
A T Q ⎰⎪⎪⎭⎫ ⎝⎛环δ<S T Q r B
A ∆=⎪⎭⎫ ⎝⎛⎰δ 上式可改写为
⎩⎨
⎧=>≥∆⎰
>-逆
可不可逆 B
A
B A T Q S δ
(1)
这就是克劳修斯不等式。
式中Q δ是实际过程的热效应,T 是环境温度。
在可逆过程中取等号,不可逆过程中取大于号。
用上式可以判断过程的可逆性,也可作为热力学第二定律的数学表达式。
上式表明,当体系从A 经过一过程到达B 时,如果过程是可逆的,则体系的熵变等于过程的热温商;如果过程是不可逆的,则体系的熵变大于过程的热温商。
式中的环T 是热源的温度,对可逆过程,它等于体系的温度。
对微小变化过程,可有: ⎩⎨
⎧=>≥逆
可不可逆
T Q dS δ (2) 这是热力学第二定律最普遍的表示形式。
对绝热不可逆过程,虽然环T T ≠,但因0=Q δ,仍有
环
T Q
T
Q
δδ=。
对恒容可逆过程,
外p p ≠但因0=dV ,仍有dV p pdV 外=。
2.2.4 熵增原理
对绝热体系中发生的过程,因0=Q δ ,所以: 0≥dS 或 0≥∆S
即在绝热可逆过程中,只能发生0≥∆S 的变化。
在绝热可逆过程中,体系的熵不变;在绝热不可逆过程中,体系的熵增加。
体系不可能发生熵减少0<∆S 的变化。
故可用体系的熵函数判断过程的可逆与不可逆。
在绝热可逆条件下,趋向于平衡的过程使体系的熵增加,这就是熵增加原理。
应该注意:自发过程必定是不可逆过程。
但不可逆过程可以是自发过程,也可以是非自发过程。
若不可逆过程是由环境对体系做功形成的,则为非自发过程;若环境没有对体系做功而发生了一个不可逆过程,则该过程必为自发过程。
对隔离体系,体系与环境之间没有热和功的交换,当然也是绝热的。
考虑到与体系密切相关的环境,即将体系与环境作为一个整体则可用下式来判断:
0≥+=环境体系隔离dS dS dS 或 0≥∆+∆=∆环境体系隔离S S S
iso ((0
S S S ∆=∆+∆≥体系)环境)
由于外界对隔离体系无法干扰,任何自发过程都是由非平衡态趋向于平衡态的。
达到平衡时,其熵值达到最大值。
上式是判断过程可逆与否的依据,故又称为熵判据.
例题:设有一化学反应在298.15 K 及Θ
p 下进行,放热41.84 kJ 。
设在同样条件下,将此反应通过可逆原电池来完成,此时放热8.37 kJ 。
试计算:(1)此反应的S ∆;(2)当此反应不在可逆原电池内发生时的S ∆外及S ∆总,并判断此反应能否自动进行;(3)体系可能做的最大有效功。
(答案:①△S = -28.1 J ·K -1,②△S 外 = 140.3 J ·K -1,△S 总 = 112.2 J ·K -1,③ W /= 33.47 kJ ) 解: (1) S ∆体= Q r /T = -8370÷298.15= -28.1 J ·K -1
(2) S ∆外= -Q /T 外= (-41840)÷298.15 =140.3 J ·K -1
S ∆总 =S ∆体+S ∆环= (-28.1) +140.3 =112.2 J ·K -1
反应可自动进行
(3) 在恒温恒压下体系可能作的最大有效功即为的负值,即 W max ’= -G ∆
∴ W max ’= -(H ∆-T S ∆) = - (- 41840) -298.15×(-28.1) = 33462 J
2.2.5 熵的物理意义
(1).几率、宏观状态与微观状态
某一宏观状态相对应的微观状态的数目,称为该宏观状态的“微观状态数”,即该宏观状态的“热力学几率Ω”.
(2).熵是系统混乱度的度量
在热力学过程中,系统混乱度Ω的增减,与系统熵的增减是同步的.统计力学证明:
Ω=ln k S
熵是状态函数,在一定状态下系统有一定的熵值.那么系统含有熵的大小代表的物理意义是什么呢? 理论和实践都说明,恒温膨胀、恒压或恒容升温、气体混合、固→液→气相变等过程,无一例外都是体系无序度(又称混乱度)增加而熵也增加的过程.这说明“熵”是量度体系无序度的函数.可以预料,随着温度的下降, 体系的无序度减小,到0K 时,纯物质完美晶体的无序将达最小,熵亦应最小.。