19 过渡金属(I)钛钒
- 格式:ppt
- 大小:4.41 MB
- 文档页数:94




钛钒铬锰实验报告引言钛、钒、铬和锰是重要的过渡金属元素,具有重要的工业应用和研究价值。
本实验旨在通过合成和表征钛钒铬锰化合物,探究其物性和应用潜力。
通过实验研究,可以了解到钛钒铬锰化合物的结构、性质以及其在能源存储和催化领域的应用。
实验材料与方法材料•钛粉、钒粉、铬粉、锰粉•硝酸、硫酸、氢氧化钠•乙酸铵、乙二胺四乙酸•甲醇、丙酮方法1.合成TiO2-V2O5-Cr2O3-MnO2复合氧化物–将适量的钛粉、钒粉、铬粉和锰粉按一定比例混合。
–将混合粉末加入硝酸中,放置反应釜中进行反应,控制反应时间为3小时。
–将反应产物洗涤并干燥,得到TiO2-V2O5-Cr2O3-MnO2复合氧化物。
2.表征复合氧化物的结构和性质–使用X射线衍射仪(XRD)分析复合氧化物的晶体结构。
–利用扫描电子显微镜(SEM)观察复合氧化物的形貌和微观结构。
–运用傅里叶变换红外光谱(FT-IR)研究复合氧化物的化学键和功能团。
3.能源存储性能测试–制备TiO2-V2O5-Cr2O3-MnO2复合氧化物电极。
–使用循环伏安法(CV)测试电极在锂离子电池中的充放电性能。
–测试电极的循环稳定性和比容量。
4.催化性能测试–制备TiO2-V2O5-Cr2O3-MnO2复合氧化物催化剂。
–在一定温度下,利用甲醇气相催化反应评估催化剂的活性。
结果与讨论TiO2-V2O5-Cr2O3-MnO2复合氧化物的合成通过控制反应的时间和温度,成功合成了TiO2-V2O5-Cr2O3-MnO2复合氧化物。
采用XRD对产物进行分析,得到其晶体结构的信息,进一步确认了合成的化合物。
TiO2-V2O5-Cr2O3-MnO2复合氧化物的表征SEM观察结果显示,TiO2-V2O5-Cr2O3-MnO2复合氧化物呈现出颗粒形貌,并且颗粒之间有较好的结合。
FT-IR光谱显示,复合氧化物中存在着特定的化学键和功能团,这对于复合氧化物的应用具有重要意义。
能源存储性能测试结果通过对TiO2-V2O5-Cr2O3-MnO2复合氧化物的充放电性能测试,得到了其电化学性能的数据。

化学元素表化学元素表1. 氢(H)氢是最简单的化学元素,因为它只含有一个质子和一个电子。
它是宇宙中最丰富的元素之一,因为它构成了大约74%的物质,包括恒星和行星。
在自然界中,氢通常以分子的形式出现,如H2。
2. 氦(He)氦是稀有气体中第二丰富的元素,与氢一样,它在宇宙中很常见。
在地球上,氦存在于自然气和一些矿物中。
它被广泛应用于氦气球、氦气激光和核磁共振成像等领域。
3. 锂(Li)锂是一种可燃的碱金属,具有低密度、高热导率和低融点等性质。
它广泛用于制造锂离子电池、玻璃和铝合金等。
4. 铍(Be)铍是一种质轻、硬度高的金属,具有良好的导热性和防腐蚀性。
它被广泛用于电子设备、核反应堆和卫星等领域。
5. 碳(C)碳是地球上最常见的元素之一,以固体、液体和气体的形式存在。
它是一种非金属元素,被广泛应用于制造钢铁、石墨、石墨烯、钻石和有机化合物等。
6. 氮(N)氮是一种气体元素,占大气中78%的成分。
它被广泛应用于化肥、硝化剂、液氮和氮气等领域。
7. 氧(O)氧是地球上最常见的元素之一,占大气中21%的成分。
它对生命至关重要,因为它是呼吸过程中必需的元素之一。
氧也被广泛应用于氧气、臭氧和氧化剂等领域。
8. 氟(F)氟是一种极具反应性的元素,它是自然界中最常见的卤素之一。
它被广泛应用于制造氟化物、药品、冷却剂和不粘锅等。
9. 氖(Ne)氖是稀有气体中第四丰富的元素,它是一种无色、无味、无毒的气体。
它被广泛用于氖灯、激光和气体测量仪等领域。
10. 钠(Na)钠是一种可燃的碱金属,具有强烈的反应性。
它被广泛应用于制造肥皂、化学品和钠灯等。
11. 镁(Mg)镁是一种质轻的金属,具有良好的导热性和耐蚀性。
它被广泛应用于制造铝合金、镁合金、电子设备和防腐材料等。
12. 铝(Al)铝是一种质轻的金属,具有良好的导电性和耐蚀性。
它被广泛应用于制造汽车、飞机、建筑材料和罐装饮料等。
13. 硅(Si)硅是地球上第二丰富的元素之一,也是太阳系中第七丰富的元素之一。

化学元素周期表读音和记忆锂(lǐ)铍(pí)硼(pãng)碳(tàn) 氮(dàn) 氧(yǎng)氟(fú)氖(nǎi)钠(nà)镁(měi)铝(lǚ)硅(guī)磷(lín) 硫(liú)氯(lǜ)氩(yà)钾(jiǎ) 钙(gài) 钪(kàng)钛(tài)钒(fán)铬(gâ)锰(měng)铁(tiě) 钴(gǔ) 镍(ni â) 铜(tïng) 锌(xīn)锗(zhě) 砷(shēn) 硒(xī) 溴(xiù)氪(kâ)铷(rú) 锶(sī) 钇(yǐ) 锆(gào)铌(n í) 钼(mù) 锝(dã) 钌(liǎo) 铑(lǎo)钯(pá) 银(yín) 镉(gã) 铟(yīn) 锡(xī) 锑(tī) 碲(dì) 碘(diǎn) 氙(xiān)铯(sâ)钡(bâi) 镧(lán) 铪(hā) 钽(tǎn) 钨(wū) 铼(lái) 锇(ã) 铱(yī) 铂(bï) 金(jīn)汞(gǒng) 铊(tā) 铅(qiān) 铋(bì) 钋(pō)砹(ài) 氡(dōng)钫(fāng) 镭(lãi) 锕(ā)钅卢(lú) 钅杜(dù) 钅喜(xǐ) 钅波(bō) 钅黑(hēi)钅麦(mài) 钅达(dá) 钅仑(lún) 镧(lán) 铈(shì)镨(pǔ) 钕(nǚ) 钷(pǒ) 钐(shān) 铕(yǒu)钆(gá) 铽(tâ) 镝(dí) 钬(huǒ) 铒(ěr)铥(diū) 镱(yì) 镥(lǔ) 锕(ā) 钍(tǔ)镤(pú) 铀(yïu) 镎(ná) 钚(bù) 镅(mãi)锔(jū) 锫(pãi) 锎(kāi) 锿(āi) 镄(fâi)钔(mãn) 锘(nuî) 铹(láo)(一)N 氮 O 氧 S 硫,C 碳 P 磷金 Au;K 钾 I 碘 Al 铝,钨的符号 W。

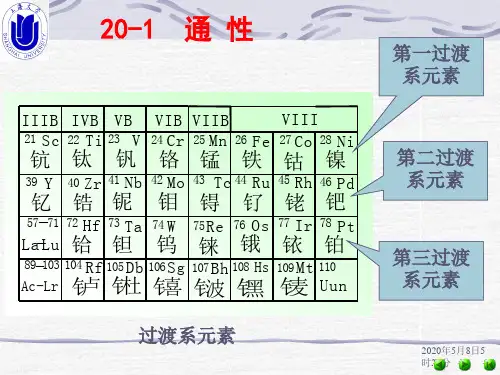
第一过渡系元素(一)(钛、钒、铬、锰)第一过渡系元素是指周期表中第3至第12族的元素,它们在化学性质上有相似之处。
其中,钛(Ti)、钒(V)、铬(Cr)和锰(Mn)是第一过渡系元素中的前四个元素,它们具有一些共通的特性,同时也存在一些区别。
本文将从以下几个方面来介绍这四个元素:元素性质、物理性质、化学性质以及地质应用。
一、元素性质1.钛(Ti)钛是一种质轻、高强度、高耐腐蚀性、抗疲劳性能好的金属。
它具有优异的机械性能,被广泛应用于航空、航天、化工、海洋开发等领域。
同时,钛也是一种生物医用材料,被用于制作人体骨骼支架、人造关节、人工心脏瓣膜等。
2.钒(V)钒是一种银白色金属,比铁硬但稍加工艺处理后可以获得良好的延展性和强度。
它还有广泛的应用,用于制造钢、化学试剂和合金等。
不仅如此,钒还是一种强化剂,在钢铁生产过程中起到重要的作用。
3.铬(Cr)铬是一种具有高度耐腐蚀性的银白色金属,它主要应用于不锈钢、电子元器件、航空航天、制药等领域。
除此之外,铬还是一种环保型材料,可以用于净水和净化技术。
4.锰(Mn)锰是金属元素中的一种,它是一种银灰色的金属,具有良好的延展性和韧性。
锰还是钢铁生产中的一种重要元素,可以增强钢的硬度和韧性。
二、物理性质钛是一种具有低密度和高强度的金属,密度为4.54克/厘米立方。
它具有较高的熔点(1668℃)和沸点(3287℃),同时也具有较高的热导率和电导率。
三、化学性质钛是一种化性非常稳定的金属,在常温下不会被大多数酸和碱腐蚀。
它可以与氧、氮、氢反应,产生相应的氧化物、氮化物和氢化物。
此外,钛还可以和卤素反应,如氯、溴和碘等,生成相应的卤化物,例如TiCl4、TiBr3等。
锰可以和许多元素和化合物发生反应。
它可以与氧、氯、酸、弱碱等反应,生成各种不同的化合物。
在大气环境下,锰会逐渐氧化形成氧化锰,该过程是一种蓝黑色的化学反应。
四、地质应用钒是一种重要的工业金属,在地球上的丰度较低,但在一些特定的矿物中含量较高。

实验七第一过渡系元素 (钛、钒、镉、锰)第一过渡系元素是指周期表中第3到第12族元素,它们拥有类似的电子结构和化学性质,具有宽广的应用前景。
其中,钛、钒、镉、锰是较为常见的第一过渡系元素,本篇文章将介绍这些元素的基本性质、应用领域以及相关实验。
一、钛(Ti)钛是一种银白色、质地轻巧的金属,熔点高达1670℃,具有较高的强度和耐腐蚀性。
由于其优良的物理和化学性质,钛被广泛应用于航空、航天、能源、汽车、医药等领域。
目前,钛制品已成为高端制造业的主要材料之一。
钛的化学性质活泼,易于形成氧化物。
在实验中,常用Na2TiO3或K2TiO3作为钛标准溶液,通过络合滴定法测定样品中的钛含量。
此外,钛还可以与硫酰化剂反应,生成具有深色化合物,可以用于反应的定量分析。
二、钒(V)钒是一种银灰色金属,化学性质活泼。
钒元素存在于许多矿物中,主要产地为俄罗斯、中国和南非等地。
钒是重要的合金元素,可以提高钢的韧性和耐磨性。
此外,钒也可以用于生产电池和电导管等。
钒的分析方法比较复杂。
在实验中,可以通过还原-氧化反应测定样品中钒的含量。
首先,将样品转化为VO2+,然后将VO2+还原为V2+,最后再进行氧化反应。
三、镉(Cd)镉是一种银灰色金属,属于类锌金属。
长期以来,镉被广泛用于电池、电子器件、涂料、塑料等领域。
然而,由于其高毒性和紫外线敏感性,镉已被列入高毒性元素之列。
在实验中,可以用电化学或原子吸收光谱法测定样品中的镉含量。
电化学分析时,将样品置于电极中,然后进行电位扫描,以测定镉的还原电位。
原子吸收光谱法则是将样品原子吸收到特殊的光源中,测量其吸收的光谱信号,以得到镉的含量。
四、锰(Mn)锰是一种灰黑色的金属,具有较高的硬度和抗腐蚀能力。
由于其良好的物理和化学性质,锰被广泛应用于铁合金、电池、合成橡胶、开本工业等领域。
在实验中,可用酸碱滴定法测定锰的含量。
首先,将锰溶解为Mn2+,然后加入过量的氧化还原剂,使Mn2+被氧化为MnO4-。

第19章 过渡元素(一)习题1.选择题19-1下列配离子属于反磁性的是……………………………………………( )(A) [Mn(CN)6]4-(B) [Cu(en)2]2+ (C) [Fe(CN)6]3- (D) [Co(CN)6]3-19-2下列氧化物与浓H 2SO 4共热,没有O 2生成的是……………………( ) (A) CrO 3 (B) MnO 2 (C) PbO 2(D) V 2O 5 19-3下列离子中磁性最大的是………………………………………………( )(A) V 2+ (B) Cr 3+ (C) Mn 2+ (D) Fe 2+19-4 在某种酸化的黄色溶液中,加入锌粒,溶液颜色从黄经过蓝、绿直到变为紫色,该溶液中含有……………………………………………………………( )(A) Fe 3+ (B) +2VO (C)-24CrO (D) Fe (CN)-4619-5在碱性溶液中氧化能力最强的是………………………………………( )(A) -4MnO (B) NaBiO 3 (C) Co 2O 3 (D)-272O Cr19-6过渡金属和许多非金属的共同点是……………………………………( )(A) 有高的电负性 (B) 许多化合物有颜色(C) 有多种氧化态 (D) 许多化合物具有顺磁性 19-7 CrO 5中Cr 的氧化数为 …………………………………………………( )(A) 4 (B) 6 (C) 8 (D) 10 19-8在酸性介质中加入过氧化氢(H 2O 2)时不生成过氧化物的化合物是…( )(A) 钛酸盐 (B) 重铬酸盐 (C) 钒酸盐 (D) 高锰酸盐 19-9根据铬在酸性溶液中的元素电势图可知, ϕ(Cr 2+/Cr)为…………… ( )Cr 3+──── Cr 2+ ───── Cr(A) -0.58 V (B) -0.91 V(C) -1.32 V (D) -1.81 V19-10 已知V 3+ / V 2+ 的 ϕ= -0.26 V ,O 2/H 2O 的 ϕ= 1.23 V ,V 2+离子在下述溶液中能放出氢的是………………………………………………………………( )(A) pH = 0的水溶液 (B) 无氧的pH = 7的水溶液 -0.41 V -0.74 V(C) pH = 10的水溶液 (D) 无氧的pH = 0的水溶液19-11对第四周期的过渡元素,不具备的性质是…………………………( )(A) 形成多种氧化态 (B) 形成配位化合物(C) 配位数为4或6 (D) 形成的离子必具有4s 23d n 的电子排布19-12根据价层电子的排布,预料下列化合物中为无色的是………………( )(A) TiCl 3 (B) ScF 3 (C) MnF 3 (D) CrF 319-13由铬在酸性溶液中的元素电势图,可确定能自发进行的反应是……( ) Cr 3+ ───── Cr 2+ ───── Cr(A) 3Cr 2+ → 2Cr 3+ + Cr(B) Cr + Cr 2+ → 2Cr 3+(C) 2Cr → Cr 2+ + Cr 3+(D) 2Cr 3+ + Cr → 3Cr 2+19-14用 Nernst 方程式 ϕ =][][lg 0592.0还原剂氧化剂n + ϕ,计算MnO 4-/Mn 2+的电极电势 ϕ ,下列叙述不正确的是…………………………………………………( )(A) 温度应为298 K (B) Mn 2+ 浓度增大则ϕ 减小(C) H + 浓度的变化对ϕ 无影响 (D) MnO -4浓度增大,则ϕ 增大19-15下列各组自由离子的磁矩从小到大变化顺序,正确的是………( )(A) Cu 2+ < Ni 2+ < Co 2+ (B) Cr 2+ < Fe 2+ <Fe 3+(C) Cr 2+ < Mn 2+ < V 2+ (D) Ti 2+ < V 3+ < Cr 2+19-16在强碱性介质中,钒(Ⅴ)存在的形式是………………………………( )(A) VO (B) VO 3+(C) V 2O 5·n H 2O(D)-34VO 19-17已知某黄色固体是一种简单化合物,它不溶于热水而溶于热的稀盐酸,生成一种橙红色溶液。

化学元素介绍化学元素介绍11 氢(qīng)H 62 氦(hài)He 63 锂(lǐ)Li 74 铍(pí)Be 85 硼(péng)B 96 碳(tàn)C 97 氮(dàn)N 108 氧(yǎng)O 109 氟(fú)F 1110 氖(nǎi)Ne 1211 钠(nà)Na 1212 镁(měi)Mg 1313 铝(lǚ)Al 1414 硅(guī)Si 1415 磷(lín)P 1516 硫(liú)S 1617 氯(lǜ)Cl 1618 氩(yà)Ar 1719 钾(jiǎ)K 1820 钙(gài)Ca 1822 钛(tài)Ti 2023 钒(fán)V 2024 铬(gè)Cr 2125 锰(měng)Mn 2226 铁(tiě)Fe 2227 钴(gǔ)Co 2328 镍(niè)Ni 2429 铜(tóng)Cu 2530 锌(xīn)Zn 2531 镓(jiā)Ga 2632 锗(zhě)Ge 2733 砷(shēn)As 2734 硒(xī)Se 2835 溴(xiù)Br 2936 氪(kè)Kr 2937 铷(rú)Rb 3038 锶(sī)Sr 3039 钇(yǐ)Y 3140 锆(gào)Zr 3141 铌(ní)Nb 3242 钼(mù)Mo 3344 钌(liǎo)Ru 3445 铑(lǎo)Rh 3446 钯(pá)Pd 3547 银(yín)Ag 3648 镉(gé)Cd 3649 铟(yīn)In 3750 锡(xī)Sn 3851 锑(tī)Sb 3852 碲(dì)Te 3953 碘(diǎn)I 3954 氙(xiān)Xe 4055 铯(sè)Cs 4156 钡(bèi)Ba 4157 镧(lán)La 4258 铈(shì)Ce 4259 镨(pǔ)Pr 4360 钕(nǚ)Nd 4361 钷(pǒ)Pm 4462 钐(shān)Sm 4463 铕(yǒu)Eu 4464 钆(gá)Gd 4566 镝(dí)Dy 4667 钬(huǒ)Ho 4668 铒(ěr)Er 4769 铥(diū)Tm 4770 镱(yì)Yb 4771 镥(lù)Lu 4872 铪(hā)Hf 4873 钽(tǎn)Ta 4974 钨(wū)W 5075 铼(lái)Re 5076 锇(é)O s 5177 铱(yī)I r 5278 铂(bó)Pt 5279 金(jīn)Au 5380 汞(gǒng)Hg 5481 铊(tā)Tl 5482 铅(qiān)Pb 5583 铋(bì)Bi 5684 钋(pō)Po 5685 砹(ài)At 5786 氡(dōng)Rn 5788 镭(léi)Ra 5889 锕(ā)Ac 5990 钍(tǔ)Th 5991 镤(pú)Pa 6092 铀(yóu)U 6093 镎(ná)Np 6194 钚(bù)Pu 6195 镅(méi)Am 6296 锔(jū)Cm 6297 锫(péi)Bk 6398 锎(kāi)Cf 6399 锿(āi)Es 63 100 镄(fèi)Fm 64 101 钔(mén)Md 64 102 锘(nuò)No 64 103 铹(láo)Lr 64 104 鈩(íǔ)Rf 65 105 钅杜Db 66 106 钅喜Sg 66 107 钅波Bh 67 108 钅黑Hs 671 氢(qīng)H原子序数1,元素名来源于希腊文,原意是“水素”。
金属元素与所处周期一、金属元素的概念金属元素是指在元素周期表中,具有金属光泽、良好的导电性、导热性和可塑性的元素。
金属元素通常位于周期表的左侧和中间区域。
二、金属元素的电子排布金属元素的原子结构特点是外层电子较少,容易失去电子形成阳离子。
金属元素的最外层电子数一般小于4个,多数金属元素的最外层电子数为1、2或3个。
三、金属元素所处的周期金属元素主要位于周期表的左侧和中间区域,它们所处的周期一般为第1、2、3周期。
其中,第1周期的金属元素有锂(Li)、铍(Be);第2周期的金属元素有钠(Na)、镁(Mg)、铝(Al);第3周期的金属元素有钾(K)、钙(Ca)、钪(Sc)、钛(Ti)、钒(V)、铬(Cr)、锰(Mn)、铁(Fe)、钴(Co)、镍(Ni)、锌(Zn)、镓(Ga)、锗(Ge)、砷(As)、硒(Se)、溴(Br)等。
四、金属元素的性质1.金属光泽:金属元素具有独特的金属光泽,能够反射光线。
2.导电性:金属元素具有良好的导电性,可以传导电流。
3.导热性:金属元素具有良好的导热性,能够迅速传递热量。
4.可塑性:金属元素具有可塑性,可以被拉伸成丝或压制成片。
5.延展性:金属元素具有延展性,可以被拉伸成细丝或压制成薄片。
6.韧性:金属元素具有韧性,能够承受较大的冲击和振动。
7.耐腐蚀性:金属元素具有一定的耐腐蚀性,能够抵抗化学腐蚀。
五、金属元素的分类金属元素可以根据其化学性质和物理性质进行分类。
常见的金属元素分类有:1.碱金属:如锂(Li)、钠(Na)、钾(K)等。
2.碱土金属:如铍(Be)、镁(Mg)、钙(Ca)等。
3.过渡金属:如钛(Ti)、钒(V)、铬(Cr)、锰(Mn)等。
4.贵金属:如金(Au)、银(Ag)、铂(Pt)等。
5.轻金属:如铝(Al)、镁(Mg)等。
6.重金属:如铁(Fe)、铜(Cu)、锌(Zn)等。
六、金属元素的应用金属元素在工业、建筑、电子、航空等领域具有广泛的应用。
例如,铁(Fe)主要用于制造钢铁和建筑材料;铝(Al)广泛应用于包装、建筑和交通工具制造;铜(Cu)用于电线电缆和各种电器制造;金(Au)主要用于珠宝首饰和电子工业等。
实验七第一过渡系元素(一) (钛、钒、镉、锰)实验摘要:为了掌握钛、钒、镉、锰的主要氧化态的化合物的重要性质及各氧化态间的相互转化的条件,本实验用常用方法完成了钛、钒、镉、锰的氧化还原性质的探究及其缩合物的实验。
结果表明钛、钒、镉、锰的化合物均具有一定的氧化还原性,有些离子在不同条件下可以相互转化。
并且钒酸盐可以与酸缩合反应生成不同缩合度的多钒酸盐,随着pH值的下降,多钒根中含钒原子越多,缩合度越大,颜色越深。
关键词:钛的化合物钒的化合物镉的化合物锰的化合物缩合平衡氧化还原性溶解性实验用品:试管台秤蒸发皿PH试纸玻璃棒实验内容:1、取0、5偏钒酸铵固体放入蒸发皿中,在沙浴上加热,不断搅拌,记录反应过程中固体颜色的变化,把产物分成四份。
第一份固体中,加入1 mL浓H2SO4振荡,放置,观察现象。
第二份固体中,加入NaOH溶液加热。
第三份固体中,加入少量蒸馏水,煮沸、静置,待其冷却后,测定溶液的pH 。
第四份固体中,加入浓盐酸,微沸,检验气体产物,加入少量蒸馏水,观察溶液颜色。
三、铬的化合物的重要性质2-转化为Cr3+与CrO的相互转化)2-转变为CrO2-1、氢氧化锰(Ⅱ)的生成与性质结果及讨论:V2O5具有两性,既溶于酸又溶于碱。
向钒酸盐溶液中加酸,pH值逐渐下降,则生成不同缩合度的多钒酸盐,随着pH值的下降,多钒根中含钒原子越多,缩合度越大。
缩合度增大,溶液的颜色逐渐加深,即由淡黄色变到深红,溶液转为酸性后,缩合度不再改变,而就是获得质子的反应。
Cr2O72-与CrO42-离子之间在不同酸性环境中可以相互转化。
Cr(OH)3具有两性,既溶于酸又溶于碱。
CrO2中的Cr(Ⅲ)具有还原性,被氧化为Cr(VI) CrO42-该转化常在碱性介质中进行。
MnO2具有氧化性。
KMnO4具有氧化性,在不同介质中其还原产物不同。