元素周期表及元素周期律 高三一轮
- 格式:ppt
- 大小:3.60 MB
- 文档页数:92

第17讲元素周期表和元素周期律一、选择题:本题共10小题,每小题只有一个选项符合题目要求。
1.(2024·北京55中高三检测卷)中国科学家经过光谱分析发觉一颗锂元素含量极高的恒星。
下列说法不正确的是( B )A.LiOH的碱性强于Be(OH)2B.在第ⅠA族的元素中,锂元素的第一电离能最大C.依据对角线规则,锂元素和镁元素的有些性质相像D.原子光谱的产生与电子跃迁有关,可利用原子光谱中的特征谱线来鉴定元素[解析]同周期元素,从左到右元素的金属性依次减弱,最高价氧化物对应水化物的碱性减弱,则氢氧化锂的碱性强于氢氧化铍,A正确;同主族元素,从上到下的第一电离能依次减小,在第ⅠA族的元素中,氢元素的第一电离能最大,B错误;依据对角线规则可知,元素周期表中位于对角线上的锂元素和镁元素的有些性质相像,C正确;用光谱仪器摄取各种元素的电子的吸取光谱或放射光谱总称原子光谱,原子光谱的产生与电子跃迁有关,不同元素原子的吸取光谱或放射光谱不同,所以可以利用原子光谱中的特征谱线来鉴定元素,D正确,故选B。
2.(2024·湖南模拟)某同学设计了如图所示元素周期表,已知Z元素的最外层电子数是次外层的3倍。
空格中均有对应的元素填充。
下列说法正确的是( C )A.白格中都是主族元素,灰格中都是副族元素B.X、Y分别与Z形成的化合物都只有两种C.X、Y元素最高价氧化物对应的水化物酸性:X>YD.X、Y、Z的气态氢化物中最稳定的是X的氢化物[解析]依据Z元素的最外层电子数是次外层的3倍知Z为O,则X为N,依据图示可得出X、Y同族,则Y为P。
依据图示,白格填充的为主族元素和稀有气体元素,灰格填充的为副族元素和Ⅷ族元素,A错误;X和Z可以形成NO、NO2、N2O5等氮氧化物,不止两种,B错误;X的最高价氧化物对应的水化物为HNO3,Y的最高价氧化物对应的水化物为H3PO4,则酸性HNO3>H3PO4,C正确;元素非金属性越强,其气态氢化物的稳定性越强,同主族元素,从上到下非金属性减弱,同周期元素,从左到右非金属性增加,则非金属性强弱依次为O>N>P,气态氢化物最稳定的是Z的气态氢化物,即H2O,D错误。

课前完成导学案,掌握基本题型,时间不超过20分钟,A 层次完成所有会做的题目;B 层次完成除**所有会做的题目; C 层次完成不带*所有会做的题目,坚决杜绝抄袭现象1【基础知识梳理】 一、元素周期表 1、编排原则(1)按原子___________________________顺序从左到右排列。
(2)将__________________________相同的元素排成一个横行。
(3)把__________________________相同的元素(个别例外)排成一个纵行。
2、结构______纵行、____个族_______个主族,分别位于第___________________________________________________纵行 分别是___________________________________________________族______个副族,分别位于第___________________________________________________纵行 分别是___________________________________________________族 第Ⅷ族 位于第____________________纵行 0族(稀有气体)第________纵行 【针对练习】1、 请预测117号元素将在元素周期的位置A 第七周期 第ⅤA 族B 第七周期 第ⅦA 族C 第六周期 第ⅤA 族D 第六周期 第ⅦA 族2、A 、B 是元素周期表中相邻两主族的两种元素,若A 的原子序数为a,则B 的原子序数不可能是( ) A 、a-17 B 、 a-7 C 、a+18 D 、a+19 二、元素周期律1、定义:元素的性质随着_________________的递增而呈周期性变化的规律2、实质:元素性质的周期性变化 是________________________周期性变化的必然结果.3、元素周期律的内容(重点)【小结】元素金属性和非金属性比较规律 1、根据元素在元素周期表中的位置2、根据实验 (1)金属性强弱比较(2)非金属性强弱比较三、元素周期表和元素周期律的应用 1、元素周期表的分区金属区 非金属区课前完成导学案,掌握基本题型,时间不超过20分钟,A 层次完成所有会做的题目;B 层次完成除**所有会做的题目; C 层次完成不带*所有会做的题目,坚决杜绝抄袭现象2 【针对练习】3. (2007海南·13)下表为元素周期表的一部分,请回答有关问题:(1)⑤和⑧的元素符号是 和 ;(2)表中最活泼的金属是 ,非金属最强的元素是 ;(填写元素符号)(3)表中能形成两性氢氧化物的元素是 ,分别写出该元素的氢氧化物与⑥、⑨最高价氧化 物的水化物反应的化学方程式:; (4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:; 2.粒子半径大小的比较规律 ⑪原子①电子层数越多,原子半径越大②电子层数相同时,原子序数越大,半径 _________(稀有气体除外) ⑫离子①电子层数越多,离子半径越大②电子层结构相同时,原子序数越大,半径越小 ③同种元素的离子半径比较:r (阴离子) r (原子) r (阳离子) r (原子) 【针对练习】4.元素X 、Y 、Z 原子序数之和为36, X 、Y 在同一周期,X +与 Z 2- 具有相同的核外电子层结构。

元素周期表和元素周期律(建议用时:40分钟)一、选择题(每小题只有一个选项符合题意)1.下列说法中正确的是( )A.所有非金属元素都分布在p区B.最外层电子数为2的元素都分布在s区C.元素周期表中第ⅢB族到第ⅡB族10个纵行的元素都是金属元素D.同一主族元素从上到下,金属性呈周期性变化C 解析:非金属元素中氢在s区,其余非金属元素均分布在p区,A项错误;最外层电子数为2的元素可能在s区(如Mg)、p区(如He)或d区(如Ti、Fe)等,B项错误;同主族元素从上到下,金属性逐渐增强,非金属性逐渐减弱,属递变性质而不是周期性变化,D项错误。
2.(2020·江苏高考)下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是( )A.NaOH的碱性比Mg(OH)2的强B.Cl2得到电子的能力比Br2的弱C.原子半径r: r(Br)>r(Cl)>r(Mg)>r(Na)D.原子的最外层电子数n: n(Na)<n(Mg)<n(Cl)<n(Br)A 解析:同周期元素自左至右金属性减弱,所以金属性:Na>Mg,则碱性:NaOH>Mg(OH)2,故A正确;同主族元素自上而下非金属性减弱,所以非金属性:Cl>Br,所以Cl2得电子的能力比Br2强,故B 错误;电子层数越多原子半径越大,电子层数相同,核电荷数越小原子半径越大,所以原子半径:r(Br)>r(Na)>r(Mg)>r(Cl),故C错误;Cl和Br为同主族元素,最外层电子数相等,故D错误。
3.周期表中27号元素钴的方格中注明“3d74s2”,由此可以推断( )A.它位于周期表的第四周期第ⅡA族B.它的基态核外电子排布式可简写为[Ar]4s2C.Co2+的核外价层电子排布式为3d54s2D.Co位于周期表中第9列D 解析:“3d74s2”为Co的价层电子排布,其简写式中,也要注明3d轨道,B项错误;“7+2=9”,说明它位于周期表的第9列,位于第Ⅷ族,A项错误,D项正确;失电子时,应失去最外层的电子,即先失4s上的电子,Co2+的价层电子排布式为3d7,C项错误。
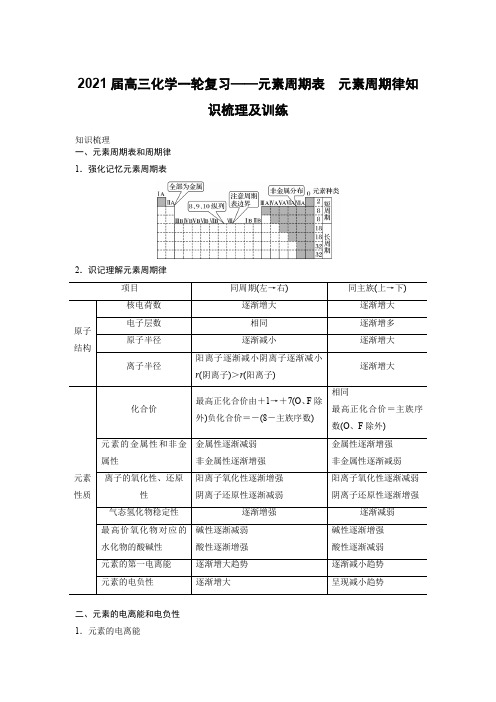
2021届高三化学一轮复习——元素周期表元素周期律知识梳理及训练知识梳理一、元素周期表和周期律1.强化记忆元素周期表2.识记理解元素周期律项目同周期(左→右)同主族(上→下)原子结构核电荷数逐渐增大逐渐增大电子层数相同逐渐增多原子半径逐渐减小逐渐增大离子半径阳离子逐渐减小阴离子逐渐减小r(阴离子)>r(阳离子)逐渐增大元素性质化合价最高正化合价由+1→+7(O、F除外)负化合价=-(8-主族序数)相同最高正化合价=主族序数(O、F除外)元素的金属性和非金属性金属性逐渐减弱非金属性逐渐增强金属性逐渐增强非金属性逐渐减弱离子的氧化性、还原性阳离子氧化性逐渐增强阴离子还原性逐渐减弱阳离子氧化性逐渐减弱阴离子还原性逐渐增强气态氢化物稳定性逐渐增强逐渐减弱最高价氧化物对应的水化物的酸碱性碱性逐渐减弱酸性逐渐增强碱性逐渐增强酸性逐渐减弱元素的第一电离能逐渐增大趋势逐渐减小趋势元素的电负性逐渐增大呈现减小趋势二、元素的电离能和电负性1.元素的电离能第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。
常用符号I1表示,单位为kJ·mol-1。
(1)原子核外电子排布的周期性随着原子序数的增加,主族元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,主族元素原子的外围电子排布重复出现从n s1到n s2n p6的周期性变化(第一周期除外)。
(2)元素第一电离能的周期性变化随着原子序数的递增,元素的第一电离能呈周期性变化:同周期从左到右,第一电离能有逐渐增大的趋势,稀有气体的第一电离能最大,碱金属和氢的第一电离能最小;同主族从上到下,第一电离能有逐渐减小的趋势。
说明同周期元素,从左到右第一电离能呈增大趋势。
同能级的轨道为全满、半满时第一电离能较相邻元素要大,即第ⅡA族、第ⅤA族元素的第一电离能分别大于同周期相邻元素。
如Be、N、Mg、P。
(3)元素电离能的应用①判断元素金属性的强弱电离能越小,金属越容易失去电子,金属性越强;反之,则越弱。

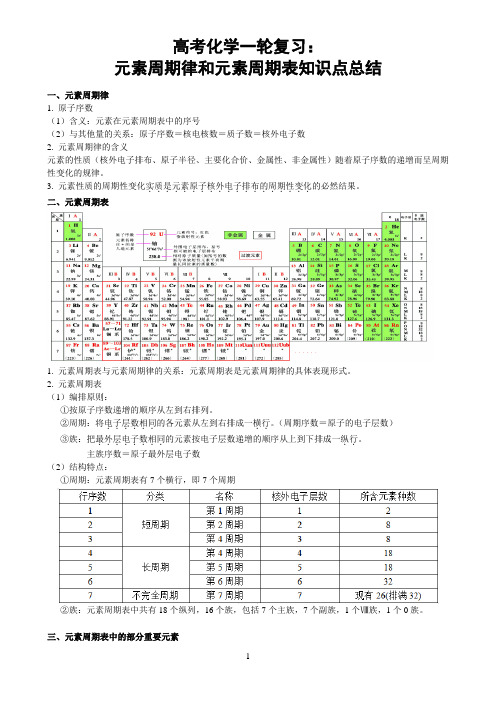
高考化学一轮复习:元素周期律和元素周期表知识点总结一、元素周期律1. 原子序数(1)含义:元素在元素周期表中的序号(2)与其他量的关系:原子序数=核电核数=质子数=核外电子数2. 元素周期律的含义元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着原子序数的递增而呈周期性变化的规律。
3. 元素性质的周期性变化实质是元素原子核外电子排布的周期性变化...................的必然结果。
二、元素周期表1. 元素周期表与元素周期律的关系:元素周期表是元素周期律的具体表现形式。
2. 元素周期表(1)编排原则:①按原子序数递增的顺序从左到右排列。
②周期:将电子层数相同..。
(周期序数=原子的电子层数)......的各元素从左到右排成一横行③族:把最外层电子数相同..。
........的元素按电子层数递增的顺序从上到下排成一纵行主族序数=原子最外层电子数(2)结构特点:①周期:元素周期表有7个横行,即7个周期②族:元素周期表中共有18个纵列,16个族,包括7个主族,7个副族,1个Ⅷ族,1个0族。
三、元素周期表中的部分重要元素四、焰色反应1、Na 黄Li 紫红K 浅紫(透过蓝色钴玻璃观察,因为钾里面常混有钠,黄色掩盖了浅紫色)2、Rb 紫Ca 砖红色Sr 洋红Rb 紫Cu 绿Ba 黄绿Co 淡蓝五、微粒半径的大小与比较(1)一看“电子层数”:当电子层数不同时,电子层数越多,半径越大。
如:同一主族元素,电子层数越多,半径越大如:r(Cl)>r(F)、r(O2-)>r(S2-)、r(Na)>r(Na+)。
(2)二看“核电荷数”:当电子层数相同时,核电荷数越大,半径越小。
如:同一周期元素,电子层数相同时核电荷数越大,半径越小。
如r(Na)>r(Cl)、r(O2-)>r(F-)>r(Na+)。
(3)三看“核外电子数”:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
如:r(Cl-)>r(Cl) 、r(Fe2+)>r(Fe3+)。
2021年高考化学一轮复习专题6.2 元素周期表和元素周期律讲案(含解析)复习目标:1、掌握元素周期律的实质;了解元素周期表(长式)的结构(周期、族)及其应用。
2、以第三周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
3、以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
4、了解金属、非金属在元素周期表中的位置及其性质的递变规律。
基础知识回顾:一、元素周期表1、元素周期表的编排原则(1)横行:把电子层数相同的元素按原子序数递增的顺序从左至右排成横行。
(2)纵行:把不同横行中最外层电子数相等的元素,按电子层数递增的顺序,由上而下排成纵行。
2、元素周期表的结构(1)周期(七个横行,七个周期)(2)族(18个纵行,16个族)族序ⅢBⅣBⅤBⅥBⅦBⅠBⅡB 第Ⅷ族第 8、9、10 共3个纵行0族第 18 纵行3.元素周期表的分区按构造原理最后填入电子的能级的符号可把周期表里的元素划分为5个区,分别为s区、d区、ds、p 区、f区,各区分别包括ⅠA、Ⅱ族元素、ⅢB~Ⅷ族元素、ⅠB、ⅡB族元素、ⅢA~ⅦA族和0族元素、镧系和锕系元素,其中s区(H除外)d区、ds区和f区的元素都为金属。
【注意】根据元素原子最后一个电子填充的原子轨道的所属能级不同,将元素周期表中的元素分为5个区,并以此电子所处能级的符号作为该区的符号。
元素的化学性质主要决定于价电子,而周期表的分区主要基于元素的价电子构型,处于同一区内的元素价电子排布是相似的,具体情况如下表所示。
分区价层电子的电子排布式s区Ns1~2p区ns2np1~6d区(n-1)d1~9ns1~2ds区(n-1)d10ns1~2f区(n-2)f1~14(n-1)d0~2ns2【典型例题1】已知X、Y、Z三种主族元素在周期表中的位置如图所示,设X的原子序数为a。
则下列说法不正确的是( ) A.Y与Z的原子序数之和可能为2aB.Y的原子序数可能为a-17C.Z的原子序数可能为a+31D.X、Y、Z一定为短周期元素【迁移训练1】已知M、N是元素周期表中同主族的两种元素。
元素周期律和元素周期表(精练)完卷时间:50分钟一、选择题(每小题只有一个正确选项,共12*5分)1.(2020年全国统一考试化学试题(新课标Ⅲ))W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。
下列叙述正确的是A.非金属性:W> X>Y> Z B.原子半径:Z>Y>X>WC.元素X的含氧酸均为强酸D.Y的氧化物水化物为强碱【答案】D【解析】根据题干信息可知,W、X、Y、Z为原子序数依次增大的短周期元素,化合物XW3与WZ相遇会产生白烟,则WX3为NH3,WZ为HCl,所以W为H元素,X为N元素,Z为Cl元素,又四种元素的核外电子总数满足X+Y=W+Z,则Y的核外电子总数为11,Y为Na元素。
根据上述分析可知,W为H元素,X为N元素,Y 为Na元素,Z为Cl元素,则A.Na为金属元素,非金属性最弱,非金属性Y<Z,A选项错误;B.同周期元素从左至右原子半径依次减小,同主族元素至上而下原子半径依次增大,则原子半径:Na>Cl>N>H,B 选项错误;C.N元素的含氧酸不一定全是强酸,如HNO2为弱酸,C选项错误;D.Y的氧化物水化物为NaOH,属于强碱,D选项正确;答案选D。
2.(北京市2020年普通高中学业水平等级性考试)已知:33As(砷)与P为同族元素。
下列说法不正确的是A.As原子核外最外层有5个电子B.AsH3的电子式是C.热稳定性:AsH3<PH3D.非金属性:As<Cl【答案】B【解析】A.As与P为同族元素,为VA族元素,则其原子核外最外层有5个电子,A说法正确;B.AsH3属于共价化合物,电子式与氨气相似,为,B说法不正确;C.非金属的非金属性越强,其气体氢化物越稳定,非金属性As<P,热稳定性:AsH3<PH3,C说法正确;D.同周期元素,原子序数越小,非金属性越强,非金属性:As<Cl,D说法正确;答案为B。