镁和铝的重要化合物
- 格式:ppt
- 大小:214.00 KB
- 文档页数:13
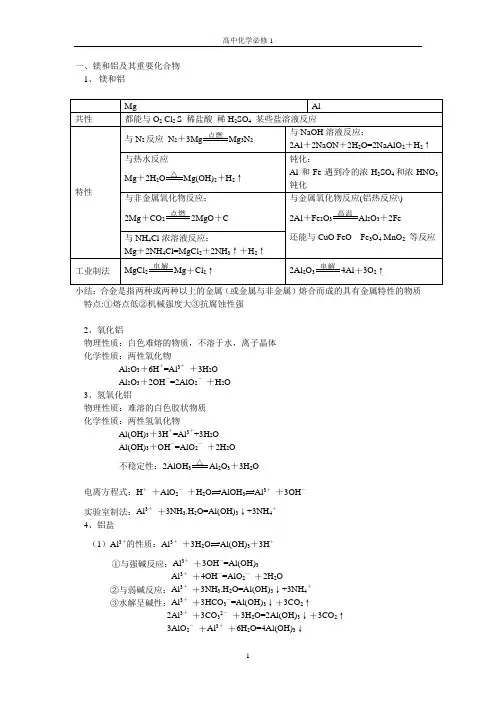
一、镁和铝及其重要化合物1、镁和铝特点:①熔点低②机械强度大③抗腐蚀性强2、氧化铝物理性质:白色难熔的物质,不溶于水,离子晶体化学性质:两性氧化物Al2O3+6H+=Al3++3H2OAl2O3+2OH-=2AlO2-+H2O3、氢氧化铝物理性质:难溶的白色胶状物质化学性质:两性氢氧化物Al(OH)3+3H+=Al3++3H2OAl(OH)3+OH-=AlO2-+2H2O△不稳定性:2AlOH3Al2O3+3H2O电离方程式:H++AlO2-+H2O33++3OH-实验室制法:Al3++3NH3.H2O=Al(OH)3↓+3NH4+4、铝盐(1)Al3+的性质:Al3++3H2O Al(OH)3+3H+①与强碱反应:Al3++3OH-=Al(OH)3Al3++4OH-=AlO2-+2H2O②与弱碱反应:Al3++3NH3.H2O=Al(OH)3↓+3NH4+③水解呈碱性:Al3++3HCO3-=Al(OH)3↓+3CO2↑2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑3AlO2-+Al3++6H2O=4Al(OH)3↓总结:AlCl 3溶液滴加到NaOH 溶液中开始无沉淀后有沉淀NaOH 溶液滴加到AlCl 3溶液中先出现沉淀后沉淀溶解 (2)AlO 2-的性质AlO 2- +2H 2O=Al(OH)3↓+OH - ① 与强酸反应: AlO 2- +H +(少量) +H 2O=Al(OH)3↓ AlO 2-+4H + (过量)=Al 3+ +H 2O②与弱酸反应:AlO 2-+CO 2+2H 2O=Al(OH)3↓+HCO 3-③与水解呈酸性的物质反应:3AlO 2- +Al 3+ +6H 2O=4Al(OH)3↓3AlO 2- +Fe 3+ + 6H 2O=3Al(OH)3↓+Fe(OH)3↓总结:将HCl 滴加到NaAlO 2中先出现沉淀后溶解 将NaAlO 2滴加到HCl 中开始无沉淀后有沉淀 (3)明矾2KAl(SO 4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO 4+K 2SO 4 KAl(SO 4)2+2Ba(OH)2=2BaSO 4↓+KAlO 2+H 2O小结:Al 3+AlOH 3AlO 2AlOH 3Al 3+ 未知溶液白色沉淀白色沉淀溶解,从而未知溶液中含Al 3+未知溶液白色沉淀白色沉淀溶解,从而未知溶液含AlO 2-二、铁及其重要化合物1、铁:第四周期第Ⅷ族 26号元素 各层电子数为2 8 14 2 常见价态+2和+3(1)与弱氧化剂反应 Fe Fe 2+ S +Fe I 2+Fe 2(2)与强氧化剂反应Fe Fe 3+ 3Cl 2+2Fe=2FeCl 3 3Br 2+2Fe 3稀硝酸:Fe +4HNO 3=Fe(NO 3)3+2NO ↑+2H 2O 3Fe +8HNO 3=3Fe(ON 3)3+2NO 2↑+4H 2O特殊:3Fe +2O 23O 4 3Fe +4H 2O 3O 4+4H 2↑2、 氧化物 FeO :黑色固体不溶于水,在空气中加热会生成Fe 3O 4Fe 2O 3:红棕色固体不溶于水,俗称铁红、铁锈,可做红色染料 Fe 3O 4:黑色固体不溶于水,俗称磁性氧化铁3、 氢氧化物Fe(OH)2 白色沉淀迅速变成灰绿色,最后变成红褐色 4Fe(OH)2+O 2+2H 2O=4Fe(OH)3Fe(OH)3:红褐色沉淀 具有不稳定性,受热易分解2FeOH 3Fe 2O 3+3H 2O4、Fe 2+ Fe 3+的盐 (1)Fe 2+的性质 ①颜色:浅绿色△高温点燃△△△过量HClHCl 过量NaOH H +H +OH - OH -②易水解:Fe2++2H2O2+2H+如何保存FeSO4溶液:加几滴稀硫酸或加铁粉③强还原性:与O2Cl2Br2HNO3浓H2SO4KMnO4酸性溶液反应Fe2+检验:①加碱法(NaOH或氨水)②先加KSCN溶液,无现象再加氨水会出现血红色(2)Fe3+的性质①颜色:棕黄色②易水解:Fe3++3H2O3+3H+Fe3++3HCO3-=Fe(OH)3↓+3CO2↑(与CO32-AlO2-也双水解) ③强氧化性:氧化S2-I-SO2SO32-Cu Fe2Fe3++2S2-=2Fe2++2S↓2Fe3++2I-=2Fe2++I2 (Fe3+能使湿润的淀粉KI试纸变蓝)2Fe3++Cu=2Fe2++Cu2+④络合性:KSCN溶液--血红色Fe3++3SCN-=Fe(SCN)3↓⑤制Fe(OH)3胶体:FeCl3+3H2O=Fe(OH)3胶体+3HCl⑥与苯酚显紫色⑧Fe3+检验:溶液加碱法加苯酚法。


镁和铝的重要化合物(3节时)镁和铝的重要化合物 (3节时)目的要求】: 1. 认识镁和铝的几种重要化合物的性质和主要用途;2. 认识氧化铝和氢氧化铝的两性和主要用途;3. 了解复盐和明矾的净水作用。
【重、难点】: 氢氧化铝的两性【教学方法】: 自学阅读,思考总结,启发引导。
【课时安排】: 第一课时完成镁的重要化合物及氧化铝的物理性质和用途第二课时完成铝的重要化合物的性质和用途第三课时简单介绍明矾及知识归纳和拓展,评讲练习【教学过程】: (第一节时)〖引言〗:直接引入〖自学阅读〗:学生阅读课本26-27页〖投影〗:[思考讨论]:1. 课本介绍了MgO和MgCl2的哪些知识?2. MgO有何突出的物理特性?因而有何应用?3. 自然界无MgO矿石,怎样得到它?有哪些制取途径,哪些途径合理?4. MgCl2主要用于做什么?如何得到它,什么方法更有实际意义?5. 从海水中提取MgCl2,最后冶炼Mg,运用了MgCl2什么化学性质?〖演示实验〗:1.展示MgO和MgCl2的样品,有学生观察总结物理性质。
2. MgO溶于水,滴加酚酞〖师生活动〗:教师引导,学生回答、讨论思考题,得出结论。
〖补充讲解〗:海水的综合利用1. 海水咸、苦的原因;量多:淡水占99%,咸水占1%2. 海水含盐量高,若全部提取出来,地壳陆地可上升160米3. 海水淡化问题及将来解决办法的设想【板书设计】:一、镁的'重要化合物MgO MgCl2物理性质熔点很高吸水性,易潮解1.性质: 酸 HCl化学性质MgO + H2O = Mg(OH)2MgCl2(盐) + 碱 Mg(OH)2(极少) 盐……电解2.用途: 耐火材料 MgCl2 Mg提取NaClCa(OH)2HCl高温3.制法: MgCO3=== MgO + CO2↑海水苦卤 Mg(OH)2 MgCl2(第二节时)〖引入〗:直接引入〖演示实验〗:展示Al2O3和Al(OH)3样品〖投影〗:[思考讨论]:1. 有何突出的化学性质?2. 有化学方程式和离子方程式表示Al2O3和Al(OH)3分别与H2SO4和NaOH的反应。
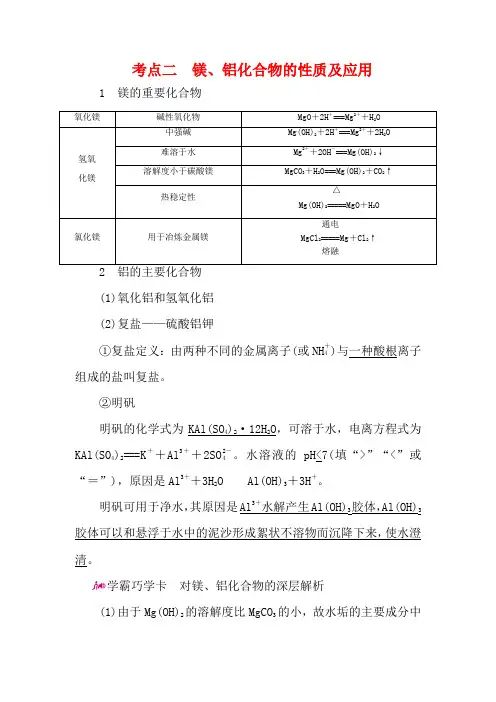
考点二 镁、铝化合物的性质及应用1 镁的重要化合物 氧化镁 碱性氧化物 MgO +2H +===Mg 2++H 2O 氢氧化镁 中强碱Mg(OH)2+2H +===Mg 2++2H 2O 难溶于水 Mg 2++2OH -===Mg(OH)2↓ 溶解度小于碳酸镁MgCO 3+H 2O===Mg(OH)2+CO 2↑ 热稳定性 Mg(OH)2=====△MgO +H 2O氯化镁 用于冶炼金属镁 MgCl 2=====通电熔融Mg +Cl 2↑2 铝的主要化合物(1)氧化铝和氢氧化铝(2)复盐——硫酸铝钾①复盐定义:由两种不同的金属离子(或NH +4)与一种酸根离子组成的盐叫复盐。
②明矾明矾的化学式为KAl(SO 4)2·12H 2O ,可溶于水,电离方程式为KAl(SO 4)2===K ++Al 3++2SO 2-4。
水溶液的pH<7(填“>”“<”或“=”),原因是Al 3++3H 2O Al(OH)3+3H +。
明矾可用于净水,其原因是Al 3+水解产生Al(OH)3胶体,Al(OH)3胶体可以和悬浮于水中的泥沙形成絮状不溶物而沉降下来,使水澄清。
学霸巧学卡 对镁、铝化合物的深层解析(1)由于Mg(OH)2的溶解度比MgCO 3的小,故水垢的主要成分中是Mg(OH)2,而非MgCO3。
(2)Al2O3、Al(OH)3只与强酸、强碱溶液反应,与氨水和碳酸溶液不反应。
(3)Al3+只能存在于酸性溶液中,AlO-2只能存在于碱性溶液中。
若将分别含Al3+和AlO-2的盐溶液混合,发生反应:Al3++3AlO-2+6H2O===4Al(OH)3↓。
(4)Al2O3、Al(OH)3是中学阶段接触的唯一与碱反应的金属氧化物和氢氧化物,经常应用到除杂、计算题中,所以一定要熟记这两个反应的离子方程式。
(5)明矾净水只能除去水中的悬浮杂质,不能杀菌消毒,与氯气消毒原理不同。
1.思维辨析(1)在加热情况下利用氢气还原氧化铝的方法得到金属铝。


第09讲镁、铝及其重要化合物考情分析网络构建考点一镁及其化合物【夯基·必备基础知识梳理】知识点1镁的性质知识点2镁的氧化物MgO知识点3镁的氢氧化物Mg(OH)2知识点4镁的其他化合物【提升·必考题型归纳】考向1考查镁及其化合物的结构、性质及应用考向2考查镁及其化合物制备的工艺流程考点二铝及其化合物【夯基·必备基础知识梳理】知识点1铝的性质知识点2氧化铝知识点3氢氧化铝知识4常见的铝盐知识5数形结合与“铝三角”【提升·必考题型归纳】考向1考查铝及其化合物的结构、性质及其应用考向2考查铝热反应及其应用考向3考查铝及其化合物制备的工艺流程考向4考查铝及其化合物与强酸、强碱反应有关计算真题感悟考点要求考题统计考情分析镁、铝及其化合物的性质与应用2023浙江1月卷12题,2分2022浙江1月卷8题,2分2021浙江1月卷8题,2分从近三年高考试题来看,铝、镁及其化合物的性质与应用仍是高考的命题点。
高考中一方面考查铝及其化合物的性质在日常生活、生产中的应用,另一方面以“铝三角”转化关系为载体,考查图像分析和计算能力等。
预测新的一年高考可能会在选择题或化工流程图题中考查金镁、铝、氧化镁、氧化铝及氢氧化镁、镁、铝及其化合物的制备的工艺流程2023辽宁卷16题,3分2022全国卷26题,1分2021湖南卷6题,3分氢氧化铝的性质与应用或在化工流程图中考查铝及其重要考点一镁及其化合物知识点1镁的性质1.镁的原子结构及存在(1)镁的原子结构:镁元素在元素周期表中位于第三周期第ⅡA族,原子结构示意图为。
镁是较活泼的金属,在金属活动性顺序中位于铝、锌、铁的前面。
镁在化学反应中,能表现出较强的金属性,即失电子的能力强,是常用的还原剂。
(2)镁的存在:镁蕴藏量丰富,在宇宙中含量第八,在地壳中含量丰度2%。
含镁矿物主要来自白云岩[CaMg(CO3)2]、菱镁矿(MgCO3)、水镁矿[Mg(OH)2]、光卤石(KCl·MgCl2·6H2O)和橄榄石[(Mg,Fe)2SiO4]等。


第51节镁和铝的重要化合物镁和铝在自然界中的分布很广。
地壳中铝是含量最多的金属元素,约占地壳总质量的7.7%。
镁占地壳总质量的2.0%,镁、铝比较活泼,都以化合态存在于自然界中。
含镁的主要矿物有光卤石、白云石、菱镁矿、滑石和石棉等。
此外,海水中也含有大量的镁盐。
含铝的矿物主要有长石、云母、铝土矿和明矾等。
一、镁的重要化合物1.氧化镁(MgO )氧化镁是一种松软、难熔的白色粉末。
镁在空气中燃烧可以生成氧化物。
工业上一般用煅烧菱镁矿的方法来制取氧化物。
32MgCO MgO CO →+↑煅烧MgO 是一种碱性氧化物,可以与水缓慢地反应生成氢氧化镁:22MgO H O Mg(OH)+→MgO 的熔点高,硬度大,所以是优良的耐火材料,常用来制耐火砖、耐火管和坩埚等2.氯化镁(MgCl 2)氯化镁是一种无色、苦味、易溶性晶体,极易吸收空气中的水分而潮解,粗盐在潮湿的空气中容易吸湿受潮,就是由于其中含有少量氯化镁的缘故。
电解熔融状态的氯化镁,可以制得金属镁。
因此,MgCl 2是制取Mg 的重要原料。
MgCl 2(熔融)−−−→通电2Mg Cl +↑光卤石(KCl·MgCl 2·6H 2O )中含有氯化镁,把光卤石溶解,提取出KCl 后,把溶液浓缩,就得到六水合氯化镁晶体。
除了陆地上有大量含镁的矿物以外,海洋中也有大量的镁盐,海水中Mg 2+的平均含量为0.13%,仅次于氯和钠,因此海水也是镁的主要来源之一。
二、铝的重要化合物1.氧化铝(Al 2O 3)Al 2O 3是一种白色难熔的物质,熔点为2054℃,沸点为2980℃,是较好的耐火材料,也是冶炼铝的原料。
刚玉是天然产的无色A 2O3晶体,硬度很大,仅次于金刚石和碳化硅,可被用来制造砂轮、机器轴承和钟表钻石等。
刚玉中若含有微量氧化铬,为红宝石;含有铁和钛的氧化物的为蓝宝石。
红宝石是优良的激光材料。
自然界中存在的铝的矿物主要有铝土矿。
铝土矿又称矾土,是由一水合氧化铝(Al 2O 3·H 2O )、三水合氧化铝(Al 2O 3·3H 2O )及少量Fe 2O 3和石英等杂质组成的。



§ 2-3镁和铝的重要化合物(三)教学内容:高二化学(必修)第二章第三节 教学目的:氢氧化铝的两性及与此有关的计算和图像.教学过程:[复习巩固]让学生在练习本上写出下列反应的化学方程式和离子反应方程式(1) 氧化镁溶于酸溶液(2) 氧化铝溶于酸溶液(3) 氧化铝溶于碱溶液(4) 氢氧化铝溶于酸溶液(5) 氢氧化铝溶于碱溶液(6) 实验室制取氢氧化铝(7) 向偏铝酸钠溶液中通入二氧化碳至过量三.氢氧化铝两性的原因启发学生从铝在周期表中的位置角度进行思考和分析Mg,AI,Si 三种种原子的电子层数相同,但最外层电 子数不等。
Mg 是金属元素,Si 是非金属,AI 则介于 Mg 和Si 之间。
B ,Al, Ga 三种元素的原子都具有相同的最外层电 子数,但电子层数不等。
B 是非金属元素,Ga 是金属元素,Al 介于B 和 Ga 之间。
因此Al 的化合物---Al 2O 3, Al(OH) 3均具有两性。
四.AI 3+,AIOJ , Al(OH) 3之间相互转化图像:B Mg Al :Si Ga+ 3OH - = Al(OH) 3 J3 + OH _ = AlO / + 2H 20(一)向一定量氯化铝溶液中逐滴加氢氧化钠溶液:现象:立即产生白色沉淀-沉淀逐渐增多-最多(n (OH T =3 ) n (AI 3+)-逐渐减少-沉淀消失 (n (OH _) =4 ) n (AI 3+) 发生的反应及的AI(OH) 3沉淀量分析:AI(OH) 3的沉淀量与n(OH 一)有关:(二 )和一定量氢氧化钠溶液逐滴滴加氯化铝溶液: Al 3+ + 40H - = AlO 2- + 2H 2O3AIO 2- + AI 3+ + 6H 20 = 4 AI(OH) 3 J2- + H + + H 20 = AI(OH) 3 J+ 3+3 + 3H = AI + 3H 2O 2-+ 4H + = AI 3+ + 2H 2O2- + AI 3+ + 6H 2O = 4 AI(OH) 3 J 四•关于AI (OH ) 3的计算:(一)向可溶性铝盐溶液(AI 3+ )逐滴加入NaOH (或强碱)溶液: 3+(mol)(三)一定量偏铝酸钠溶液逐滴滴加盐酸溶(四)向一定量盐酸溶液中逐滴滴加偏铝酸钠溶基本图形:(moI)n(AI3+)(1) 当n(OH 4 <3时,沉淀量逐渐增大,此时A产过量,以n (OH-)n(AI3+)为标准计算。
镁、铝及其重要化合物一、镁及其化合物镁合金强度高,机械性能好,制造汽车,飞机,火箭的重要材料,冶金时,镁常用作还原剂和脱氧剂. 常温下氧化生成氧化物保护层,具有抗腐蚀的性质.镁与O2,N2,CO2等气体燃烧.2Mg+O22MgO CO2+2Mg2MgO+C 3Mg+N2Mg3N2镁与SiO2:2Mg+SiO2=2MgO+Si镁与冷水反应很慢,在加热时反应加快.Mg+2H2O=Mg(OH)2+H2↑镁与非氧化性酸.Mg+2HCl=MgCl2+H2↑镁与水解显酸性的盐溶液的反应. Mg+2NH4Cl =MgCl2+2NH3↑+H2↑镁盐与氨水,产生Mg(OH)2沉淀.Mg(OH)2又能溶解在NH4Cl溶液中.前者由Mg(OH)2的特殊溶解性决定.在常见的难溶性氢氧化物中,Mg(OH)2的溶解度最大.故产生Mg(OH)2的条件:浓的Mg2+ 盐溶液与浓氨水反应.后者是由Mg(OH)2的电离性质和+4NH的水解性质决定.通常认为Mg(OH)2完全电离,能溶解在饱和NH4Cl溶液中,MgCl2+2NH3·H2O Mg(OH)2+2NH4Cl海水提镁:㈠海水加碱,得氢氧化镁沉淀,沉淀分离出来再加盐酸,变成氯化镁;后过滤,干燥,电解得镁.Mg2++2OH-==Mg(OH)2↓,Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2Mg+Cl2↑㈡从海水提取出食盐、KCl、Br2以后留下的母液浓缩,得到卤块,主要成分是MgCl2·6H2O,然后脱水, MgCl2·6H2O MgCl2+6H2O,最后电解熔融的氯化镁得到镁.氧化镁(白色粉末,高熔点,碱性氧化物,)与水缓慢作用,与酸反应.MgO+2HCl=MgCl2+H2O MgO+H2O Mg(OH)2氢氧化镁(白色粉末,难溶于水)与H+作用,与NH4Cl溶液作用,对热不稳定.Mg(OH)2+2HCl=MgCl2+2H2O Mg(OH)2MgO+H2O↑二、铝及其化合物铝(银白色金属,导电性仅次于银、铜和金。