莽草酸代谢
- 格式:docx
- 大小:27.47 KB
- 文档页数:2

一、莽草酸途径莽草酸途径,又称为莽草酸代谢途径,是一种生物合成途径,涉及到植物细胞壁的合成与代谢。
在这条途径中,莽草酸被转化为苯丙烷类化合物,进而参与植物细胞壁的合成。
莽草酸途径是植物细胞壁生物合成途径的重要组成部分,对于植物的生长发育具有重要意义。
1. 莽草酸的来源莽草酸是一种重要的中间代谢产物,由植物体内的糖代谢途径合成。
在植物细胞中,葡萄糖通过糖醇磷酸途径(PPP)转化为磷酸葡糖酸,接着经过一系列酶催化反应转化为莽草酸。
2. 莽草酸的转化莽草酸在细胞质中被转化为对羟基苯丙酸,接着通过酶催化反应,对羟基苯丙酸被还原为苯丙烷,参与到植物细胞壁的合成过程中。
3. 莽草酸途径在植物生长发育中的作用莽草酸途径是植物细胞壁合成途径的关键步骤,对于植物的生长发育具有重要意义。
植物细胞壁决定了植物的结构与形态,同时也与植物的适应环境能力息息相关。
莽草酸途径在植物生长发育过程中发挥着重要作用。
二、苯丙烷苯丙烷是一种重要的有机化合物,广泛存在于植物细胞壁中,并参与植物的生长发育过程。
在植物中,苯丙烷通过莽草酸途径合成,是植物细胞壁合成途径的重要产物。
1. 苯丙烷的结构与性质苯丙烷是一种具有芳香环的有机化合物,含有一个苯环和一个丙烷基团。
其结构稳定,化学性质活泼,是一种重要的合成原料。
2. 苯丙烷在植物细胞壁中的作用苯丙烷是植物细胞壁合成途径的重要中间产物,参与到植物细胞壁的合成过程中。
植物细胞壁决定了植物的形态与结构,同时也对植物的生长发育起着重要作用。
3. 苯丙烷的应用苯丙烷作为一种重要的有机合成原料,广泛应用于香料、染料、医药、农药等领域。
其稳定的化学结构和丰富的化学性质,使其成为了许多合成化合物的重要前体。
三、特异木质素合成途径特异木质素合成途径是植物细胞壁生物合成途径的重要组成部分,涉及到植物木质素合成的重要中间产物。
在这条途径中,各种酶催化反应将苯丙烷类化合物转化为木质素,参与植物细胞壁的合成。
1. 特异木质素合成途径的主要步骤在特异木质素合成途径中,苯丙烷类化合物首先经过酶催化反应转化为对前苯醇,随后再经过一系列酶催化反应转化为丙烯基酚。

莽草酸可用于出口鸡场【产品简介】莽草酸存在于大量高等植物或微生物中。
众所周知的抗流感新宠“达菲”就是通过莽草酸进一步衍生化得到的。
因其口服吸收好,生物利用度高,抗病毒效果可靠,使其在流感流行期间,全球掀起了抢购的热潮。
【分子结构】化学式:3,4,5-三羟基-1-环己烯-1-羧酸分子式:C7H10O5分子量:174.15【性状】类白色精细粉末,易溶于水,在水中的溶解度为18g/100mL,难溶于氯仿、苯和石油醚,气味辛酸。
【药理作用】莽草酸可以直接通过影响花生四烯酸代谢,抑制血小板聚集,抑制动、静脉血栓及脑血栓形成发挥作用,莽草酸还具有抗炎、镇痛作用。
莽草酸可以作为抗病毒和抗癌药物中间体,在体内莽草酸还可转化为多种对病毒、细菌和癌细胞有抑杀作用的物质。
抗菌抗肿瘤作用,1987年有报道中提到日本学者发现莽草酸的一种化合物对海拉细胞株(HeLacells)和埃希利腹水癌(Ehrlichascitescarcinoma)有明显的抑制作用,并能延长接种白血病细胞L1210的小鼠的存活时间,而且毒性相对较低,其抑制作用主要与硫氢化物反应有关。
流感病毒在宿主细胞内复制表达和组装之后,会以出芽的形式突出宿主细胞,但与宿主细胞以凝血酶-唾液酸相连接,神经氨酸酶以唾液酸为作用底物,可催化唾液酸水解,解除成熟病毒颗粒与宿主细胞之间的联系,使之可以自由移动侵袭其他健康的宿主细胞。
如果抑制神经氨酸酶的活性可以阻止病毒颗粒的释放,切断病毒的扩散链,从而抑制病毒的复制。
在发病后24小时内使用,病程会减短20%-30%,病情会减轻25%,作为预防用药,对流感病毒暴露者的保护率在60%-80%之间。
另外还可以通过阻断病毒的糖蛋白合成及抑制病毒成熟后从细胞的释放达到抗病毒效果。
口服迅速被吸收,进入血液循环,2~3小时后达血药峰浓度,其在体内可以定向分布至肺部、支气管、鼻窦等部位。
【特点】药效更持久:本品在体内发挥药效的同时,其体内衍生化产物同样具有抗病毒作用,因而药效稳定时间更长。

莽草酸途径生物碱的生物合成莽草酸(Scopolamine)是一种具有神经抑制活性的天然生物碱,广泛存在于茄科植物的树龙眼(Hyoscyamus niger)和曼陀罗(Datura stramonium)中。
被用作药物,主要用于镇静、止呕等药物配方中。
莽草酸的生物合成途径非常复杂,涉及多个酶和中间代谢物的参与。
本文将从植物开始,详细介绍莽草酸生物合成的途径。
莽草酸是一种羧酸类生物碱,首先我们可以从植物的羧酸代谢途径开始。
在植物细胞中,葡萄糖通过糖酷酶(Hexokinase)和磷酸果糖同工酶(Phosphofructokinase)的催化下,生成果糖-6-磷酸(F6P)。
F6P可以进一步被磷酸果糖异构酶(Phosphopentose isomerase)转化为果糖-6-磷酸(G6P)。
G6P进入戊糖磷酸途径,在戊糖-6-磷酸糖化酶(G6PDH)的催化下,转化为戊糖-6-磷酸(Glu6P)。
Glu6P通过磷酸葡萄糖异构酶(Phosphoglucoisomerase)和酮糖转移酶(Transketolase)的参与下,生成吡喃糖化合物庚糖醛酸(Sedoheptulose-7-phosphate,S7P)。
接下来,庚糖醛酸会参与到幂坏脱羧酶(Polyol dehydrogenase)催化的反应中,转化为丙酮醛(Dihydroxyacetone phosphate,DHAP)和乙酰辅酶A(acetyl-CoA)。
丙酮醛进一步参与到半乳糖磷酸途径中,在磷酸醛糖庚糖醛酸脱氢酶(Phosphogluconate dehydrogenase)的催化下,转化为戊酮糖酸(Ketogluconate)。
戊酮糖酸通过环化酶(Cyclase)的参与,生成γ-酮戊糖酸(γ-Ketoglutarate)。
γ-酮戊糖酸是一个中间代谢物,在α-酮戊二酸脱羧酶(Alpha-ketoglutarate decarboxylase)的作用下,转化为D-(-)-鸟脑酮酸(D-(–)-Dihydrozeatin)。


葡萄果实中莽草酸途径与多酚积累的关系摘要概述了莽草酸途径及其在植物次生代谢中的重要作用、葡萄果实类黄酮代谢与调控的研究现状,并对莽草酸代谢与葡萄多酚积累的关系进行探讨和展望。
关键词莽草酸途径;类黄酮代谢;多酚积累葡萄果实RelationshipbetweenShikimateAcidPathwayandPolyphenolAccumulationinGrap eBerriesLI Chun-lan(College of Biolgical Science and Technology,Beijing Forestry University,Beijing 100083)AbstractIn this paper,shikimate acid pathway and its role in plant secondary metabolism were summarized,as well as the research status offlavonoid metabolism and regulation in grape berries. Finally,the relationship between shikimate acid metabolism and polyphenol accumulation wasdiscussed.Key wordsshikimate acid pathway;flavonoid metabolism;polyphenol accumulation grape berry1莽草酸途径的简介莽草酸途径是存在于植物、真菌和微生物中重要的代谢途径,是连接糖代谢和次生代谢的主要桥梁。
糖酵解途径(EMP)产生的磷酸烯醇式丙酮酸(PEP)和戊糖磷酸途径(PPP)产生的赤藓糖-4-磷酸(E4P)进入莽草酸途径(Shikimate pathway),经过7个步骤的反应形成分支酸(Chorismate)。
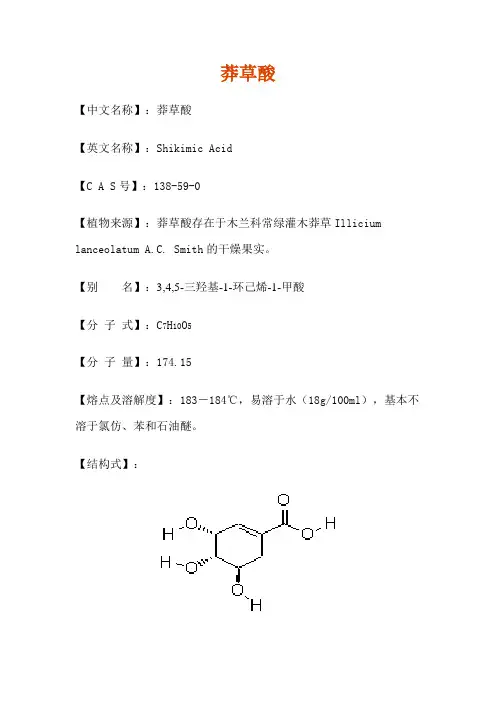
莽草酸
【中文名称】:莽草酸
【英文名称】:Shikimic Acid
【C A S号】:138-59-0
【植物来源】:莽草酸存在于木兰科常绿灌木莽草Illicium lanceolatum A.C. Smith的干燥果实。
【别名】:3,4,5-三羟基-1-环己烯-1-甲酸
【分子式】:C7H10O5
【分子量】:174.15
【熔点及溶解度】:183-184℃,易溶于水(18g/100ml),基本不溶于氯仿、苯和石油醚。
【结构式】:
【产品简介】:白色针状结晶
【产品规格】:98% HPLC
【药理作用】:莽草酸通过影响花生四烯酸代谢,抑制血小板聚集,抑制动、静脉血栓及脑血栓形成,莽草酸具有有抗炎、镇痛作用,莽草酸还可作为抗病毒和抗癌药物中间体。
【应用剂型】:栓剂、洗剂、注射液、片剂、胶囊等。
【产品保存】:置于阴凉干燥、避光,避高温处。
【保质期】:两年
【生产厂家】:陕西永健制药有限公司。

水杨酸(SA)的合成来自于不同的前体和路径:一个是在细胞质中以苯丙氨酸为合成前体的莽草酸途径/苯丙氨酸解氨酶途径(phenylalanine ammonia lyase pathway);另一个则是在叶绿体中进行的异分支酸途径(isochorismate synthases pathway)[1]。
但在多数植物中发现莽草酸途径是SA合成的主要路径。
莽草酸的转化产物苯丙氨酸,经过苯丙氨酸解氨酶(PAL)合成反式肉桂酸,后再转化为香豆酸或苯甲醛。
香豆酸可直接转化为SA,苯甲醛需先转化为苯甲酸(BA),在苯甲酸羟化酶(BA2H)的作用下才能转化为SA[2]。
Serino等人发现细菌SA生物合成通过异分支酸合酶(sochorismate synthase,ICS)使分支酸异构化为异分支酸,再经过异分支酸裂解酶(isochorismate pyruvate lyase,IPL)合成SA。
在拟南芥中发现有两种ICS基因即ICS1(sid2)和ICS2,通过ICSI(sid2)突变体感染病原体后,叶片中总SA含量只有野生型的5%~10%,这说明其SA可能是通过ICS2或其他途径合成的[3]。
虽然在植物中发现了ICS基因并加以研究,但至今尚未发现存在于植物体的IPL基因,在拟南芥中也未发现编码类似于于细菌IPL蛋白的DNA序列[4]。


莽草酸分子式:C7H10O5相对分子质量:174.15名称:3,4,5-三羟基-1-环己烯-1-羧酸状态:白色结晶粉末熔点:185~187 ℃相对密度:1.64水中溶解度:180 g/L莽草酸分子结构中有三个羟基、一个羧基、一个双键,具有手性异构体。
它可以成酯,也可以成盐。
莽草酸是合成生物体内、新陈代谢化合物的中间体,也是合成许多生物碱、芳香氨基酸与吲哚衍生物、手性药物(如抗病毒药)的原料。
抗禽流感药物(Tamiflu,商品名:达菲)就是以莽草酸为原料,经过十步反应合成制得的:【名称】八角油树脂【物化性质】:色泽:深棕色或绿色液体香气:八角的香味、滋味和感观特性。
主要成分:精油、辛辣成分、色素和多糖类化合物等,比精油更完整地体现辛香料的特征。
【制法】:采用八角干果,进行95%乙醇提取。
【包装】:PVF内涂铁桶,每桶净重200公斤。
【储存要求】:保存在密闭容器中。
储存在阴凉、干燥、通风处,避免杂气污染,远离火源。
【应用范围】: 1.食品加香剂:八角油树脂可用于肉制品、酒类、饮料、糖果、烘烤食品、烹调、酱卤制品、咸菜、色拉、煮豆、果汁、面包等食品的加香、着色、防腐、调味剂;由于八角油树脂具有祛寒健胃、健胃、兴奋神经、驱虫止呕、理气治疝的功能,起到保健食品的作用。
2.在日用化工业:香烟、皂类、洗涤剂和香水上的加香。
3.在调味料中的应用便面调味料、休闲食品,如薯片、虾条、锅巴、米线、粉丝制品调味中等调味料。
4.其他用途作为饲料的天然添加剂,其作用远远不只是调味,它集调味增香、抗菌抗氧化、抑菌防病、调节机体功能、改善畜禽肉质等多种功能于一身 ,是目前任何合成的饲料添加剂所无法相比的。
【应用特点】①卫生。
在制造过程中使微生物丧失生长繁殖能力 ,且在油树脂中微生物中无法生存。
②利用率高。
油树脂能将植物香料中的绝大部分赋香成分提取出来 ,使用中可分散均匀 ,呈味能力强。
③易保存。
由于油树脂是高度浓缩的产品 ,其体积很小,变质机会少;提取后的油树脂保存期长 ,通常都不低于一年。


各种植物代谢途径介绍高等植物呼吸代谢的特点,一是复杂性,呼吸作用的整个过程是一系列复杂的酶促反应;二是物质代谢和能量代谢的中心,它的中间产物又是合成多种重要有机物的原料,起到物质代谢的枢纽作用;三是呼吸代谢的多样性,表现在呼吸途径的多样性。
如植物呼吸代谢并不只有一种途径,不同的植物、同一植物的不同器官或组织在不同的生育时期、不同环境条件下,呼吸底物的氧化降解可以走不同的途径。
此外,表现在电子传递系统的多样性和末端氧化酶的多样性。
1糖酵解在无氧条件下酶将葡萄糖降解成丙酮酸,并释放能量的过程,称为糖酵解(glycolysis)。
为纪念在研究糖酵解途径方面有突出贡献的三位德国生物化学家Embden,Meyerhof和Parnas,又把糖酵解途径称为Embden-Meyerhof-Parnas途径(EMPPathway)。
糖酵解普遍存在于动物、植物、微生物的所有细胞中,是在细胞质中进行的。
虽然糖酵解的部分反应可以在质体或叶绿体中进行,但不能完成全过程。
糖酵解过程中糖分子的氧化分解是没有氧分子的参与下进行的,其氧化作用所需的的氧是来自水分子和被氧化的糖分子,故又称为分子内氧化。
以葡萄糖为例,糖酵解的反应式如下:C6H12O6+2NA D++2ADP+2Pi→2C3H4O3+2NADH+2H++2 A TP+2H2O糖酵解具有多种功能。
(1)糖酵解的一些中间产物(如甘油醛-3-磷酸等)是合成其他有机物质的重要原料,其终产物丙酮酸在生化上十分活跃,可通过各种代谢途径,产生不同物质。
(2)糖酵解中生成的A TP和NADH,可使生物体获得生命活动所需要的部分能量和还原力。
(3)糖酵解普遍存在生物体中,是有氧呼吸和无氧呼吸经历的共同途径。
(4)糖酵解有三个不可逆反应,但其它反应均是可逆的,它为糖异生作用提供基本途径。
糖酵解的调控。
糖酵解过程中有3个不可逆反应,分别由已糖激酶,磷酸果糖激酶,丙酮酸激酶所催化.磷酸果糖激酶(PFK):ADP和AMP为它的别构激活剂,A TP为抑制剂。
tca代谢物
TCA(三羧酸循环,也称为柠檬酸循环或Krebs循环)是细胞内的一个关键代谢途径,它涉及将乳酸、脂肪酸和氨基酸等有机物氧化为二氧化碳和水,并产生能量。
TCA循环的代谢物包括:
1.柠檬酸(Citrate): TCA循环的起始物质,它与辅酶A(CoA)结合形成莽草酸,进入TCA循环。
2.莽草酸(Isocitrate):在莽草酸脱氢酶的催化下,莽草酸被氧化为α-酮戊二酸。
3.α-酮戊二酸(α-Ketoglutarate):由莽草酸经莽草酸脱氢酶反应生成。
α-酮戊二酸脱羧酶催化下,它进一步脱羧生成琥珀酸。
4.琥珀酸(Succinate):由α-酮戊二酸脱羧而来。
琥珀酸在琥珀酸脱氢酶催化下被氧化为丙酮酸。
5.丙酮酸(Fumarate):丙酮酸通过丙酮酸脱水酶反应被脱水成顺丙烯酸。
6.顺丙烯酸(Malate):由丙酮酸脱水生成,然后通过顺丙烯酸脱氢酶反应生成柠檬酸,从而完成TCA循环。
这些代谢物在TCA循环中的转化是一个很复杂的过程,其中涉及多种酶催化的氧化、脱羧和脱水等反应。
TCA循环不仅产生ATP,还生成多种生物合成的前体分子,对维持细胞的能量平衡和代谢活动至关重要。
1 / 1。
莽草酸途径中26种代谢物的NMR谱归属刘富发;杨晓艳;豪富华;王玉兰;唐惠儒【摘要】莽草酸代谢途径广泛存在于植物、微生物与某些寄生虫中,是芳香氨基酸、植物激素与多种重要活性次生代谢物的主要合成通路.这些代谢物的系统核磁共振(NMR)研究尚不完备,且5-羟基吲哚乙酸与吲哚乳酸等代谢物的NMR数据归属尚不完整.本文对莽草酸代谢途径介导的26种代谢物(包括2种非芳香羧酸、2种植物激素、3种芳香类氨基酸、19种植物次生代谢物)结构进行了较为系统的NMR分析,对这些代谢物的1H和13C NMR信号进行了归属,为植物化学及代谢组学研究提供了基础数据.%Shikimate metabolic pathway exists in plants, microorganisms and parasites as an important route for biosynthesis of aromatic amino acids, antibiotics, plant hormones and secondary metabolites with essential physiological activities. Although the NMR data and assignments of relevant metabolites are available in the literature, these data were not easily adaptable to modern metabonomics studies, in which water and acetonitrile were frequently used as solvents. In addition, the NMR data for some of the metabolites, such as 5-hydroxyindoleacetic acid and indolelactic acid, were either incomplete or incompletely assigned, especially for the quaternary carbons. With 1H NMR and 1H-13C HMBCtwo-dimensional NMR, we completely assigned the 1H and 13C NMR signals of 26 metabolites associated with the shikimate pathway, including 2 non-aromatic carboxylic acids, 2 plant hormones, 3 essential aromatic amino acids, and 19 plant secondary metabolites. A databank was constructed for the 1H and 13C NMR spectra of these metabolites in D2Oand acetonitrile, providing a systematic and useful data collection for phytochemistry and metabonomics studies.【期刊名称】《波谱学杂志》【年(卷),期】2017(034)003【总页数】12页(P311-322)【关键词】核磁共振(NMR);莽草酸代谢途径;代谢物归属【作者】刘富发;杨晓艳;豪富华;王玉兰;唐惠儒【作者单位】中国科学院生物磁共振分析重点实验室,波谱与原子分子物理国家重点实验室,武汉磁共振中心(中国科学院武汉物理与数学研究所),湖北武汉 430071;中国科学院大学,北京 100049;中国科学院生物磁共振分析重点实验室,波谱与原子分子物理国家重点实验室,武汉磁共振中心(中国科学院武汉物理与数学研究所),湖北武汉 430071;中国科学院大学,北京 100049;中国科学院生物磁共振分析重点实验室,波谱与原子分子物理国家重点实验室,武汉磁共振中心(中国科学院武汉物理与数学研究所),湖北武汉 430071;中国科学院生物磁共振分析重点实验室,波谱与原子分子物理国家重点实验室,武汉磁共振中心(中国科学院武汉物理与数学研究所),湖北武汉 430071;复旦大学生命科学学院,上海 200438【正文语种】中文【中图分类】O482.53在高等植物及微生物体内,莽草酸代谢途径为芳香族氨基酸的合成提供底物.对于植物而言,此途径还为多种次生代谢物的合成提供前体物质.在植物正常生长的过程中,大约有20%的碳流量经莽草酸代谢途径合成芳香族氨基酸、木质素、黄酮类、生物碱及植物激素等[1,2].这些莽草酸途径介导的代谢物不仅具有植物生长发育调控、信号传导、抗病抗逆等重要生理功能[3,4],而且它们可以介导人体与肠道菌群的共代谢进而影响人体健康[5–7],甚至具有一定的药理作用[8,9].莽草酸由赤藓糖-4-磷酸与磷酸烯醇式丙酮酸经一系列酶的催化代谢而成,它进一步被代谢为分支酸,进而形成色氨酸、苯丙氨酸及酪氨酸等3种芳香类必需氨基酸[10–12].莽草酸也是奎宁酸的代谢前体及奥塞米韦等抗病毒药物的中间体.色氨酸代谢会产生吲哚乙酸、5-羟基吲哚乙酸及吲哚乳酸等生物碱[13].吲哚乙酸这种植物激素生长素是由吲哚丙酮酸脱羧酶(IPDC)催化吲哚丙酮酸合成[14].苯丙氨酸可进一步通过羟基化而代谢为酪氨酸,这两种氨基酸再经过苯丙氨酸解氨酶(PAL)催化而形成肉桂酸和对羟基肉桂酸,进而合成植物激素水杨酸及一系列多酚酸等植物次生代谢物. 上述代谢物还可以再通过哺乳动物与肠道微生物的共代谢而产生一批芳香类代谢物[5,7,15–17].为此,植物莽草酸代谢途径中部分代谢物的定量分析颇为重要.研究发现丹参中多酚酸具有环境及品种依赖性[3,4],莽草酸途径代谢物存在于绿豆种子[18,19].研究还发现具有抗肿瘤及抗雄激素活性的杨梅醇是经4-香豆酸转化为4-羟基苯丙酸而实现其生物合成[20];玛咖中类黄酮木质素具有抗炎及抗癌的活性,4-香豆酸也具有一定的生理活性[21].其次,多酚酸是植物抗逆抗病的重要次生代谢物,它们对丹参根茎抵抗脱水有显著应答[4],莽草酸代谢途径介导的次生代谢物在植物代谢组应答盐胁迫过程中有潜在重要功能[22].再次,水稻对褐飞虱的抗性与其莽草酸途经介导的次生代谢相关[23],奎宁酸及绿原酸含量与桃子抵抗害虫攻击的抗性呈正相关[24].此外,吲哚乙酸与水杨酸都是重要的植物激素,其功能的不可或缺性显而易见.因此,“次生代谢物”这个传统名称已无法准确反映此类代谢物的重要性.如此重要代谢物组的核磁共振(NMR)分析显然需要完备的NMR数据与归属.虽然大部分的代谢物结构的NMR数据归属已被报道[13,20,24–36],但测定NMR数据的溶剂系统较多,代谢组学研究常使用水或乙腈作为溶剂.另外,前述文献中5-羟基吲哚乙酸及吲哚乳酸等莽草酸代谢途径介导代谢物的NMR基础数据及信号归属不甚完善,一些季碳NMR数据未见报道.因此,针对代谢组学研究中常用水与乙腈作为溶剂的特点,本文使用1D1H NMR与2D 1H-13C HMBC NMR谱图对该途径介导的26种代谢物进行了系统的分析研究,对它们的所有1H 与13C NMR信号进行了归属,为基于NMR的相关代谢组学等研究提供了基础数据.1.1 仪器及试剂水杨酸、2-羟基苯乙酸、3-羟基苯乙酸、4-羟基苯乙酸、2-羟基苯丙酸、4-羟基苯丙酸及吲哚乳酸购自上海Sigma-Aldrich公司.肉桂酸、4-香豆酸、莽草酸、咖啡酸、奎宁酸、芥子酸及绿原酸购自上海阿拉丁化学试剂有限公司.酪氨酸、色氨酸购自上海如吉生物科技有限公司.5-羟基吲哚乙酸、吲哚乙酸购自北京百灵威化学试剂有限公司.3-羟基苯丙酸购自天津阿法埃莎试剂公司.没食子酸、香草酸、阿魏酸购自南京泽朗医药科技公司.苯甲酸、苯乙酸、苯丙酸、苯丙氨酸、三水合磷酸氢二钾(K2HPO4·3H2O)、二水合磷酸二氢钠(NaH2PO4·2H2O)购自上海国药集团化学试剂有限公司.分析纯叠氮钠(NaN3)购于天津福晨化学试剂厂.氘代乙腈(CD3CN,99.8%氘代)、重水(D2O,99.9%氘代)、用于定标的2,2,3,3-氘代三甲基硅烷丙酸钠(TSP)购自Cambridge Isotope Laboratories公司.配制溶液的超纯水来自Elix Advantage System(默克Millipore,德国)纯水系统(电阻率大于18.2 MΩ·cm–1).26种代谢物的化学结构及代谢途径见图1所示.1.2 NMR实验酪氨酸与绿原酸分别使用D2O配制的磷酸盐缓冲溶液(0.1 mol/L,pD = 7.4)作为溶剂,其余代谢物直接溶于D2O(含TSP 0.5 mg/mL)或CD3CN中(见表1).溶于CD3CN溶剂的样品以溶剂中残留质子信号定标.溶于D2O的样品以TSP的甲基信号定标(dH 0.00,dC 0.00).1D1H NMR和2D 1H-13C HMBC 图谱均在Bruker AVIII 600 MHz NMR谱仪(Bruker BioSpin)上采集,1H NMR和13C NMR的共振频率分别为600.13 MHz 和150.90 MHz,实验温度为298 K.1D 1H NMR谱的参数设置如下:脉冲序列为Noesygppr1d,采样点数(TD)为32 k,累加次数(NS)为16,空扫次数(DS)为4,等待时间(D1)为2 s,谱宽(SW)设置为12 000 Hz,90˚脉宽(P1)约为10 ms.2D1H-13C HMBC谱的参数设置如下:脉冲序列为HMBCgppr,F2维(1H)的采样点数为2 048,F1维(13C)采样点数为200,NS为8,DS为16,D1为2 s,2-羟基苯丙酸、4-羟基苯丙酸、苯丙氨酸的SW分别设为6 000 Hz(1H)与30 000 Hz(13C),其余样品的SW为6 000 Hz和33 000 Hz.所有代谢物的分析均使用直径为5 mm的高质量NMR样品管.本文研究的代谢物存在于植物等细胞时,其所在环境pH值有一定分布,但研究中常使用不同的溶剂进行提取.经典的植物化学研究中常使用有机溶剂的水溶液作为NMR检测溶剂,而代谢组学研究中也常使用水与乙腈作为溶剂.因此,本文根据代谢物的溶解性重点选择了D2O与CD3CN作为溶剂进行溶液配制,代谢物的信号归属采用与文献中所报道的相似策略[19,37–39].众所周知,溶剂化效应使得不同溶剂对这些代谢物的1H与13C核的化学位移有不同的影响(特别是可置换活泼氢),文献[19,37-39]中使用的氘代溶剂包括氯仿、二甲亚砜、甲醇、丙酮、水及其它们的不同比例混合物,故此文不准备与文献中如此复杂的多种溶剂系统中所得数据进行简单对比.鉴于乙腈是植物代谢组学研究常用的提取溶剂,也是代谢物结构确定所用方法——液相色谱-固相卒取-核磁共振-质谱联用技术(LC-SPE-NMR-MS)的关键溶剂,但文献中没有本文所关注代谢物群的乙腈溶液的NMR数据.因此本文所得信息库是对文献已有数据的补充,也是LC-SPE-NMR等相关研究的参比基础数据.本文中使用的代谢物均是纯品,因此1D 1H NMR与2D1H-13C HMBC谱图的结合分析足以实现所有1H和13C NMR信号的归属.此文对26种莽草酸代谢途径介导的代谢物进行了谱图归属.这里以5-羟基吲哚乙酸为例,对其1D1H NMR谱(图2)和2D1H- 13C HMBC谱(图3)进行了解析讨论.首先,1H NMR谱中脂肪区只有一个单峰dH 3.78归属为H-2,芳香区唯一的单峰dH 7.26归属为H-6.芳香区出现的ABX耦合系统分别归属为苯环的H-12(dH 7.38)、H-11(dH 6.84)及H-10(dH 7.03).其次,直接联接质子的13C核的化学位移均通过1H-13C HMBC谱中对应的卫星峰确定,C-2、C-6、C-9、C-11与C-12的化学位移分别归属为dC 33.8、128.6、105.6、114.6与115.9.羧基的13C核信号一般在dC 165~185之间,因此谱图中唯一的一个羧基信号dC 180.9归属为C-1.上述归属还可以使用1H-13C HMBC谱中的远程耦合关系进行再确认.C-1与H-2及H-6均有远程耦合.H-6与C-2、C-7、C-8及C-13均有远程耦合,同时H-2与C-7、C-8有远程耦合,由此可确定C-7、C-8与C-13的化学位移分别为dC 109.8、129.5及134.4.这些还可以通过C-8/H-12与C-13/H-11的耦合进一步确认.另一个季碳C-10的化学位移可以通过它与H-12、H-11、H-9之间的耦合关系确定为dC 151.6.由于氧原子的电负性大于氮原子,而碳原子电负性均弱于前二者,C-10的化学位移大于C-13且C-7与C-8化学位移均小于前二者也比较合理.综上所述,5-羟基吲哚乙酸的所有1H与13C NMR信号则可以得到归属.其余代谢物NMR谱中信号均按照上述解析方法进行了归属,其结果罗列于表1中.根据1H NMR谱的自旋耦合,及1H-13C HMBC谱中的耦合信息,本文对莽草酸途径介导的26种代谢物的1H与13C NMR信号进行了系统归属,对文献中已有报道的多个代谢物水溶液和乙腈溶液的NMR数据进行补充,对文献中未见报道的5-羟基吲哚乙酸及吲哚乳酸等代谢物季碳的化学位移信息进行了完善,这些代谢物NMR数据库将为基于NMR的代谢组学等研究提供基础数据.需要指出的是,这些代谢物的化学位移会有一定的溶剂依赖性,因此使用文中所报道的化学位移进行植物提取物中代谢物归属时,需要考虑溶剂及代谢物之间相互作用等因素的影响.生物代谢组中此类物质的浓度一般处于经典稀溶液的范畴,代谢物间相互作用的影响较小.本文中的NMR数据,特别是代谢物的J耦合常数及1H-13C HMBC谱图提供的原子间远程耦合关系对代谢物的指认有一定帮助.[1] HERRMANN K M. The shikimate pathway: early steps in the biosynthesis of aromatic-compounds[J]. Plant Cell,1995, 7(7): 907-919. [2] MAEDA H,DUDAREVA N. Annual review of plant biology[M]. Palo Alto: Annual Reviews, 2012.[3] DAI H, XIAO C N, LIU H B, et al. Combined NMR and LC-DAD-MS analysis reveals comprehensive metabonomic variations for three phenotypic cultivars ofSalvia miltiorrhizabunge[J]. J Proteome Res,2010,9(3): 1565-1578.[4] DAI H, XIAO C N, LIU H B, et al. Combined NMR and LC-MS analysis reveals the metabonomic changes in Salvia miltiorrhiza bunge induced by water depletion[J]. J Proteome Res,2010, 9(3): 1460-1475.[5] WANG Y L, TANG H R, NICHOLSON J K, et al. A metabonomic strategy for the detection of the metabolic effects of chamomile (Matricaria recutita L.) ingestion[J]. J Agric Food Chem,2005, 53(2): 191-196.[6] SHI X H, XIAO C N, WANG Y L, et al. Gallic acid intake induces alterations to systems metabolism in rats[J]. J Proteome Res,2013, 12(2):991-1006.[7] NICHOLSON J K, HOLMES E,WILSON I D. Gut microorganisms, mammalian metabolism and personalized health care[J]. Nat Rev Microbiol,2005, 3(5): 431-438.[8] CHEN C, TANG H R, SUTCLIFFE L H, et al. Green tea polyphenols react with 1,1-diphenyl-2-picrylhydrazyl free radicals in the bilayer of liposomes: Direct evidence from electron spin resonance studies[J]. J Agric Food Chem,2000, 48(11): 5710-5714.[9] LU Z B, NIE G J, BELTON P S, et al. Structure-activity relationship analysis of antioxidant ability and neuroprotective effect of gallic acid derivatives[J]. Neurochem Int,2006, 48(4): 263-274.[10] MIR R, JALLU S,SINGH T P. The shikimate pathway: Review of amino acid sequence, function and three-dimensional structures of the enzymes[J]. Crit Rev Microbiol,2015, 41(2): 172-189.[11] WEAVER L M,HERRMANN K M. Dynamics of the shikimate pathway in plants[J]. Trends Plant Sci,1997, 2(9): 346-351.[12] WILSON D J, PATTON S, FLOROVA G, et al. The shikimic acid pathway and polyketide biosynthesis[J]. J Ind Microbiol Biotechnol,1998, 20(5): 299-303.[13] NIGOVIC B, ANTOLIC S, KOJIC-PRODIC B, et al. Correlation of structural and physico-chemical parameters with the bioactivity of alkylated derivatives of indole-3-acetic acid, a phytohormone (auxin)[J]. Acta Crystallogr,2000, 56(1): 94-111.[14] SCHUTZ A, GOLBIK R, KONIG S, et al. Intermediates and transitionstates in thiamin diphosphate-dependent decarboxylases. A kinetic and NMR study on wild-type indolepyruvate decarboxylase and variants using indolepyruvate, benzoylformate, and pyruvate as substrates[J]. Biochemistry2005, 44(16): 6164-6179.[15] TIAN Y, ZHANG L M, WANG Y L, et al. Age-related topographical metabolic signatures for the rat gastrointestinal contents[J]. J Proteome Res,2012, 11(2): 1397-1411.[16] ZHAO Y, WU J F, LI J V, et al. Gut microbiota composition modifies fecal metabolic profiles in mice[J]. J Proteome Res,2013, 12(6): 2987-2999.[17] LIN H, AN Y P, HAO F H, et al. Correlations of fecal metabonomic and microbiomic changes induced by high-fat diet in the pre-obesity state[J]. Sci Rep,doi: 10.1038/srep21618.[18] WU X Y, LI N, LI H D, et al. An optimized method for NMR-based plant seed metabolomic analysis with maximized polar metabolite extraction efficiency, signal-to-noise ratio, and chemical shift consistency[J]. Analyst,2014, 139(7): 1769-1778.[19] WU X Y, LI N, TANG H R. Quantitative analysis of metabolites in Mungbean (Vigna Radiata) extracts using NMR techniques[J]. Chinese J Magn Reson, 2014, 31(4): 548-563.吴香玉, 李宁, 唐惠儒. 绿豆(VignaRadiata)代谢物组成的核磁共振定量分析[J]. 波谱学杂志, 2014, 31(4): 548-563.[20] KAWAI S, NAKATA K, ICHIZAWA H, et al. 3-(4-Hydroxyphenyl)propionic acid is involved in the biosynthesis of myricanol in Myrica rubra[J]. J Wood Sci,2010, 56(2): 148-153.[21] BAI N S, HE K, ROLLER M, et al. Flavonolignans and otherconstituents from lepidium meyenii with activities in anti-inflammation and human cancer cell lines[J]. J Agric Food Chem,2015, 63(9): 2458-2463. [22] ZHANG J T, ZHANG Y, DU Y Y, et al. Dynamic metabonomic responses of tobacco (Nicotiana tabacum) plants to salt stress[J]. J Proteome Res,2011, 10(4): 1904-1914.[23] LIU C X, HAO F H, HU J, et al. Revealing different systems responses to brown planthopper infestation for pest susceptible and resistant rice plants with the combined metabonomic and gene-expression analysis[J]. JProteome Res,2010, 9(12): 6774-6785.[24] CAPITANI D, SOBOLEV A P, TOMASSINI A, et al. Peach fruit: Metabolic comparative analysis of two varieties with different resistances toinsect attacks by NMR spectroscopy[J]. J Agric Food Chem,2013, 61(8): 1718-1726.[25] HUANG Y, SHAO H K, LI K, et al. Chemical analysis and activity evaluation of anti-inflammatory constituents of Fi-cus microcarpa L. f.[J]. Chinese Traditional Patent Medicine, 2014, 36: 1227-1233.黄洋, 邵慧凯, 李康, 等. 小叶榕叶抗炎成分分析及活性评价[J]. 中成药, 2014, 36: 1227-1233.[26] FORINO M, TARTAGLIONE L, DELL'AVERSANO C, et al. NMR-based identification of the phenolic profile of fruits of Lycium barbarum (goji berries). Isolation and structural determination of a novel N-feruloyl tyramine dimer as the most abundant antioxidant polyphenol of goji berries[J]. Food Chem,2016, 194: 1254-1259.[27] SCOTT K N. NMR parameters of biologically important aromatic acids. 2.phenylacetic acid and derivatives [J]. J Magn Reson,1972, 6(1): 55-73.[28] SWISLOCKA R, PIEKUT J,LEWANDOWSKI W. The relationship between molecular structure and biological activity of alkali metal salts of vanillic acid: spectroscopic, theoretical and microbiological studies[J]. Spectroc Acta A-Mol Biomol Spectrosc,2013, 100: 31-40.[29] WALKER T S, BAIS H P, HALLIGAN K M, et al. Metabolic profiling of root exudates of arabidopsis thaliana [J]. J Agric Food Chem,2009, 57(19): 9346-9346.[30] GOTTLIEB H E, KUMAR S, SAHAI M, et al. Ethyl brevifolin carboxylate from Flueggea microcarpa[J]. Phytochemistry,1991, 30(7): 2435-2438.[31] VINOD K S, PERIANDY S,GOVINDARAJAN M. Spectroscopic analysis of cinnamic acid using quantum chemical calculations[J]. Spectroc Acta A-Mol Biomol Spectrose,2015, 136: 808-817.[32] KINROSS J M, ALKHAMESI N, BARTON R H, et al. Global metabolic phenotyping in an experimental laparotomy model of surgical trauma[J]. J Proteome Res,2011, 10(1): 277-287.[33] CAI R, ARNTFIELD S D,CHARLTON J L. Structural changes of sinapic acid and sinapine bisulfate during autoclaving with respect to the development of colored substances[J]. J Am Oil Chem Soc,1999, 76(4): 433-441.[34] AMIN R P, KUNAPARAJU N, KUMAR S, et al. Structure elucidation and inhibitory effects on human platelet aggregation of chlorogenic acid from Wrightia tinctoria[J]. J Complemen Integr Med,2013, 10(1): 97-104.[35] KOLLA J P N, PEDDIKOTLA P,MUVVA V. Biological activity of phenylpropionic acid isolated from a Terrestrial Streptomycetes[J]. 2007, 56(3): 191-197.[36] CONNELLY J C, CONNOR S C, MONTE S, et al. Application of directly coupled high performance liquid chromatography-NMR-mass spectometry and H-1 NMR spectroscopic studies to the investigation of 2,3-benzofuran metabolism in Sprague-Dawley rats[J]. Drug Metab Dispos,2002, 30(12): 1357-1363.[37] AN Y P, YANG X Y, LI H D, et al. NMR analysis of nicotinamide N-oxide and pseudouridine in rat urine[J]. Chinese J Magn Reson, 2014, 31(2): 232-242.安艳捧,杨晓艳, 李洪德, 等. 大鼠尿液中N-氧化烟酰胺和伪尿嘧啶核苷的NMR分析[J]. 波谱学杂志, 2014, 31(2): 232-242.[38] TIAN Y, TANG H R. Identification and structural determination of saccharides in rat feces[J]. Chinese J Magn Reson, 2012, 29(3): 361-371.田园, 唐惠儒. 大鼠粪样中几种糖类物质的结构确定[J]. 波谱学杂志, 2012, 29(3): 361-371.[39] YANG X Y, WU X Y, AN Y P, et al. An NMR study on keto-enol tautomerism of indole-3-pyruvic acid[J]. Chinese J Magn Reson, 2014,31(1): 81-90. 杨晓艳, 吴香玉,安艳捧, 等. 吲哚丙酮酸的酮-烯醇互变异构化的NMR研究[J]. 波谱学杂志, 2014, 31(1): 81-90.。
莽草酸(shikimic acid)是一种化学物质,广泛存在于植物中,尤其是杜鹃花科、爵床科、豆科、苦苣苔科、马鞭草科、唇形科、大戟科等植物中。
莽草酸是一种重要的化工原料和药物中间体,可用于合成多种药物,如抗流感药物达菲(Tamiflu)、抗病毒药物金刚烷胺(Amantadine)等。
此外,莽草酸还具有抗菌、抗氧化、抗炎等多种生物学活性。
莽草酸的代谢途径主要包括以下几个步骤:
1. 莽草酸在细胞质中被酶催化水解,生成莽草酸-7-磷酸(shikimic acid-7-phosphate)。
2. 莽草酸-7-磷酸在细胞质中被磷酸酶催化脱去磷酸基,生成莽草酸-7-羟基酸(shikimic acid-7-hydroxy acid)。
3. 莽草酸-7-羟基酸在细胞质中被还原酶催化还原,生成莽草酸-7-醛(shikimic acid-7-aldehyde)。
4. 莽草酸-7-醛在细胞质中被氧化酶催化氧化,生成莽草酸-7-酮(shikimic acid-7-one)。
5. 莽草酸-7-酮在细胞质中被还原酶催化还原,生成莽草酸-7-羟基酸。
6. 莽草酸-7-羟基酸在细胞质中被转酮酶催化脱羧,生成莽草酸-3-羧酸(shikimic acid-3-carboxylic acid)。
7. 莽草酸-3-羧酸在细胞质中被转氨酶催化脱氨,生成莽草酸-3-酮(shikimic acid-3-one)。
8. 莽草酸-3-酮在细胞质中被氧化酶催化氧化,生成莽草酸。
莽草酸的代谢途径涉及多个酶的参与,其中莽草酸-7-磷酸合成酶、莽草酸-7-羟基酸还原酶、莽草酸-7-醛氧化酶、莽草酸-7-酮还原酶等是关键的酶。
莽草酸的代谢途径是植物代谢的一个重要组成部
分,对于植物的生长发育、防御反应等具有重要的作用。
同时,莽草酸的代谢途径也为合成药物提供了重要的原料和途径。