物质构成及微观示意图
- 格式:doc
- 大小:2.69 MB
- 文档页数:17

物质的组成、构成及分类组成:物质(纯净物)由元素组成原子:金属、稀有气体、碳、硅等。
物质 构成 分子:如氯化氢由氯化氢分子构成。
H 2、O 2、N 2、Cl 2。
离子:NaCl 等离子化合物,如氯化钠由钠离子(Na +)氯离子(Cl-)构成混合物(多种物质)分类 单质 :金属、非金属、稀有气体纯净物 (一种元素)(一种物质) 化合物: 有机化合物 CH 4、C 2H 5OH 、C 6H 12O 6、淀粉、蛋白质(多种元素) 无机化合物 第四单元 物质构成的奥秘课题1 原 子考试要求:知道原子是由原子核和电子构成的 考点一、原子的构成 (1)原子结构的认识 (2)在原子中由于原子核带正电,带的正电荷数(即核电荷数)与核外电子带的负电荷数(数值上等于核外电子数)相等,电性相反,所以原子不显电性因此: 核电荷数 = 质子数 = (3)原子的质量主要集中在原子核上 注意:①原子中质子数不一定等于中子数2、相对原子质量:⑴ ⑵相对原子质量与原子核内微粒的关系:相对原子质量 = 质子数 + 中子数课题2 元 素考试要求:认识氢、碳、氧、氮等与人类关系密切的化学元素 记住常见元素的名称和符号 了解元素的分类 能根据原子序数在周期表中找到指定元素 认识元素符号的意义 注意元素符号周围的数字的意义和区别 考点一、元素1、 含义:具有相同质子数(或核电荷数)的一类原子的总称。
注意:元素是一类原子的总称;这类原子的质子数相同因此:元素的种类由原子的质子数决定,质子数不同,元素种类不同。
2、 相对原子质量=3、元素的分类:元素分为金属元素、非金属元素和稀有气体元素三种(考点二)4、元素的分布:①地壳中含量前四位的元素:O、Si、Al、Fe ②生物细胞中含量前四位的元素:O、C、H、N③空气中前二位的元素:N、O 注意:在化学反应前后元素种类不变二、元素符号(考点三)1、书写原则:第一个字母大写,第二个字母小写。
2、表示的意义;表示某种元素、表示某种元素的一个原子。


物质的构成1.知道分子、原子、离子都是构成物质的粒子; 2.知道什么是分子、原子和离子(含原子团);3.认识分子的主要性质, 能用微粒的观点解释某些常见的现象4.知道原子是由原子核和核外电子构成的,原子核一般由质子和中子构成; 5.记住在原子里质子数==核电荷数==核外电子数;6.记住原子的质子数决定元素的种类,最外层电子数决定化学性质;一、知识脉络二、中考考点质子中子小 动 间隔金属 元素 非金属元素质子数==核电荷数==核外电子数 相对原子质量==质子数+中子数两个 等式 质子数决定元素种类最外层电子数决定元素化学性质两个 决定7.知道分子是由原子构成的,同一元素的原子和离子可以相互转化;8.理解元素符号的含义,记住一些常见的元素符号和名称,会判断元素的种类;9.能根据原子序数在元素周期表中找到指定元素;10.能说出几种常见元素的化合价;11.能用化学式表示常见物质的组成;12.理解化学式的含义,能看懂某些商品标签上标识的物质成分及含量;13.能应用元素的化合价推求化合物的化学式,能依据化合物的化学式推求某一元素的化合价。
三、能力训练一、选择题(每小题只有一个选项符合题意。
)(一)微粒构成物质1.(08·泰安)分子、原子、离子都是构成物质的基本微粒。
下列由原子直接构成的A.铜 B.氧气 C.氯化钠 D.二氧化碳2.(08·厦门)构成氧气的微粒是A.分子 B.原子 C.离子 D.元素3.(08朝阳一模)下列物质由原子直接构成的是A.水B.氧气C.氯化钠D.铁4.(11·延庆期末)下列物质中,含有氧分子的是A.O2B.H2O C.CO2D.SO25.(08·福建)下图中的符号表示2个氢原子的是6. (08宣武一模)能保持氧气化学性质的最小粒子是A .OB .O 2C .O 2-D .2O7.(08延庆一模)若用“”表示氧原子,则保持水的化学性质的最小粒子可表示为A B . C . D . 8.为形象表示水分解的微观过程,某同学制作了一些模型,表示相应的微观粒子。

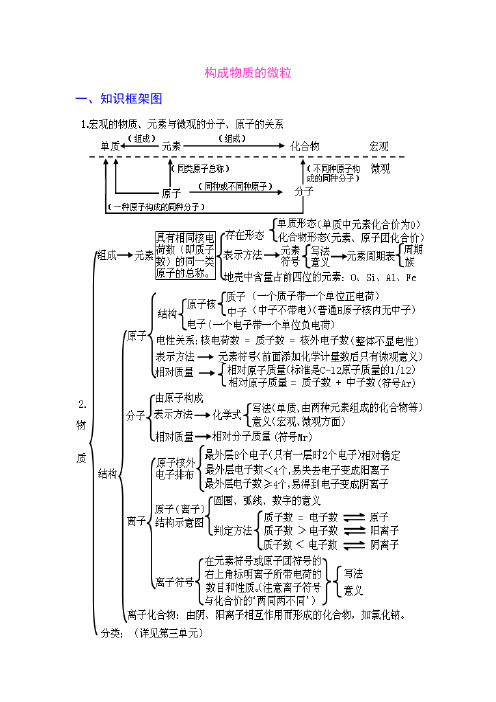
构成物质的微粒一、知识框架图二、学生应该掌握的核心知识构成物质的微粒(一)、概述微观的粒子有:原子、离子、分子、电子、质子等,它们都是微观概念,既表示种类又可表示个数。
分子、原子、离子都是构成物质的粒子。
A 、金属单质和稀有气体由原子直接构成;B 、非金属单质、非金属与非金属形成的化合物由分子构成。
C 、化合物中既有金属元素又有非金属元素的离子化合物是由离子构成。
(二)、分子:分子是保持物质化学性质的最小粒子。
分子由原子构成。
例:1个水分子由2个氢原子和1个氧原子构成A 、分子是构成物质的一种微粒,常见由分子构成的物质:水、氢气、氧气、氮气、二氧化硫、二氧化碳等。
【由分子构成的物质,在物理变化中,分子本身不发生改变;在化学变化中,分子本身发生改变,生成新的分子。
】B 、分子的微观特性:分子总是在不断地运动着;分子之间存在间隔;分子的质量很小。
(三)、原子:1、原子是构成物质的另一种微粒。
原子构成分子,原子也可直接构成物质,如金属汞、稀有气体等。
2、在化学变化中,分子本身发生变化,而原子本身没有变化,只是重新组合成新的分子,构成新的物质,所以,原子是化学变化中的最小粒子。
(注意:原子不是构成物质的最小粒子。
)化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
(四)、相对原子质量:以一种碳原子(碳-12)质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,是该种原子的相对原子质量。
相对原子质量=一个碳原子的质量一个某原子的质量×12 (相对原子质量是个比,单位为1)相对原子质量≈质子数 +中子数 (五)、原子的构成原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子 和不带电的中子构成。
在不显电性的粒子里: 核电荷数=质子数=核外电子数注意:原子不是构成物质的最小粒子。
原子只是化学变化中的最小粒子; 普通氢原子核中只有质子无中子,氢原子的原子核就是一个质子。


1、分子和原子:是由2、分子是由原子构成的;有些分子由同种原子构成如:1个氧分子O2是由多数分子由不同种原子构成如:1个二氧化碳分子CO23、注意:水是由水构成的,水分子是由构成的,1个水分子是由和构成的;有的物质是由原子直接构成的,如:汞是由4、用分子观点解释由分子构成的物质的物理变化和化学变化物理变化:;化学变化:;如:水蒸发时水分子的变大,但水分子,故为变化,实验室用过氧化氢分解制取氧气时, 分子就变成了和 ,故为变化;再如,加热红色的氧化汞粉末时, 会分解成 和 ,每 个结合成 个 ,许多 聚集成 ;5、化学变化的实质:在化学变化过程中, 分裂变成 , 重新组合,形成新物质的 ;如:水在化学变化中的最小粒子是 ;6、从微观角度解释纯净物和混合物由分子构成的物质的区别:纯净物 ,混合物由 如: 又如图: 7、原子的构成1原子结构示意图的认识8、原子是由居于原子中心的________________________和______________________构成的;原子核是由 和 两种粒子构成的; 9、由于原子核内的质子带__________________,中子____________,原子核带的___________________与____________________相等, 相反,所以整个原子不显电性;不同种类的原子,核内的质子数________,核外的电子数______________;+12 28 2电子带 电不带电电带 电原子10、在原子中 =______________=________________ 11、不同原子的根本区别是__________________________________说明:原子一般是由质子、中子和电子构成,有的原子不一定有中子,质子数也不一定等于中子数;12、练习:13、原子核外电子的排布:电子在核外是 的14、相对原子质量是指以____________________________,其他原子的质量跟_____________________;符号为Ar;单位为“1” 15、⨯=(kg) (kg) 相对原子质量16、原子的质量主要集中在__________________上,质子和中子的质量跟相对原子质量标准相比较,均约等于____,而电子的质量约为质子质量的1/1836,可以忽略不计;17、相对原子质量≈ +决定元素种类 核电荷数18、三决定决定元素化学性质决定原子的质量19、在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,填在相应的横线上:1能保持物质化学性质的最小粒子是 2化学变化中的最小粒子是3带正电荷的粒子是 4不显电性的粒子是5质量最小的粒子是 6在同一原子中数目相等的粒子是7决定原子质量大小的粒子主要是8构成物质的基本粒子是和离子9构成原子的基本粒子是 10参加化学反应一定发生变化的粒子是20、离子的形成:氯化钠NaCl中,钠原子的最外层有个电子,容易而 ,形成 ;氯原子最外层有个电子,容易电子而 ,形成 ;这样两者都形成相对稳定结构,整个化合物电性;21、离子定义;阳离子如:镁离子;铝离子;阴离子如:硫离子;氧离子;22、符号:表示:E F25、上述示意图中表示原子的是:;表示阳离子的是:;表示阴离子的是:;表示稳定结构的是:;表示金属元素的是:;表示非金属元素的是:;表示稀有气体元素的是:;表示同种元素的是:;化学性质相似的是: ;26、分子与原子区别:原子与离子区别:27、元素:观察下表中几种不同的碳原子相对原子质原子种类质子数核电荷数中子数核外电子数量碳原子 6 6 6 12碳原子 6 7 6 13碳原子 6 8 6 14填空1原子中的质子数核外电子数都是 ,这样的原子都是 ;1.元素定义:元素是数即数相同的一类原子的总称; 1元素种类有种;组成了几千万种物质;元素种类决定于原子的数或数,即不同元素的本质区别是原子的不同如:质子数为8的氧原子统称为;质子数为1的氢原子统称为;2元素分类:、、 ;通过汉子的偏旁来区分;P62 提示:化学反应前后原子的种类 ,元素的种类 ;p59讨论元素原子理一理:学完本课,你对“分子,原子,元素,物质“四个概念间的相互关系有哪些认识课堂练习:1、下列说法有没有错误把错误的说法加以改正;①水是由1个氧元素和2个氢元素组成的;②二氧化硫中有硫和氧2个元素;2、判断下列说法是否正确并将错误的说法加以改正;a.加热氧化汞生成汞和氧气,氧化汞中含有氧气分子;b.二氧化硫分子是由硫元素和氧元素构成的;c.水是由氧原子和氢原子构成的;3、说一说:①水是由构成的;②水分子是由构成的;③一个水分子是由构成的;④水是由组成的;⑤铁是由构成的;⑥铁是由组成的;⑦氯化钠NaCl是由组成的;是由构成的;4、1二氧化碳是由碳和氧组成的;2二氧化碳分子是由碳和氧构成的;3氧化镁MgO、二氧化碳CO2、氧化汞HgO中都含有元素 ;5.我们在看电视的时候,经常看到为健康劝人们“补铁”、“补钙”、“补锌”、“加碘”的广告,这里的“铁”、“钙”、“锌”、“碘”指的是什么6.地壳和生物体中的一些元素的含量:阅读P60图3-17和表3-3回答1地壳中含量居于前五位的元素分别是:、、、、 ,其中属于金属元素的是 ,属于非金属的是 ;2生物体内含量居于前三位的元素分别是、、 ;3空气中最多的元素是、其次是 ;7、物质的组成、构成及分类组成:物质纯净物由组成原子:金属Cu、Fe;稀有气体He、Ne、Ar;碳、硅、硫、磷C、Si、S、P等;、物质构成分子:如氯化氢HCl、CO2; H2、O2、N2、F2、Cl2、Br2离子:NaCl等离子化合物,如氯化钠由、构成混合物多种物质分类单质一种元素:、、纯净物化合物:多种元素氧化物酸、碱、盐、有机物定义:单质:化合物:氧化物:8.在①水H2O、②氢气H2、③二氧化碳CO2、④液氧O2、⑤铁Fe、⑥冰水混合物⑦氨气NH3、⑧过氧化氢H2O2、⑨高锰酸钾KMnO4等物质中用序号填空:属于单质的是;属于化合物的是 ,属于氧化物的是 ;9.下列物质:①空气,②氧气,③二氧化硫,④五氧化二磷,⑤高锰酸,⑥氯酸钾,⑦氯化钾,⑧河水,⑨糖水,⑩汽水; 其中属于混合物的是________________________;属于单质的是;属于化合物的是____________________________;属于氧化物的是________________________;含有氧元素的是__________;含有氧分子的是__________;二、元素符号:3.元素符号的意义:1表示宏观意义;2表示微观意义3金属、稀有气体、固非金属的元素符号还可以表示如:H表示、 ;2H表示 ;Cu表示、、 ;元素符号前面加数值,表示原子的数目,只有微观意义;如:2N表示2个氮;5个铁原子写作: ,6个氟原子写作: ,n个镁原子写作: ;二、写出下列符号的含义及符号:C :P :He:硅元素 :氖气: I : Fe:一个钾原子 :金属钠: Ca : 氮原子: 银元素:H:2H:H22H2H+: 2 H+: O:2O:O2-:2O2-:Fe2+: Fe3+:三、写出下列符号中数字“2”的含义:O:2He: 2Ne: 2Mg: H2Mg2+ : 2Mg2+ : 2S:: ①:2N: 2N2②:2O2-:前边的2:后边的2:O:前边的22Fe: 2H2。








物质的构成1.知道分子、原子、离子都是构成物质的粒子; 2.知道什么是分子、原子和离子(含原子团);3.认识分子的主要性质, 能用微粒的观点解释某些常见的现象4.知道原子是由原子核和核外电子构成的,原子核一般由质子和中子构成; 5.记住在原子里质子数==核电荷数==核外电子数;6.记住原子的质子数决定元素的种类,最外层电子数决定化学性质;一、知识脉络二、中考考点质子中子小 动 间隔金属 元素 非金属元素质子数==核电荷数==核外电子数 相对原子质量==质子数+中子数两个 等式 质子数决定元素种类最外层电子数决定元素化学性质两个 决定7.知道分子是由原子构成的,同一元素的原子和离子可以相互转化;8.理解元素符号的含义,记住一些常见的元素符号和名称,会判断元素的种类;9.能根据原子序数在元素周期表中找到指定元素;10.能说出几种常见元素的化合价;11.能用化学式表示常见物质的组成;12.理解化学式的含义,能看懂某些商品标签上标识的物质成分及含量;13.能应用元素的化合价推求化合物的化学式,能依据化合物的化学式推求某一元素的化合价。
三、能力训练一、选择题(每小题只有一个选项符合题意。
)(一)微粒构成物质1.(08·泰安)分子、原子、离子都是构成物质的基本微粒。
下列由原子直接构成的A.铜 B.氧气 C.氯化钠 D.二氧化碳2.(08·厦门)构成氧气的微粒是A.分子 B.原子 C.离子 D.元素3.(08朝阳一模)下列物质由原子直接构成的是A.水B.氧气C.氯化钠D.铁4.(11·延庆期末)下列物质中,含有氧分子的是A.O2B.H2O C.CO2D.SO25.(08·福建)下图中的符号表示2个氢原子的是6. (08宣武一模)能保持氧气化学性质的最小粒子是A .OB .O 2C .O 2-D .2O7.(08延庆一模)若用“”表示氧原子,则保持水的化学性质的最小粒子可表示为A B . C . D . 8.为形象表示水分解的微观过程,某同学制作了一些模型,表示相应的微观粒子。
其中表示水分解过程中不能再分的粒子是( )9.(08大兴一模)近年用红外激光技术研究液氢,发现液氢中含有H 3+。
H 3+属于 A .单质B .分子C .原子D .离子10.(08·苏州)在H 2O 、OH 一、H 、H +四种微粒中,属于分子的是 A .OH 一 B .H C .H 2O D .H11.(10·上海)用不同的球代表不同元素的原子,“ ”代表氧原子。
表示氧化物分子的是12.关于分子、原子、离子的说法中正确的是A .原子是最小的粒子,不可再分B .化学反应前后分子的数目一定不变C .当二氧化碳气体变成干冰时,二氧化碳分子间不存在间隔D .分子、原子、离子都可以直接构成物质 13.下列关于分子和原子的说法中正确的是A . 分子不停地运动,原子不能运动A .B .C .D .B. 分子构成物质,原子也能直接构成物质C. 不同种类的原子,不能够相互结合成分子D. 在化学反应前后,分子和原子的种类都保持不变14.下列叙述正确的是A.原子是由原子核和核外电子构成的B.构成物质的粒子只有分子和原子C.气体易被压缩,说明构成气体的分子可以分解成原子D.物质在不同条件下的三态变化,主要是由于分子的大小发生了变化15.(09·北京)氧是地壳中含量最多的元素。
已知一种氧原子,原子核内含有8个质子和10个中子,则该氧原子核外电子数为A.2 B.8 C.10 D.18 16.(08·南京)氢是新型清洁能源,但难储运。
研究发现,镧和镍的一种合金是储氢材料。
下列有关57号元素镧(La)的说法不正确的是A.该元素原子的质子数为57 B.该元素原子的核电荷数为57C.该元素原子的核外电子数为57 D.该元素为非金属元素17.(08·东城一模)朝核问题引发了国际关注,核问题的关键是核能的如何利用。
已知某种核原料的原子核中含有1个质子和2个中子。
下列说法正确的是A.该原子是一种氢原子B.该元素是金属元素C.该原子核外有3个电子D.该原子核带2个单位的正电荷18.由我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕等几种元素的相对原子质量新值,其中他测定核电荷数为63的铕元素的相对原子质量的新值为152。
则下列说法正确的是A.铕元素的原子质子数为63 B.铕元素的原子中子数为63 C.铕元素的原子核外电子数为152 D.铕元素的原子的质量为152品红加入水中后,用扫描隧道显微镜获得的苯分子的图像19.(08·福州)图l 信息能说明A .分子很小B .分子是构成物质的唯一微粒C .分子间有同隔D .分子总是在不断运动20.(09·北京)水果散发出诱人的香味,你能闻到香味的原因是A .分子在不断运动B .分子的质量很小C .分子之间有间隔D .分子的体积很小21.(10·桂林)水电解的过程可用下列图示表示,微粒运动变化的先后顺序是A.①②③④B.④①③②C. ①②④③D. ①④③② 22.(08·西城一模)下列各图中能说明分子间的间隔变小的是A B C D23.(10·东城一模)16.对下列实验现象的解释,不正确...的是分子的质量水分子在不同温24.(10·北京)压瘪的乒乓球放入热水中重新鼓起,是因为球内的气体分子A.体积增大B.质量增大C.间隔增大D.个数增多25.(10·上海)关于原子和分子的说法,正确的是A.原子不能直接构成物质 B.分子是由原子构成的C.原子在化学变化中可以再分 D.分子之间没有间隙26.(10·桂林)从下列图片中不能..获取的信息是A.分子之间有间隔B.硅原子是由原子核和电子构成的C.受热水分子运动速率加快D.构成物质的粒子有分子、原子和离子27.(08·重庆)下列叙述中不正确的是A.钠原子失去电子后变成钠离子B.氯离子失去电子变成氯原子C.原子的质量主要集中在原子核上D.化学变化中分子不能再分28.(10·东城一模)根据下列四种粒子的结构示意图,所获取的信息不正确...的是A.它们表示三种元素B.②③的化学性质相同C.②表示的元素是金属元素D.①表示的是原子,而④表示的是阴离子29.下图为X、Y、Z三种不同的气体分子在一定条件下反应前后的变化示意图,该反应可表示为3X +Y==2Z,下列叙述中错误的是A.分子之间有间隔B .分子是在不断运动的C .一个Z 分子由三个原子构成D .图中反应前后的表示物均为混合物 (二)有关元素1.(10·北京)地壳中含量最多的非金属元素是A .氧B .硅C .铝D .铁2. 地壳里含量最多的金属元素是 A .氧 B .硅 C .铝 D .铁3.(08·北京)决定元素种类的是A .质子数B .中子数C .电子数D .最外层电子数 4.(10·北京)碳元素与氧元素的本质区别是 A .质子数不同 B .电子数不同 C .中子数不同D .最外层电子数不同5.与元素化学性质有密切关系的是A .质子数B .中子数D .最外层电子数 6.氧元素的原子结构示意图是 氧元素相似的是7.下列原子结构示意图所表示的元素中,属于非金属元素的是8.(10·兰州)水被称为“生命之源”, 双氧水被称为“绿色氧化剂”。
下列关于它们的说法中正确的是A .都含有氢气B .都含有氢元素C .都含有氢分子D .都含有2个氢原子 9.(10·北京)“锌强化营养盐”中的“锌”指的是:A .单质B .分子C .原子 D.元素 10.某全麦饼干部分营养成分的含量如下表所示,表中的“铁、镁、锌、钙”是指A. 分子B. 原子C. 元素D. 非金属11.2008年5月17日,在“5. 12汶川大地震”抗震救灾现场,自贡市疾病预防控制中心的防疫人员受到了胡锦涛总书记的接见,当时他们正在喷洒“含氯消毒液”。
“含氯消毒液”中的“氯”在这里指的是 A .元素 B .原子 C .分子 D .离子12.(09·北京)元素周期表中钠元素的信息如右图所示,对图中信息理解不正确...的是 A .质子数为11 B .元素名称为钠 C .元素符号为Na D .核外电子数为22.9913.(10·海南)右图为元素周期表第三周期的局部。
据此判断下列说法中正确的是:A .它们都属于金属元素B .1个铝原子的质量是26.98gC .硅元素的原子序数为l4D .镁元素的相对原子质量为l2 (三)物质组成的表示1.(07·北京)下列物质的化学式中,书写正确的是A .氮气N 2B .氯化铁FeCl 2C .氧化镁MgO 2D .氯化钙CaCl 2.(10·北京)次氯酸钠(NaClO)是某种家用消毒液的主要成分,其中氯元素的化合价为A.+5 B.+3 C.+1 D.-1 3.(10·兰州)翡翠是人们喜爱的一种装饰品,翡翠的主要成分是硬玉,其化学式为NaAl(SiO3)2。
其中Si的化合价是A.+1 B.+2 C.+3 D.+44.卟啉铁(C34H32ClFeN4O4)对人体缺铁性贫血有显著疗效。
对卟啉铁的说法中正确的是A.卟啉铁中含有5种元素B.“缺铁性贫血”中的“铁”指单质铁C.1个卟啉铁分子中含有34个碳原子D.卟啉铁氢元素与氧元素的质量比为32:4 5.如图为某物质的分子模型示意图,其中“”代表氢原子,“”代表氧原子。
下列叙述正确的是A.此物质属于混合物B.此物质中氧元素的化合价为0C.此物质的一个分子由4个原子构成D.此物质中氢元素与氧元素的质量比为1:16.(08·湖北宜昌)维生素是人体必需的重要营养素之一,它能促进人体生长发育,增强人体对疾病的抵抗能力。
关于维生素C(C6H8O6)的说法错误..的是A.C6H8O6表示维生素C这种物质B维生素C是由C、H、O三种元素组成C.维生素C是由C、H、O三种原子构成D1个维生素C分子中含有20个原子7.下列化学符号正确的是A.1个一氧化碳分子:Co B.2个碳酸根离子:2CO32-C.3个亚铁离子:3Fe3+D.4个氢原子:2H28.关于“3CO2”的含义叙述正确的是①表示二氧化碳这种物质②表示三个碳原子和六个氧原子③表示三个二氧化碳分子④表示二氧化碳分子由一个碳原子和两个氧分子构成⑤相对分子质量为132 ⑥碳原子与氧原子的质量比为3∶8A.①③④B.②⑤⑥C.③⑥D.②⑥二、填空题1.化学就在我们身边,它与我们的生活息息相关,在C、N、O、S、K、Ca、H、元素中,选择适当的元素,组成符合下列要求的物质各一种(用化学式表示)(1)抢救危重病人常用的物质的一种单质;(2)天然气的主要成分;(3)燃煤时排放的废气中所含的能形成酸雨的主要气体是;(4)人们常称之为纯碱,广泛用作食品发酵剂的物质是___;(5)易与人体血液中血红蛋白结合的有毒气体是___;(6)“波力海苔”袋内干燥剂的主要成分是______ ;(7)参与绿色植物光合作用的一种气体是_________;(8)可配制蕃茄无土栽培营养液的复合肥料是_____。