GSP缺陷项汇总
- 格式:docx
- 大小:420.73 KB
- 文档页数:6

新版GSP进行委托配送的合理缺陷项第一篇:新版GSP进行委托配送的合理缺陷项新版GSP进行委托配送的,合理缺陷项有145项:机构和质量管理职责2项:*01711、*01716;人员与培训9项:*02203、*02204、*02205、02206、02207、*02208、*02802、02902、03002;质量管理体系文件1项:04202;设施与设备:31项(不含*04301);校准与验证:9项;收货与验收:29项;储存与养护:34项;出库13项;运输与配送:17项。
第二篇:GSP缺陷项汇总主要缺陷项:1、(*07301)收货人员未发现来货药品的随货同行单与首营企业档案中留存的随货同行样单不一致。
2、(*00802)质量负责人、企业负责人变更后,未进行内审。
一般缺陷项:质量管理体系(01001)企业委托第三方物流进行储存、运输,企业物流部门风险评估工作中未包含对被委托单位的风险评估和控制;(01001)企业建立了风险管理档案,但对质量风险的评估、沟通不够,现场提问时,采购员及储运部负责人不能熟悉表述岗位风险点及风险管控措施内容。
(01101)企业对供货单位进行了评审,但未对质量信誉进行确认;(01101)企业未对购货单位的质量管理体系进行评审,无相关档案。
机构和质量管理职责(01702)质量管理部门未能指导督促收货人员执行收货管理制度及规程;(01704)药品质量档案信息不完善;(01704)对所经营品种质量信息收集不全,羟乙基淀粉2013年曾被FDA及欧洲药品管理局发布风险警示,企业未收集相关质量信息。
(01704)质量信息收集不全质量信息包括:1、国家新颁布的药品管理法律法规及行政规章;2、国家新颁布的药品标准及其他技术性文件;3、国家发布的药品质量公告及当地有关部门发布的管理规定等;4、供应商质量保证能力及所供应药品的质量情况;5、同行竞争对手的质量措施、管理水平、效益等情况。
6、企业各经营环节手机、反馈的与质量相关的数据、资料、记录、报表及文件等,包括药品质量、工作质量和服务质量方面的信息;7、在用户访问、质量查询、质量投诉和质量事故中收集的质量信息。

药品经营企业GSP符合性检查常见缺陷项汇总(四)一、条款:03402企业使用的文件应当为现行有效的文本,已废止或者失效的文件除留档备查外,不得在工作现场出现。
检查缺陷描述:03402 企业办公场所出现无效文件,如质管科张贴了《企业负责人质量管理制度》,企业提供的制度目录中未见该文件;工作现场出现已废止的文件,如质量部职责文件;过期文件出现在工作场所,如2017年1月起草的冷库操作规程;阴凉库上墙的药品质量验收管理制度为旧版文件,与制度手册中现行的药品质量验收管理制度验收时限规定不相符;未将已废止的2016版冷库、冷藏车、保温箱使用操作规程收回。
03402 部分废止和失效的文件未及时清理,仍出现在现场。
03402 过期文件(部分岗位职责)悬挂于库房墙面。
03402 企业文件发放不受控,已发放的文件无受控标示。
03402 现场《操作规程》新旧版本并存。
03402企业一层出库复核区墙上有非现行版的《仓储部复核装箱作业标准流程》)(2011年版)。
03402.现场检查时养护员陈X X提供的岗位职责文件与企业现行执行文本不符。
03402.采购部门使用的文件(描述版本号)为失效、废止版本。
03402.企业不能提供已经废止或者失效文件的留存档案。
03402.企业收货员、冷藏车上放置的岗位操作规程为已废止的文件。
03402.修订后文件未按文件管理操作规程要求重新起草、审核并发放相关岗位的。
03402.未定期进行文件审核或无记录支持已审核文件的。
03402.部门或岗位使用文件与质量管理部门文件内容不相符,无标识的。
03402 仓库内同时发现现行质量管理体系文件(第二版)与已废止的质量管理体系文件(第一版)。
03402 企业已经失效的2015版《质量管理制度》未及时清理出工作场所。
03402.现行的体系文件不完整且有废止的文件夹杂其中。
二、条款00801:企业应当定期开展质量管理体系内审。
检查缺陷描述:00801企业2020年组织的内审,内审评审表中“检查记录”一栏为空,未填写检查结论,未对内审中存在的问题进行分析并依据分析结论制定相应的质量管理体系改进措施;企业于2020年5月25日变更了企业负责人和质量负责人,未做专项内审;企业于2020年6月4日增加了零售连锁经营范围,未做专项内审。


最新药品经营企业GSP符合性检查缺陷项汇总(一)一、库房内墙顶光洁,地面平整,门窗结构严密。
检查缺陷描述:常温库房墙顶有脱落物、裂痕、霉斑、水迹等。
现场检查发现中药饮片库的两侧墙角与外界相通。
现场检查发现库内多处地面有大量灰尘,高架库近入库区地面明显沉陷;库区多处门窗结构不严密,漏光;阴凉库整件库区屋顶破损、漏光。
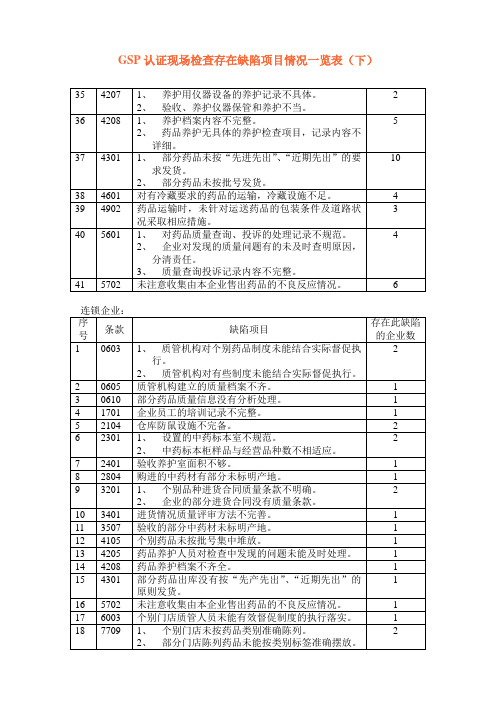
现场检查发现中药材库房内墙有墙皮脱落、漏水痕迹。
现场检查发现企业中药饮片库XX号空调旁有直径10cm的洞,与室外相通。
现场检查发现企业中药饮片库墙体、顶棚破损、地面积水。
常温库地面不平整,部分区域有凹陷;常温库内墙不光洁,有脱落现象;仓库出入口的门缝隙过大,结构不严密;阴凉库部分内墙有水迹、起泡等现象;三楼中药饮片库房顶空调冷却管道处有渗水。
库区内有污染源,且无有效控制及处理。
库房地面及墙壁较脏,不平整,容易掉块;库房有漏雨迹象且无维修记录;门窗不严密,外部的灰尘及飞虫进入库房。
二、经营冷藏、冷冻药品的应当配备冷藏车。
检查缺陷描述:冷藏车的配置不符合国家相关标准要求。
该公司2014年3月11日从乌鲁木齐市天和汽贸有限公司第一分公司购买新A33561轻型厢式货车,品牌型号:长安牌SC5026XXXXYDA4,2014年3月26日由新疆中集考格尔特种汽车销售有限公司改装,新疆中集考格尔特种汽车销售有限公司非工信部认可的改装企业,改装车辆不予认可企业提供厢式运输车(新QD0103)购买发票,未能提供冷藏车购买发票,未能提供改装冷藏车的企业名称,仅提供制冷机组的购买发票。
未能提供冷藏车购买发票,未能提供改装冷藏车的企业名称。
三、储存、运输设施设备的定期检查、清洁和维护应当由专人负责,并建立记录和档案。
检查缺陷描述:未见设施设备台账;无设施设备的定期检查记录;个别储存设施设备未进行定期清洁检查和维护,如冷藏车积灰较多,冷藏柜漏水;企业不合格品库及冷库的门锁损坏未及时维修;常温库有两台空调已损坏,不能正常使用,未及时修复;仓库顶棚降温水泵、柴油发电机组未建立设施设备档案;一楼恒温库柜机、暖风机、排气扇设备档案不全;设施设备档案未见空调机组的发票原件或者复印件。

最新药品经营企业GSP符合性检查缺陷项汇总(五)一、企业应当制定药品采购、收货、验收、储存、养护、销售、出库复核、运输等环节及计算机系统的操作规程。
检查缺陷描述:企业制定的《验收操作规程》(版本号2018-01,文件号WYYY-QR-02-2018)中无冷藏药品验收操作相关内容,冷藏冷冻药品操作规程也未见相关内容。
企业未对冷库开门作业、冷库断电后重新启动、药品装卸等制定相关操作规程。
不合格药品实际处置流程与操作规程不相符。
公司《药品质量验收管理规程》(编号:CST-CX-019-01)未明确待验药品的验收期限。
企业制定的《药品配送运输程序》中未明确运输记录人,只表明由复核员负责查对。
企业制定的操作规程内容不全面。
如无二类精神药品的收货、验收、销售、运输、销售退回等操作内容。
企业经营的4个国家集中采购品种已经入驻码上放心追溯系统并按要求扫码,实际追溯操作完整,但缺少重点品种(国家集中采购药品)追溯操作规程。
企业未能及时修订完善相关文件,如2021年4月20日企业新增5号冷库(442m³)、冷藏车1辆、保温箱132L的5只,未能及时修订《冷链标准操作程序》(HL-SOP-08-2020)操作的相关内容。
企业未制定计算机系统操作规程。
企业计算机系统操作规程中无质量基础数据修改的具体操作要求。
企业制定的操作规程没有涵盖企业经营质量管理的各个环节,有空白;实际操作与操作规程规定不相符的。
企业制定的操作规程不具有操作性或操作性差,或影响到其他质量活动。
企业未制定相应的药品采购退回操作规程。
二、部门及岗位职责应当包括:(一)质量管理、采购、储存、销售、运输、财务和信息管理等部门职责;(二)企业负责人、质量负责人及质量管理、采购、储存、销售、运输、财务和信息管理等部门负责人的岗位职责;(三)质量管理、采购、收货、验收、储存、养护、销售、出库复核、运输、财务、信息管理等岗位职责;(四)与药品经营相关的其他岗位职责。
药品GSP飞行检查缺陷项1.私设中药饮片仓库,存储条件不符GSP要求,库内计算机库存管理系统与公司计算机库存管理系统不一致。
2.计算机系统显示冷藏库中有大量低温保存药品,现场检查冷藏库为空库,经查,该宗药品存放于企业阴凉库中,企业对上述事实存在隐瞒行为。
3.质量负责人未能在职在岗履行职责。
4.企业自行设定温湿度探头温湿度上限,数值显示与实际温度不符,部分温湿度探测终端超温时不报警。
5.新版GSP认证时提出的多条缺陷问题在此次检查中仍然存在;非药品库中存放有大量药品,且库房破损,有漏水情况;未入采购系统且未经验收的货物进入整货区,且无有效标识;阴凉库中“五区”划分不明确,未严格按照划分区域存放货物,零货、整货混放、混垛、药品存放地面现象严重。
3.GSP管理混乱:新任命的质管部长未进行岗前培训和健康查体;待验区有大量药品未及时验收,温度未进行有效控制,有些药品无随货同行单;药品未严格按照既定区划放置,也未按照五距进行管理;阴凉库发货区预冷用的冷柜内存放有多种冷藏药品。
4.温湿度监测体系存在缺陷:温湿度自动监测系统历史数据的温湿度涉嫌与实际不符,且其中的数据可以手工修改,冷库的历史数据有超温现象;飞检当天全部阴凉库温度超标;未见保温箱的温度记录仪;温湿度自动监测系统未进行介质备份;冷库、冷藏车、保温箱和温湿度自动监测系统均未按制度规定进行定期验证,相关设备也未按制度规定进行定期校准。
2.赠品库内存有作为赠送药品的血塞通、卡托普利等多种处方药和甲类非处方药,且无来源证明。
1.擅自设置不符合GSP要求的库房储存药品(现场整改到位,并在检查结束的第三天向省局提请增设新仓库的申请)。
2.温湿度监控系统断电后未见声光报警、未定期验证、断电后未见不间断电源供电;温湿度监控系统测点终端安装位置不符合规定;3.未对冷库、保温箱进行定期验证以及极高温、极低温验证,温湿度监控系统未见冷藏车的温度数据,未对冷藏车、保温箱进行定期检查及维修,未建立记录;4.常温库内药品与非药品混放,药品库存放中药饮片,阴凉库温度超标后未采取调控措施等。
药品GSP认证现场检查不合格项目情况RZZX-JL-03-007-00企业名称XX医药有限公司认证范围批发经营范围中药材、中药饮片、中成药、化学原料药及其制剂、抗生素原料药及其制剂、生化药品、生物制品、第二类精神药品制剂、疫苗、蛋白同化制剂、肽类激素按风险评估原则,检查组认为严重缺陷0项,主要缺陷0项,一般缺陷19项,详述如下:1. 01001 总公司2014年未采取回顾的方式开展药品质量风险评估;2. 01704 总公司2014年未对药品质量信息进行收集传递;3. 01709 分公司2014年未做药品质量查询;4. 01715 分公司未对2013年度购货单位进行质量评审;5. 02702 总公司2014年GSP培训考试无培训记录;6. 02902 总公司一楼仓库冷藏药品存储区工作人员未配备棉衣;7. 03001 分公司健康体检档案中无体检汇总表;8. 03501 总公司验收员XXX岗位上未能获取其岗位职责及操作规程;9. 04603 总公司负一层仓库地面不平整;10.04604 总公司仓库对无关人员进入仓储作业区未实行可控管理;11、04605 总公司负一层仓库无装卸作业顶棚;11.04702 总公司一楼仓库北墙西侧排风扇风帘损坏,封闭不严密;12.04705 总公司负一层仓库内一个照明灯损坏;13.04706 总公司负一层仓库发货区无零货拣选拼箱发货工具;14.05201 总公司仓库扫码手持终端未定期维护并做记录;15.08505 总公司一楼仓库风帘破损不能有效防虫;16.08514 总公司仓库未采取防止无关人员进入作业区的有效措施;18、11101 总公司与XXX物流有限公司签订的委托运输协议未明确在途时限;19、12201 总公司不能实现网络在线填报《药品不良反应报告表》;企业负责人签字:年月日检查组成员签字:年月日观察员签字:年月日说明: 1. 表中空间不足,可附页。
2. 此表签字复印件无效。
药品GSP认证现场检查缺陷项目整改报告一、GSP认证现场检查缺陷项情况:按照***食品药品监督管理局审评认证中心的安排,GSP认证现场检查组于***10日至11日对我公司的药品经营质量管理情况进行了现场检查。
按风险评估原则,检查组认为严重缺陷项0项,主要缺陷项0项,一般缺陷12项,详述如下:1、01001:企业风险评估报告内容不全面,缺少资金流向方面的评估。
2、01101:企业对购货方对天津中医医院实地考察记录中质量负责人有签字,无签字日期。
3、02702:企业对20***年度外部培训记录未及时归档。
4、03001:企业验收员张艺芝没有进行辨色力检查。
5、03302:企业《运输管理制度》文件中文字表达不准确、不清晰语句。
6、04603:药材阴凉库房顶西北角有小面积墙皮脱落。
7、04706:中药饮片常温库、阴凉库无药品拣选设备。
8、05201:药品运输车无清洁维护记录。
9、08505:饮片常温库防蝇灯不能起到有效防蝇作用。
10、08603:中药饮片阴凉库排风扇封闭不严,养护员未及时发现并采取措施。
11、09001:企业质量管理部门未对20***年库存药品进行分析。
12、11802:药品库房区域未公布投诉举报渠道。
二、GSP认证现场检查缺陷项整改报告1、01001:企业风险评估报告内容不全面,缺少资金流向方面的评估。
(1)原因分析:公司进行的风险评估中内容不全面,未涉及资金流向方面的评估。
(2)风险评估:中风险,有可能导致财务风险。
(3)整改措施:质量风险评估小组重新对财务资金流向方面进行评估(4)责任人:质管科科长***(5)完成时间:***15日(6)整改结果:符合规范要求。
2、01101:企业对购货方对天津中医医院实地考察记录中质量负责人有签字,无签字日期。
(1)原因分析:由于在对购货方天津中医医院实地考察结束后,签写考察记录时没有注意到签字日期,导致记录内容不完整。
(2)风险评估:低风险,有可能造成其他资质过期,实地考察表还在有效期内继续使用。
主要缺陷项:
1、(*07301)收货人员未发现来货药品的随货同行单与首营企业档案中留存的随货同行样单不一致。
2、(*00802)质量负责人、企业负责人变更后,未进行内审。
一般缺陷项:
质量管理体系
(01001)企业委托第三方物流进行储存、运输,企业物流部门风险评估工作中未包含对被委托单位的风险评估和控制;
(01001)企业建立了风险管理档案,但对质量风险的评估、沟通不够,现场提问时,采购员及储运部负责人不能熟悉表述岗位风险点及风险管控措施内容。
(01101)企业对供货单位进行了评审,但未对质量信誉进行确认;
(01101)企业未对购货单位的质量管理体系进行评审,无相关档案。
机构和质量管理职责
(01702)质量管理部门未能指导督促收货人员执行收货管理制度及规程;
(01704)药品质量档案信息不完善;
(01704)对所经营品种质量信息收集不全,羟乙基淀粉2013年曾被FDA及欧洲药品管理局发布风险警示,企业未收集相关质量信息。
(01704)质量信息收集不全
质量信息包括:1、国家新颁布的药品管理法律法规及行政规章;2、国家新颁布的药品标准及其他技术性文件;3、国家发布的药品质量公告及当地有关部门发布的管理规定等;4、供应商质量保证能力及所供应药品的质量情况;5、同行竞争对手的质量措施、管理水平、效益等情况。
6、企业各经营环节手机、反馈的与质量相关的数据、资料、记录、报表及文件等,包括药品质量、工作质量和服务质量方面的信息;7、在用户访问、质量查询、质量投诉和质量事故中收集的质量信息。
(01717)质量管理部门协助开展疫苗知识相关教育和培训不够
人员与培训:
(02702)培训记录未归档;
(02702)培训内容不全,缺少影像资料;
(03001)直接接触药品岗位的人员健康体检报告不全;
(02601)缺少法律法规培训,计算机ERP升级后,培训不到位;培训内容缺《江苏省药品监督管理条例》等相关内容。
(02601)企业对部分业务岗位人员培训不到位,培训内容缺少相关质量管理制度、岗位职责及操作规程方面的内容,现场检查时,行政部负责人不熟悉公司文件管理操作规程,财务部负责人不熟悉公司财务管理制度。
质量管理体系文件
(03402)已失效的文件在工作现场出现;
(03301)企业文件未实施编号管理。
(03501)现场检查时行政部提供的岗位文件无受控痕迹。
设施与设备
(04604)肽类激素仓库,无摄像头;
(04701)冷冻库未配备地架。
(04702)纱窗未固定。
(05201)企业用于疫苗运输的租赁冷藏车无车辆维护记录和档案。
标准与验证
(05501)冷冻库温度分布验证方案质量负责人未批准签字计算机系统
(05802)计算机机房缺少温湿度调控设施;
采购
(07101)企业对药品采购的整体情况综合质量评审内容不明确;
(07101)未对药品采购情况进行综合质量评审;
(06103)对药品采购的质量体系控制不够。
对上下游客户,重要的客户要现场考核质量体系,对质量体系进行审核评估。
收货与验收
(07704)产品外包装变形,未验收至最小包装。
储存与养护
(08514)已安装门禁系统,已发通行卡,未对相关人员履行审批手续。
(08605)计算机系统不能自动生成养护计划。
(08906)企业对不合格药品未进行原因分析,无预防措施运输与配送
(10702)保温箱内未使用隔离装置将药品与蓄冷剂进行隔离
(11302)委托运输协议中缺少药品在途时间的要求。
售后管理
(11701)投诉管理操作规程中缺少事后跟踪内容。
企业按要求制定了质量管理投诉制度,但未制定投诉管理操作规程。
(12201)配备专人负责药品不良反应报告工作,但未开展不良反应报告。
其他
1、岗位文件无受控痕迹;
2、培训缺岗位职责、制度、SOP;
3、有经营范围的都要制定相应的制度,制度、程序要与
实际行为匹配;
4、职责、规程要由行政部分发到个人,以前的版本不要
再出现在工作场合;
5、委托第三方的协议中不要再出现多少面积,多少托盘;
6、内审计划质量负责人要签字,内审报告参与审计者都
要签字,并且与制度匹配;
7、不良反应要有制度,程序,要申请网上填报不良反应
的账户密码,并且会在线申报;
8、上游客户的印章模板、账户等资料要给财务,财务要
按照首营企业资料中的账户打款,不能擅自变更账户
打款;
9、培训要针对各个岗位制定具体培训内容,有针对性,
结束后有考核,仅有试卷是不够的;
10、主要人员变动要及时开展内审,涉及到制度的变更要
重新签发;
11、授权委托书的有限期要及时跟进,不要过期;
全省药品经营企业出现主要缺陷项:
*00802企业负责人、质量负责人发生变化时未及时进行内审。
*01401企业负责人***未全面负责企业日常管理,质量方针、质量目标、质量管理制度、职责、规程均非***签字批准,未能
有效履行职责。
*01901企业负责人***不熟悉新版GSP相关条款。
*02301企业质量管理部门负责人***不在职(企业质量管理部门负责人***的劳动合同与**有限公司签订,社保由**有限公司缴纳)。
*04704 企业每个独立的药品仓库只安装了一只温湿度测点终端。
*04906 冷藏车厢内部没有保证气流充分循环的空间。
*05304企业使用的型号为2.6T红宇HYJ5062XLC冷藏车未开展使用前验证。