对碳酸氢铵和氯化钠复分解制碱的看法
- 格式:pdf
- 大小:2.56 MB
- 文档页数:7

![硫酸钠与碳酸氢铵单相分解制碳酸氢钠的方法[发明专利]](https://uimg.taocdn.com/bd0372f459f5f61fb7360b4c2e3f5727a4e9244c.webp)
[19]中华人民共和国专利局[12]发明专利申请公开说明书[11]公开号CN 1089235A[43]公开日1994年7月13日[21]申请号93115453.7[22]申请日93.12.29[71]申请人张祥林地址612260四川省丹棱县农业局共同申请人兰尚贞 张学 张南 张宏[72]发明人张祥林 兰尚贞 张学 张南 张宏 [74]专利代理机构乐山市专利事务所代理人叶建民[51]Int.CI 5C01D 7/02C01D 7/32C01D 7/12C01C 1/244权利要求书 1 页 说明书 6 页 附图 1 页[54]发明名称硫酸钠与碳酸氢铵单相分解制碳酸氢钠的方法[57]摘要本发明涉及一种以硫酸钠和碳酸氢铵为原料,生产碳酸氢钠的方法,其特点是采用离子交换树脂为介质,通过对硫酸钠和碳酸氢铵进行分离交换、低温浓缩、结晶干燥,达到制取碳酸氢钠(小苏打)的目的。
该方法具有原料利用充分,产品质量高,工艺紧凑、先进的优点,可直接一步产出碳酸氢钠,成本低,设备少,基本无污染,经济效益好。
93115453.7权 利 要 求 书第1/1页 1、一种硫酸钠与碳酸氢铵单相分解制碳酸氢钠的方法,以硫酸钠和碳酸氢铵为原料,采用离子交换和渗析技术进行,其特征在于所述的交换是以阳离子交换树脂为介质,对碳酸氢铵中的NH+4和硫酸钠中的Na+进行分离交换,而制取产品碳酸氢钠和硫酸铵溶液,再以离子交换树脂所压制成的离子交换膜为介质,将碳酸氢钠溶液进行电渗析浓缩和冷却结晶的循环作业,通过分离、结晶和干燥,制取碳酸氢钠。
2、根据权利要求1所述的硫酸钠与碳酸氢铵单相分解制碳酸氢钠的方法,其特征在于可将以阳离子交换树脂分离交换得来的碳酸氢钠溶液直接加热、浓缩、干燥、锻烧,制取纯碱(碳酸钠)。
3、根据权利要求1所述的硫酸钠与碳酸氢铵单相分解制碳酸氢钠的方法,其特征在于可将以阳离子交换树脂分离交换得来的硫酸铵溶液进行加热、浓缩,制取硫酸铵。

九年级化学化学科普阅读题试题经典含分析一、中考化学科普阅读题1.阅读下边科普短文(本文由网络文章改写)。
松花蛋又称皮蛋、变蛋、灰包蛋等,因剥开蛋壳后胶冻状的蛋清中常有松针状的结晶或花纹而得名,是一种我国传统风味食品,口味鲜滑可口,色香味均有独到之处。
中医以为,松花蛋性凉,对牙痛、眼痛等疾病有必定疗效。
因为松花蛋会有一股碱涩味,在吃松花蛋的时候能够加入少许的姜醋汁。
松花蛋是用料泥包裹鸭蛋、鸡蛋等加工而成。
料泥是由生石灰、纯碱、食盐、红茶、草木灰(主要成分K2CO3)等原料与水按比率混淆平均制得。
料泥制作过程中,经过一系列反应,产生的强碱(NaOH、 KOH)经蛋壳渗透到蛋清和蛋黄中,与此中的蛋白质作用,以致蛋白质分解、凝结并放出少许硫化氢气体和氨气。
同时渗透的碱还会与蛋白质分解出的氨基酸进一步发生中和反响,生成的盐的晶体堆积在凝胶态的蛋清中,便出现了朵朵“松花”。
而硫化氢气体则与蛋清和蛋黄中的矿物质作用生成各样硫化物,使蛋清和蛋黄的颜色发生改变,蛋清呈特别的茶褐色、蛋黄则呈墨绿色。
以下图表示松花蛋腌制时间与此中蛋清和蛋黄的 pH 的变化关系。
好多人在平常生活中都特别喜爱吃皮蛋瘦肉粥、凉拌松花蛋,专家提示这类食品少吃不妨,却不可以过多食用。
其一,松花蛋腌制过程中蛋白质分解、变质,以致营养价值受到了必定的损坏。
其二,市售松花蛋还可能含铅(国家规定松花蛋中铅含量需小于mg/kg)。
微量铅很简单被小孩汲取,以致铅中毒。
其三,剥开皮的松花蛋0.51至 2小时内一定要吃完,若长时间裸露在空气中,特别简单感染沙门氏杆菌,沙门氏杆菌会快速生殖,此时食用松花蛋很简单惹起中毒现象。
依照文章内容,回答以下问题。
(1)食用松花蛋时加入少许姜醋汁能够除掉松花蛋中______________味。
(2)料泥制作过程中会生成强碱NaOH和 KOH,钾元向来自于原猜中的 _________。
生成 NaOH的过程中,属于复分解反响的化学方程式为_________________。
![试验一碳酸氢铵和氯化钠制备碳酸钠[最新]](https://uimg.taocdn.com/7141f557bf1e650e52ea551810a6f524ccbfcb0a.webp)
实验一碳酸氢铵和氯化钠制备碳酸钠一、实验目的1、通过实验了解联合制碱法的反应原理。
2、学会利用各种盐类溶解度的差异并通过复分解反应来制取一种盐的方法。
二、原理碳酸钠又名苏打,工业上叫纯碱。
用途很广,工业上的联合制碱法是将二氧化碳和氨气通入氯化钠溶液中,先生成碳酸氢钠,再高温下灼烧,使它失去一部分二氧化碳,转化为碳酸纳。
反应方程式:NH3+CO2+H2O+NaCl==NaHCO3↓+NH4Cl△NaHCO3===Na2CO3+H2O+CO2↑在第一个反应中,实质上是碳酸氢铵与氯化钠在水溶液中的复分解反应,因此本实验直接用碳酸氢铵与氯化纳作用来制取碳酸氢钠反应方程式NH4HCO3+NaCl==NH4Cl+NaHCO3↓NH4Cl、NaCl、NH4HCO3和NaHCO3同时存在于水溶液中,是一个复杂的四元交互体系。
它们在水溶液中的溶解度互相发生影响。
不过,根据各纯净盐在不同温度下在水中的溶解度的互相对比,也仍然可以粗略地判断出以上反应体系中分离几种盐的最佳条件和适宜的操作步骤。
各种纯净盐在水中溶解度见下表:表1 各种纯净盐在水中溶解度温度溶度度℃0 10 20 30 40 50 60g/100g水溶质NaCl 35.1 35.8 36.0 36.3 36.6 37.0 37.3 NH4HCO311.9 15.8 21.0 27.0NaHCO3 6.9 8.2 9.6 11.1 12.7 14.4 16.4 NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.2 当温度超过35℃NH4HCO3就开始分解。
所以反应温度不能超过35℃。
但温度太低又影响了NH4HCO3的溶解度。
故反应温度又不宜低于30℃。
另外从外表还可以看出NaHCO3在30~35℃温度范围内的溶解度在四种盐中是最低的,所以当使研细的固体NH4HCO3溶于浓的NaCl溶液中,在充分搅拌下,就析出NaHCO3晶体。
三、实验材料及设备(一)原料及试剂1、碳酸氢铵(工业纯或化学纯)2、氯化钠(工业纯或食盐)3、酚酞指示剂0.5%溶液4、甲基橙指示剂0.1N5、HCl标准溶液0.1N(二)设备及仪器1、恒温水浴锅2、5000ml烧杯3、布式漏斗4、抽滤瓶5、真空泵6、温度计四、实验步骤(一)化盐与精制往2500ml烧杯中加入1000ml24~25%的粗盐水溶液。

化工的实习报告四篇化工的实习报告篇1江苏德邦兴华化工股份有限公司是工业氯化铵、农业氯化铵、颗粒氯化铵、纯碱、小苏打等产品专业生产加工的合资经营企业(港或澳、台资),公司总部设在连云港市海州江化南路51号,江苏德邦兴华化工股份有限公司拥有完整、科学的质量管理体系。
江苏德邦兴华化工股份有限公司的诚信、实力和产品质量获得业界的认可。
对于学习化学工程与工艺专业的本科生来说,具有一定的生产实践能力是十分有必要的,去化工厂生产实习是我们专业课学习过程中必不可少的一部分。
我们工科生的生产实习是理论结合实践、培养高级工程技术人才,为后续专业课的学习以及工作打下坚实的基础的重要环节。
通过这次去江苏连云港德邦化工厂的生产实习,我们了解到化工工艺流程和主要机械设备的实践知识,了解化工生产的概况,为以后更加专业的学习增强了全局意识,提高了对所学知识观察和分析实际问题的能力。
此次实习虽然时间不长,但在碱厂各车间工艺员与负责人的细心介绍和指导下,我感觉受益匪浅,对此次实习十分肯定。
一、实习目的通过对德邦化工各车间的实际学习,初步了解联合制减法原理和工艺流程、各车间的主要设备以及特点、各车间岗位的特点,并且对江苏省连云港德邦化工厂的发展历史、企业模式等做相关了解。
通过对化工设备的实际学习,了解其工作原理。
在学习相关专业知识后,通过生产实习,理论联系实际,巩固书本知识,学习动手实践技能,丰富与提高理论知识;同时接触了解生产的形式,以及实际生产有可能遇到的问题以及解决方法;最后,为以后融入社会上岗工作提供机会。
二、实习单位连云港德邦化工有限公司企业简介:江苏德邦化学工业集团有限公司是由原连云港化肥厂改制成立的国有独资公司。
企业始建于1921年,1921年投产,是全国首批小联碱企业,生产能力3000吨,经过30年的发展,目前拥有固定资产2.3亿,占地22万M2,员工2365人,1921年兼并一个企业,托管一个企业,1999年生产能力扩大到10万吨,完成工业总产值2.2亿,销售收入2.1亿,实现利润1200万元,企业被评为(或命名)无泄漏工厂二级计量单位,市十佳领导先进单位,化工部清洁文明工厂。

海水“制碱”的原理和过程•侯氏制碱法:•联合制碱法是我国化学家侯德榜先生于四十年代研究成功的制碱新工艺,又称"侯氏制碱法".与氨碱法相比,联合制碱法工艺进步了很多.此法保持了氨碱法的优点,消除了它的缺点.一方面使食盐的利用率提高到96%;另一方面生产出的NH4Cl可做氮肥,是一种制碱和制氨相结合的联合生产方法.•侯氏制碱法:•第一步是:氨气与水和二氧化碳反应生成一分子的碳酸氢铵。
•第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它•的溶解度较小。
根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,•在278K~283K(5℃~10℃)时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥。
•反应方程式:•(1)NH3+H2O+CO2==NH4HCO3•(2)NH4HCO3+NaCl==NH4Cl+NaHCO3↓•(3)2NaHCO3Na2CO3+H2O+CO2↑•即:①NaCl(饱和)+NH3+H2O+CO2==NH4Cl+NaHCO3↓•②2NaHCO3Na2CO3+H2O+CO2↑•氨碱法——索尔维制碱法:•本法以食盐和石灰石为原料,以氨气为媒介来生产纯碱,生产能力大,产品质量好,纯度高(纯碱即由此得名)。
•(1)原理:NH3+H2O+CO2==NH4HCO3;NH4HCO3+NaCl==NH4Cl+NaHCO3↓•2NaHCO3Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O•(2)过程:将饱和的食盐溶液在冷却时用氨饱和后在加压下通入CO2(由CaCO3分解而来),由于NaHCO3•溶解度较小而析出,将析出的NaHCO3晶体煅烧,即可制得碳酸钠。
母液中的氯化铵加消石灰回收氨,以•便循环利用。
制氨盐水先通入氨气,再通二氧化碳。
因为氨气的溶解度大,若先通二氧化碳,则有大•部分没有溶解到海水中。

侯氏制碱法的核心化学方程式-概述说明以及解释1.引言1.1 概述侯氏制碱法是一种常用的化学制碱方法,它是由中国古代科学家侯德榜创立的。
侯氏制碱法通过一系列化学反应将石灰石转化为氢氧化钠或氢氧化钾,从而获得纯净的碱性物质。
侯氏制碱法在中国历史上有着重要的地位和影响力。
自古以来,制碱一直是我国经济发展的重要支柱,而侯氏制碱法则成为其中最重要的一种制碱方法。
这种方法的重要性在于它具备了简单易行以及成本较低的特点,同时能够产出高纯度的碱性物质。
在侯氏制碱法中,关键的化学反应是将石灰石与盐酸反应,生成氯化钙和二氧化碳的过程。
接着,利用碱性物质与氯化钙反应,产生氢氧化钠或氢氧化钾。
整个过程中,化学方程式的平衡和反应条件的控制都非常重要,它们直接影响着制碱过程的效率和产物的纯度。
通过深入研究侯氏制碱法的核心化学方程式,我们可以更好地理解这一制碱方法的原理和特点。
同时,对于提高制碱效率和优化制碱工艺也具有重要意义。
接下来的文章将详细介绍侯氏制碱法的背景、原理以及核心化学方程式。
我们将通过对其重要性和未来发展的展望,来总结侯氏制碱法在化学制碱领域的意义和潜力。
希望本文能为读者们提供清晰的了解和深入的思考,进一步推动侯氏制碱法的发展与应用。
1.2 文章结构部分的内容:文章将按照以下结构进行组织和阐述侯氏制碱法的核心化学方程式:第一部分,引言。
在引言部分,我们将概述侯氏制碱法的背景和原理,以及本文的目的。
通过这一部分,读者将对侯氏制碱法有一个初步的了解,并明确本文的研究目标和意义。
第二部分,正文。
在正文部分,我们将详细介绍侯氏制碱法的背景,包括该方法的历史渊源、发展背景以及在化学领域的重要性。
接着,我们将深入探讨侯氏制碱法的原理,包括其反应机制和关键步骤。
最重要的是,我们将重点阐述侯氏制碱法的核心化学方程式,揭示方程式中每一步骤的化学反应过程。
通过这些详细的解释,读者将更好地理解和掌握侯氏制碱法的本质和应用。
第三部分,结论。

化学资料道尔顿在化学领域的主要贡献有:创立原子学说。
1303年继承古希腊朴素原子论和牛顿微粒说,提出原子学说,其要点:(1)化学元素由不可分的微粒—原子构成,它在一切化学变化中是不可再分的最小单位。
(2)同种元素的原子性质和质量都相同,不同元素原子的性质和质量各不相同,原子质量是元素的基本特征之一。
(3)不同元素化合时,原子以简单整数比结合。
推导并用实验证明倍比定律。
如果一种元素的质量固定时,那么另一元素在各种化合物中的质量一定成简单整数比。
最先从事测定原子量工作,提出用相对比较的办法求取各元素的原子量,并发表第一张原子量表,为后来测定元素原子量工作开辟了光辉前景。
建议用简单的符号来代表元素和化合物的组成。
卢瑟福在化学领域的主要贡献有:开创了对原子放射性的研究。
波尔在化学领域的主要贡献有:将卢瑟福的发现成果与观察到的光谱相结合,用跳跃的直觉思维提出了一种新的原子模型。
波尔提出在原子周围沿轨道运行的电子只能在特定的能级存在(也就是距核子一定的距离),而不是卢瑟福原子模型中所期望的连续能级。
当气管中的原子吸收来自电流的能量时,电子会被激活,于是便从低能级(接近核子)跃迁到高能级(距核子更远)。
激活态的电子将会恢复到原来的能级,以光的形式释放出能量。
由于能级之间存在特定的差异,因此在光谱中只能看到特定波长的光(谱线)。
居里夫人在化学领域的主要贡献有:1896年亨利·贝克勒耳(Henri Becq-uerel)发现了铀的放射性,玛丽·居里有理由相信贝克勒耳处理过的沥青铀矿样品中可能还有新的元素,但首先她需要有地方工作和铀矿供给。
她得到同意她可以在她丈夫的实验室内工作。
她的第一个任务是看看除铀之外还有没有其它物质是放射性的。
她的方法是把物质放在皮埃尔设计的灵敏静电计的一块平板上,看看两块平板之间是否有电流产生。
不久,她发现钍也是放射性的。
她的下一项发现不管从哪个角度来说都是最重要的。
她试图了解铀或钍的不同化合物是否具有不同量的放射性。
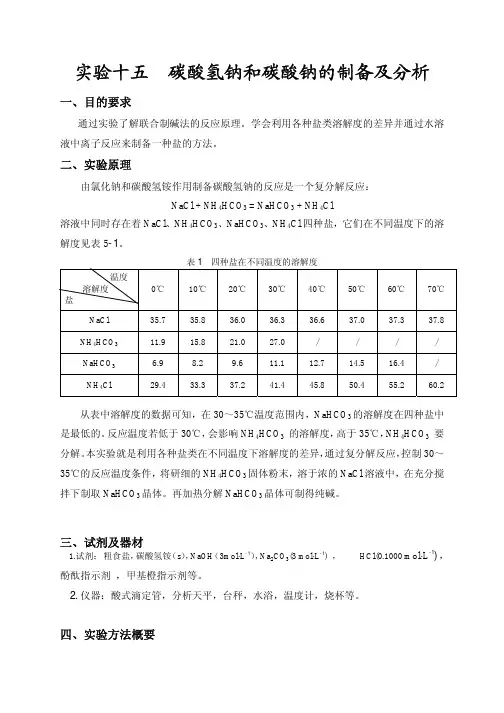
实验十五碳酸氢钠和碳酸钠的制备及分析一、目的要求通过实验了解联合制碱法的反应原理。
学会利用各种盐类溶解度的差异并通过水溶液中离子反应来制备一种盐的方法。
二、实验原理由氯化钠和碳酸氢铵作用制备碳酸氢钠的反应是一个复分解反应:NaCl + NH4HCO3 = NaHCO3 + NH4Cl溶液中同时存在着NaCl、NH4HCO3、NaHCO3、NH4Cl四种盐,它们在不同温度下的溶解度见表5-1。
从表中溶解度的数据可知,在30~35℃温度范围内,NaHCO3的溶解度在四种盐中是最低的。
反应温度若低于30℃,会影响NH4HCO3的溶解度,高于35℃,NH4HCO3要分解。
本实验就是利用各种盐类在不同温度下溶解度的差异,通过复分解反应,控制30~35℃的反应温度条件,将研细的NH4HCO3固体粉末,溶于浓的NaCl溶液中,在充分搅拌下制取NaHCO3晶体。
再加热分解NaHCO3晶体可制得纯碱。
三、试剂及器材1.试剂:粗食盐,碳酸氢铵(s),NaOH(3mol⋅L-1),Na2CO3(3 mol⋅L-1) , HCl(0.1000 mol⋅L-1),酚酞指示剂,甲基橙指示剂等。
2.仪器:酸式滴定管,分析天平,台秤,水浴,温度计,烧杯等。
四、实验方法概要1.化盐与精制在150毫升烧杯中加50毫升24%~25%的粗的食盐水溶液,用3mol ⋅L -1NaOH 和 3mol ⋅L -1Na 2CO 3组成 1﹕1(体积比)的混合溶液调至pH =11左右,得到大量胶状沉淀[Mg 2(OH)2CO 3⋅CaCO 3],加热至沸,抽滤,分离沉淀.将滤液用6 mol ⋅L -1 HCl 调pH 至7。
2.转化将盛有滤液的烧杯放在水浴上加热,控制溶液温度在30~35℃之间.在不断搅拌的情况下,分多次把21克研细的碳酸氢铵加入滤液中。
加完料后,继续保温,搅拌半小时,使反应充分进行。
静置,抽滤、得到 NaHCO 3晶体,用少量水洗涤二次(除去粘附的铵盐),再抽干,称湿重。

纯碱制碱工艺和产量
纯碱,也被称为碳酸氢钠或碳酸钠,是一种重要的化工原料,
广泛应用于玻璃、化肥、造纸、洗涤剂等行业。
它的制备工艺主要
包括氯化铵法、氯化钠法和天然碱法。
氯化铵法是一种较为常见的制碱工艺。
该工艺首先将氯化铵和
石灰石混合,并加热分解生成氨气和氯化钠。
接着,氨气和二氧化
碳反应生成碳酸铵,再经过加热分解得到纯碱。
这种工艺具有较高
的产量和纯度,但同时也存在原料成本较高的缺点。
氯化钠法是另一种常用的制碱工艺。
该工艺利用氯化钠和石灰
石作为原料,经过反应生成碳酸钠。
这种工艺相对简单,且原料成
本较低,但产量较低且纯度较低。
天然碱法则是利用天然碱矿石(如纯碱矿石)进行提取和加工,得到纯碱。
这种工艺的优点是原料资源丰富,但成本较高且产量受限。
关于产量,纯碱的产量取决于原料的质量和工艺的控制。
一般
来说,氯化铵法和氯化钠法的产量较高,而天然碱法的产量相对较
低。
此外,随着生产技术的不断改进和提高,纯碱的产量也在不断提升。
总的来说,纯碱的制备工艺和产量受到多种因素的影响,包括原料成本、工艺复杂度、资源可持续性等。
随着科技的发展和工艺的改进,相信纯碱的制备工艺和产量会不断得到提升和完善。

的溶解度随温度变化较为稳定,而氯化铵则变化幅度较大,可根据两者在溶解度上的差别,高温分离出氯化钠,低温冷析分离出氯化铵。
取混盐溶液500g ,减压蒸馏。
分离盐饼时采用80℃热过滤和20℃冷析过滤两种方式,作为对比。
分离后的盐饼经干燥粉碎称重后取样检测成分。
在多个浓缩比例下进行分离,以便得到最佳浓缩比例。
实验数据如表2、表3所示。
通过实验数据可知,在氯化铵占混盐质量80%的条件下,热分离不能将氯化钠单独分离出来,在分离出来的盐饼中,氯化铵还是占绝大部分。
而冷析分离可以得到高纯度的氯化铵,原因是在冷析过程中,随着大量氯化铵低温析出,之前析出的氯化钠重新溶解回溶液中,从而提高了氯化铵的纯度。
因此将表3中的条件3视为分离氯化铵的最佳条件。
二级蒸馏分离氯化钠一级蒸馏分离氯化铵后,母液中的成分如表4所示。
经过一级蒸馏后,母液中的氯化钠占混盐质量比大幅提升,由原溶液的17.11%升至36.13%。
在此比例下,可通过蒸馏分离纯度较高的氯化钠。
取分离氯化铵后的母液500g ,进行减压蒸馏,以冷凝水的质量来判断浓缩倍数,用80℃热过滤进行分离,得到的盐饼经干燥、粉碎后,称重,并分析其成分,进行多个浓缩比例条件,以便得到最佳浓缩比例。
实验结果如表5所示。
0 引言碳酸氢钠,又称小苏打,是一种常见的化学品。
在化工、农业、食品助剂领域有着应用的广泛。
用氯化钠溶液与碳酸氢铵复分解法生产碳酸氢钠是一种较为成熟的工艺,有着原料来源广泛,生产成本低,工艺流程简单等优点,同时生成的氯化铵可作为副产物出售。
目前氯化铵的回收通常采用冷冻法,将分离碳酸氢钠之后的母液直接冷却,以便析出氯化铵。
该方法不仅氯化铵的回收率不高,且纯度偏低。
本文将改用蒸发法,先盐酸中和除去母液中残留的碳酸氢铵和碳酸氢钠,使母液中的成分变成氯化钠和氯化铵两种盐,然后浓缩蒸馏,分离两种盐来达到回收氯化铵的目的。
1 实验流程饱和氯化钠溶液与碳酸氢铵复分解法生产小苏打后的母液中,除了含有大量的氯化铵外,还有少量残留的氯化钠、碳酸氢钠和碳酸氢铵,用盐酸将母液pH 调至5~5.5,使其中的碳酸氢钠和碳酸氢铵转化成氯化钠和氯化铵,中和后的母液成分如表1。
侯氏制碱法其化学方程式可以归纳为以下三步反应。
(1)NH 3+H2O+CO 2=NH4HCO3(首先通入氨气,然后再通入二氧化碳)(2)NH 4HCO3+NaCI=NH 4Cl+NaHCO 3 J(NaHCO 3溶解度最小,所以析出。
)加热(3)2NaHCO 3=Na2CO3+CO2 f +H2O(NaHCO 3热稳定性很差,受热容易分解)且利用NH4CI的溶解度,可以在低温状态下向(2)中的溶液加入NaCI,则NH4CI析出,得到化肥,提高了NaCI 的利用率。
侯氏制碱法的原理是依据离子反应发生的原理进行的,离子反应会向着离子浓度减小的方向进行。
也就是很多初中高中教材所说的复分解反应应有沉淀、气体和难电离的物质生成。
他要制纯碱(Na2CO3 ),就利用NaHCO3在溶液中溶解度较小,所以先制得NaHCO3,再利用碳酸氢钠不稳定性分解得到纯碱。
要制得碳酸氢钠就要有大量钠离子和碳酸氢根离子,所以就在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,这其中NaHCO3溶解度最小,所以析出,其余产品处理后可作肥料或循环使用。
分析一下整个过程原料是NH3和CO2以及食盐水发生的反应为:NaCI + NH3 + CO2 +H2O 宀NaHCO3 J + NH4CI进入沉淀池以后,得到NaHCO3进入煅烧炉,煅烧后得到Na2CO3和CO2 , CO2进入循环II,所以X是CO2 , 沉淀池中的母液为食盐水、NH3、Na2CO3和NH4CI的混合物所以可以再次进入沉淀池,其中食盐水是循环利用的NH4CI通过食盐细粉的同离子效应而析出了得到了铵肥,由于NH3被消耗了,所以需要再次补充氨气所以侯氏制碱法中循环利用的是CO2和食盐水好处是产生纯碱的同时,产生了铵肥,同时氯化钠的利用率比较高索氏制碱法分析一下整个流程:原料也是NH3、NH3和食盐水发生的反应为:NaCI + NH3 + CO2 +H2O 宀NaHCO3 J + NH4CICO2是由CaCO3煅烧得到的,产物同时还有CaO在母液中含有的成分为NaCI、NH3、Na2CO3还有CaCI2等其中排除液W包含CaCI2和NaCICaO和母液中的NH4CI结合又生成了NH3可以循环利用,即Y为NH3主要区别:索维尔制碱法===原料利用率低,有CaCI2副产物,几乎无用和侯氏制碱法--原料利用率高,副产物NH4CI,肥料例1 1892年比利时人索尔维以NaCI、CO?、NH3、H2O为原料制得了纯净的Na z CO s,该法又称氨碱法, 其主要生产流程如下:饱和食盐水分离1结晶法分NHQ+ 他物质的溶液MajCOj + |co^ +[pfap](1) 从理论上看,循环生产是否需要再补充NH3?___________________(2) 从绿色化学原料的充分利用的角度看,该方法有二个明显的缺陷是:a ________________________ ;b _______________________________ 。
索氏制碱法(氨碱法)
1859年,比利时人索尔维,用食盐、氨水、二氧化碳为原料,于室温下从溶液中析出碳酸氢钠,将它加热,即分解为碳酸钠,人们将此方法称为索氏制碱法,此法一直沿用至今:[9]氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步:
第二步是:碳酸氢铵与氯化钠反应生成的碳酸氢钠沉淀和氯化铵,碳酸氢钠之所以沉淀是因为它的溶解度较小。
经过滤得到碳酸氢钠固体:
这两步总的化学方程式是:
第三步:加热分解碳酸氢钠,生成水、二氧化碳和碳酸钠即我们要的纯碱:
第四步:将第二步中副产的氯化铵和熟石灰混合加热,得到的氨气可循环利用:
氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半——食盐成分里的钠离子(Na+)和石灰石成分里的碳酸根离子(CO32-)结合成了碳酸钠,可是食盐的另一成分氯离子(Cl-)和石灰石的另一成分钙离子(Ca2+)却结合成了没有多大用途的氯化钙(CaCl2),因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
附:氨碱法生产纯碱反应原理和工艺流程图:。
侯氏制碱法解读氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步。
第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它的溶解度较小。
根据NH4Cl 在常温时的溶解度比NaCl 大,而在低温下却比NaCl 溶解度小的原理,在278K ~283K(5 ℃~10 ℃) 时,向母液中加入食盐细粉,而使NH4Cl 单独结晶析出供做氮肥。
化学原理侯氏制碱法又名联合制碱法(1)NH3+H2O+CO2=NH4HCO3(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓(3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑即:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓②2NaHCO3(加热)=Na2CO3+H2O+CO2↑优点保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96 %;NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气CO 转化成CO2,革除了CaCO3制CO2这一工序。
注:纯碱就是碳酸钠国外研究情况(1862年至一战前)碳酸钠用途非常广泛。
虽然人们曾先后从盐碱地和盐湖中获得碳酸钠,但仍不能满足工业生产的需要。
1862年,比利时人索尔维(Ernest Solvay 1838—1922)发明了以食盐、氨、二氧化碳为原料制取碳酸钠的“索尔维制碱法”(又称氨碱法)。
此后,英、法、德、美等国相继建立了大规模生产纯碱的工厂,并组织了索尔维公会,对会员以外的国家实行技术封锁。
第一次世界大战期间,欧亚交通梗塞。
由于我国所需纯碱都是从英国进口的,一时间,纯碱非常缺乏,一些以纯碱为原料的民族工业难以生存。
1917年,爱国实业家范旭东在天津塘沽创办了永利碱业公司,决心打破洋人的垄断,生产出中国的纯碱。
他聘请正在美国留学的侯德榜先生出任总工程师。
侯氏制碱法的产生和发展1920年,侯德榜先生毅然回国任职。
他全身心地投入制碱工艺和设备的改进上,终于摸索出了索尔维法的各项生产技术。
废盐回收制烧碱的原理
废盐回收制烧碱的原理是通过碳酸氢铵和氢氧化钠的化学反应来实现的。
具体步骤如下:
1. 将废盐(含氯化钠)与过量的碳酸氢铵混合,并加热。
2. 在加热的过程中,氯化钠会与碳酸氢铵发生置换反应,生成氯化铵和碳酸钠。
2NaCl + (NH4)2CO3 →2NH4Cl + Na2CO3
3. 将生成的氯化铵与氢氧化钠反应,生成氨气和水。
NH4Cl + NaOH →NH3↑+ H2O + NaCl
4. 收集生成的氨气和水。
5. 剩余的氯化钠与碳酸钠被称为"碱废渣",可以通过显热分解技术进行烧碱的回收和再利用。
通过这个化学反应过程,废盐中的氯化钠被转化为氨气和水,从而回收废盐中的氯化钠,并通过碳酸钠的分解过程,再生产烧碱。
这种方法不仅实现了资源的回收利用,还减少了对环境的污染。
从NH4HCO3+NaCl=NaHCO3↓+NH4Cl 反应谈对复分解反应的理解黔南民族师范学院2001年第3期从NH4HCO3+NaC1=NaHCO3+NH4C1反应谈对复分解反应的理解邢焰(黔南民族师院化学系贵州都匀558000)近年来,在全国和许多省市的初中化学竞赛试题中,多次出现与索尔维斜碱法中的主要反应:NrI,HCO,+NaCI=NaHCO+NrI,CI有关的试题.这个反应是否具备现行统编初中化学教材[以下简称初中教材]中复分饵反应进行的条件(即:生成物中有沉淀析出,有气体放出,或有难电离的物质生成),中学化学教学中一直有争议,争议的焦点主要集中在这个反应中生成的NaHC03是不是沉淀这个问题上.有部分教师认为…:这个反应中生成的NaHCO,不是沉淀,理由是NaHC0,不是难溶物质.我认为这一观点有待商榷.NaHCO,不是难溶物质,这是毫无疑问的.但是,它在上述反应中是不是沉淀?一个反应[指水溶液中进行的化学反应,以下同]中的生成物沉淀析出的基本原因是什么?我们能否仅根据物质的溶解性来判断一个反应中的生成物是否沉淀析出?对此,本文拟从以下三方面谈谈自己的一些认识和看法,以供商讨.1对沉淀的理解和认识初中教材中没有提及沉淀的定义,为此,笔者查阅了一些鞍权威的文献.其中,《无机化学》[武汉大学等校编,第二版,上册]中对沉淀的定义为:"这种处于溶液中的溶质粒子转为固体状态,并从溶液中析出的过程称为沉淀";《科学技术百科全书》[第九卷,物理化学,分析化学分册,1986年版]中对沉淀的定义为:"沉淀是在液体介质中产生一种可分离的固相的过程;《辞海》[1989年版]中对沉淀的定义为:沉淀:在化学上指从溶液中析出固体物质的过程,也指在沉淀过程中析出的固体物质".从以上所列沉淀的定义来看,前两种主要强调沉淀是一种过程,而在初中教材中第176页"进一步研究证明,蕊种物质在溶液中相互交换离子,生成物中如果有沉淀析出,有气体放出,或有水生成,那么复分解反应就可以发生,否则就不能发生."这一段话里的"沉淀"一词从语法上来讲是名词.所以,我认为《辞海》中沉淀的定义较全面,准确.由《辞海》中沉淀的定义可看出,一种溶解状态的物质,无论它是溶液中原有的,还是在溶液中生成的,也无论它在水中的溶解性如何,只要它以固体的形式从其所处的溶液中析出,我们就称它是沉淀.因此,笔者认为上述反应中以固体形式析出的NaHC仉是沉淀.2溶液中物质沉淀析出的基本原因浅析2.1物质从其水溶液中沉淀析出的基本原因我们知道,一般情况下,如果不指明溶剂,物质的溶僻度是指物质在水里的溶懈度,而且物质的溶解度与温度有关.通常我们把在室温时溶解度小于0.Ol克的物质叫难溶物质,而把溶解度在lO克以上,大于1克和小于l克的物质分别叫做易溶物质,可溶物质和微溶物质.一个物质是难溶物质,只能说明在室温时该物质的溶解度很小,它不易溶于水,并不能说明改变条件后该物质能否从其水溶液中沉淀析出.因为,某物质能否从其水溶液中沉淀析出,不仅与其水溶液的温度和其在此温度下的溶解度有关,牧稿日期:20002.2338?酵南民攘师范学院20O1年第3期而且还与它的浓度有关.一定温度下,只有当它的浓度大于它此时的溶解度时,它才可能沉淀析出.也就是说,一定温度下,如果一个物质的水溶液的浓度很小,并小于它时的溶解度,既使该物质是难溶物质,它也不会沉淀析出;如果一个物质的水溶液的浓度很大,并大于它此时的溶解度,既使该物质是易溶物质,它也可能沉淀析出.当一个物质水溶液的浓度一定时,改变此溶液的温度,该物质的溶解度就会随温度的改变币改变,若此物质的溶解度降到了它的浓度以下,它就会沉淀析出.故在物质水溶液浓度一定时,改变溶液的温度,处于溶解状态的物质有沉淀析出的可能,处于沉淀状态的物质有重新溶解的可能,而不论此物质是易溶物质还是难溶物质.2.2反应中生成物沉淀析出的基本原因与上述物质沉淀析出的原因相似,某生成物能否从反应体系中沉淀析出,与反应体系的温度,该生成物在反应体系中的溶解度和生成浓度有关.值得注意的是,一个生成物在反应体系中的溶解度,与同温度下它在水中的溶解度通常是不同的.无论一个生成物是难溶物质还是易溶物质,在一定温度下,只要它的生成浓度大于此时它在反应体系中的溶解度,它就可能沉淀析出.在索尔维制碱法中,将饱和的食盐溶液在冷却时用氨饱和,然后在加压下通^c,体系中就会有NaHCO,生成,当生成的NaHCO,的浓度大于它在体系中的溶解度时,它就会结晶析出.反应为:N+CO2+0=NII4HCO,,NH.Hco]+NaC1:NaHCO++N}l'C1.如果改变某反应体系的温度,生成物在反应体系中的溶解度就会随着改变,当一个处于溶解状态的生成物在反应体系中的溶解度降到它的生成浓度以下时,它就会沉淀析出.在无机化工生产中,我们就是用高温(373K)转化(析出NaC1)常温(298K)析盐(KNo1)的方法来生产KN的.反应为:NaNO,+KC1=o1+NaCl+(373K),NaNO3+KC1=KN++NaC1(298K).由上可看出,在一个反应物浓度很大的反应体系中,常温时溶解麈较大的生成物,有沉淀析出的可能;而通过调节反应体系的温度,也可以使常温时溶解度较大的生成物沉淀析出.3能否根据物质的溶解性来判断一个反应中的生成物是否沉淀析出从上面的分析可看出,溶解性只是判断处于溶解状态的物质,能否沉淀析出的一个因素.严格的讲,仅从溶解性这一方面,是不能判断出一个物质能否从其所处的溶液中沉淀析出的.但是,在初中阶段,由于学生所学化学知识的局限,化学教材中出现的反应,通常都是在室温下进行的常量反应.由于一种生成物在室温下的常量反应中的溶解度,与同温度下它在水中的溶解度的差0,一般不会影响我们定性的判断它能否从反应体系中沉淀析出;又由于,在室温下的常量反应中,难溶物质的生成浓度,一般都会大于它们在反应体系中的溶解度,而可溶物质和易溶物质的生成浓度,通常不会超过它们各自在反应体系中的溶解度,即是说,在室温下的常量反应中生成的难溶物质,一般都会从体系中沉淀析出,而生成的可溶物质和易溶物质,通常不会从体系中沉淀析出.因此,在初中化学教学中,我们通常把一种生成物在水中的溶解度,看作是它在反应体系中的溶解度,并忽略该生成物在反应体系中的浓度,仅根据初中教材后所附的"部分酸,碱和盐的溶解性表[2o℃)"来定性判断它是否从反应体系中沉淀析出.即当该生成物在此表中为不溶于水的物质(即难溶物质]时,我们认为它在反应中是沉淀,而当它在此表中为可溶于水的物质[指可溶物质和易溶物质]时,我们则认为它不是沉淀.也就是说,在初中化学教学中,我们仅根据某生成物在宣温时的溶解性,来定性判断该生成物在反应中是否沉淀析出.我认为,在初中阶段,这种判断方法是合理可行的.但是由上面的分析可看出,对于反应物浓度很大的非常量反应或非常温反应,当一种生成物在上述溶解性表中为可溶于水或微溶于水的物质时.用这种方法不能判断出该生成物能否从反应体系中沉淀析出.而且,这种方法容易使学生产生析出沉淀即是析出难溶物质,可溶于水和微溶于水的物质不会形成沉淀的错误观念.因此,在初中化学教学中,向学有余力的学生适度的介绍沉淀的含义和体系中物质沉淀析出的基本原因,将有助于提高他们对物质溶解性的认识,促进他们对复分解反应条件的理解和掌握.综上所述,沉淀与难溶物质是两个不同的概念.一般情况下,难溶物质较易从溶液中沉淀析出,但39?辟南民族师范学院2001年第3期沉淀不一定是由难溶物质形成的.一定温度时.一个处于溶解状态的物质能否沉淀析出,与该物质在其所处的体系中的溶解度和浓度有关,无论该物质在水中的溶解性如何.只要它在体系中的浓度大于此时它在体系中的溶解度,它就可能沉淀析出.当体系的温度改变时.物质的溶解状况也会随着改变,这时体系中处于溶解状态的物质有沉淀析出的可能.因此,沉淀既可能是由难溶物质形成的,也可能是由微溶物哦,可溶物质或易溶物质形成的.在室温下的常量反应中沉淀析出的生成物,一般都是难溶物质,但在反应物浓度很大的非常量反应中或反应时改变体系的温度.徽溶物质,可溶物质和易溶物质均有可能沉淀析出.总之,我们对复分懈反应的理解不应只停留在常量,常态的阶段,索尔维制碱法中的主要反应:N}LHC0|+NaCI=NaHC++N}LCI在特定的浓度条件下析出了NaHCO.具备了初中教材中提出的复分解反应进行的条件.参考文献[1]吕芳霞.中学化学最学事者1997.I~2台期:54[2]武汉戈学等杖墙.无机化学上昔.(第二版).上海:南等教育出版社,1983.34[3]科学技术百科奎书第九卷轴理化学,舟折化学舟册.北京:科学技术出版社,1986.15[43辞海嫡蚌垂受套.辞海(中).上海:上海辞书由版牡,19892354[5]人民教育出版社化学宣.化学(九年制艾奔教育三年制初救中学教科书).北京:人民教育出版社.1995.P135,176[6]北京师范戈学无机化学教研室等墙?无机化学下册.北京:南等教育由版社.1981.P741f上接第78页)在学习上将取得很快的进步,这时老师再给予充分的鼓励,学生就会逐步从不愿学——志愿学——积极学,进入一种学习的良性循环.所以,针对中职生的非智力因素特点.教师加强情感效能,强化对学生非智力因素的培养,是有助于学生理论课的学习的.3结束语中职化工专业学生加强理论知识的学习.将关系到未来化工企业一线劳动生产者的素质是否满足现代化生产的要求,有着重要的现实意义.中职化学教师在激发学生理论知识学习兴趣,提高理论知识教学质量,培养合格的化工技术工人方面肩负重任,在教学中开展一些有益的探索是非常必要而意义重大的.参考文献[1]卫予光,南珥主墙.化学教育比较研完.袭育科学出版社,1993.[2]刘如新,王租浩着.化学教育系魄{}.广西教育出版社,1996.[3]刘如新主蝙,何年,半年蛛着.化学译租论.广西教育出版杜,199640。