碱性蛋白酶活力的测定
- 格式:doc
- 大小:152.00 KB
- 文档页数:4

迪信泰检测平台
碱性蛋白酶检测
碱性蛋白酶(Alkaline protease)是属于内肽酶中的一种丝氨酸蛋白酶类,在碱性环境下作用于肽键,可将蛋白质水解为氨基酸、多肽以及游离氨基酸,还能够水解酯键、酰胺键,具有转酯及转肽的功能,广泛应用于酶洗涤剂工业、食品加工、酿造、医药和皮革加工等领域。
迪信泰检测平台采用生化法,结合相应的酶类的试剂盒可以高效、精准的检测碱性蛋白酶的活性变化。
此外,我们还提供其他酯酶类的检测服务,以满足您的不同需求。
生化法测定碱性蛋白酶样本要求:
1. 请确保样本量大于0.2g或者0.2mL。
周期:2~3周。
项目结束后迪信泰检测平台将会提供详细中英文双语技术报告,报告包括:
1. 实验步骤(中英文)。
2. 相关参数(中英文)。
3. 图片。
4. 原始数据。
5. 碱性蛋白酶活性信息。
迪信泰检测平台可根据需求定制其他物质测定方案,具体可免费咨询技术支持。


蛋白酶活力的测定1范围本文件规定了酱油和黄豆酱的菌种、种曲、成曲酶活力的测定方法。
本文件适用于酱油和黄豆酱的菌种、种曲、成曲酶活力的测定。
2规范性引用文件下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。
其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682分析实验室用水规格和试验方法3术语和定义3.1中性蛋白酶活力单位neutral protease active unit在温度为40℃、pH值为7.2的条件下,在1min内水解酪蛋白产生相当于1μg酪氨酸的酶量,定义为1个中性蛋白酶活力单位。
3.2酸性蛋白酶活力单位acidic protease active unit在温度为40℃、pH值为3.0的条件下,在1min内水解酪蛋白产生相当于1μg酪氨酸的酶量,定义为1个酸性蛋白酶活力单位。
3.3碱性蛋白酶活力单位alkaline protease active unit在温度为40℃、pH值为10.5的条件下,在1min内水解酪蛋白产生相当于1μg酪氨酸的酶量,定义为1个碱性蛋白酶活力单位。
4原理蛋白酶在一定的温度与pH条件下,水解酪蛋白底物产生含有酚基的氨基酸(如:酪氨酸、色氨酸等),在碱性条件下,可将福林试剂(Folin)还原,生成钼蓝与钨蓝,其颜色的深浅与酚基氨基酸含量成正比。
采用分光光度计(波长660nm)测定其吸光度,进而计算蛋白酶活力。
5试剂和材料5.1试剂除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的三级水。
5.1.1钨酸钠(Na 2WO 4·2H 2O)。
5.1.2钼酸钠(Na 2MoO 4·2H 2O)。
5.1.3硫酸锂(Li 2SO 4)。
5.1.4溴(Br)。
5.1.5无水碳酸钠(Na 2CO 3)。
5.1.6三氯乙酸(CCl 3COOH)。

1 蛋白酶活力的测定1.1 原理采用福林-酚试剂法。
福林-酚试剂在碱性条件下可被酚类化合物还原呈蓝色(钼蓝和钨蓝混合物),由于蛋白质分子中有含酚基的氨基酸(如酪氨酸、色氨酸等),可使蛋白质及其水解产物呈上述反应。
因此可利用此原理测定蛋白酶活力。
通常以酪蛋白为底物,在一定pH值和温度条件下,同酶液反应,经一段时间后终止酶促反应,经离心或过滤除去酪蛋白筹沉淀物后取上清液,用Na2CO3碱化,再加入福林-酚试剂显色,蓝色的深浅与滤液中生成产物酪氨酸量成正比;酪氨酸含量用分光光度计在660nm波长处测定,从而计算出蛋白酶的活力。
1.2 试剂1.2.l 福林-酚试剂向2000mL的磨口回流瓶中加入100g钨酸钠(Na2WO4?2H2O)、25g钼酸钠及700mL的去离子水,再加入50mL85%的磷酸及浓盐酸l00mL,充分混合后,接上回流冷凝管,以文火回流10h,结束后再加入150g的硫酸锂(LiSO4)、50mL去离子水及数滴溴水,再继续沸腾15min,以驱除过量的溴,冷却后滤液呈黄绿色(如仍呈绿色,需再重复滴加溴水的步骤),加去离子水定容至1000mL乱,过滤,滤液置于棕色试剂瓶中,贮于冰箱中可长期保存备用。
此溶液使用时可按1:3比例用去离子水稀释。
1.2.2 0.4mol/L三氯乙酸(TCA)溶液精确称取TCA65.4g,加去离子水定容至1000mL。
1.2.3 0.4mo1/L碳酸钠溶液精确称取无水碳酸钠42.4g,加去离于水溶解后,定容至1000mL。
1.2.4 pH值3~6醋酸缓冲液精确取NaAc?3H2O16g与268mL浓度为6mol/L醋酸溶液混合,用去离子水稀释定容至1000mL。
1.2.5 2%酪蛋白底物缓冲液1.2.5.1 测试酸性蛋白酶缓冲液精确称取酪蛋白20g,加入0.1mol/L氢氧化钠20mL(用去离子水配制),在水浴中加热溶解,然后用pH值3.6醋酸缓冲液定容至1000mL。

实验三. 碱性蛋白酶活力测定【实验目的】1. 掌握测定碱性蛋白酶活力的原理和酶活力的计算方法。
2. 学习测定酶促反应速度的方法和基本操作。
【实验原理】酶活力是指酶催化某些化学反应的能力。
酶活力的大小可以用在一定条件下它所催化的某一化学反应的速度来表示。
测定酶活力实际就是测定被酶所催化的化学反应的速度。
酶促反应的速度可以用单位时间内反应底物的减少量或产物的增加量来表示,为了灵敏起见,通常是测定单位时间内产物的生成量。
由于酶促反应速度可随时间的推移而逐渐降低其增加值,所以,为了正确测得酶活力,就必须测定酶促反应的初速度。
碱性蛋白酶在碱性条件下,可以催化酪蛋白水解生成酪氨酸。
酪氨酸为含有酚羟基的氨基酸,可与福林试剂(磷钨酸与磷钼酸的混合物)发生福林酚反应。
(福林酚反应:福林试剂在碱性条件下极其不稳定,容易定量地被酚类化合物还原,生成钨蓝和钼蓝的混合物,而呈现出不同深浅的蓝色。
)利用比色法即可测定酪氨酸的生成量,用碱性蛋白酶在单位时间内水解酪蛋白产生的酪氨酸的量来表示酶活力。
【实验材料】1.实验器材电热恒温水浴槽;分析天平;容量瓶;移液管;721分光光度计2.实验试剂(1)福林试剂:在1L容积的磨口回流瓶中加入50g钨酸钠(Na2WO4·2H2O)、125g钼酸钠(Na2MoO4·2H2O)、350ml蒸馏水、25ml 85%磷酸及50ml浓盐酸,充分混匀后回流10h。
回流完毕,再加25g硫酸锂、25ml蒸馏水及数滴液体溴,开口继续沸腾15分钟,以便驱除过量的溴,冷却后定容到500ml。
过滤,置于棕色瓶中暗处保存。
使用前加4倍蒸馏水稀释。
(2)1%酪蛋白溶液:称取酪蛋白1克于研钵中,先用少量蒸馏水湿润后,慢慢加入0.2mol/L NaOH 4ml,充分研磨,用蒸馏水洗入100ml容量瓶中,放入水浴中煮沸15分钟,溶解后冷却,定容至100ml,保存于冰箱内。
(3)pH10缓冲溶液:甲液(0.05mol/L硼砂溶液):取硼砂(Na2B4O7·10H2O) 19克,用蒸馏水溶解并定容至1000ml。
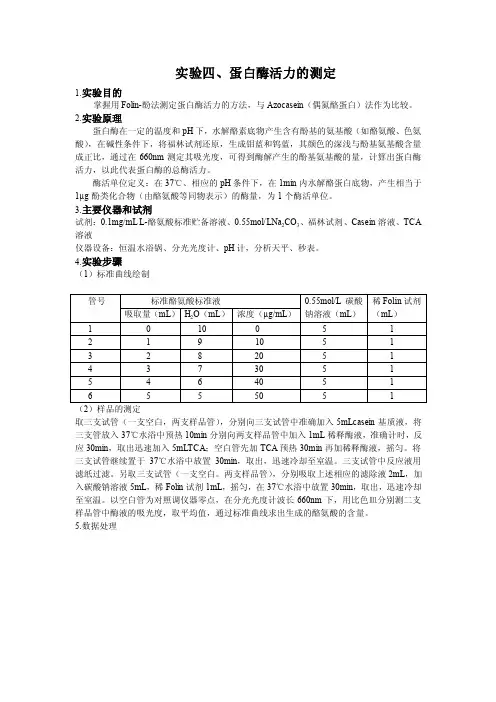
实验四、蛋白酶活力的测定1.实验目的掌握用Folin-酚法测定蛋白酶活力的方法,与Azocasein(偶氮酪蛋白)法作为比较。
2.实验原理蛋白酶在一定的温度和pH下,水解酪素底物产生含有酚基的氨基酸(如酪氨酸、色氨酸),在碱性条件下,将福林试剂还原,生成钼蓝和钨蓝,其颜色的深浅与酚基氨基酸含量成正比,通过在660nm测定其吸光度,可得到酶解产生的酚基氨基酸的量,计算出蛋白酶活力,以此代表蛋白酶的总酶活力。
酶活单位定义:在37℃、相应的pH条件下,在1min内水解酪蛋白底物,产生相当于1µg酚类化合物(由酪氨酸等同物表示)的酶量,为1个酶活单位。
3.主要仪器和试剂试剂:0.1mg/mL L-酪氨酸标准贮备溶液、0.55mol/LNa2CO3、福林试剂、Casein溶液、TCA 溶液仪器设备:恒温水浴锅、分光光度计、pH计,分析天平、秒表。
4.实验步骤(1)标准曲线绘制取三支试管(一支空白,两支样品管),分别向三支试管中准确加入5mLcasein基质液,将三支管放入37℃水浴中预热10min分别向两支样品管中加入1mL稀释酶液,准确计时,反应30min,取出迅速加入5mLTCA;空白管先加TCA预热30min再加稀释酶液,摇匀。
将三支试管继续置于37℃水浴中放置30min,取出,迅速冷却至室温。
三支试管中反应液用滤纸过滤。
另取三支试管(一支空白。
两支样品管),分别吸取上述相应的滤除液2mL,加入碳酸钠溶液5mL,稀Folin试剂1mL,摇匀,在37℃水浴中放置30min,取出,迅速冷却至室温。
以空白管为对照调仪器零点,在分光光度计波长660nm下,用比色皿分别测二支样品管中酶液的吸光度,取平均值,通过标准曲线求出生成的酪氨酸的含量。
5.数据处理。

蛋白酶酶活的测定方法(福林法)1. 酶单位定义: 1g固体酶粉(或1mL液体酶),在一定温度和pH值条件下,1min水解酪素产生1ug酪氨酸为一个酶活力单位,以u /g(u/mL)表示。
2.原理蛋白酶在一定温度和pH值条件下,水解酪素底物,产生含有酚基的氨基酸(如酪氨酸、色氨酸等),在碱性条件下,将福林试剂(Folin)还原,生成钼蓝和钨蓝,用分光光度法测定,计算其酶活力。
3.试剂和溶液3.1福林试剂的准备于2000mL磨口回流装置中加入钨酸钠(Na2WO4.2H2O)100g,钼酸钠(Na2MoO4.2H2O)25g,水700mL、85%磷酸50mL、浓盐酸100mL,小火沸腾回流10h,取下回流冷却器,在通风橱中加入硫酸锂(LiSO4)50g,水50mL和数滴浓溴水(99%),再微沸15min,以除去多余的溴(冷却后仍有绿色需要再加入溴水,再煮沸除去过量的溴),冷却,加水定容至1000mL,混匀,过滤。
制得得试剂应呈金黄色,贮存于棕色瓶内。
使用溶液:一份福林试剂与二份水混合,摇匀。
3.2碳酸钠溶液c(Na2CO3)=0.4mol/L称取无水碳酸钠(Na2CO3)42.4g,加水溶解并定容至1000mL。
3.3三氯乙酸c(CCl3.COOH)=0.4mol/L称取三氯乙酸65.4g,加水溶解并定容至1000mL。
3.4 氢氧化钠溶液c(NaOH)=0.5mol/L按GB601配制。
3.5 盐酸溶液c(HCl)=1mol/L及0.1 mol/L按GB601配制。
3.6 缓冲溶液a.磷酸缓冲液(pH=7.5),适用于中性蛋白酶。
称取磷酸氢二钠(Na2HPO4.12H2O)6.02g和磷酸二氢钠(NaH2PO4. 2H2O)0.5g,加水溶解并定容至1000mL。
b.乳酸缓冲液(pH=3.0),适用于酸性蛋白酶甲液称取乳酸(80%~90%)10.6g,加水溶解并定容至1000mL。
乙液称取乳酸钠(70%)16g,加水溶解并定容至1000mL。

碱性蛋白酶活力的测定1、实验原理蛋白酶在一定的温度与pH值条件下,水解酪素底物,产生含有酚基的氨基酸(如酪氨酸、色氨酸等),在碱性条件下,将福林试剂(Folin)还原,生成钼蓝与钨蓝,用分光光度法测定,计算其酶活力。
2、实验试剂2.1 福林试剂的制备于2000mL磨口回流装置中加入钨酸钠(Na2WO4·2H2O)100g、钼酸钠(Na2MoO4·2H2O)25g、水700mL、85%磷酸50mL、浓盐酸100mL,小火沸腾回流10h,取下回流冷却器,在通风橱中加入硫酸锂(Li2SO4)50g、水50mL和数滴浓溴水(99%),再微沸15min,以除去多余的溴(冷后仍有绿色需再加溴水,再煮沸除去过量的溴),冷却,加水定容至1 000mL。
混匀,过滤。
制得的试剂应呈金黄色,贮存于棕色瓶内。
使用溶液:1份福林试剂与2份水混合,摇匀。
2.2. 碳酸钠溶液(Na 2CO3)=0.4mol/l 称取无水碳酸钠42.4g,用水溶解并定容至1 000mL。
2.3. 三氯乙酸c(CCl 3·COOH)=0.4mol/l 称取三氯乙酸65.4g,用水溶解并定容至1 000mL。
2.4. 氢氧化钠溶液(NaOH)=0.5mol/l2.5. 盐酸溶液(HCl)=lmol/l及0.lmol/l2.6. 硼酸缓冲溶液(pH10.5)甲液称取硼酸钠(硼砂)19.08g,加水溶解并定容至1 000mL。
乙液称取氢氧化钠4.0g,加水溶解并定容至1 000mL。
使用溶液:取甲液500mL、乙液400mL混匀,用水稀释至1 000mL。
上述各种缓冲溶液,均需用pH计校正。
2.7. 10g/L酪素溶液称取酪素1.000g,精确至0.001g,用少量0.5mol/L氢氧化钠溶液湿润后,加入适量的各种适宜pH值的缓冲溶液约80mL,在沸水浴中边加热边搅拌,直至完全溶解,冷却后,转入100mL容量瓶中,用适宜的pH值缓冲溶液稀释至刻度。
![碱性蛋白酶活力的测定[整理版]](https://uimg.taocdn.com/d0e064c727fff705cc1755270722192e45365889.webp)
实验四碱性蛋白酶活力的测定一、实验原理以酪蛋白为底物测定碱性蛋白酶的活力。
酪蛋白经蛋白酶作用后,会降解成相对分子质量较小的肽和氨基酸,在反应混合物中加入三氯醋酸溶液,相对分子质量较大的蛋白质和肽就沉淀下来,相对分子质量较小的肽和氨基酸仍留在溶液中。
溶解于三氯醋酸溶液中的肽的数量正比于酶的数量和反应时间。
因而采用Folin法测定上清液中肽的含量就可以计算酶的活力。
二、试剂和仪器试剂:0.1mol/L碳酸钠-碳酸氢钠缓冲液(pH10)、5%三氯醋酸、1%酪蛋白溶液(称取5g酪蛋白置于500mL 0.1mol/L碳酸钠-碳酸氢钠缓冲液(pH10)中,加热使其溶解)、0.4mol/L碳酸钠溶液、100μg/mL酪氨酸溶液、Folin试剂,稀释3倍使用仪器:水浴锅、721分光光度计(含比色皿)、秒表、常规玻璃仪器三、实验步骤1、酶液的萃取称取1g粗酶制剂置于研钵中,加少量缓冲液一起研磨,然后定容至100mL,从容量瓶中取出5mL酶液(视酶活而定)再定容至100mL,稀释后的酶液经滤纸过滤后得到澄清的酶液。
2、酶活力的测定样品管:取不同量的酶液(0.1~1.0mL:0.2mL、0.4mL、0.6mL),用0.1mol/L 碳酸钠-碳酸氢钠缓冲液(pH10)(对应为0.8mL、0.6mL、0.4mL)补足体积到1.0mL,然后在每个样品管中再加入1mL预先在40℃保温的1%酪蛋白溶液,混匀,在40℃准确保温10min,加入2mL 5%三氯醋酸溶液,迅速摇匀,于室温静置半小时。
空白管:先在每支试管中各加入1.0mL 1%酪蛋白溶液和2.0mL 5%三氯醋酸溶液,摇匀后,再加入1.0mL的酶液,酶液浓度分别与对应的样品管相同,在40℃下准确保温10min,以下操作同样品管。
将酶反应混合物过滤后收集滤液,在1mL滤液中加5mL 0.4mol/L碳酸钠溶液和1mL Folin试剂,摇匀后在40℃恒温水浴中显色20 min,以相应的空白管中的反应液为对照,在680nm下测定样品管中反应液的吸光度。

碱性蛋白酶活力分析方法研究张剑;赵雷敏;康林霞【摘要】通过福林法对液体碱性蛋白酶的活力进行了测定.研究比较了不同温度及pH下的酶促反应对酶活力测定方法的影响,结果显示:酶活力随反应温度的升高表现为先上升后下降,40~50℃时相对较稳定;pH降低对碱性蛋白酶活力有着负面影响.在确定出较优的适合碱性蛋白酶的活力测定方法后,进一步测试了该方法在液体洗涤剂酶活力测定中的应用,发现在洗涤剂中简单地加入酶制剂后,测定酶活力时会出现较大偏差,酶活力值不稳定.因此,在配制加酶液体洗涤剂时,应该对各种因素,例如温度、pH以及洗涤剂中各种成分与酶的相互影响等进行综合考虑.%Activity of liquid alkaline protease was measured by using Folin method. Effects of enzymatic reaction under different temperature and different pH on the enzyme activity assay were investigated and compared. Results showed that as the reaction temperature raises,the enzyme activity increases firstly and then declines j while lowering of the pH of the reaction shows negative impact of the alkaline protease activity. After the optimum conditions for alkaline protease activity assay were identified, the application of the assay method in the determination of enzyme activity of enzymed liquid detergent was further tested. It was discovered that if the enzyme was simply added and mixed with the liquid detergent, the measured enzyme activity of the detergent will appear big deviation and an unstable value. This phenomenon indicated that during the formulation of enzymed liquid detergent, many factors such as the temperature, pH,and the mutual influence of components in the detergent should be comprehensively considered.【期刊名称】《日用化学工业》【年(卷),期】2012(042)003【总页数】4页(P192-195)【关键词】蛋白酶;活力分析;福林法;液体洗涤剂【作者】张剑;赵雷敏;康林霞【作者单位】山西大学化学化工学院,山西太原 030006;山西大学化学化工学院,山西太原 030006;山西大学化学化工学院,山西太原 030006【正文语种】中文【中图分类】TQ925+.2酶由生物体中的活细胞经过各种生理活动产生,是一种具有催化作用的物质。

蛋白酶活性的测定方法(GB/T23527-2009)1 原理蛋白酶对酪蛋白、乳清蛋白、谷物蛋白等都有很好的水解作用。
磷钨酸和磷钼酸混合试剂,即福林-酚试剂,碱性条件下极不稳定,易被酚类化合物还原而呈蓝色反应(钨兰和钨兰混合物)。
由于蛋白质中含有具有酚基的氨基酸(酪氨酸、色氨酸、苯丙氨酸),因此,蛋白质及其水解产物也呈此反应。
利用蛋白酶分解酪素(底物)生成含酚基氨基酸的呈色反应,来间接测定蛋白酶的活力。
2 仪器和设备2.1 分析天平:精度0.0001g2.2 恒温水浴:精度±0.2℃2.3 计时表2.4 分光光度计2.5 沸水浴器2.6 振荡混合器2.7 pH计: 精度0.01pH单位3 试剂和溶液3.1 乳酸缓冲液(pH=3.0)适用于酸性蛋白酶甲液:称取乳酸(80%-90%)10.6g,加水溶解并定容至1000ml。
乙液:称取乳酸钠(70%)16g,加水溶解并定容至1000ml.使用溶液:取甲液8ml,加乙液1ml,摇匀,稀释一倍,即成0.05mol/L乳酸缓冲溶液。
3.2 磷酸缓冲液的制备(pH=7.5)适用于中性蛋白酶准确称取磷酸氢二钠(Na2HPO3.12H2O)6.02和磷酸二氢钠(NaH2PO3.2H2O)0.5g,加水定容至1000ml3.3 硼酸缓冲液(pH=10.5) 适用于碱性蛋白酶甲液:称取硼酸钠19.08g,加水溶解并定容至1000ml。
乙液:称取氢氧化钠4.0g,加水溶解并定容至1000ml.使用溶液:取甲液500ml,加乙液400ml,摇匀,用水稀释至1L。
3.4 0.4mol/L碳酸钠溶液:准确称取无水碳酸钠42.4g,以蒸馏水溶解定溶至1000ml.3.5 0.4mol/L的三氯醋酸液:准确称取65.4三氯醋酸,以蒸馏水溶解定溶至1000ml3.6 0.5mol/L的NaOH:准确称取2g NaOH溶解并定至100ml3.7 10.00mg/ml酪素溶液称取酪素1.000g,准确至0.001g,用少量的0.5mol/L的氢氧化钠溶液(若为酸性蛋白酶则用浓乳酸2-3滴)润湿,,加入适量的各适宜的缓冲液约80ml,在沸水浴中边加热边搅拌,直至完全溶解,冷却后,转入100ml容量瓶中,用适宜的缓冲液稀释至刻度,此溶液在冰箱内贮存,有效期为三天.3.8 100μg/ml酪氨酸标准溶液3.8.1 准确称取预先于105℃干燥至恒重的L-酪氨酸0.1000g ,用1mol/L 的盐酸60ml 溶解后定容至100ml,即为1.00mg/ml的酪氨酸溶液.3.8.2 吸取1.00mg/ml酪氨酸标准溶液10.00ml,用0.1mol/L盐酸定容至100ml,即得100.0μg/ml L-酪氨酸标准溶液.3.9 酶样的制备准确称取1.000g固体酶或移取1ml液体酶样,用少量的适宜缓冲液溶解并用玻璃棒捣研,然后将上清液倒入100ml容量瓶,沉渣中再添入少量缓冲液捣研多次,最后全部移入容量瓶,稀释到刻度,用四层纱布过滤。
碱性蛋白酶(AKP)活性测定试剂盒说明书碱性蛋白酶(Alkaline protease, AKP)活性测定试剂盒说明书微量法100T/48S注意:正式测定之前选择23个预期差异大的样本做预测定。
测定意义:AKP是指在碱性条件下催化蛋白质肽键水解的酶类,属于丝氨酸蛋白酶。
此外,该酶还能够水解酯键、酰胺键,具有转酯及转肽的功能。
该酶是主要工业用酶之一,广泛应用于制药、丝绸、食品、制革等行业。
测定原理:在碱性条件下,AKP水解酪蛋白生成酪氨酸;在碱性条件下,酪氨酸还原磷钼酸生成钨蓝;钨蓝在680nm有特征吸收峰,测定680nm吸光度增加速率,来计算AKP活性。
自备仪器和用品:可见分光光度计/酶标仪、微量玻璃比色皿/96孔板、水浴锅、磁力搅拌器、可调式移液枪、0.5 mL EP管和蒸馏水。
试剂组成和配制:试剂一:液体100mL×1瓶,4℃保存。
试剂二:粉剂×1瓶,4℃保存。
临用前加5mL蒸馏水溶解。
试剂三:粉剂×1瓶,4℃避光保存。
临用前加入10mL试剂一,沸水浴中磁力搅拌溶解。
(可在烧杯上盖一层保鲜膜,注意观察,避免水分全部蒸发,一般加热1530分钟,该试剂为过饱和试剂,充分混匀后仍出现颗粒物不溶物不影响使用)。
试剂四:粉剂×1瓶,4℃保存。
临用前加20mL蒸馏水溶解。
试剂五:液体5mL×1瓶,4℃保存。
标准品:液体1mL×1支,0.25μmol/mL标准酪氨酸溶液,4℃保存。
粗酶液提取:1. 组织:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL试剂一)冰浴匀浆,8000g,4℃离心10min,取上清,即粗酶液。
2. 血清或培养液:直接测定。
3. 细菌、真菌:按照细胞数量(104个):试剂一体积(mL)为500~1000:1的比例(建议500万细胞加入1mL试剂一),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后8000g,4℃,离心10min,取上清置于冰上待测。
分光光度法测定蛋白酶酶活1适用范围本方法适用于中性蛋白酶、酸性蛋白酶酶活得测定。
2测定原理蛋白酶在一定得温度与pH条件下,水解酪素(酪蛋白)底物,产生含有酚基得氨基酸(如:酪氨酸、色氨酸等),在碱性条件下,将福林试剂(Folin)还原,生产钼蓝与钨蓝,用分光光度计于波长680nm下测定溶液吸光度。
酶活力与吸光度成正比,由此可以计算产品得酶活力。
酶活单位得定义:每1mL粗酶液,在一定温度与pH值条件下,10min水解酪素产生1μg酪氨酸为一个酶活力单位,以(u/mL)表示。
3仪器与设备3.1分析天平:精度为0。
0001g。
3.2紫外分光光度计。
3.3恒温水浴锅:精度±0。
2℃。
3.4PH计:精度为0.01PH单位。
4试剂与溶液除非另有说明,在分析中仅使用分析纯试剂与蒸馏水。
4.1福林(Folin)试剂市售分析纯福林试剂、4.2福林使用溶液一份福林试剂与两份水混合,摇匀。
4.3碳酸钠溶液(42、4g/L)称取无水碳酸钠(Na2CO3)42.4g,用水溶解并定容至1000ml。
4.4三氯乙酸c(CCl3COOH)=0、4mol/L称取三氯乙酸65、4g,用水溶解并定容至1000 mL、4.5氢氧化钠溶液c(NaOH)=0.5mol/L称取氢氧化钠片剂20。
0g,加水900ml并搅拌溶解,待溶液到室温后加水定容至1000ml,摇匀。
4.6盐酸溶液c(HCL)=1 mol/L及0。
1mol/L1 mol/L HCL:取90mL浓盐酸溶解于蒸馏水中,定容至1000mL。
0、1 mol/L HCL:取9mL浓盐酸溶解于蒸馏水中,定容至1000mL、4.7缓冲溶液4.7.1磷酸缓冲液(pH=7。
5,适用于中性蛋白酶)称取磷酸氢二钠(Na2HPO4•12H2O)6、02g与磷酸二氢钠(NaH2PO4•12H2O)0、5g,加水溶解并定容至1000mL。
4.7.2乳酸缓冲液(pH=3。
0,适用于酸性蛋白酶)甲液:称取乳酸(80%~90%)10、6g,加水溶解并定容至1000 mL。
蛋白酶活力的测定一、实验目的1、了解碱性蛋白酶活力测定的原理;2、掌握碱性蛋白酶活力测定的方法。
二、实验原理蛋白酶在一定条件下不仅能够水解蛋白质中的肽键,也能够水解酰胺键和酯键,因此可用蛋白质或人工合成的酰胺及酯类化合物作为底物来测定蛋白酶的活力。
本实验选用酪蛋白为底物,测定微生物蛋白酶水解肽键的活力。
酪蛋白经蛋白酶作用后,降解成相对分子质量较小的肽和氨基酸,在反应混合物中加入三氯醋酸溶液,相对分子质量较大的蛋白质和肽就沉淀下来,相对分子质量较小的肽和氨基酸仍留在溶液中,溶解于三氯醋酸溶液中的肽的数量正比于酶的数量和反应时间。
在280nm波长下测定溶液吸光度的增加,就可计算酶的活力。
三、实验步骤1、将5%TCA溶液和1%酪蛋白溶液在37℃下保温。
2、取四支15ml具塞试管,分别标上记号A1,A0,B1和B0。
在A1和A0试管中各吸入0.20ml酶液,在B1和B0试管中各吸入0.40ml酶液,分别用0.2mol/L 磷酸盐缓冲液定容至2.00ml。
在A0和B0试管中各吸入6.00ml5%三氯醋酸溶液,上述四支试管都置于37℃水浴中保温。
3、在各试管中吸入2.00ml1%酪蛋白溶液,在37℃下保温10min(准确计时)后,再向A1和B1试管中吸入6.00ml5%三氯醋酸溶液。
4、奖试管从水浴中取出,在室温下放置1h,用少量上清液润湿滤纸后过滤,保留滤出液。
5、在280nm波长下,分别以A0和B0滤液为空白,测定A1和B1滤液的吸光度。
三、实验试剂①微生物蛋白酶萃取液(0.01g/ml):称取1.0g酶制剂,加100ml蒸馏水搅拌30min,在4℃下离心分离后,将上层清夜置于冰箱中保存,使用前稀释一定倍数;②0.02mol/L磷酸盐缓冲液(PH7.5);③1%酪蛋白溶液:取1.0g酪蛋白,加100ml 0.2mol/L磷酸盐缓冲液(PH7.5),加热并搅拌使它完全分散,然后置于冰箱中保存;④5%三氯醋酸(TCA)溶液。
实验三蛋白酶活力的测定一、目的掌握用分光光度计法测定蛋白酶活力的原理与操作技术。
二、原理蛋白酶水解酪蛋白,其产物酪氨酸能在碱性条件下使福林——酚试剂还原,生成鉬蓝与钨蓝,以比色法测定。
三、试剂及仪器1.福林—酚试剂称取50g钨酸钠(Na2WO4•2H2O),12.5g钼酸钠(Na2MoO4•2H2O),置入1000mL原底烧瓶中,加350mL水,25mL85%磷酸,50mL浓盐酸,文火微沸回流10h,取下回流冷凝器,加50g硫酸锂(Li2SO4)和25mL水,混匀后,加溴水脱色,直至溶液呈金黄色,再微沸15min,驱除残余的溴,冷却,用4号耐酸玻璃过滤器抽滤,滤液用水稀释至500mL。
使用时用2倍体积的水稀释。
2.0.4mol/L碳酸钠溶液:称取42.4g碳酸钠,用水溶解并定容至1000mL。
3.0.4mol/L三氯乙酸溶液:称取65.5g三氯乙酸,用水溶解并定容至1000mL。
4.2%酪蛋白溶液称取2.00g酪蛋白(又名干酪素),加约40mL水和2~3滴浓氨水,于沸水浴中加热溶解,冷却后,用pH7.2磷酸缓冲溶液稀释定容至100mL,贮存于冰箱中。
5.pH7.2磷酸缓冲液0.2mol/L 磷酸二氢钠溶液:称取31.2g磷酸二氢钠(NaH2PO4•2H2O),用水溶解稀释至1000mL;0.2mol/L 磷酸氢二钠溶液:称取71.6g磷酸氢二钠(Na2HPO4•12H2O),用水溶解稀释至1000mL;pH7.2磷酸缓冲溶液:取28mL 0.2mol/L磷酸二氢钠溶液和72mL 0.2mol/L磷酸氢二钠溶液,用水稀释至1000mL。
6.标准酪氨酸溶液:准确称取0.1g DL-酪氨酸,加少量0.2mol/L盐酸溶液(取1.7mL浓盐酸,用水稀释至100mL),加热溶解,用水定容至1000mL,每毫升含DL-酪氨酸100微克。
7.仪器:分光光度计、试管四、操作步骤1.标准曲线绘制编号0 1 2 3 4 5 6 7 80 1 2 3 4 5 6 7 8标准酪氨酸溶液(mL)[100g/mL]水(mL) 10 9 8 7 6 5 4 3 2稀释酪氨酸溶液浓度(g/mL) 0 10 20 30 40 50 60 70 80在上述各管中各取1mL,分别加入5mL 0.4mol/L碳酸钠溶液,1mL福林—酚试剂,于400C水浴显色20min,在680nm波长下测吸光度,绘制标准曲线,在标准曲线上求得吸光度为1时相当的酪氨酸g数,即为K值。
蛋白酶产生菌的筛选及酶活力的测定一、实验目的学习用选择平板从自然界中分离胞外蛋白酶产生菌的方法掌握蛋白酶活力测定的原理与基本方法学习并掌握细菌菌株的药瓶液体发酵技术二.实验原理能够产生胞外蛋白酶的菌株在牛奶平板上生长后,其菌落周围可形成明显的蛋白水解圈。
水解圈与菌落直径的比值常被作为判断该菌株蛋白酶产生能力的初筛依据。
不同类型的蛋白酶都能在牛奶平板上形成蛋白水解圈,细菌在平板上的生长条件和液体环境中生长的情况相差很大,因此在平板上产圈能力强的菌株不一定就是碱性蛋白酶的高产菌株。
碱性蛋白酶活力测定按中华人民共和国颁布标准QB747-80进行。
原理:Folin试剂与酚类化合物(Tyr,Trp,Phe)在碱性条件下发生反应形成蓝色合物,用蛋白酶分解酪蛋白生成含酚基的氨基酸与Folin试剂呈蓝色反应,通过分光光度计测定可知酶活大小。
三、实验材料样品:邢台学院电教楼附近的土壤。
试剂:蛋白胨,酵母粉,脱脂奶粉,琼脂,干酪素,三氯醋酸,NaOH,Na2CO3,Folin试剂,硼砂,酪氨酸,水等仪器和用品:三角烧瓶,培养皿,吸管,试管,涂布棒,玻璃搅拌棒,水浴锅,分光光度计,培养摇床,高压灭菌锅,尺,玻璃小漏斗和滤纸,玻璃搅拌棒,培养摇床,高压灭菌锅,尺,玻璃小漏斗和滤纸四、实验步骤(一)配制所需培养基(配置完一起灭菌)按照以下配方配制所需的培养基1、牛肉膏蛋白胨培养基:牛肉膏0.5g,蛋白胨1g,NaCl 0.5g,琼脂 1.5~2.0g,水100ml,pH7.0~ 7.2,配制200mL2、奶粉培养基:牛肉膏0.5g,蛋白胨1g,NaCl 0.5g,琼脂 2.0g,水100ml,pH7.0~ 7.2,脱脂奶粉3g,配制200mL (在普通肉汤蛋白胨固体培养基中添加终质量浓度为1.5%的牛奶)单独灭菌112℃,30min,以防破坏蛋白质。
3、发酵培养基:玉米粉4%,黄豆饼粉3%,Na2HPO4 0.4%,KH2PO4 0.03%,3 mol/l NaOH 调节pH到9.0,0.1MPa 灭菌20min,250ml三角烧瓶的装瓶量为50ml。
实验原理见讲义思考题(只是给出了简单答案):1、大孔吸附树脂法分离纯化果蔬花青素1.1一般提取率随提取温度的升高而提高,但是温度提高色素受到的破坏也增加。
1.2 因为色素易溶于水和在酸性条件下稳定。
1.3 防止色素被空气氧化,影响测定结果。
2、植物组织中DNA和RNA的提取和鉴定2.1 因为在核酸提取分离过程中是使用浓的高氯酸来提取RNA,而小分子物质一般多是酸溶性的,所以要在分离核酸时用冰冷的稀三氯乙酸或高氯酸溶液将小分子物质去掉。
此外,核酸中如果混有小分子或者脂类物质或者其他杂质都是有可能对后续步骤产生影响,比如说使限制酶失活或者改变特异性,所以还要在分离核酸时用有机溶剂如丙酮、乙醇去除脂溶性的磷脂类物质。
2.2 不能2.3苔黑酚法可快速鉴别RNA,二苯胺法可快速鉴定DNA。
3、碱性蛋白酶活力的测定3.1 碳酸钠作用是使反应体系为碱性。
三氯醋酸的作用是使反应体系为酸性。
3.2在碱性条件下福林-酚试剂不稳定,能被酪氨酸中的酚基还原,生成钼蓝、钨蓝的混合物,所生成的蓝色化合物才可以用比色法测定。
40℃则是加速反应的进行。
3.3 不能,酶是蛋白质,放置久了会发生降解导致变质。
4、垂直板聚丙烯酰胺凝胶电泳分离蛋白质4.1 凝胶系统的不连续性,即上层胶的孔径大,下层胶的孔径小;缓冲体系的不连续性,即上层胶pH为6.7-6.8,下层胶pH为8.9。
4.2 浓缩效应,分子筛效应,电荷效应,怎样造成的答案详见讲义。
4.3可以,缓冲液在电泳过程中的一个作用是维持合适的pH。
电泳时正极与负极都会发生电解反应,正极发生的是氧化反应,负极发生的是还原反应,长时间的电泳将使正极变酸,负极变碱。
但电泳结束后,将上下槽缓冲液混合在一起后只要具有缓冲能力就可以再次使用。
4.4 主要目的是增加溶液的粘稠度,加样的时候更加容易操作。
4.5 30%丙烯酰胺贮液配制时要注意:将丙烯酰胺和N,N’-亚甲双丙烯酰胺要溶于热水中,并验证其pH值不大于7.0。
实验四碱性蛋白酶活力的测定
一、实验原理
以酪蛋白为底物测定碱性蛋白酶的活力。
酪蛋白经蛋白酶作用后,会降解成相对分子质量较小的肽和氨基酸,在反应混合物中加入三氯醋酸溶液,相对分子质量较大的蛋白质和肽就沉淀下来,相对分子质量较小的肽和氨基酸仍留在溶液中。
溶解于三氯醋酸溶液中的肽的数量正比于酶的数量和反应时间。
因而采用Folin法测定上清液中肽的含量就可以计算酶的活力。
二、试剂和仪器
试剂:0.1mol/L碳酸钠-碳酸氢钠缓冲液(pH10)、5%三氯醋酸、1%酪蛋白溶液(称取5g酪蛋白置于500mL 0.1mol/L碳酸钠-碳酸氢钠缓冲液(pH10)中,加热使其溶解)、0.4mol/L碳酸钠溶液、100μg/mL酪氨酸溶液、Folin试剂,稀释3倍使用
仪器:水浴锅、721分光光度计(含比色皿)、秒表、常规玻璃仪器
三、实验步骤
1、酶液的萃取
称取1g粗酶制剂置于研钵中,加少量缓冲液一起研磨,然后定容至100mL,从容量瓶中取出5mL酶液(视酶活而定)再定容至100mL,稀释后的酶液经滤纸过滤后得到澄清的酶液。
2、酶活力的测定
样品管:取不同量的酶液(0.1~1.0mL:0.2mL、0.4mL、0.6mL),用0.1mol/L 碳酸钠-碳酸氢钠缓冲液(pH10)(对应为0.8mL、0.6mL、0.4mL)补足体积到1.0mL,然后在每个样品管中再加入1mL预先在40℃保温的1%酪蛋白溶液,混匀,在40℃准确保温10min,加入2mL 5%三氯醋酸溶液,迅速摇匀,于室温静置半小时。
空白管:先在每支试管中各加入1.0mL 1%酪蛋白溶液和2.0mL 5%三氯醋酸溶液,摇匀后,再加入1.0mL的酶液,酶液浓度分别与对应的样品管相同,在40℃下准确保温10min,以下操作同样品管。
将酶反应混合物过滤后收集滤液,在1mL滤液中加5mL 0.4mol/L碳酸钠溶
液和1mL Folin试剂,摇匀后在40℃恒温水浴中显色20 min,以相应的空白管中的反应液为对照,在680nm下测定样品管中反应液的吸光度。
3、标准曲线
为了确定酪氨酸与OD值的对应关系,需事先用不同浓度标准酪氨酸溶液与Folin试剂反应显色,测定OD值标准曲线。
(1)不同浓度的标准酪氨酸溶液按下表配置:
(2)向上表配制的不同浓度的酪氨酸溶液中分别加入0.4mol/L碳酸钠溶液5mL,Folin试剂1mL,置于40℃恒温水浴显色20min,在680nm下以空白为对照,测定各样品管溶液的吸光度。
(3)以吸光度(OD)为纵坐标,酪氨酸浓度为横坐标,绘制标准曲线,由直线斜率计算K值。
四、数据记录与处理
1、根据标准曲线计算K值
用Excel拟合得,K=114.7(OD值为1时相当的微克数)。
2、酶活力计算
酶液加入量/mL 相当于粗
酶制剂/克
空白管
OD值
样品管
OD值
净OD值酶活力/[*104单
位数/克酶制剂]
平均酶活力/[*104
单位数/克酶制剂]
0.2 0.0001 0.000 0.361 0.361 16.56
13.48
0.4 0.0002 0.000 0.569 0.569 13.05
0.6 0.0003 0.000 0.709 0.709 10.84
酶活力的计算:
酶活力(单位数/克酶制剂)=4/10×K×OD×n
式中:4——反应混合物总体积为4mL;
10——酶反应时间为10min;
K——标准曲线中OD值为1时相当的酪氨酸微克数,结果为114.7;
n——酶液的稀释倍数
五、讨论
1、酶反应的温度、pH和时间对被水解的肽键数量有直接的影响,因此必须严格控制。
2、用三氯醋酸终止反应后,过滤反应混合物所得的滤液必须是澄清的。
3、因为Folin试剂对酸性环境比较敏感,容易发生变化,因此在测定时有顺序的规定,需要先加入碳酸钠溶液形成一个碱性环境,之后再加入Folin试剂,使其能正常发挥作用。