蛋白酶活力的测定
- 格式:doc
- 大小:53.50 KB
- 文档页数:3

蛋白酶活力测定实验报告
实验目的:
通过测定蛋白酶的活力,了解其功能和活性。
实验原理:
蛋白酶是一类能够水解蛋白质的酶,可以将蛋白质分解为多肽和氨基酸。
蛋白酶活力是指单位时间内酶水解蛋白质的能力,通常以单位时间内水解的底物的量来表示。
本实验使用的方法是酶促反应测定法。
首先,将待测蛋白酶与底物混合,反应一定时间后,停止反应并添加淀粉溶液产生反应终止剂,最后用碘化钾溶液滴定反应产物。
实验步骤:
1. 预备试剂:制备蛋白酶和底物的工作液,制备淀粉溶液和反应终止剂,制备碘化钾溶液。
2. 实验装置:准备滴定装置和试管架。
3. 设置实验条件:保持温度恒定,控制pH值。
4. 实验操作:在试管中加入待测蛋白酶和底物工作液,反应一定时间后,加入淀粉溶液和反应终止剂,最后用碘化钾溶液滴定。
5. 记录数据:记录滴定所需碘化钾的体积,计算出酶活力。
实验结果:
根据实验数据,计算出蛋白酶的活力,通常以单位时间内水解的底物的量来表示。
实验讨论:
分析实验结果,比较不同条件下蛋白酶的活力差异,并讨论影响蛋白酶活力的因素。
实验结论:
通过分析实验结果,得出结论,总结蛋白酶活力与其他因素之间的关系,并提出可能的应用前景。
实验总结:
总结实验过程,评价实验结果及数据,提出改进意见,并对今后可能的研究方向进行展望。
参考文献:
列出所参考的文献。

蛋白酶活性的测定方法
蛋白酶活性的测定方法有多种,常见的方法包括:
1. 比色法:基于酶催化底物的产物与染色剂之间发生化学反应的原理。
测定过程中,酶水解底物产生的产物与染色剂发生反应形成有色产物,通过测定产物的吸光度来估计酶活性的强弱。
2. 荧光法:利用荧光底物的酶催化产物发出的荧光信号来测定酶活性。
荧光强度与酶催化产物的浓度成正比,通过测定荧光强度来分析酶活性。
3. 放射性标记法:将底物标记上放射性同位素,使其具有放射性。
通过测定底物放射性崩解的程度来估计酶活性的大小。
4. 免疫学方法:利用特异性抗体与酶结合形成抗原-抗体-酶复合物,测定抗原-抗体-酶复合物的活性来检测酶活性的强弱。
5. 吸收光谱法:利用特定的酶底物,通过测量其吸收光谱的变化来分析酶活性的强弱。
需要根据具体实验目的和条件选择适合的测定方法。

福林酚法测定蛋白酶活力原理1. 引言:蛋白酶的神秘面纱哎呀,说到蛋白酶,大家可能会觉得这玩意儿离我们有点远。
其实不然,蛋白酶可是咱们身体里忙前忙后、默默奉献的小工人。
它们像一群勤劳的清道夫,帮我们分解食物中的蛋白质,让营养更好地被吸收。
不过,有时候我们得搞清楚这些小工人到底干了多少活儿,这时候就需要用到福林酚法了。
说到这儿,可能有人要问:啥是福林酚法?怎么听起来这么高大上?别急,我这就给大家捋捋这其中的门道。
2. 福林酚法的基本原理2.1 蛋白酶活力的测定首先,福林酚法其实是个很聪明的办法,它可以用来测定蛋白酶的活力。
蛋白酶,顾名思义,就是能把蛋白质搞得七零八落的那种酶。
我们要知道它的活力,就得看看它把蛋白质分解的效率如何。
简单来说,就是用这套方法来测一测它干了多少活儿。
咋测呢?这就需要一点点化学的小窍门了。
2.2 福林酚法的步骤那么,福林酚法到底怎么操作呢?这个过程其实没那么复杂,只要几个步骤就能搞定。
首先,我们需要一种叫做“福林酚试剂”的化学液体。
这个试剂像是福尔摩斯,能准确找出蛋白酶分解蛋白质后剩下的东西。
接下来,我们会把待测的蛋白质样品和福林酚试剂混合,然后放到一个小瓶里。
再往里面加上另一种试剂,这时候,瓶子里的液体就会发生颜色变化。
这种颜色的变化,就告诉我们蛋白酶的活力到底如何。
明白了吧?简单来说,颜色越深,蛋白酶活力越强。
3. 实验操作的细节3.1 样品准备为了让实验结果更准确,我们需要对样品进行准备。
首先,得把蛋白质样品溶解成一定浓度的液体。
这个过程就像是在做一道美味的汤,得控制好原料的比例,才能保证最终的味道。
我们通常会用去离子水来溶解,这样可以避免杂质影响结果。
接着,样品需要经过过滤,确保液体里没有大颗粒的沉淀物。
这样一来,实验才会更靠谱,像是给蛋白酶干活提供了一个干净整洁的环境。
3.2 反应时间与测量接下来,就是关键的反应时间了。
通常,我们会让样品和试剂反应一段时间,这个时间的长短可是有讲究的,太短了可能测不出准确的结果,太长了又可能产生误差。

蛋白酶活力的测定1范围本文件规定了酱油和黄豆酱的菌种、种曲、成曲酶活力的测定方法。
本文件适用于酱油和黄豆酱的菌种、种曲、成曲酶活力的测定。
2规范性引用文件下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。
其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682分析实验室用水规格和试验方法3术语和定义3.1中性蛋白酶活力单位neutral protease active unit在温度为40℃、pH值为7.2的条件下,在1min内水解酪蛋白产生相当于1μg酪氨酸的酶量,定义为1个中性蛋白酶活力单位。
3.2酸性蛋白酶活力单位acidic protease active unit在温度为40℃、pH值为3.0的条件下,在1min内水解酪蛋白产生相当于1μg酪氨酸的酶量,定义为1个酸性蛋白酶活力单位。
3.3碱性蛋白酶活力单位alkaline protease active unit在温度为40℃、pH值为10.5的条件下,在1min内水解酪蛋白产生相当于1μg酪氨酸的酶量,定义为1个碱性蛋白酶活力单位。
4原理蛋白酶在一定的温度与pH条件下,水解酪蛋白底物产生含有酚基的氨基酸(如:酪氨酸、色氨酸等),在碱性条件下,可将福林试剂(Folin)还原,生成钼蓝与钨蓝,其颜色的深浅与酚基氨基酸含量成正比。
采用分光光度计(波长660nm)测定其吸光度,进而计算蛋白酶活力。
5试剂和材料5.1试剂除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的三级水。
5.1.1钨酸钠(Na 2WO 4·2H 2O)。
5.1.2钼酸钠(Na 2MoO 4·2H 2O)。
5.1.3硫酸锂(Li 2SO 4)。
5.1.4溴(Br)。
5.1.5无水碳酸钠(Na 2CO 3)。
5.1.6三氯乙酸(CCl 3COOH)。

1 蛋白酶活力的测定1.1 原理采用福林-酚试剂法。
福林-酚试剂在碱性条件下可被酚类化合物还原呈蓝色(钼蓝和钨蓝混合物),由于蛋白质分子中有含酚基的氨基酸(如酪氨酸、色氨酸等),可使蛋白质及其水解产物呈上述反应。
因此可利用此原理测定蛋白酶活力。
通常以酪蛋白为底物,在一定pH值和温度条件下,同酶液反应,经一段时间后终止酶促反应,经离心或过滤除去酪蛋白筹沉淀物后取上清液,用Na2CO3碱化,再加入福林-酚试剂显色,蓝色的深浅与滤液中生成产物酪氨酸量成正比;酪氨酸含量用分光光度计在660nm波长处测定,从而计算出蛋白酶的活力。
1.2 试剂1.2.l 福林-酚试剂向2000mL的磨口回流瓶中加入100g钨酸钠(Na2WO4?2H2O)、25g钼酸钠及700mL的去离子水,再加入50mL85%的磷酸及浓盐酸l00mL,充分混合后,接上回流冷凝管,以文火回流10h,结束后再加入150g的硫酸锂(LiSO4)、50mL去离子水及数滴溴水,再继续沸腾15min,以驱除过量的溴,冷却后滤液呈黄绿色(如仍呈绿色,需再重复滴加溴水的步骤),加去离子水定容至1000mL乱,过滤,滤液置于棕色试剂瓶中,贮于冰箱中可长期保存备用。
此溶液使用时可按1:3比例用去离子水稀释。
1.2.2 0.4mol/L三氯乙酸(TCA)溶液精确称取TCA65.4g,加去离子水定容至1000mL。
1.2.3 0.4mo1/L碳酸钠溶液精确称取无水碳酸钠42.4g,加去离于水溶解后,定容至1000mL。
1.2.4 pH值3~6醋酸缓冲液精确取NaAc?3H2O16g与268mL浓度为6mol/L醋酸溶液混合,用去离子水稀释定容至1000mL。
1.2.5 2%酪蛋白底物缓冲液1.2.5.1 测试酸性蛋白酶缓冲液精确称取酪蛋白20g,加入0.1mol/L氢氧化钠20mL(用去离子水配制),在水浴中加热溶解,然后用pH值3.6醋酸缓冲液定容至1000mL。

简述蛋白酶活力测定的原理蛋白酶活力测定是一种用于评估酶分解蛋白质的能力的方法。
蛋白质是生命活动不可或缺的重要分子,然而,它们需要在体内被分解为较小的分子才能被利用。
其中,蛋白酶是一种特殊的酶,它能够将蛋白质分解为较小的肽链或氨基酸。
蛋白酶活力测定的原理主要基于蛋白质分解后的产物——氨基酸的检测。
在这个测定中,蛋白质被蛋白酶分解为氨基酸,然后这些氨基酸与一些特定的化学物质反应,产生一种有颜色的产物,这种产物能够吸收光,从而使溶液的吸光度增加。
通过测量溶液的吸光度,可以定量地测定蛋白酶的活力。
具体来说,测定蛋白酶活力的步骤如下:1.准备测试样品:将待测的蛋白酶与适当底物(即待分解的蛋白质)混合,置于适宜的反应条件下。
2.设定反应时间:在一定时间内,蛋白酶将底物分解为氨基酸。
为了确保反应在最佳条件下进行,需要设定一个适当的反应时间。
3.终止反应:在反应达到设定时间后,需要终止酶促反应,以便停止蛋白质的分解。
通常使用一种称为终止液的化学物质来实现这一步骤。
4.显色反应:终止液中的化学物质将与氨基酸反应,生成一种有颜色的产物。
这种产物能够吸收光,从而使溶液的吸光度增加。
5.吸光度测量:使用分光光度计测量溶液的吸光度。
吸光度的大小与溶液中氨基酸的浓度成正比,因此可以用来计算蛋白酶的活力。
通过这种测定方法,可以评估不同样品中蛋白酶的相对活力,并了解在不同条件下的酶促反应动力学。
这对于研究蛋白质分解过程、优化蛋白质分解反应的条件以及生物工程等领域都具有重要意义。
此外,蛋白酶活力测定也可以用于诊断和治疗某些与蛋白质分解相关的疾病,如胰腺炎等。
总之,蛋白酶活力测定的原理是基于蛋白质分解后的氨基酸形成染料,通过测量溶液的吸光度来定量测定蛋白酶活力。
这种方法在生物学、生物工程和医学等领域具有广泛的应用价值。

实验四、蛋白酶酶活力的测定一、原理以酪蛋白为反应底物,令蛋白酶在其最适宜条件下反应一定时间,用三氯乙酸终止反应后过滤或离心得上清液,用Folin比色法测上清液中蛋白酶解物的浓度,计算蛋白酶活力。
蛋白酶活力定义:在一定的条件下,每分钟水解酪蛋白生成与1μg酪氨酸相当的三氯醋酸可溶物所需的木瓜蛋白酶的量,为1个酶活力单位(u)。
二、材料、仪器与试剂(一)材料:木瓜蛋白酶(二)仪器:可见-紫外分光光度计、水浴锅、天平、具塞刻度试管(10、15ml)、漏斗、滤纸、试管架,容量瓶、移液管(1、10ml)、烧杯(25ml)、玻璃棒。
(三)试剂:1福林试剂(Folin试剂)市场购买的Folin试剂。
此溶液使用时加2倍蒸馏水稀释,即成已稀释3倍的福林试剂。
2、中性稀释液-pH7.2磷酸盐缓冲液称取磷酸二氢钠(NaH2PO4·2H2O)31.2g,定容至1000mL,即成0.2mol/L溶液(A液)。
称取磷酸氢二钠(Na2HPO4·12H2O)71.63g,定容至1000mL,即成0.2mol/L 溶液(B液)。
取A 液28mL 和B 液72mL,再用蒸馏水稀释1倍,即成0.1mol pH7.2的磷酸盐缓冲液。
3、酪蛋白溶液2g恒重的酪蛋白,用0.5mol/LNaOH溶液润湿后加入80ml pH7.2磷酸盐缓冲液,沸水浴溶解,冷却后,用1 mol/L盐酸调至pH 7.0,再用磷酸盐缓冲液定容至100ml,得浓度为2%的酪蛋白溶液。
临用现配。
4、三氯醋酸溶液称取三氯乙酸(CCL3COOH)65.4g,定容至1000mL,得0.4mol/L三氯乙酸(TCA)溶液5、酪氨酸标准溶液精确称取精确称取在105℃烘箱中烘至恒重的酪氨酸0.1000g,逐步加入6mL 1N盐酸使溶解,用0.2N盐酸定容至100mL,其浓度为1000μg/mL,再用水稀释5倍,得到200μg/mL的酪氨酸标准溶液。
取200μg/mL的标准酪氨酸溶液,配成不同浓度的溶液(0、20、40、60、80、100μg/mL)6、样品溶液称取木瓜蛋白酶0.100g, 置于研钵中,加入相应的缓冲液定容至50mL,得到稀释500倍的酶液(当天配制、稀释)。
实验四、蛋白酶活力的测定1.实验目的掌握用Folin-酚法测定蛋白酶活力的方法,与Azocasein(偶氮酪蛋白)法作为比较。
2.实验原理蛋白酶在一定的温度和pH下,水解酪素底物产生含有酚基的氨基酸(如酪氨酸、色氨酸),在碱性条件下,将福林试剂还原,生成钼蓝和钨蓝,其颜色的深浅与酚基氨基酸含量成正比,通过在660nm测定其吸光度,可得到酶解产生的酚基氨基酸的量,计算出蛋白酶活力,以此代表蛋白酶的总酶活力。
酶活单位定义:在37℃、相应的pH条件下,在1min内水解酪蛋白底物,产生相当于1µg酚类化合物(由酪氨酸等同物表示)的酶量,为1个酶活单位。
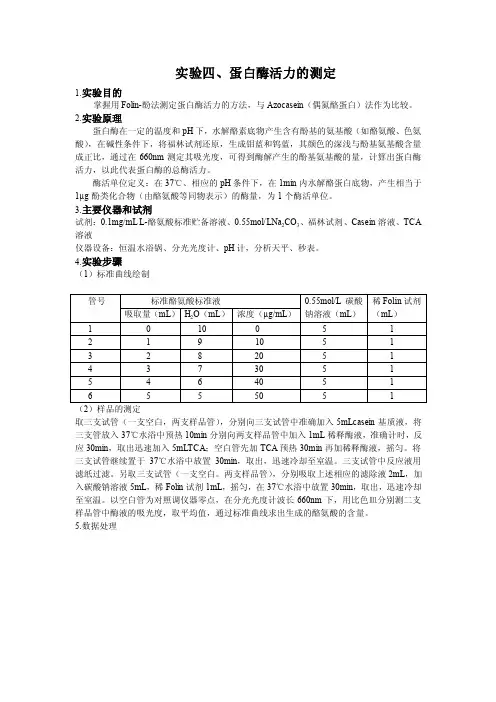
3.主要仪器和试剂试剂:0.1mg/mL L-酪氨酸标准贮备溶液、0.55mol/LNa2CO3、福林试剂、Casein溶液、TCA 溶液仪器设备:恒温水浴锅、分光光度计、pH计,分析天平、秒表。
4.实验步骤(1)标准曲线绘制取三支试管(一支空白,两支样品管),分别向三支试管中准确加入5mLcasein基质液,将三支管放入37℃水浴中预热10min分别向两支样品管中加入1mL稀释酶液,准确计时,反应30min,取出迅速加入5mLTCA;空白管先加TCA预热30min再加稀释酶液,摇匀。
将三支试管继续置于37℃水浴中放置30min,取出,迅速冷却至室温。
三支试管中反应液用滤纸过滤。
另取三支试管(一支空白。
两支样品管),分别吸取上述相应的滤除液2mL,加入碳酸钠溶液5mL,稀Folin试剂1mL,摇匀,在37℃水浴中放置30min,取出,迅速冷却至室温。
以空白管为对照调仪器零点,在分光光度计波长660nm下,用比色皿分别测二支样品管中酶液的吸光度,取平均值,通过标准曲线求出生成的酪氨酸的含量。
5.数据处理。



蛋白酶活性的测定方法(GB/T23527-2009)1 原理蛋白酶对酪蛋白、乳清蛋白、谷物蛋白等都有很好的水解作用。
磷钨酸和磷钼酸混合试剂,即福林-酚试剂,碱性条件下极不稳定,易被酚类化合物还原而呈蓝色反应(钨兰和钨兰混合物)。
由于蛋白质中含有具有酚基的氨基酸(酪氨酸、色氨酸、苯丙氨酸),因此,蛋白质及其水解产物也呈此反应。
利用蛋白酶分解酪素(底物)生成含酚基氨基酸的呈色反应,来间接测定蛋白酶的活力。
2 仪器和设备2.1 分析天平:精度0.0001g2.2 恒温水浴:精度±0.2℃2.3 计时表2.4 分光光度计2.5 沸水浴器2.6 振荡混合器2.7 pH计: 精度0.01pH单位3 试剂和溶液3.1 乳酸缓冲液(pH=3.0)适用于酸性蛋白酶甲液:称取乳酸(80%-90%)10.6g,加水溶解并定容至1000ml。
乙液:称取乳酸钠(70%)16g,加水溶解并定容至1000ml.使用溶液:取甲液8ml,加乙液1ml,摇匀,稀释一倍,即成0.05mol/L乳酸缓冲溶液。
3.2 磷酸缓冲液的制备(pH=7.5)适用于中性蛋白酶准确称取磷酸氢二钠(Na2HPO3.12H2O)6.02和磷酸二氢钠(NaH2PO3.2H2O)0.5g,加水定容至1000ml3.3 硼酸缓冲液(pH=10.5) 适用于碱性蛋白酶甲液:称取硼酸钠19.08g,加水溶解并定容至1000ml。
乙液:称取氢氧化钠4.0g,加水溶解并定容至1000ml.使用溶液:取甲液500ml,加乙液400ml,摇匀,用水稀释至1L。
3.4 0.4mol/L碳酸钠溶液:准确称取无水碳酸钠42.4g,以蒸馏水溶解定溶至1000ml.3.5 0.4mol/L的三氯醋酸液:准确称取65.4三氯醋酸,以蒸馏水溶解定溶至1000ml3.6 0.5mol/L的NaOH:准确称取2g NaOH溶解并定至100ml3.7 10.00mg/ml酪素溶液称取酪素1.000g,准确至0.001g,用少量的0.5mol/L的氢氧化钠溶液(若为酸性蛋白酶则用浓乳酸2-3滴)润湿,,加入适量的各适宜的缓冲液约80ml,在沸水浴中边加热边搅拌,直至完全溶解,冷却后,转入100ml容量瓶中,用适宜的缓冲液稀释至刻度,此溶液在冰箱内贮存,有效期为三天.3.8 100μg/ml酪氨酸标准溶液3.8.1 准确称取预先于105℃干燥至恒重的L-酪氨酸0.1000g ,用1mol/L 的盐酸60ml 溶解后定容至100ml,即为1.00mg/ml的酪氨酸溶液.3.8.2 吸取1.00mg/ml酪氨酸标准溶液10.00ml,用0.1mol/L盐酸定容至100ml,即得100.0μg/ml L-酪氨酸标准溶液.3.9 酶样的制备准确称取1.000g固体酶或移取1ml液体酶样,用少量的适宜缓冲液溶解并用玻璃棒捣研,然后将上清液倒入100ml容量瓶,沉渣中再添入少量缓冲液捣研多次,最后全部移入容量瓶,稀释到刻度,用四层纱布过滤。
实验:蛋白酶的活力测定一、实验目的1、学习蛋白酶活力的测定方法。
2、深入了解酶的活力和比活力的概念。
二、实验原理1、酶活力的大小,是以该酶在适宜的温度和pH下,酶催化一定时间后,反应底物的减少量或者反应产物的增加量来表示。
2、本实验蛋白酶的活力大小是以分解出的酪氨酸的量来表示,其单位为:每分钟内分解出1微克酪氨酸的酶量称为1单位。
3、本实验采用福林-酚与蛋白质水解出的酪氨酸生成兰色物,从兰色的深浅程度可以求知酪氨酸的多少,从而确定酶活力的大小。
4、在测酶活力前,先用福林-酚与用已知的不同浓度的酪氨酸作用,作出兰色深浅程度(用光密度表示)与酪氨酸浓度关系的标准曲线。
5、将酶与底物反应产生的产物与福林-酚试剂作用后测光密度,从标准曲线上查出相当于多少微克的酪氨酸,就可以计算出酶的单位了。
三、实验材料、仪器和试剂1.实验材料1398中性蛋白酶粗酶粉(上海新型发酵厂)、滤纸2.仪器(1)试管(1.5*15cm*24) (2)移液管(3)电热恒温水浴(4)721型分光光度计3.试剂(1)福林-酚试剂B(2)标准酪氨酸溶液称取50毫克酪氨酸(预先在105摄氏度烘至恒重),加0.2MHCL溶液后定容至100ml,在加水稀释5倍得到100微克/毫升的酪氨酸溶液。
(3)酪蛋白溶液称取酪蛋白2克,置150ml三角烧瓶中,加入0.2M磷酸氢二钠61ml,在水浴上搅拌使溶解,再加入39ml0.2M磷酸二氢钠,得到pH7的酪蛋白液,倾出上清液备用。
(4)0.4M三氯醋酸溶液(TCA)(5)0.4M碳酸钠溶液四、操作步骤1、酪氨酸标准曲线制作:按下列次序加入试剂,混合均匀,保温,然后在分光光度计上进行比色,测出650nm处的光密度值。
以酪氨酸浓度为横坐标,光密度值为纵坐标,作出标准曲线。
管号 1 2 3 4 5 62、蛋白酶活力测定 (1)浸出酶液称取0.5克酶粉加入40ml 水,在室温下放置1小时并时加搅动。
将酶浸出液过滤,取滤液1ml 用水稀释至20ml ,即为稀释1600倍的酶液。
实验三蛋白酶活力的测定一、目的掌握用分光光度计法测定蛋白酶活力的原理与操作技术。
二、原理蛋白酶水解酪蛋白,其产物酪氨酸能在碱性条件下使福林——酚试剂还原,生成鉬蓝与钨蓝,以比色法测定。
三、试剂及仪器1.福林—酚试剂称取50g钨酸钠(Na2WO4•2H2O),12.5g钼酸钠(Na2MoO4•2H2O),置入1000mL原底烧瓶中,加350mL水,25mL85%磷酸,50mL浓盐酸,文火微沸回流10h,取下回流冷凝器,加50g硫酸锂(Li2SO4)和25mL水,混匀后,加溴水脱色,直至溶液呈金黄色,再微沸15min,驱除残余的溴,冷却,用4号耐酸玻璃过滤器抽滤,滤液用水稀释至500mL。
使用时用2倍体积的水稀释。
2.0.4mol/L碳酸钠溶液:称取42.4g碳酸钠,用水溶解并定容至1000mL。
3.0.4mol/L三氯乙酸溶液:称取65.5g三氯乙酸,用水溶解并定容至1000mL。
4.2%酪蛋白溶液称取2.00g酪蛋白(又名干酪素),加约40mL水和2~3滴浓氨水,于沸水浴中加热溶解,冷却后,用pH7.2磷酸缓冲溶液稀释定容至100mL,贮存于冰箱中。
5.pH7.2磷酸缓冲液0.2mol/L 磷酸二氢钠溶液:称取31.2g磷酸二氢钠(NaH2PO4•2H2O),用水溶解稀释至1000mL;0.2mol/L 磷酸氢二钠溶液:称取71.6g磷酸氢二钠(Na2HPO4•12H2O),用水溶解稀释至1000mL;pH7.2磷酸缓冲溶液:取28mL 0.2mol/L磷酸二氢钠溶液和72mL 0.2mol/L磷酸氢二钠溶液,用水稀释至1000mL。
6.标准酪氨酸溶液:准确称取0.1g DL-酪氨酸,加少量0.2mol/L盐酸溶液(取1.7mL浓盐酸,用水稀释至100mL),加热溶解,用水定容至1000mL,每毫升含DL-酪氨酸100微克。
7.仪器:分光光度计、试管四、操作步骤1.标准曲线绘制编号0 1 2 3 4 5 6 7 80 1 2 3 4 5 6 7 8标准酪氨酸溶液(mL)[100g/mL]水(mL) 10 9 8 7 6 5 4 3 2稀释酪氨酸溶液浓度(g/mL) 0 10 20 30 40 50 60 70 80在上述各管中各取1mL,分别加入5mL 0.4mol/L碳酸钠溶液,1mL福林—酚试剂,于400C水浴显色20min,在680nm波长下测吸光度,绘制标准曲线,在标准曲线上求得吸光度为1时相当的酪氨酸g数,即为K值。
测定蛋白酶活力实验一、实验目的1.加深了解酶活力的概念。
2.学习掌握测定蛋白酶活力的方法。
二、实验原理酶活力指酶催化某一特定反应的能力。
其大小可用在一定条件下酶催化反应进行一定时间后,反应体系中底物的减少量或产物的生成量来表示。
酶活力单位是表示酶活力大小的重要指标。
本实验规定酶活力单位(U)为一定条件下每分钟分解1μg 酪氨酸所需的酶量。
实验选用枯草杆菌蛋白酶水解酪蛋白产生酪氨酸的反应体系。
产物酪氨酸在碱性条件下与Folin-酚试剂反应生成蓝色化合物,该蓝色化合物在680nm 处有最大光吸收,其吸光值与酪氨酸含量呈正比。
因此通过测定一定条件下产物酪氨酸的含量变化,可计算出蛋白酶的活力。
三、仪器和试剂仪器:恒温水浴锅、分光光度计、试管及试管架、干燥滤纸、玻璃漏斗。
原料枯草杆菌蛋白酶:称取1g 枯草杆菌蛋白酶粉,用少量0.02mol/L,pH7.5磷酸缓冲液溶解并定容至100mL,震荡15分钟,使充分溶解,干纱布过滤,取滤液冰箱备用。
使用时视酶活力高低用缓冲液适当稀释。
试剂1. Folin-酚试剂:在2L 磨口回流瓶中加入钨酸钠(Na2WoO4. 2H2O)100g,钼酸钠(Na2WoO4. 2H2O)25g,蒸馏水700mL,85%磷酸50mL 以及浓盐酸100mL,充分混匀后,微火回流加热10小时。
再加入硫酸锂150g,蒸馏水50mL 和液溴数滴,摇匀后开口继续煮沸15min,以驱赶过剩的溴。
冷却后加蒸馏水定容至1000mL,过滤,溶液呈黄绿色,置于棕色试剂瓶中暗处贮藏。
使用前用标准NaOH 溶液、酚酞为指示剂标定酸度(约为2mol/L),然后加水稀释至1mol/L,即可使用。
2. 0.2mol/L 盐酸溶液3. 0.04mol/L 氢氧化钠溶液4. 0.55mol/L 碳酸钠溶液5. 10%三氯乙酸溶液6. 0.02mol/LpH7.5磷酸缓冲液:称取磷酸氢二钠(Na2HPO4 . 12H2O)7.16g,用水定容至100mL(A 液);称取磷酸二氢钠(Na2HPO4 .12H2O)3.12g,用水定容至100mL(B 液)。
实验三蛋白酶活力的测定
一、目的
掌握用分光光度计法测定蛋白酶活力的原理与操作技术。
二、原理
蛋白酶水解酪蛋白,其产物酪氨酸能在碱性条件下使福林——酚试剂还原,生成鉬蓝与钨蓝,以比色法测定。
三、试剂及仪器
1.福林—酚试剂
称取50g钨酸钠(Na2WO4•2H2O),12.5g钼酸钠(Na2MoO4•2H2O),置入1000mL原底烧瓶中,加350mL水,25mL85%磷酸,50mL浓盐酸,文火微沸回流10h,取下回流冷凝器,加50g硫酸锂(Li2SO4)和25mL水,混匀后,加溴水脱色,直至溶液呈金黄色,再微沸15min,驱除残余的溴,冷却,用4号耐酸玻璃过滤器抽滤,滤液用水稀释至500mL。
使用时用2倍体积的水稀释。
2. 0.4mol/L碳酸钠溶液:称取42.4g碳酸钠,用水溶解并定容至1000mL。
3. 0.4mol/L三氯乙酸溶液:称取65.5g三氯乙酸,用水溶解并定容至1000mL。
4. 2%酪蛋白溶液
称取2.00g酪蛋白(又名干酪素),加约40mL水和2~3滴浓氨水,于沸水浴中加热溶解,冷却后,用pH7.2磷酸缓冲溶液稀释定容至100mL,贮存于冰箱中。
5. pH7.2磷酸缓冲液
0.2mol/L 磷酸二氢钠溶液:称取31.2g磷酸二氢钠(NaH2PO4•2H2O),用水溶解稀释至1000mL;
0.2mol/L 磷酸氢二钠溶液:称取71.6g磷酸氢二钠(Na2HPO4•12H2O),用水溶解稀释至1000mL;
pH7.2磷酸缓冲溶液:取28mL 0.2mol/L磷酸二氢钠溶液和72mL 0.2mol/L磷酸氢二钠溶液,用水稀释至1000mL。
6.标准酪氨酸溶液:
准确称取0.1g DL-酪氨酸,加少量0.2mol/L盐酸溶液(取1.7mL浓盐酸,用水稀释至100mL),加热溶解,用水定容至1000mL,每毫升含DL-酪氨酸100微克。
7.仪器:分光光度计、试管
四、操作步骤
1.标准曲线绘制
编号012345678
012345678标准酪氨酸溶液 (mL)[100
g/mL]
水 (mL)1098765432
稀释酪氨酸溶液浓度 (g/mL)01020304050607080
在上述各管中各取1mL,分别加入5mL 0.4mol/L碳酸钠溶液,1mL福林—酚试剂,于400C水浴显色20min,在680nm波长下测吸光度,绘制标准曲线,在标准曲线上求得吸光度为1时相当的酪氨酸g数,即为K值。
2. 酶液的制备
准确称取酶粉0.5g ,用pH7.2磷酸缓冲溶液定容至100mL ,置入400
C 水浴浸取0.5h ,用纱布过滤。
根据酶活力的高低,再用pH7.2磷酸缓冲溶液稀释一定倍数(使其测定的吸光度在0.2~0.4范围内为宜,约4-5倍)。
3. 测定
取一支离心管,加入1mL 稀释酶液,置入400C 水浴中预热3~5min ,再加入预热至400
C 的2%酪蛋白溶液1mL ,准确及时保温10min 。
立即加入2mL0.4mol/L 三氯乙酸溶液,15min 后离心分离或用滤纸过滤。
吸取1mL 清液,加5mL0.4mol/L 碳酸钠溶液,最后加入1mL 福林—
酚试剂,摇匀,于400
C 水浴中显色20min 。
另取一支离心管为空白管。
在空白管中先加入1mL 稀释酶液,再加入2mL0.4mol/L 三氯乙酸溶液,再加1mL2% 酪蛋白溶液,15min 后离心分离或用滤纸过滤。
吸取1mL 清液,加
5mL 0.4mol/L 碳酸钠溶液,最后加入1mL 福林—酚试剂,摇匀,于400
C 水浴中显色20min 。
以空白为对照,在680nm 波长下测吸光度。
4. 计算
蛋白酶活力单位的定义:1g 酶粉,在400
C ,pH7.2下,每分钟水解酪蛋白为酪氨酸的微克(g)数。
蛋白酶活力 = W
N E K 1104⨯⨯⨯
⨯
式中: E ——试管的吸光度
4——离心管中反应液的总体积,mL 10——反应10min N ——稀释倍数
W ——酶粉称取量,g
K 为Y=1时X 的值 即1.14
结果与分析:
OD680 CK 1 2 3
0 3.85 2.05 3.71
表面上看2号样的数据看似很有可以于是从上面的表格分析,平均的习惯值为
3.203
3.71
2.05
3.85=++ 样品标准误差为
()()() 1.001
-3 3.20-3.713.20-2.053.20-3.852
22=++
根据格拉布斯法则s x p )
,(n x ∂>-λ来判断样品2数据是否舍去。
『1』
Xp=质疑的数据
x =平均值
∂为置信水平
N 为样品数
S 为样品标准误差
15.120.305.2=- 15.11.1531.00153.1s )3,05.0(>=⨯=⨯λ所以样品2的数据属于正常
范围内。
即在处理数据的时候不应该将样品2忽略舍去。
于是样品的酶的活力。
样品1酶活力为=⨯⨯⨯
⨯5.012001043.851.14702.24 样品2酶活力为=⨯⨯⨯⨯5.01
2001042.051.14373.92
样品3酶活力为=⨯⨯⨯⨯5
.01
2001043.711.14676.704
平均酶活力为: =++3
676.704
373.92702.24584.288
从上述的实验,样品2的波动的原因可以归结为一、有可能是在酶液移液的时候有过多的损失而造成了酶活力很少的偏差 二、 有可能是在处理酶液的时候由于条件的不适而造成酶活力的降低,有可能实验时候温度的波动 三、有可能是分光光度计的操作的失误。
参考文献:[1]《实验设计与数据处理》 李云雁 胡传荣 化学工业出版社 12页
(注:专业文档是经验性极强的领域,无法思考和涵盖全面,素材和资料部分来自网络,供参考。
可复制、编制,期待你的好评与关注)。