硬软酸碱理论(HSAB理论)
- 格式:doc
- 大小:39.50 KB
- 文档页数:3


软硬酸碱理论(HSABprinciple)软硬酸碱理论(HSAB principle)软硬酸碱理论:将酸和碱根据性质的不同各分为软硬两类的理论。
the theory of hard and soft acids and bases概念:体积小,正电荷数高,可极化性低的中心原子称作硬酸,体积大,正电荷数低,可极化性高的中心原子称作软酸。
电负性高,极化性低难被氧化的配位原子称为硬碱,电负性低,可极化性高易被氧化的配位原子为软碱。
将酸和碱根据性质不同分为软硬两类的理论。
1963年由R.G. 皮尔孙提出。
1958 年S.阿尔兰德、J.查特和N.R.戴维斯根据某些配位原子易与Ag+、Hg2+、Pt2+ 配位;另一些则易与Al3+、Ti4+配位,将金属离子分为两类。
a类金属离子包括碱金属、碱土金属Ti4+、Fe3+、Cr3+、H+;b 类金属离子包括Cu+、Ag+、Hg2+、Pt2+。
皮尔孙在前人工作的基础上提出以软硬酸碱来区分金属离子和配位原子,硬酸包括a 类金属离子,硬碱包括H2O、F-等;软酸包括b类金属离子,软碱包括H-、I-等;交界酸包括Fe2+、Cu2+等,交界碱包括等。
表:软硬酸碱分类皮尔孙提出的酸碱反应规律为:“硬酸优先与硬碱结合,软酸优先与软碱结合。
”这虽然是一条经验规律,但应用颇广:①取代反应都倾向于形成硬- 硬、软- 软的化合物。
②软-软、硬-硬化合物较为稳定,软- 硬化合物不够稳定。
③硬溶剂优先溶解硬溶质,软溶剂优先溶解软溶质,许多有机化合物不易溶于水,就是因为水是硬碱。
④解释催化作用。
有机反应中的弗里德-克雷夫茨反应以无水氯化铝(AlCl3)做催化剂,AlCl3是硬酸,与RCl中的硬碱Cl -结合而活化。


软硬酸碱理论在无机化学教学中的应用软硬酸碱理论(Soft and Hard Acids and Bases Theory,简称SHAB)是一种说明离子性反应原理的理论,其在无机化学教学中也有重要应用。
本文将阐述SHAB理论在无机化学教学中的应用及其具体作用,供学习者参考。
一、介绍SHAB理论SHAB理论的主要思想是碱和酸的作用原理如何影响反应的发生。
SHAB理论认为,碱和酸有其特定的性质,碱是“软”的,酸是“硬”的。
硬酸也称为阳离子酸性物质。
一般认为,硬酸能强烈地与其它物质反应,软碱只有在某种特定环境下才能与其它物质发生化学反应。
二、SHAB理论在无机化学教学中的具体应用1. SHAB理论可以用来解释无机反应的原理SHAB理论可以用来解释常见的无机反应,比如硫化反应、氧化反应、碱解反应和酸解反应等。
它能帮助学生更好地理解反应过程中有关各种物质的性质,加深对反应机理的认识。
2. SHAB理论可以帮助学生预测反应结果学习者可以根据SHAB理论,针对某些反应分析涉及碱和酸的性质及其相互作用,并基于其结果预测反应结果。
例如,用SHAB理论来解释金属离子与水分解时,软碱游离度通常比较低,因此金属离子不易发生碱解反应;只有当碱浓度比较高时,金属离子才易发生碱解反应。
3. SHAB理论可以帮助学生理解水解反应SHAB理论也可以用来帮助学生理解水解反应的原因。
据说,水解反应是由于水分子中的氢原子能够被硬酸或硬碱所活化,从而引起碱性或酸性水解反应的发生。
三、总结从上述内容可以看出,SHAB理论在无机化学教学中有着重要的作用。
无机化学是一门理论性较强的科学,而SHAB理论可以帮助学习者更好地理解无机反应的机理及其结果,从而拓展学生的无机化学知识面。

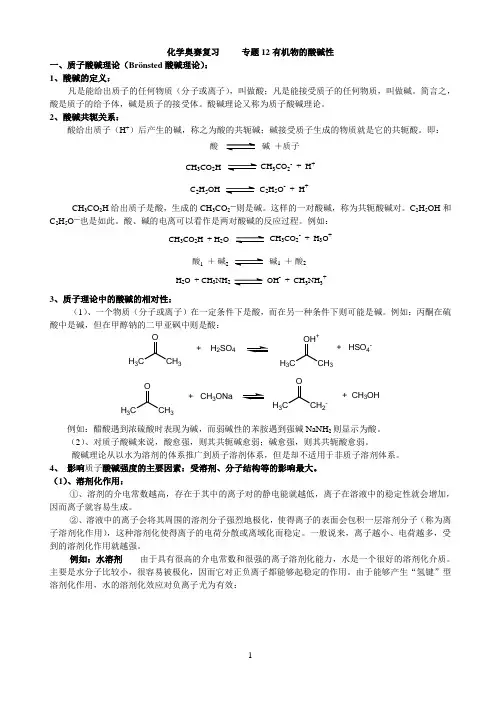
化学奥赛复习 专题12有机物的酸碱性一、质子酸碱理论(Brönsted 酸碱理论): 1、酸碱的定义:凡是能给出质子的任何物质(分子或离子),叫做酸;凡是能接受质子的任何物质,叫做碱。
简言之,酸是质子的给予体,碱是质子的接受体。
酸碱理论又称为质子酸碱理论。
2、酸碱共轭关系:酸给出质子(H +)后产生的碱,称之为酸的共轭碱;碱接受质子生成的物质就是它的共轭酸。
即:酸碱 +质子CH 3CO 2H CH 3CO 2- + H +C 2H 5OHC 2H 5O - + H +CH 3CO 2H 给出质子是酸,生成的CH 3CO 2―则是碱。
这样的一对酸碱,称为共轭酸碱对。
C 2H 5OH 和C 2H 5O ―也是如此。
酸、碱的电离可以看作是两对酸碱的反应过程。
例如:CH 3CO 2H + H 2OCH 3CO 2- + H 3O +酸1 + 碱2碱1 + 酸2H 2O + CH 3NH2OH - + CH 3NH 3+3、质子理论中的酸碱的相对性:(1)、一个物质(分子或离子)在一定条件下是酸,而在另一种条件下则可能是碱。
例如:丙酮在硫酸中是碱,但在甲醇钠的二甲亚砜中则是酸:H 3CCH 3O+ H 2SO 4H 3CCH 3OH ++ HSO 4-H 3CCH 3O+ CH3ONaH 3CCH 2-O+ CH 3OH例如:醋酸遇到浓硫酸时表现为碱,而弱碱性的苯胺遇到强碱NaNH 2则显示为酸。
(2)、对质子酸碱来说,酸愈强,则其共轭碱愈弱;碱愈强,则其共轭酸愈弱。
酸碱理论从以水为溶剂的体系推广到质子溶剂体系,但是却不适用于非质子溶剂体系。
4、 影响质子酸碱强度的主要因素:受溶剂、分子结构等的影响最大。
(1)、溶剂化作用:①、溶剂的介电常数越高,存在于其中的离子对的静电能就越低,离子在溶液中的稳定性就会增加,因而离子就容易生成。
②、溶液中的离子会将其周围的溶剂分子强烈地极化,使得离子的表面会包积一层溶剂分子(称为离子溶剂化作用),这种溶剂化使得离子的电荷分散或离域化而稳定。

HSAB 理论简介软硬酸碱理论:将酸和碱根据性质的不同各分为软硬两类的理论。
the theory of hard and soft acids and bases概念:体积小,正电荷数高,可极化性低的中心原子称作硬酸,体积大,正电荷数低,可极化性高的中心原子称作软酸。
将电负性高,极化性低难被氧化的配位原子称为硬碱,反之为软碱。
硬酸和硬碱以库仑力作为主要的作用力;软酸和软碱以共价键力作为主要的相互作用力。
分类将酸和碱根据性质不同分为软硬两类的理论。
1963年由R.G. 皮尔孙提出。
1958 年 S.阿尔兰德、J.查特和N.R.戴维斯根据某些配位原子易与 Ag+、Hg2+、Pt2+ 配位;另一些则易与Al3+、Ti4+配位,将金属离子分为两类。
a类金属离子包括碱金属、碱土金属 Ti4+、Fe3+、Cr3+、H+;b 类金属离子包括Cu+、Ag+、Hg2+、Pt2+。
皮尔孙在前人工作的基础上提出以软硬酸碱来区分金属离子和配位原子:硬酸包括a类金属离子(碱金属、碱土金属 Ti4+、Fe3+、 Cr3+、H+)硬碱包括F-、OH-、H2O、NH3、O2-、CH3COO-、PO43-、SO42-、CO32-、ClO4-、NO3-、ROH等软酸包括b类金属离子Cu+、Ag+、Hg2+、Pt2+ Au+;Cd2+; Pd2+、Hg2+及M0等软碱包括I-、SCN-、CN-、CO、H-、S2O32-、C2H4、RS-、S2-等交界酸包括Fe2+、Co2+、Ni2+; Zn2+、Pb2+、Sn2+、Sb3+、Cr2+、Bi3+ 、Cu2+等,交界碱包括N3-、Br- 、NO2-、N2 、SO32-等皮尔孙提出的酸碱反应规律为:“硬酸优先与硬碱结合,软酸优先与软碱结合。
”这虽然是一条经验规律,但应用颇广:①取代反应都倾向于形成硬 - 硬、软 - 软的化合物。
②软-软、硬-硬化合物较为稳定,软 - 硬化合物不够稳定。
③硬溶剂优先溶解硬溶质,软溶剂优先溶解软溶质,许多有机化合物不易溶于水,就是因为水是硬碱。


hsab原理范文HSAB理论是指硬和软酸碱的理论,是由哲学家-化学家罗尔夫·斯科特·皮尔斯提出的。
HSAB是Hard and Soft, Acid and Base的缩写,意为硬和软酸碱。
该理论认为在化学反应中,酸和碱可以分为硬酸、软酸、硬碱和软碱。
硬酸和硬碱之间具有较强的相互作用,而软酸和软碱则更容易形成配对。
硬酸和硬碱通常具有较高的电离能和较小的原子尺寸,而软酸和软碱则具有较低的电离能和较大的原子尺寸。
根据HSAB理论,酸与碱可以通过它们的硬度和软度进行配对,反应的速率和平衡常数取决于酸碱配对的硬度差异。
硬酸与硬碱的反应速率较快且平衡常数较大,软酸与软碱的反应速率较慢且平衡常数较小。
而硬酸与软碱,以及软酸与硬碱之间的反应速率和平衡常数则介于以上两者之间。
HSAB理论对于解释化学反应的速率和平衡性具有重要意义。
它可以用来预测酸碱反应的方向和速率,指导化学合成的设计和优化。
此外,HSAB理论还可以用于解释酸碱性质对生物活性和毒性的影响,对药物研究和环境科学等领域有着重要的应用。
在有机化学中,HSAB理论可以解释一些特定反应的发生机理。
例如,亲电试剂(如卤代烷)通常是硬酸,而亲核试剂(如水或醇)通常是软碱。
硬酸与软碱的反应通常发生迅速,而硬酸和硬碱之间的反应则较为缓慢。
因此,当硬酸和硬碱以及软酸和软碱共存时,反应通常优先发生硬酸和软碱之间的配对反应。
HSAB理论还可以解释金属离子和配位化合物之间的配位作用。
硬酸通常可以与硬碱形成稳定的配位络合物,而软酸则更容易形成与软碱的络合物。
硬酸和硬碱之间的络合物通常具有较强的络合能力和较高的稳定性。
总之,HSAB理论提供了一种理解和解释酸碱反应的框架。
通过硬度和软度的概念,可以预测化学反应的速率和平衡常数,并且可以指导化学设计和合成。
同时,HSAB理论对于解释金属离子和配位化合物之间的配位作用也具有重要意义。
它是化学中一种重要的理论工具,对于研究和应用具有广泛的价值。

软硬酸碱理论简称HSAB(Hard-Soft-Acid-Base)理论,是一种尝试解释酸碱反应及其性质的现代理论。
20世纪60年代初,拉尔夫·皮尔逊介绍了HSAB的原理,作为一种尝试,用以统一有机和无机化学反应。
它目前在化学研究中得到了广泛的应用,其中最重要的莫过于对配合物稳定性的判别和其反应机理的解释。
软硬酸碱理论的基础是酸碱电子论,即以电子对得失作为判定酸、碱的标准(即路易斯酸碱理论)。
该理论可用于定性描述,而非定量的描述,这将有助于了解化学性质和反应的主要驱动因素。
尤其是在过渡金属化学,化学家们已经完成了无数次实验,以确定配体和过渡金属离子本身的硬和软方面的相对顺序。
原理概念:体积小,正电荷数高,可极化性低的中心原子称作硬酸,体积大,正电荷数低,可极化性高的中心原子称作软酸。
将电负性高,极化性低,难被氧化的配位原子称为硬碱,反之为软碱。
硬酸和硬碱以库仑力作为主要的作用力;软酸和软碱以共价键力作为主要的相互作用力。
此理论的中心主旨是,在所有其他因素相同时,“软”的酸与“软”的碱反应较快速,形成较强键结;而“硬”的酸与“硬”的碱反应较快速,形成较强键结。
大体上来说,“硬亲硬,软亲软”生成的化合物较稳定。
拉尔夫·佩尔森在六十年代首次提出了该理论。
自那以后,化学家们不断开拓该理论的应用范围,使之如今已成为了最重要的无机化学基础理论之一。
软硬酸碱酸碱硬软硬软氢离子H+汞CH3Hg+,Hg2+,Hg22+氢氧根OH−氢化物H−碱金属Li+,Na+,K+铂Pt4+醇盐RO−硫醇盐RS−钛Ti4+钯Pd2+卤素F−,Cl−卤素I−铬Cr3+,Cr6+银Ag+氨NH3膦PR3三氟化硼BF3硼烷BH3羧酸盐CH3COO−硫氰酸盐SCN−碳正离子R3C+四氯苯醌C6Cl4O2碳酸盐CO32−一氧化碳CO 重金属M0肼N2H4苯C6H6金Au+极端的情况下,还定义:交界酸(trimethylborane),二氧化硫和Fe(II),Co(II), Cs(I), Pb(II )。

1.2.7 硬软酸碱理论(HSAB理论)对于质子酸碱,我们可用pK来描述酸碱的强度,用pH或HO来表示溶液的酸度。
但是对于不涉及质子转移的路易斯酸碱,我们只能通过比较它们形成的配合物的热力学稳定性来估计它们的强度。
20世纪50年代,Ahrland等人发现,配位体是同族元素时,金属配合物的稳定性随中心金属离子的类型不同而表现出不同的变化规律,例如,卤素离子配合物的稳定性如下表所示:卤素离子配合物的稳定常数由表中数据我们发现,对于金属离子酸Fe3+、Al3+、H+等,配合物的稳定性顺序是F->Cl->Br->F;对于金属离子酸Hg2+、Ag+等,配合物的稳定性顺序是F-<Cl-<Br-<I-。
Ahrland等人就根据上述偏爱成键的特性将阳离子分成A,B两类。
20世纪60年代,皮尔逊在Ahrland等人工作的基础上,进一步总结归纳各种金属离子与各种配位体形成配合物时其稳定性所表现的规律,形象地称Ahrland的A类金属离子为硬酸,B类金属离子为软酸;能与硬酸形成稳定配合物的配位体为硬碱,而与软酸形成稳定配合物的配位体为软碱。
并将这种偏爱成键的规律归纳为“硬软酸碱原理”,该原理说“硬酸趋向于跟硬碱形成稳定的配合物,而软酸趋向于跟软碱形成稳定的配合物”。
1.硬酸与软酸硬酸金属离子包括IA, ⅡA,ⅢA,ⅢB, Ln3+ ,An3+以及处于高氧化态的d区过渡金属离子,如Ti4+,Cr3+,Fe3+,Co3+等。
硬酸离子的特点是:电荷量高、半径小,也即离子势Zeff /r高,不易被极化。
它们跟不同类型配位原子形成的配合物的稳定性变化规律是:R 3N>> R3P>> R3As>> R3SbR 2O>> R2S>R2Se>R2TeF->Cl->Br->I-软酸金属离子包括较低氧化态的过渡金属离子如Cu+、Ag+、Cd2+和重过渡金属离子如Pd2+、Pt2+、Hg2+、Hg22+等。
这些软酸离子的特点是:半径大、氧化态低,Zeff/r值小,易被极化变形。
1.2.7 硬软酸碱理论(HSAB理论)对于质子酸碱,我们可用pK来描述酸碱的强度,用pH或HO来表示溶液的酸度。
但是对于不涉及质子转移的路易斯酸碱,我们只能通过比较它们形成的配合物的热力学稳定性来估计它们的强度。
20世纪50年代,Ahrland等人发现,配位体是同族元素时,金属配合物的稳定性随中心金属离子的类型不同而表现出不同的变化规律,例如,卤素离子配合物的稳定性如下表所示:卤素离子配合物的稳定常数由表中数据我们发现,对于金属离子酸Fe3+、Al3+、H+等,配合物的稳定性顺序是F->Cl->Br->F;对于金属离子酸Hg2+、Ag+等,配合物的稳定性顺序是F-<Cl-<Br-<I-。
Ahrland等人就根据上述偏爱成键的特性将阳离子分成A,B两类。
20世纪60年代,皮尔逊在Ahrland等人工作的基础上,进一步总结归纳各种金属离子与各种配位体形成配合物时其稳定性所表现的规律,形象地称Ahrland的A类金属离子为硬酸,B类金属离子为软酸;能与硬酸形成稳定配合物的配位体为硬碱,而与软酸形成稳定配合物的配位体为软碱。
并将这种偏爱成键的规律归纳为“硬软酸碱原理”,该原理说“硬酸趋向于跟硬碱形成稳定的配合物,而软酸趋向于跟软碱形成稳定的配合物”。
1.硬酸与软酸硬酸金属离子包括IA,ⅡA,ⅢA,ⅢB,Ln3+,An3+以及处于高氧化态的d区过渡金属离子,如Ti4+,Cr3+,Fe3+,Co3+等。
硬酸离子的特点是:电荷量高、半径小,也即离子势Zeff /r高,不易被极化。
它们跟不同类型配位原子形成的配合物的稳定性变化规律是:R3N>>R3P>>R3As>>R3SbR2O>>R2S>R2Se>R2TeF->Cl->Br->I-软酸金属离子包括较低氧化态的过渡金属离子如Cu+、Ag+、Cd2+和重过渡金属离子如Pd2+、Pt2+、Hg2+、Hg22+等。
这些软酸离子的特点是:半径大、氧化态低,Zeff/r值小,易被极化变形。
硬软酸碱理论(HSAB理论)对于质子酸碱,我们可用pK来描述酸碱的强度,用pH或HO来表示溶液的酸度。
但是对于不涉及质子转移的路易斯酸碱,我们只能通过比较它们形成的配合物的热力学稳定性来估计它们的强度。
根据路易斯酸碱电子论的定义,认为在反应中能给出电子对的物质是碱,能接受电子对的物质是酸。
在配合物中,中心离子是电子对的接受体,是路易斯酸;配位体是电子对给予体,是路易斯碱。
1963年皮尔逊(Peauson)提出了软硬酸碱(Soft and Hard acids and bases,简称SHAB)概念,即根据酸、碱对外层电子控制的程度,应用了“软”和“硬”两字进行分类,把接受孤对电子能力强、对外层电子吸引得紧、没有易极化的电子轨道、电荷半径比较大的金属离子叫“硬酸”;把接受电子能力弱、对外层电子抓得松、易极化、电荷半径比较小的叫“软酸”,介乎二者之间的金属离子叫“交界酸”。
按同样道理也把配体分为软、硬和交界三类。
给出电子对的原子电负性大、对外层电子吸引力强、不易失去电子、变形性小的叫做“硬碱”;给出电子对的原子电负性小、对外层电子吸引力弱、易给出电子、变形性大的叫做“软碱”;介乎二者之间的为“交界碱”。
硬酸和硬碱之所以称为“硬”是形象化地表明它们的不易变形;软酸和软碱之所以称为“软”是表明它们较易变形.由于路易斯酸碱多种多样,分类比较粗糙,反应也较复杂,还没有大家公认的定量理论,目前只有一个软硬酸碱规则,其内容是:硬酸倾向于与硬碱相结合,而软酸倾向于与软碱结合。
用通俗的话来说,是“硬亲硬,软亲软,软硬交界就不管”。
所谓软硬交界就不管的意思是指中间酸(交界酸)与软、硬碱也能结合,中间碱与软、硬酸也能结合,但稳定性较前者差。
显然这一规则既不定量,而且有不少例外,但它仍是一个很有用的简单规则,能用它说明大量的事实,并能作一定的预测。
例如能对化合物相对稳定性给予较好的解释,如HF 和HCl很稳定,但HI不稳定。
软硬酸碱理论(HSAB principle)软硬酸碱理论:将酸和碱根据性质的不同各分为软硬两类的理论。
the theory of hard and soft acids and bases概念:体积小,正电荷数高,可极化性低的中心原子称作硬酸,体积大,正电荷数低,可极化性高的中心原子称作软酸。
电负性高,极化性低难被氧化的配位原子称为硬碱,电负性低,可极化性高易被氧化的配位原子为软碱。
将酸和碱根据性质不同分为软硬两类的理论。
1963年由R.G. 皮尔孙提出。
1958 年S.阿尔兰德、J.查特和N.R.戴维斯根据某些配位原子易与Ag+、Hg2+、Pt2+ 配位;另一些则易与Al3+、Ti4+配位,将金属离子分为两类。
a类金属离子包括碱金属、碱土金属Ti4+、Fe3+、Cr3+、H+;b 类金属离子包括Cu+、Ag+、Hg2+、Pt2+。
皮尔孙在前人工作的基础上提出以软硬酸碱来区分金属离子和配位原子,硬酸包括 a 类金属离子,硬碱包括H2O、F-等;软酸包括b类金属离子,软碱包括H-、I-等;交界酸包括Fe2+、Cu2+等,交界碱包括等。
表:软硬酸碱分类皮尔孙提出的酸碱反应规律为:“硬酸优先与硬碱结合,软酸优先与软碱结合。
”这虽然是一条经验规律,但应用颇广:①取代反应都倾向于形成硬- 硬、软- 软的化合物。
②软-软、硬-硬化合物较为稳定,软- 硬化合物不够稳定。
③硬溶剂优先溶解硬溶质,软溶剂优先溶解软溶质,许多有机化合物不易溶于水,就是因为水是硬碱。
④解释催化作用。
有机反应中的弗里德-克雷夫茨反应以无水氯化铝(AlCl3)做催化剂,AlCl3是硬酸,与RCl中的硬碱Cl -结合而活化。
硬软酸碱理论(HSAB理论)
对于质子酸碱,我们可用pK来描述酸碱的强度,用pH或HO来表示溶液的酸度。
但是对于不涉及质子转移的路易斯酸碱,我们只能通过比较它们形成的配合物的热力学稳定性来估计它们的强度。
根据路易斯酸碱电子论的定义,认为在反应中能给出电子对的物质是碱,能接受电子对的物质是酸。
在配合物中,中心离子是电子对的接受体,是路易斯酸;配位体是电子对给予体,是路易斯碱。
1963年皮尔逊(Peauson)提出了软硬酸碱(Soft and Hard acids and bases,简称SHAB)概念,即根据酸、碱对外层电子控制的程度,应用了“软”和“硬”两字进行分类,把接受孤对电子能力强、对外层电子吸引得紧、没有易极化的电子轨道、电荷半径比较大的金属离子叫“硬酸”;把接受电子能力弱、对外层电子抓得松、易极化、电荷半径比较小的叫“软酸”,介乎二者之间的金属离子叫“交界酸”。
按同样道理也把配体分为软、硬和交界三类。
给出电子对的原子电负性大、对外层电子吸引力强、不易失去电子、变形性小的叫做“硬碱”;给出电子对的原子电负性小、对外层电子吸引力弱、易给出电子、变形性大的叫做“软碱”;介乎二者之间的为“交界碱”。
硬酸和硬碱之所以称为“硬”是形象化地表明它们的不易变形;软酸和软碱之所以称为“软”是表明它们较易变形.
由于路易斯酸碱多种多样,分类比较粗糙,反应也较复杂,还没有大家公认的定量理论,目前只有一个软硬酸碱规则,其内容是:硬酸倾向于与硬碱相结合,而软酸倾向于与软碱结合。
用通俗的话来说,是“硬亲硬,软亲软,软硬交界就不管”。
所谓软硬交界就不管的意思是指中间酸(交界酸)与软、硬碱也能结合,中间碱与软、硬酸也能结合,但稳定性较前者差。
显然这一规则既不定量,而且有不少例外,但它仍是一个很有用的简单规则,能用它说明大量的事实,并能作一定的预测。
例如能对化合物相对稳定性给予较好的解释,如HF 和HCl很稳定,但HI不稳定。
从表7-11可知H是硬酸,F、Cl是硬碱,而I是软碱,前者硬-硬结合稳定,而后者硬-软结合不稳定。
又如F为何可以从[Fe(SCN)]中将SCN取代出来,因为Fe是硬酸,SCN是软碱,取代前是硬-软结合不太稳定,取代后是硬-硬结合更稳定。
1.硬酸与软酸
硬酸金属离子包括IA, ⅡA,ⅢA,ⅢB, Ln3+ ,An3+ [lanthanide (Ln3+)and actinide (An3+)cations] 以及处于高氧化态的d区过渡金属离子,如Ti4+,Cr3+,Fe3+,Co3+等。
硬酸离子的特点是:电荷量高、半径小,也即离子势Zeff /r高,不易被极化。
它们跟不同类型配位原子形成的配合物的稳定性变化规律是:
R3N>>R3P>>R3As>>R3Sb
R2O>>R2S>R2Se>R2Te
F->Cl->Br->I-
软酸金属离子包括较低氧化态的过渡金属离子如Cu+、Ag+、Cd2+和重过渡金属离子如Pd2+、Pt2+、Hg2+ 、Hg22+等。
这些软酸离子的特点是:半径大、氧化态低,Zeff/r值小,易被极化变形。
它们跟不同类型配位原子形成的配合物的稳定性变化顺序是:
R3N<<R3P<R3As<R3Sb
R2O<<R2S<R2Se<R2Te
F-<Cl-<Br-<I-
介于上述两类酸之间的物种称为交界酸,如Fe2+、Co2+、Cu2+、Zn2+、Ni2+等。
2.硬碱和软碱
跟硬酸能形成稳定配合物的碱称为硬碱;跟软酸能形成稳定配合物的碱称为软碱。
介于硬碱与软碱之间的配位体称为交界碱。
硬碱配位原子的特点是:电负性高,把持价电子能力强,
不易被极化,如含O、N、F配位原子的配位体H2O、F-、NH3、R3N以及PO43-、SO42-和CO32-等。
软碱所含配位原子电负性小,把持价电子能力差,半径大,易被极化,如含P, As, S, I 配位原子以及含π键的配位体SCN-、CO、CN-、I-、S2-、R3As、R3P、R2S等。
介于这两种碱之间的配位体为交界碱,如C6H5NH2、Br-、NO2- 等。
3.硬软酸碱原理的应用
应用硬软酸碱原理,可以很方便地对化合物的稳定性做出预言。
例如比较Cd2+的两种配离子[Cd(CN)4]2-和[Cd(NH3)4]2+的稳定性。
由于Cd2+属于软酸,而配位体NH3属于硬碱,CN- 属于软碱,很明显,[Cd(CN)4]2-应该比[Cd(NH3)4]2+更稳定。
实测的稳定常数,前者为K=5.8×1010,后者的K=1×107,说明上述预言是正确的。
硬软酸碱原理也可以用来解释地球化学中的Goldschmidt分类规则,即“亲硫”元素如Li,Mg,Ti,Ca,Al,Sr,Ba,Fe等多以硅酸盐、磷酸盐、硫酸盐、碳酸盐、氧化物、氟化物的形式存在,而“亲硫”元素如Cd, Pb, Cu, Ag, Hg, Ni多以硫化物如CuS, Cu2S, Ag2S,HgS,CdS,PbS 等形式存在。
很明显它们都分别符合“硬亲硬,软亲软”的原则。
这个规则不但能说明多种化学现象,能解释不少过去不能解释的问题,而且还能预测某些反应的规律。
主要有以下几方面:
①说明化合物稳定性
H+为硬酸,HO+为软酸,F-为硬碱,I-为软碱,氟化氢是硬-硬结合,次碘酸HOI是软-软结合所以稳定;而碘化氢和次氟酸HOF都是软-硬匹配,因而稳定性差或不能稳定存在。
酸碱双取代反应,总是以稳定的硬-硬和软-软加合物取代两个较不稳定的软硬不相匹配的酸碱加合物。
自然界中硬金属镁、钙、锶、钡、铝等多与硬碱形成氧化物、氟化物、碳酸盐、硫酸盐等;而软金属铜、银、金、锌、铅、汞、钴、镍等则多与软碱s2-形成硫化物。
②说明溶解度
相似相溶实质是硬溶质易溶于硬溶剂,软溶质易溶于软溶剂。
硬-硬结合的离子型物质和极性化合物易溶于硬溶剂水;而非极性有机物(软溶质)易溶于苯(软溶剂)。
③金属的电极电势若金属离子是硬酸,则较易与硬碱(水)结合,金属的电极电势偏高;若金属离子是软酸,与水结合力较弱,金属的电极电势偏低。
④说明类聚现象
软配体趋向于使酸、碱变软,而硬配体趋向于使硬性增强。
例如,F-为硬配体,H-为软配体,故BF3为硬酸,BH3为软酸,当它们与醚加合时,醚R2O是硬碱,硫醚R2S是软碱。
所以,H3B∶SR2和F3B∶OR2稳定,而H3B∶OR2和F3B∶SR2不稳定。
这种软——软或硬——硬相聚合的趋势称为类聚效应。
⑤异性双基配体与酸结合
SCN-,SeCN-,OCN-,CN-,CNO-,S2O2(-3)都为异性双基配体。
配位原子氧和氮属硬碱配体,亲硬酸;碳、硫和硒属软碱配体,亲软酸。
所以硬酸皆与氧或氮原子键合;软酸皆与碳、硫和硒原子成键。
例如,Fe3+为硬酸与NCS-配位成〔Fe(NCS)2〕+而不是〔Fe(SCN)2〕+,Ag+是软酸与SCN-配位成〔Ag(SCN)2〕-。
⑥加合反应的热效应
硬酸和硬碱与水硬溶剂有强烈水合作用,硬酸与硬碱加合时要把离子周围的水化层去掉,需吸收能量,热效应一般吸热或放少量热;而软酸和软碱水合作用微弱,酸碱反应时主要是两者加合成键,故为放热,软度越高,放热越多。
如:Al(3+) + F(-) →〔AlF〕2+为硬酸硬碱结合,其δh为4.6kjmol-1;而Hg(2+) + Br- →〔hgbr〕+为软酸软碱结合,其δh为42.7kjmol-1;
⑦取代反应的速率不论亲核取代还是亲电取代,凡是硬-硬取代产物或软-软取代产物的反应皆很迅速。
例如,CH3+为软酸,RS-为软碱,而RO-为硬碱,CH3+与RS-取代反应的速率常数比CH3+与RS-取代反应的要大100倍。
⑧催化反应可说明许多催化剂的作用机理,例如,苯的烷基化可用三氯化铝催化,因为三氯化铝是硬酸,可与氯代烷中的硬碱Cl-配合使其中软酸烷基成为正离子R+,从而对软碱苯核的反应性增大。
再如,软金属催化剂铂、镍等可吸附软碱,对不饱和烃加氢起催化作用。
若气体中有磷、砷、硫等软碱杂质时,这些杂质能吸附在金属表面,形成极稳定的软-软加合物,而使催化剂中毒。
HSAB理论规则是个简单而又易掌握的规则,它还可用于萃取剂选择的研究、生物体内微量元素生理作用的研究、常温下固氮的研究等。
但是,它没有定量或半定量的标准,还是个定性规则,而且对某些问题的解释还有与事实不符合的。