黏多糖贮积症各型的临床表现
- 格式:pdf
- 大小:577.89 KB
- 文档页数:1

代谢底物堆积引起的疾病
代谢底物堆积是一种与代谢过程相关的疾病,常见的疾病包括:
1. 酮症酸中毒:当体内糖原储备不足时,机体开始分解脂肪产生酮体作为能量来源。
然而,在一些代谢障碍的情况下,酮体无法正常代谢,导致酮体在体内堆积,引发酮症酸中毒。
2. 铜沉积病:铜沉积病是一组遗传性疾病,其中铜在体内不能正常排泄、处理和合成。
这导致铜在体内堆积,最常见的铜沉积病是威尔逊病,可以影响肝脏、中枢神经系统和其他器官。
3. 粘多糖病:粘多糖病是一组遗传性疾病,它们影响糖蛋白的降解酶的产生或功能。
这导致糖蛋白在细胞内无法正常降解,积累在细胞内,造成组织和器官损害。
粘多糖病有多种亚型,如猩红病、科布病等。
4. 糖原贮积病:糖原贮积病是一组遗传性疾病,影响到体内糖原的合成、降解或转化。
这些疾病导致体内糖原无法正常代谢,导致糖原在组织和器官中过度堆积。
糖原贮积病有多种类型,如麦考尔-克滕病、Andersen病等。
5. 高胆固醇/高甘油三酯血症:这是一种与脂质代谢障碍相关
的疾病,主要是由于体内胆固醇或甘油三酯代谢异常,导致胆固醇或甘油三酯在血液中过度堆积,增加心血管疾病的风险。
这些疾病的症状和严重程度各不相同,治疗方法也因疾病而异,
包括节食、药物治疗和酶替代治疗等。
及早诊断和治疗可以减轻疾病的影响。


液相色谱串联质谱检测尿黏多糖在黏多糖贮积症患者诊断与随访中的应用占霞;高晓岚;季文君;常思宇;刘丹;张惠文【期刊名称】《临床儿科杂志》【年(卷),期】2024(42)5【摘要】目的运用液相色谱串联质谱(LC-MS/MS)技术建立尿液中硫酸软骨素(CS)、硫酸皮肤素(DS)和硫酸乙酰肝素(HS)含量的检测方法,探究该方法在黏多糖贮积症(MPS)患者诊断及治疗随访中的应用。
方法收集20例MPS患儿及37例正常儿童尿液样本,测定尿液中CS、DS和HS等浓度。
尿样氮气吹干,盐酸甲醇衍生化,再次氮气吹干,复溶后LC-MS/MS分析;评价方法的线性、定量限、精密度、加样回收率和基质效应。
结果LC-MS/MS检测CS、DS和HS的线性均大于0.99。
CS、DS和HS的定量下限依次为:0.5、1.0和1.0 mg/L。
批内不精密度为1.9%~10.4%,批间不精密度为2.6%~9.8%。
加标回收率为85.6%~110.4%,相对基质效应为84.9%~115.5%。
CS、DS和HS在正常儿童尿液中呈正态分布,以x+1.64 SD计算正常儿童尿液中的参考区间上限,分别为16.5、1.8、1.4mg/mmol。
通过分析MPS患儿尿液黏多糖特点,LC-MS/MS法能有效检出MPS I、MPSⅡ、MPSⅢ和MPSⅥ等MPS患儿。
已接受造血干细胞移植的MPSⅠ和MPSⅡ患儿尿DS、HS水平降低。
结论LC-MS/MS检测尿黏多糖性能良好,有望用于MPS患者的精准诊断和治疗随访监测。
【总页数】8页(P399-406)【作者】占霞;高晓岚;季文君;常思宇;刘丹;张惠文【作者单位】上海交通大学医学院附属新华医院儿内分泌遗传代谢科上海市儿科医学研究所;上海爱博才思分析仪器贸易有限公司【正文语种】中文【中图分类】R28【相关文献】1.液相色谱-串联质谱联用技术检测人尿中去氨加压素及其在人尿中的消除研究2.液相色谱-串联质谱检测血、尿中2'-氯地西泮3.妊娠期胆汁淤积症应用液相色谱-串联质谱检测的早期诊断价值4.突变特异性扩增系统和变性高效液相色谱分析法结合DNA测序法快速产前诊断黏多糖贮积症Ⅱ型高危胎儿5.高效液相色谱串联质谱电喷雾检测法快速测定人尿中帕洛诺司琼的浓度因版权原因,仅展示原文概要,查看原文内容请购买。

疾病名:糖原贮积病Ⅸ型英文名:glycogen storage disease type Ⅸ缩写:GSD-Ⅸ别名:糖原累积病Ⅸ型疾病代码:ICD:E74.0概述:糖原贮积病(glycogen storage disease,GSD)是一类先天性酶缺陷所造成的糖原代谢障碍疾病。
这类疾病的共同生化特征是糖原储存异常,多数病种是糖原在肝脏、肌肉、肾脏等组织中储积量增加。
根据其临床表现和生化异常的特征,可以分为 12 种类型。
糖原贮积病Ⅸ型(glycogen storage disease type Ⅸ,GSD-Ⅸ)是由于缺乏磷酸化酶激酶所致的一组不同的疾病,包括X 连锁遗传性肝磷酸化酶激酶缺乏症、常染色体遗传性肝和肌磷酸化酶激酶缺乏症、特定性肌磷酸化酶激酶缺乏症和心脏磷酸化酶激酶缺乏。
流行病学:糖原贮积病的发病率较低,有报道为 1/6 万。
最常见的是糖原贮积病Ⅰ型。
GSD-Ⅸ发病率不详。
病因:本型糖原贮积病是由于缺乏磷酸化酶激酶所致。
磷酸化酶激酶是由 4 个亚单位(α、β、γ、δ)组成的一个蛋白激酶,来自神经中枢的冲动或激素的调控可通过它激活磷酸化酶,从而促进糖原的分解过程。
磷酸化酶激酶本身的激活是经由 Ca2+ 、腺苷酸环化酶、环腺苷酸(cAMP)依赖性蛋白激素等一系列的作用进行的,这一过程主要由胰高糖素调控。
组成磷酸化酶激酶的 4 个亚单位都各自有位于不同染色体上的编码基因,在各种组织中的表达亦各不相同。
从理论上讲,上述过程中任一酶的缺陷都可以造成糖原分解受阻而累积,而实际上仅磷酸化酶激酶缺乏是最主要的病因,依据其病变累及的器官和遗传特征加以区分:1.X 连锁遗传性肝磷酸化酶激酶缺乏症是因位于Xp22 的α亚单位编码基因突变所致。
2.常染色体遗传性肝和肌磷酸化酶激酶缺乏症这是由于位于常染色体上编码α、β亚单位的基因突变所造成的(目前仅β亚单位已定位于16q12-q13)。
3.特定性肌磷酸化酶激酶缺乏症这是由于在肌组织中编码α 亚单位的结构基因(位于Xql2)突变所造成的。

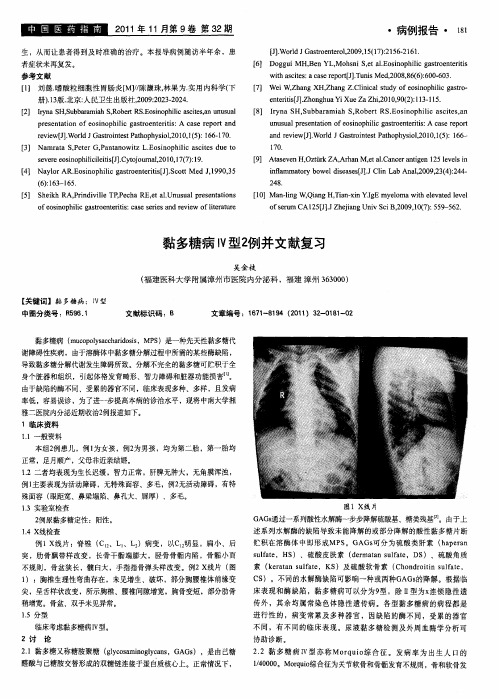
概述粘多糖病(mucopolysacharidosis,MPS)是因酸性粘多糖降解酶缺乏,使之不能完全降解,其产物在体内堆积所致。
由于各种成分在体内分布的不同,以及不同酶的缺乏,粘多糖病在临床上表现亦各异,多以骨骼病变为主,还可累及中枢神经系统、心血管系统以及肝、脾、关节、肌腱、皮肤等。
按其代谢产物和临床表现共分为8型,有的还有数种亚型。
病因和发病机制粘多糖(macopolg sacrotein MPS)是骨基质和结缔组织的主要成分之一。
粘多糖的正确命名应该是糖胺多糖(glycosaminoglycan,GAG),它是由糖醛酸与乙酰氨基糖或其硫酸酯组成的二糖单位形成的重复序列。
已知哺乳动物的GAG包括4-硫酸软骨素(chondroitin-4-sulfate,C4S),6-硫酸软骨素(C6S),硫酸皮肤素(dermatan sulfate,SD),硫酸角质(素)(Karatansulfate,KS)和肝素(haparin,HP)还有硫酸肝素或硫酸乙酰肝素(haparan,HS)总称为类肝素,及透明质酸(hyaluronic acid,HA)七种。
这些糖胺多糖与核心蛋白连接后组成蛋白多糖(proteoglycan,PG)。
蛋白多糖的旧名称粘蛋白。
糖胺多糖就是酸性粘多糖(acid mucopolysaccharide,AMPS)。
这些多糖的降解必须在溶酶体中进行,目前已知有10种溶酶体糖苷酶、硫酸酯酶和乙酰转移酶参与其降解过程,任何一种酶的缺陷都会造成氨基葡聚糖链的分解障碍而积聚体内,并自尿中排出。
病理改变粘多糖在纤维细胞内沉积,染色成为气球样细胞,称为Hurler细胞,存在于肝、脾、淋巴组织的网状细胞中,在软骨细胞和成骨细胞,中枢神经系统和周围神经节,视网膜细胞和角膜细胞中也均有类似的物质堆积。
在心内膜沉积形成斑状增厚,主动脉,肺动脉、冠状动脉和脑、肾、肝、脾和四肢的动脉壁均有沉积。
临床表现出生后发育正常,1岁前逐渐出现体征。
遗传代谢病(inherited metabolic disorders,IMD)是一大类以生化代谢通路中的酶、辅酶或转运体等功能缺陷为特征的单基因遗传病,已命名的IMD 近 1500 种。
溶酶体贮积症是由于溶酶体内多种酶、酶激活因子或溶酶体膜蛋白基因变异所致的一大类以多系统损害为特征的遗传代谢病。
以黏多糖贮积症为代表的多种溶酶体贮积症可出现特征性的多发性骨发育代谢障碍。
该文简要介绍一些以骨改变为特征的溶酶体贮积症。
关键词遗传代谢病(inherited metabolic disorders,IMD)是一组以生化代谢通路中的酶、辅酶或转运体等功能缺陷为特征的单基因遗传病,目前已命名的IMD 近 1500 种[1]遗传代谢病的临床表现具有多样性,以多脏器受累为其特点,其中骨代谢异常是某些代谢病的主要或常见表现,也称为先天性代谢性骨病(congenital metabolic bone diseases)[2]溶酶体内含50 余种可降解大分子(如黏多糖、糖蛋白、鞘脂糖原等)的酶。
由于酶、酶激活因子或溶酶体膜蛋白基因变异导致大分子在细胞内外的异常蓄积而引起各种溶酶体贮积症[3]。
根据贮积物的底物和致病基因特点分为黏多糖贮积症(mucopolysaccharidosis,MPS )寡糖贮积症、鞘脂贮积症、神经元蜡样脂褐质沉积症、溶酶体膜蛋白转运障碍和其他溶酶体病[4]。
其中最常见的是黏多糖贮积症和鞘脂贮积症[5]溶酶体贮积症可在任何年龄发病,未降解的大分子物质沉积于肝脾、骨、血液和神经系统等,引起相应的临床表现。
沉积于骨的溶酶体贮积症总结于表1。
图片溶酶体贮积症的骨骼系统相关临床表现从无症状的影像学改变到骨危象、身材矮小,具有典型的影像学特征,呈现多发性骨发育不良特点,伴有脊柱和关节畸形(黏多糖、黏脂沉积),或伴有骨软化及病理性骨折(骨石症)[6]。
典型的影像学改变包括:(1)颅骨可见”J“形蝶鞍和颅骨增厚;(2)胸部可见宽短锁骨呈板状,胸骨缩短和肋骨呈"飘带样”改变;(3)脊柱可见扁平型锥体,呈"鸟嘴样"变;(4)骨盆可见圆形髂骨翼、下骼部变细和髋关节发育不良;(5)手部指骨呈“子弹头”样改变,掌骨近端缩短和掌骨发育不全;(6)长骨可见骨骺发育不良和粗短骨干[7]。
小儿黏多糖贮积症有哪些症状?*导读:本文向您详细介绍小儿黏多糖贮积症症状,尤其是小儿黏多糖贮积症的早期症状,小儿黏多糖贮积症有什么表现?得了小儿黏多糖贮积症会怎样?以及小儿黏多糖贮积症有哪些并发病症,小儿黏多糖贮积症还会引起哪些疾病等方面内容。
……*小儿黏多糖贮积症常见症状:鼻梁低、脆性X综合征、颈短、肝脾肿大、关节强直*一、症状黏多糖是一种复合大分子,主要由糖醛酸和己糖胺构成,分布在结缔组织的基质内,为软骨、角膜、血管壁和皮下组织的重要成分。
因此黏多糖代谢异常累及全身器官,黏多糖贮积症发病后,软骨肌膜、肌腱、血管、心脏瓣膜肌肉、脑膜、网状内皮组织及皮下组织等胶原组织的成纤维细胞均肿胀,其内充以黏多糖颗粒肝、脾、肾、淋巴结和某些内分泌器官的实质细胞内,亦有类似物质沉积。
中枢神经和周围神经之神经节细胞亦肿胀,但充盈的物质主要为神经苷脂,而黏多糖含量很少或不含有黏多糖。
患者一般出生时正常,随年龄增大,临床症状逐渐明显,由于各型病情轻重不一,又有各自的临床特征,在诊断中需鉴别。
其共同特征是:A)在出生1年左右出现生长落后。
除Ⅳ型和Ⅵ型外,患者都伴有智能落后。
B)身材矮小和特殊面容,表情淡漠,头大、面部丑陋,眼裂小,眼距宽,鼻梁低平,鼻孔大,唇厚,前额和双颧突出,毛发多而发际低,颈短,大部分有角膜混浊。
关节进行性畸变,胸廓畸形,脊柱后凸或侧凸,膝外翻、爪形手。
C)早期出现肝、脾肿大,耳聋,心脏增大等。
D)由于黏多糖在血管壁的沉积,可突发冠状动脉闭塞或心肌梗死。
黏多糖病是常染色体遗传病。
由于组织细胞内溶酶体酶(如1-艾杜糖苷酸酶、硫酸脂酶、N-乙酰-D-氨基葡糖苷酶、α-N-乙酰转移酶β-半乳糖苷酶等)缺陷造成黏多糖降解不全,并在溶酶体内堆聚,尿不完全代谢产物排出增加导致软骨、结缔组织、心脏、中枢神经等功能障碍。
由于缺陷酶的不同,引起细胞内贮存的黏多糖粘脂质也不均一,目前对引起黏多糖病的酶缺陷都已鉴定,共分为6型。
2021糖原贮积病Ⅱ型GAA基因变异特点及基因型与表型的关系(全文)糖原贮积病Ⅱ型(OMIM号:232300)又称庞贝病,因α-葡萄糖苷酶(acid α-glucosidase,GAA)基因(OMIM号:606800)缺陷导致溶酶体酸性GAA缺乏所致的一种罕见溶酶体贮积病,呈常染色体隐性遗传。
随着重组人GAA替代药物的应用,该病成为可治疗罕见病,早期诊断和早期干预治疗可显著改善预后。
GAA基因变异具有种族及地域差异,且部分基因型与临床表型有一定关系。
中国尚缺乏大样本的有关该病的临床谱及分子流行病学资料。
本研究回顾性分析2010年1月至2020年5月广州市妇女儿童医疗中心确诊的18岁前起病的57例糖原贮积病Ⅱ型患者的临床表现及GAA基因检测结果,探索GAA基因变异特点及基因型与表型的关系,并以广州市2 395名健康儿童GAA基因变异谱根据人群致病变异携带率推断该病的理论发病率。
对象和方法一、对象回顾性病例研究,广州市妇女儿童医疗中心于2010年1月至2020年5月通过GAA活性测定及GAA基因变异分析确诊糖原贮积病Ⅱ型患者共63例,选择18岁前起病的57例患者为研究对象,其诊断年龄为1月龄至27岁。
同期广州市妇女儿童医疗中心儿科研究所提供2 395名健康儿童全外显子测序中GAA基因检测结果。
本研究经广州市妇女儿童医疗中心医学伦理委员会批准(2012[024])并获儿童(监护人)或患者知情同意。
二、方法1.临床资料收集及整理:通过医院电子病例系统收集患者病史、临床表现、实验室及影像学检查结果,根据发病年龄、心脏是否受累分为婴儿型、晚发型、非典型婴儿型3种临床表型。
2.淋巴细胞GAA活性测定:采集外周静脉血4 ml,乙二胺四乙酸抗凝,分离淋巴细胞,超声破碎细胞,制备细胞匀浆,蛋白定量,采用荧光底物法测定GAA活性。
取6 mmol/L的4-甲基伞酮-ɑ-D-葡萄糖苷(美国Sigma公司)20 μl,加80 μmol/L阿卡波糖(美国Sigma公司)5 μl,加细胞混悬液20 μl(30 μg蛋白),37 ℃恒温震荡孵育1 h,加150 mmol/L乙二胺四乙酸缓冲液(pH=11.3)200 μl终止反应,Bio-Tek FLx 800 荧光分析仪测定4-甲基伞酮荧光强度,激发光波长350 nm,发射光波长460 nm,以4-甲基伞酮(美国Sigma公司)制定标准曲线。