氨碱法纯碱生产的主要原料概述
- 格式:doc
- 大小:97.00 KB
- 文档页数:15




氨碱法制备纯碱1.教学目标:(1)理解氨碱法生产纯碱的相关化学原理;(2)掌握氨碱法制备纯碱的工艺操作流程;(3)理解化学原理应用于实际化工生产的方法;2.教学难点:制碱生产原理与工艺生产过程3. 教学类容:3.1 纯碱简介无水碳酸钠(Na 2CO 3)是俗称苏打,是重要的基础化工原料,主要用于玻璃制造、化工、冶金,以及造纸、纺织、食品等轻工业,用量极大,在国名经济中占有十分重要的地位,被誉为“化工之母”。
3.2纯碱的工业制法工业上制取纯碱最早是由法国人路布兰首先提出来的,以食盐,煤,硫酸及石灰石为为原料,其反应如下:HCl NaHS O S O H NaCl 4℃12042+−−→−+HCl S O Na NaHS O NaCl 42℃700~6004+−−−→−+22℃1000422CO S Na 2C S O Na +−−→−+ C a SCO Na CaCO S Na 321000℃32+−−→−+ 路布兰生产缺点:不能连续生产,原料利用率低,产品质量差,劳动强度大,成本高等缺点不能满足工业发展的需要而逐渐被淘汰。
1861年,比利时苏尔维在总结前人各种制碱方法的基础上,提出了以食盐,石灰石,焦炭(或煤),氨为原料制取纯碱的方法,俗称氨碱法。
我国科学家侯德榜研究出联合制碱法。
目前纯碱工业上主要使用这两种制备方法。
3.3 氨碱法制备纯碱的生产原理氨碱法生产纯碱分为六个基本过程。
(1) 二氧化碳和饱和石灰水的制备 将石灰石在石灰窑内煅烧得到生石灰(氧化钙CaO )和二氧化碳(CO 2),再将生石灰加水进行消化。
CO CaO CaCO 23↑+−→− )()(s 22Ca(OH)O H s CaO −→−+ (2)精盐水的制备 将原盐溶解或采用天然盐水除去钙,镁杂质,得到合格的饱和食盐水。
(3)氨盐水的制备 用精盐水吸收氨气制成氨盐得到符合要求的氨盐水。
(4)氨盐水的碳酸化 将氨盐水与二氧化碳作用,即得到碳酸氢钠和氯化铵。

一、实验目的1. 了解氨碱法制备纯碱的原理及过程;2. 掌握氨碱法制备纯碱的实验操作步骤;3. 熟悉实验仪器的使用方法;4. 分析实验过程中可能出现的问题及解决方法。
二、实验原理氨碱法(索尔维法)是一种制备纯碱(碳酸钠)的工业方法,其主要原理是利用氨与二氧化碳反应生成碳酸氢铵,再经过加热分解得到纯碱。
具体反应方程式如下:2NH3 + CO2 + H2O → (NH4)2CO3(NH4)2CO3 → 2NH3 + CO2 + H2O + Na2CO3三、实验仪器与试剂1. 实验仪器:烧杯、试管、漏斗、玻璃棒、铁架台、加热装置、滤纸、滤液瓶等;2. 实验试剂:氨水、二氧化碳、饱和食盐水、碳酸氢铵、氢氧化钠、氢氧化钙等。
四、实验步骤1. 准备实验仪器,检查其是否完好;2. 将一定量的饱和食盐水倒入烧杯中;3. 向烧杯中加入适量的氨水,搅拌均匀;4. 将二氧化碳气体通入烧杯中的溶液中,观察溶液颜色变化;5. 当溶液颜色变为深蓝色时,停止通入二氧化碳气体;6. 将烧杯中的溶液过滤,收集滤液;7. 将滤液加热至沸腾,观察溶液中是否有沉淀产生;8. 当溶液中出现沉淀时,停止加热;9. 将沉淀物过滤,收集滤液;10. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;11. 当溶液颜色变为红色时,停止加入氢氧化钠;12. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;13. 当溶液中出现沉淀时,停止加热;14. 将沉淀物过滤,收集滤液;15. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;16. 当溶液颜色变为绿色时,停止加入氢氧化钙;17. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;18. 当溶液中出现沉淀时,停止加热;19. 将沉淀物过滤,收集滤液;20. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;21. 当溶液颜色变为紫色时,停止加入碳酸氢铵;22. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;23. 当溶液中出现沉淀时,停止加热;24. 将沉淀物过滤,收集滤液;25. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;26. 当溶液颜色变为红色时,停止加入氢氧化钠;27. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;28. 当溶液中出现沉淀时,停止加热;29. 将沉淀物过滤,收集滤液;30. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;31. 当溶液颜色变为绿色时,停止加入氢氧化钙;32. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;33. 当溶液中出现沉淀时,停止加热;34. 将沉淀物过滤,收集滤液;35. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;36. 当溶液颜色变为紫色时,停止加入碳酸氢铵;37. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;38. 当溶液中出现沉淀时,停止加热;39. 将沉淀物过滤,收集滤液;40. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;41. 当溶液颜色变为红色时,停止加入氢氧化钠;42. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;43. 当溶液中出现沉淀时,停止加热;44. 将沉淀物过滤,收集滤液;45. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;46. 当溶液颜色变为绿色时,停止加入氢氧化钙;47. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;48. 当溶液中出现沉淀时,停止加热;49. 将沉淀物过滤,收集滤液;50. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;51. 当溶液颜色变为紫色时,停止加入碳酸氢铵;52. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;53. 当溶液中出现沉淀时,停止加热;54. 将沉淀物过滤,收集滤液;55. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;56. 当溶液颜色变为红色时,停止加入氢氧化钠;57. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;58. 当溶液中出现沉淀时,停止加热;59. 将沉淀物过滤,收集滤液;60. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;61. 当溶液颜色变为绿色时,停止加入氢氧化钙;62. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;63. 当溶液中出现沉淀时,停止加热;64. 将沉淀物过滤,收集滤液;65. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;66. 当溶液颜色变为紫色时,停止加入碳酸氢铵;67. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;68. 当溶液中出现沉淀时,停止加热;69. 将沉淀物过滤,收集滤液;70. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;71. 当溶液颜色变为红色时,停止加入氢氧化钠;72. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;73. 当溶液中出现沉淀时,停止加热;74. 将沉淀物过滤,收集滤液;75. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;76. 当溶液颜色变为绿色时,停止加入氢氧化钙;77. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;78. 当溶液中出现沉淀时,停止加热;79. 将沉淀物过滤,收集滤液;80. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;81. 当溶液颜色变为紫色时,停止加入碳酸氢铵;82. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;83. 当溶液中出现沉淀时,停止加热;84. 将沉淀物过滤,收集滤液;85. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;86. 当溶液颜色变为红色时,停止加入氢氧化钠;87. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;88. 当溶液中出现沉淀时,停止加热;89. 将沉淀物过滤,收集滤液;90. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;91. 当溶液颜色变为绿色时,停止加入氢氧化钙;92. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;93. 当溶液中出现沉淀时,停止加热;94. 将沉淀物过滤,收集滤液;95. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;96. 当溶液颜色变为紫色时,停止加入碳酸氢铵;97. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;98. 当溶液中出现沉淀时,停止加热;99. 将沉淀物过滤,收集滤液;100. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;101. 当溶液颜色变为红色时,停止加入氢氧化钠;102. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;103. 当溶液中出现沉淀时,停止加热;104. 将沉淀物过滤,收集滤液;105. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;106. 当溶液颜色变为绿色时,停止加入氢氧化钙;107. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;108. 当溶液中出现沉淀时,停止加热;109. 将沉淀物过滤,收集滤液;110. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;111. 当溶液颜色变为紫色时,停止加入碳酸氢铵;112. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;113. 当溶液中出现沉淀时,停止加热;114. 将沉淀物过滤,收集滤液;115. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;116. 当溶液颜色变为红色时,停止加入氢氧化钠;117. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;118. 当溶液中出现沉淀时,停止加热;119. 将沉淀物过滤,收集滤液;120. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;121. 当溶液颜色变为绿色时,停止加入氢氧化钙;122. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;123. 当溶液中出现沉淀时,停止加热;124. 将沉淀物过滤,收集滤液;125. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;126. 当溶液颜色变为紫色时,停止加入碳酸氢铵;127. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;128. 当溶液中出现沉淀时,停止加热;129. 将沉淀物过滤,收集滤液;130. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;131. 当溶液颜色变为红色时,停止加入氢氧化钠;132. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;133. 当溶液中出现沉淀时,停止加热;134. 将沉淀物过滤,收集滤液;135. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;136. 当溶液颜色变为绿色时,停止加入氢氧化钙;137. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;138. 当溶液中出现沉淀时,停止加热;139. 将沉淀物过滤,收集滤液;140. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;141. 当溶液颜色变为紫色时,停止加入碳酸氢铵;142. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;143. 当溶液中出现沉淀时,停止加热;144. 将沉淀物过滤,收集滤液;145. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;146. 当溶液颜色变为红色时,停止加入氢氧化钠;147. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;148. 当溶液中出现沉淀时,停止加热;149. 将沉淀物过滤,收集滤液;150. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;151. 当溶液颜色变为绿色时,停止加入氢氧化钙;152. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;153. 当溶液中出现沉淀时,停止加热;154. 将沉淀物过滤,收集滤液;155. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;156. 当溶液颜色变为紫色时,停止加入碳酸氢铵;157. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;158. 当溶液中出现沉淀时,停止加热;159. 将沉淀物过滤,收集滤液;160. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;161. 当溶液颜色变为红色时,停止加入氢氧化钠;162. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;163. 当溶液中出现沉淀时,停止加热;164. 将沉淀物过滤,收集滤液;165. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;166. 当溶液颜色变为绿色时,停止加入氢氧化钙;167. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;168. 当溶液中出现沉淀时,停止加热;169. 将沉淀物过滤,收集滤液;170. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;171. 当溶液颜色变为紫色时,停止加入碳酸氢铵;172. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;173. 当溶液中出现沉淀时,停止加热;174. 将沉淀物过滤,收集滤液;175. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;176. 当溶液颜色变为红色时,停止加入氢氧化钠;177. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;178. 当溶液中出现沉淀时,停止加热;179. 将沉淀物过滤,收集滤液;180. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;181. 当溶液颜色变为绿色时,停止加入氢氧化钙;182. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;183. 当溶液中出现沉淀时,停止加热;184. 将沉淀物过滤,收集滤液;185. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;186. 当溶液颜色变为紫色时,停止加入碳酸氢铵;187. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;188. 当溶液中出现沉淀时,停止加热;189. 将沉淀物过滤,收集滤液;190. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;191. 当溶液颜色变为红色时,停止加入氢氧化钠;192. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;193. 当溶液中出现沉淀时,停止加热;194. 将沉淀物过滤,收集滤液;195. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;196. 当溶液颜色变为绿色时,停止加入氢氧化钙;197. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;198. 当溶液中出现沉淀时,停止加热;199. 将沉淀物过滤,收集滤液;200. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;201. 当溶液颜色变为紫色时,停止加入碳酸氢铵;202. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;203. 当溶液中出现沉淀时,停止加热;204. 将沉淀物过滤,收集滤液;205. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;206. 当溶液颜色变为红色时,停止加入氢氧化钠;207. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;208. 当溶液中出现沉淀时,停止加热;209. 将沉淀物过滤,收集滤液;210. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;211. 当溶液颜色变为绿色时,停止加入氢氧化钙;212. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;213. 当溶液中出现沉淀时,停止加热;214. 将沉淀物过滤,收集滤液;215. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;216. 当溶液颜色变为紫色时,停止加入碳酸氢铵;217. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;218. 当溶液中出现沉淀时,停止加热;219. 将沉淀物过滤,收集滤液;220. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;221. 当溶液颜色变为红色时,停止加入氢氧化钠;222. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;223. 当溶液中出现沉淀时,停止加热;224. 将沉淀物过滤,收集滤液;225. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;226. 当溶液颜色变为绿色时,停止加入氢氧化钙;227. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;228. 当溶液中出现沉淀时,停止加热;229. 将沉淀物过滤,收集滤液;230. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;231. 当溶液颜色变为紫色时,停止加入碳酸氢铵;232. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;233. 当溶液中出现沉淀时,停止加热;234. 将沉淀物过滤,收集滤液;235. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;236. 当溶液颜色变为红色时,停止加入氢氧化钠;237. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;238. 当溶液中出现沉淀时,停止加热;239. 将沉淀物过滤,收集滤液;240. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;241. 当溶液颜色变为绿色时,停止加入氢氧化钙;242. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;243. 当溶液中出现沉淀时,停止加热;244. 将沉淀物过滤,收集滤液;245. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;246. 当溶液颜色变为紫色时,停止加入碳酸氢铵;247. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;248. 当溶液中出现沉淀时,停止加热;249. 将沉淀物过滤,收集滤液;250. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;251. 当溶液颜色变为红色时,停止加入氢氧化钠;252. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;253. 当溶液中出现沉淀时,停止加热;254. 将沉淀物过滤,收集滤液;255. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;256. 当溶液颜色变为绿色时,停止加入氢氧化钙;257. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;258. 当溶液中出现沉淀时,停止加热;259. 将沉淀物过滤,收集滤液;260. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;261. 当溶液颜色变为紫色时,停止加入碳酸氢铵;262. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;263. 当溶液中出现沉淀时,停止加热;264. 将沉淀物过滤,收集滤液;265. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;266. 当溶液颜色变为红色时,停止加入氢氧化钠;267. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;268. 当溶液中出现沉淀时,停止加热;269. 将沉淀物过滤,收集滤液;270. 将滤液加入适量的氢氧化钙,观察溶液颜色变化;271. 当溶液颜色变为绿色时,停止加入氢氧化钙;272. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;273. 当溶液中出现沉淀时,停止加热;274. 将沉淀物过滤,收集滤液;275. 将滤液加入适量的碳酸氢铵,观察溶液颜色变化;276. 当溶液颜色变为紫色时,停止加入碳酸氢铵;277. 将溶液加热至沸腾,观察溶液中是否有沉淀产生;278. 当溶液中出现沉淀时,停止加热;279. 将沉淀物过滤,收集滤液;280. 将滤液加入适量的氢氧化钠,观察溶液颜色变化;28。
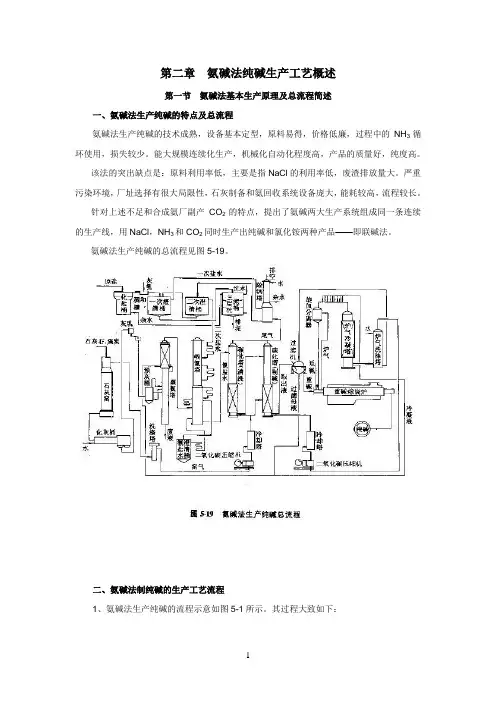
第二章氨碱法纯碱生产工艺概述第一节氨碱法基本生产原理及总流程简述一、氨碱法生产纯碱的特点及总流程氨碱法生产纯碱的技术成熟,设备基本定型,原料易得,价格低廉,过程中的NH3循环使用,损失较少。
能大规模连续化生产,机械化自动化程度高,产品的质量好,纯度高。
该法的突出缺点是:原料利用率低,主要是指NaCl的利用率低,废渣排放量大。
严重污染环境,厂址选择有很大局限性,石灰制备和氨回收系统设备庞大,能耗较高,流程较长。
针对上述不足和合成氨厂副产CO2的特点,提出了氨碱两大生产系统组成同一条连续的生产线,用NaCl,NH3和CO2同时生产出纯碱和氯化铵两种产品——即联碱法。
氨碱法生产纯碱的总流程见图5-19。
二、氨碱法制纯碱的生产工艺流程1、氨碱法生产纯碱的流程示意如图5-1所示。
其过程大致如下:2、氨碱法纯碱生产工艺流程框图:3、氨碱法纯碱生产工序的基本划分:(1)石灰工序:CO 2和石灰乳的制备,石灰石经煅烧制得石灰和CO 2,石灰经消化得石灰乳;(2)盐水工序:盐水的制备和精制;(3)蒸吸工序: 盐水氨化制氨盐水及母液中氨的蒸发与回收;原盐 石灰石 无烟煤CO 2 NH 3 废液 重质纯碱 轻质纯碱盐水精制 盐水吸氨 氨盐水碳化 石灰煅烧 石灰乳制备 母液蒸馏 重碱过滤 重碱煅烧 水合(4)碳滤工序: 氨盐水碳化制得重碱及其重碱过滤和洗涤;(5)煅烧工序:重碱煅烧得纯碱成品及CO2;和重质纯碱的生产;(6)CO2压缩工序:窑气CO2、炉气CO2的压缩工碳酸化制碱。
三、氨碱法纯碱生产原理及工艺流程叙述氨碱法生产纯碱的原料是食盐和石灰石,燃料为焦炭(煤)。
氨作为催化剂在系统中循环使用。
原料盐(海盐、岩盐、天然盐水)经精制吸氨、碳化、结晶、过滤,再煅烧即为成品。
母液经石灰乳中和后,氨蒸发并回收使用,氯化钙则排放。
其化学反应为:氨碱法具有原料来源丰富和方便,生产过程均在气液相间进行,可以大规模连续化生产及产品质量好、成本低等优点。


纯碱工业制法
氯化钠、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
放出的二氧化碳气体可回收循环使用。
含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用。
氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半——食盐成分里的钠离子和石灰石成分里的碳酸根离子结合成了碳酸钠,可是食盐的另一成分氯离子和石灰石的另一成分钙离子却结合成了没有多大用途的氯化钙,因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
NaCl +NH3+H2O +CO2=NaHCO3+NH4Cl 。
2NaHCO3=Na2CO3+H2O +CO2。

第三节海水“制碱”一、氨碱法制取纯碱一、导学提纲1、纯碱的制取⑴、原料:、、、。
⑵、工艺流程:饱和食盐水———饱和氨盐水———NaHCO3———NaCO3先向饱和食盐水中通入,制成饱和氨盐水,在加压并不断通入的条件下,使NaHCO3 晶体析出,过滤后将NaHCO3 加热分解即得纯碱。
⑶、反应原理:;。
⑷、优缺点:优点:原料经济、生产的纯碱纯度高、副产品NH3和CO2可循环使用、制造步骤简单适合大规模生产。
缺点:NaCl的利用率只有72%—74%,回收NH3时生成的CaCl2用处不大且污染环境。
2、纯碱的用途纯碱在化学工业中的用途极广,如、、、等均需要大量的纯碱,纯碱还广泛应用于、、、等领域。
3、碳酸氢钠⑴碳酸氢钠俗称,又称,化学式为。
⑵碳酸氢钠是一种色晶体,溶于水,其水溶液显性,受热易分解,化学方程式为。
⑶碳酸氢钠在生产和生活中有许多重要用途,你都知道哪一些?二、交流共享1、用氨碱法制取纯碱时,为什么氨盐水比食盐水更容易吸收CO2?2、氨盐水吸收CO2后生成的NaHCO3和NH4Cl ,哪种物质首先析出?为什么?3、用氨碱法制取纯碱时,为什么说是以氨为媒介?三、拓展应用我国化工专家侯德榜发明的“侯氏制碱法”的基本原理是:在浓氨水中通入足量的CO2生成一种盐,然后在此溶液中加入细小的食盐粉末,由于NaHCO3 在该状态下溶解度很小,呈晶体析出,同时由于NaHCO3 不稳定,加热后生成纯碱、水和二氧化碳。
根据以上叙述回答下列问题:⑴用上述方法进行生产时,所用的起始原料是(填化学),最终产品是。
⑵有关反应的化学方程式为、、。
该生产过程中没有涉及的基本反应类型是⑶有人认为侯氏制碱法的优点有四:A、生产过程中部分产品可选为起始原料使用;B副产品是一种可利用的氮肥;C反应不需要加热;D副产品不会造成环境污染,你认为其中正确的是(用代号回答)。

纯碱(Sodium Carbonate),学名碳酸钠,俗名苏打、石碱、碱灰、碱粉、洗涤碱,化学式Na2CO3。
纯碱外观为白色粉末或细粒结晶、味涩。
其水溶液水解呈碱性,有一定的腐蚀性,能与酸进行中和反应,生成相应的盐,并放出二氧化碳。
高温下可分解,生成氧化钠和二氧化碳。
纯碱在潮湿的空气里会潮解,慢慢吸收二氧化碳和水,部分变为碳酸氢钠,所以包装要严,否则会吸潮结块。
氨碱法使生产实现了连续性生产,食盐的利用率得到提高,产品质量纯净,因而被称为纯碱,但最大的优点还在于成本低廉。
1867年索尔维设厂制造的产品在巴黎世界博览会上获得铜制奖章,此法被正式命名为索尔维法。
此时,纯碱的价格大大下降。
消息传到英国,正在从事路布兰法制碱的英国哈琴森公司取得了两年独占索尔维法的权利。
1873年哈琴森公司改组为卜内门公司,建立了大规模生产纯碱的工厂,后来,法、德、美等国相继建厂。
这些国家发起组织索尔维公会,设计图纸只向会员国公开,对外绝对保守秘密。
凡有改良或新发现,会员国之间彼此通气,并相约不申请专利,以防泄露。
除了技术之外,营业也有限制,他们采取分区售货的办法,例如中国市场由英国卜内门公司独占。
由于如此严密的组织方式,凡是不得索尔维公会特许权者,根本无从问津氨碱法生产详情。
多少年来,许多国家要想探索索尔维法奥秘的厂商,无不以失败而告终。
直到1933年侯德榜著书《纯碱制造》,将索尔维制碱法公之于众。
再到后来被更为先进的侯氏制碱法取代。
它是以食盐、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳,使其生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3=Na2CO3+H2O+CO2↑放出的二氧化碳气体可回收循环使用。

氨碱法纯碱生产的主要原料概述一、原盐(食盐)1、原盐的物化性质及成份规格:原盐是氨碱法纯碱生产的主要原料。
原盐的主要成份为氯化钠,化学分子式为NaCL,纯氯化钠为无色等轴晶体,但是由于原盐是由许多晶体机和而成,晶体之间的缝隙中往往含有卤水或者空气,因而变成白色而且不透明体,同时又因含有泥沙等杂质,使原盐常呈现灰褐色,氯化钠晶体通常是正六面体。
(1)食盐的物化性质:氯化钠的分子量 58.45熔点 800℃沸点 1440℃20℃时比热 0.867(J/g℃)25℃时密度 2.161t/m3原盐中因为含有氯化镁等杂质,容易吸收空气中的水分而潮解。
氯化钠易溶于水,其溶解热为——4.9KJ/mol,溶解过程为吸热反应,当制成饱和盐水时,可使溶液温度降低6℃多。
氯化钠的溶解度随温度升高没有明显的变化,这一性质与绝大多数易溶物质溶解度随着温度升高而增加的性质不同,所以其水溶液(卤水)在冷冻工业中被用作载冷体。
(2)食盐的质量标准:作为制碱工业的原料,要求原盐中的主要成份NaCL含量尽可能高,而泥沙及其他杂质,特别是钙、镁杂质越低越好。
因为食盐中的氯化镁、硫酸镁、硫酸钙等杂质,在盐水精制、吸氨、碳化过程中,会生成炭酸镁、碳酸钙及其他复盐等,使塔器与管道堵塞,这些杂质如不能在碳化以前清除掉,就会较多地混入纯碱中,使产品的品位降低,因此用于氨碱法的食盐一般需要符合以下标准:NaCL% ≥ 90%;水分% ≤ 4.2%;Mg2+% ≤0.8%;SO42-%≤ 0.8%。
2、原盐的需要用量氨碱法纯碱生产的全过程,可以归结为一个综合的化学反应方程式。
即CaCO3+2NaCL= CaCL2 +Na2CO32×58.45 106X 1000kg按照上述反应方程式,可以计算出生产1t纯碱理论上所需要的氯化钠量X=58.45×2×1000/106=1103kg所求出的X 是指生产每吨纯碱(含Na2CO3100%) 所需要的纯的氯化钠(折NaCL100%) 的量。
氨碱法制纯碱工艺流程
氨碱法制纯碱是一种利用氨溶液与氯化钠反应制取氢氧化钠(纯碱)的工艺方法。
下面介绍一下氨碱法制纯碱的工艺流程。
首先,准备原料。
将氯化钠和氨气分别准备好。
氯化钠是通过食盐经过电解法制取的,氯化钠的纯度需要达到一定的标准要求。
氨气则是通过氨气槽制取,纯度也需要达到一定的标准。
然后,将氯化钠溶解。
将氯化钠溶解在适量的水中,形成氯化钠溶液。
溶解过程需要加热,以提高溶解度,并使用搅拌装置使溶液均匀。
接着,将溶液过滤。
为了去除氯化钙等杂质,需要将溶液进行过滤。
通过过滤,可以得到纯净的氯化钠溶液。
然后,进行氯化钠溶液的反应。
将氯化钠溶液加热至一定温度,然后将氨气通入溶液中进行反应。
反应发生时,氯化钠溶液中的氯化钠与氨气发生化学反应,生成氨氯化钠。
接下来,进行氨氯化钠的分解。
将氨氯化钠加热至一定温度,使之分解生成氢氧化钠和氨气。
反应过程中,氨气是可回收利用的。
最后,进行纯碱的结晶和干燥。
将分解后的氢氧化钠溶液进行结晶和干燥处理,得到纯碱固体。
以上就是氨碱法制纯碱的工艺流程。
这种工艺方法具有操作简
单、设备投资少、产品纯度高等优点,因此被广泛应用于纯碱的生产中。
但同时需要注意控制反应温度、氨气的浓度等参数,以确保产品的质量和工艺的安全性。
氨碱法纯碱生产的主要原料概述一、原盐(食盐)1、原盐的物化性质及成份规格:原盐是氨碱法纯碱生产的主要原料。
原盐的主要成份为氯化钠,化学分子式为NaCL,纯氯化钠为无色等轴晶体,但是由于原盐是由许多晶体机和而成,晶体之间的缝隙中往往含有卤水或者空气,因而变成白色而且不透明体,同时又因含有泥沙等杂质,使原盐常呈现灰褐色,氯化钠晶体通常是正六面体。
(1)食盐的物化性质:氯化钠的分子量 58.45熔点 800℃沸点 1440℃20℃时比热 0.867(J/g℃)25℃时密度 2.161t/m3原盐中因为含有氯化镁等杂质,容易吸收空气中的水分而潮解。
氯化钠易溶于水,其溶解热为——4.9KJ/mol,溶解过程为吸热反应,当制成饱和盐水时,可使溶液温度降低6℃多。
氯化钠的溶解度随温度升高没有明显的变化,这一性质与绝大多数易溶物质溶解度随着温度升高而增加的性质不同,所以其水溶液(卤水)在冷冻工业中被用作载冷体。
(2)食盐的质量标准:作为制碱工业的原料,要求原盐中的主要成份NaCL含量尽可能高,而泥沙及其他杂质,特别是钙、镁杂质越低越好。
因为食盐中的氯化镁、硫酸镁、硫酸钙等杂质,在盐水精制、吸氨、碳化过程中,会生成炭酸镁、碳酸钙及其他复盐等,使塔器与管道堵塞,这些杂质如不能在碳化以前清除掉,就会较多地混入纯碱中,使产品的品位降低,因此用于氨碱法的食盐一般需要符合以下标准:NaCL% ≥ 90%;水分% ≤ 4.2%;Mg2+% ≤0.8%;SO42-%≤ 0.8%。
2、原盐的需要用量氨碱法纯碱生产的全过程,可以归结为一个综合的化学反应方程式。
即CaCO3+2NaCL= CaCL2 +Na2CO32×58.45 106X 1000kg按照上述反应方程式,可以计算出生产1t纯碱理论上所需要的氯化钠量X=58.45×2×1000/106=1103kg所求出的X 是指生产每吨纯碱(含Na2CO3100%) 所需要的纯的氯化钠(折NaCL100%) 的量。
简述氨碱生产流程氨碱法生产纯碱可是个很有趣的过程呢。
氨碱法也叫索尔维法,它主要是以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱(碳酸钠)的。
一、盐水的精制。
我们得先有盐水呀。
从海水中或者盐矿里得到的粗盐可不行,里面有好多杂质呢。
这里面有钙离子、镁离子这些捣乱的家伙。
要把粗盐溶解在水里,然后通过化学的方法把这些杂质除掉。
比如加入一些试剂,让钙离子和镁离子变成沉淀,就像把调皮的小坏蛋给抓住关进小笼子(沉淀)里一样。
这样得到的精制盐水就比较纯净啦,可以进入下一步的反应咯。
二、吸氨。
接下来就是吸氨这个环节啦。
把精制盐水放到吸收塔里面,让氨气呼呼地往里钻。
氨气就像个热情的小客人,一头扎进盐水里。
这时候盐水就变成了氨盐水啦。
这个氨盐水可就有了特殊的本领,可以进行下面的反应喽。
三、碳酸化。
再然后就是碳酸化啦。
把二氧化碳通到氨盐水里。
这个二氧化碳从哪来呢?前面提到的石灰石煅烧就会产生二氧化碳呢。
二氧化碳进去之后,就会发生奇妙的反应,会生成碳酸氢钠和氯化铵。
碳酸氢钠在这个溶液里溶解度比较小,就像一个比较内向的小朋友,不太能在这个环境里待得住,就慢慢结晶出来啦。
就好像它觉得这里太挤了,想自己找个小角落待着一样。
四、过滤和煅烧。
那有了碳酸氢钠的结晶之后呢,就要把它从溶液里分离出来呀,这时候就用过滤的方法。
把碳酸氢钠的晶体过滤出来,就像把小珍珠从水里捞出来一样。
然后把这些碳酸氢钠晶体送到煅烧炉里去煅烧。
这一煅烧可不得了,碳酸氢钠就发生了变化,变成了碳酸钠,也就是我们要的纯碱啦。
同时呢,还会产生二氧化碳和水。
这个产生的二氧化碳可不能浪费,要把它收集起来,送到前面碳酸化的步骤里去循环利用呢。
五、氯化铵的处理。
前面反应还产生了氯化铵呢。
氯化铵也有它的用处。
可以把氯化铵和石灰乳混合,然后加热,这样又能得到氨气啦。
这个氨气也能收集起来,送到前面吸氨的步骤去循环使用。
这样整个氨碱生产流程就形成了一个比较完整的循环系统,既不浪费资源,又能高效地生产出纯碱来。
氨碱法纯碱生产的主要原料概述一、原盐(食盐)1、原盐的物化性质及成份规格:原盐是氨碱法纯碱生产的主要原料。
原盐的主要成份为氯化钠,化学分子式为NaCL,纯氯化钠为无色等轴晶体,但是由于原盐是由许多晶体机和而成,晶体之间的缝隙中往往含有卤水或者空气,因而变成白色而且不透明体,同时又因含有泥沙等杂质,使原盐常呈现灰褐色,氯化钠晶体通常是正六面体。
(1)食盐的物化性质:氯化钠的分子量 58.45熔点 800℃沸点 1440℃20℃时比热 0.867(J/g℃)25℃时密度 2.161t/m3原盐中因为含有氯化镁等杂质,容易吸收空气中的水分而潮解。
氯化钠易溶于水,其溶解热为——4.9KJ/mol,溶解过程为吸热反应,当制成饱和盐水时,可使溶液温度降低6℃多。
氯化钠的溶解度随温度升高没有明显的变化,这一性质与绝大多数易溶物质溶解度随着温度升高而增加的性质不同,所以其水溶液(卤水)在冷冻工业中被用作载冷体。
(2)食盐的质量标准:作为制碱工业的原料,要求原盐中的主要成份NaCL含量尽可能高,而泥沙及其他杂质,特别是钙、镁杂质越低越好。
因为食盐中的氯化镁、硫酸镁、硫酸钙等杂质,在盐水精制、吸氨、碳化过程中,会生成炭酸镁、碳酸钙及其他复盐等,使塔器与管道堵塞,这些杂质如不能在碳化以前清除掉,就会较多地混入纯碱中,使产品的品位降低,因此用于氨碱法的食盐一般需要符合以下标准:NaCL% ≥ 90%;水分% ≤ 4.2%;Mg2+% ≤0.8%;SO42-%≤ 0.8%。
2、原盐的需要用量氨碱法纯碱生产的全过程,可以归结为一个综合的化学反应方程式。
即CaCO3+2NaCL= CaCL2 +Na2CO32×58.45 106X 1000kg按照上述反应方程式,可以计算出生产1t纯碱理论上所需要的氯化钠量X=58.45×2×1000/106=1103kg所求出的X 是指生产每吨纯碱(含Na2CO3100%) 所需要的纯的氯化钠(折NaCL100%) 的量。
实际生产中,由于食盐中只有90%左右的氯化钠,而且又只能有70-75%的NaCL可以转化为Na2CO3, Na+离子至少损失27%以上,加之过程中跑、冒、滴、漏等各项损失,实际耗用食盐的量远远超过上述理论用量,这样使每生产1吨工业纯碱所需耗用的原盐实物量高达1.6—1.7t之多。
氨碱法制碱的食盐消耗量是很大的,纯碱工业从来就是用盐大户,因此必须保证有大量、廉价的原盐供应,才能维持生产并在经济上获益。
就其纯度而言,矿盐多数要比海盐为高,并可以采用注入高压水压裂地下化盐方法进行开采,得到接近饱和的卤水,节省设备和人力,降低成本。
十分适用于由湿法精制盐水的氨碱法生产,不过要铺设卤水输送管道或久盐矿附近建厂均存在其他制约因素,而我国又以盛产海盐为主,尽管其质量不如矿盐,也仍然是氨碱厂原料的天然宝库,所以我国大多数碱厂是以海盐为原料,临海发展纯碱生产。
3、我国盐资源概况3.1分类盐是NaCl(氯化钠)的俗称。
在我国,根据来源和生产方法可分为3类:以海水为原料晒制而得的盐叫作“海盐”;开采现代盐湖矿加工制得的盐叫作“湖盐”;开采地下天然卤水或古代岩盐矿床加工制得的盐则称“井矿盐”。
我国井矿盐工艺以钻井水溶汲取卤水,进而真空蒸发结晶生产高品质盐为主,因此,又称真空盐。
按照产品形式又分为固体盐和液体盐,我国以固体盐为主,液体盐主要指汲取的天然地下卤水或注水溶解地下岩盐矿床而得到的卤水,目前我国液体盐的比例不足10%,但国外发达国家较高,如美国达到51%。
氯化钠除供食用外(惯称食盐),大量用作工业原料(名曰工业用盐),国家统计局的统计年表以“原盐”为总称。
3.2资源分布我国盐资源非常丰富,开采历史悠久。
基本分布状况是:东部海盐,中部及西南部井矿盐,西北部湖盐。
海水晒盐与国家的海岸线长度、滩涂面积及气候条件等有关,我国海盐以北方海盐区(含辽宁、河北、天津、山东和江苏)为主。
井矿盐矿床广泛分布在河南、四川、湖北、湖南、江西、四川、重庆、云南、江苏、山东、安徽及陕西等18个省区。
据不完全统计,现已查明的氯化钠储量大于100亿t的盐矿床就有十余个。
湖盐主要分布在内蒙古、青海、新疆及西藏等西北部地区,以青海盐湖最为丰富,储量在3000多亿t,生产成本较为低廉,但我国西北地区经济相对落后,对盐的需求也较低,远距离运输一直是制约其发展的瓶颈。
我国1995年探明盐矿储量3824亿t,资源量在6.2万亿t以上。
目前我国的盐总产量不足6000万t,因此,我国的盐资源可以满足制盐工业长期快速发展的需求,很多省市都有发展制盐工业以及盐化工的资源条件。
4、我国制盐工业概况4.1生产情况近十余年,受我国盐化工及下游行业快速发展的影响,我国对原盐的需求也快速增加。
2007年,我国原盐生产和消费量5920万t,居世界第1位。
从历年统计数据看,海盐产能最大,井盐次之,湖盐最低。
东部沿海地区制盐产能约占总产能的60%。
海盐生产主要集中在环渤海湾的山东、河北、天津和辽宁四省市,四省市产量占全国海盐产量的90%以上。
湖盐主要集中在内蒙、新疆和青海三省。
井矿盐主要分布在四川、湖北、江苏、河南、江西、湖南、安徽、云南、重庆等省市。
近年我国原盐产量见表1。
受沿海地区各类园区和工业等项目建设发展的影响,北方海盐区的盐田面积逐年萎缩,海盐产能增幅和所占比例逐渐降低,产能进一步增加的潜力不大。
而井矿盐资源丰富且分布广,技术成熟,投资门槛不高,因此近年井矿盐产能增幅较快,在全国盐总产量中的比例逐年提高。
目前规划建设的制盐产能(主要是井矿盐)超过1000万t/a,盐业产能的增长可以满足下游行业的需求。
4.2存在问题(1)产品结构比较单一。
公路化雪、畜牧、水处理、洗浴用盐、高纯度工业盐等高附加值产品的开发,从数量、品种、质量等各方面还没有拓展和满足市场需求。
尤其是液体盐的开发利用仍处于较低水平,折盐产量仅占井矿盐总产量的12%。
卤水化工的深加工系列产品,如钾镁肥、阻燃剂、农药、医药中间体等还没有形成规模化和产业化。
(2)资源利用水平低。
目前,制盐工业仍主要以单一的制盐业为主,资源利用率很低。
海盐苦卤利用率不足20%,莱州湾地下卤水的掠夺性开采使盐、溴比例失调,这一地区出现水位下降、浓度降低、流量减少等资源枯竭的现象;湖盐区由于单一提取盐,导致镁害严重,使湖盐资源遭到污染;矿盐区的芒硝提取率不足10%。
国外则基本做到零排放。
(3)产业布局不合理。
50%以上的原盐运输半径超过200km。
在美国,80%以上的运输半径在150km以内,管输液体盐比例较高。
4.3发展思路近年盐业行业效益起伏较大,为避免产能严重过剩,国家发展改革委员会2006年发布《制盐工业结构调整指导意见》。
(1)优先考虑与两碱项目的配套建设。
制盐生产能力由2005年的5500万t提高至2010年的6500万t,年增幅控制在5%以内。
但实际预测该指标将被大大突破。
(2)稳定海盐生产,主要作为化工用盐,关键是要提高产品质量。
有序发展井矿盐。
井矿盐生产成本相对较高,但生产稳定,产品质量相对较好,在适度增加产能的前提下,增加低耗能的液体盐的供应量。
(3)按需发展湖盐。
湖盐区地处西部,运输条件还有待改善;但资源丰富,成本低廉,也具有一定优势。
4.4消费结构我国盐化工用盐占73%,食用盐占16%,其它用盐占11%。
盐化工是我国制盐工业发展的决定因素。
我国盐消费结构与发达国家相比,主要体现在盐化工耗盐比例过大;道路除雪等行业的消费比例过低(美国融雪耗盐达到1900万t);卤水直接消费比例过低(如美国达到51%),而我国液体盐消费比例只有10%左右,可见我国制盐工业的产品结构不尽合理。
我国以盐为原料的盐化工产业,主要是纯碱和氯碱两大行业(俗称“两碱”)。
近年来,氯酸钠和金属钠也发展较快,但这两种下游产品的盐的消耗较低,不足总消费量的1%,对全行业的供需平衡影响较小。
“两碱”的发展拉动了盐业的发展,我国已形成以纯碱和氯碱为龙头,下游产品开发并存的盐化工产业格局。
二、石灰石1、石灰石的物化性质及规格成分石灰石为氨碱法纯碱生产的第二大重要原料,其消耗量不亚于食盐。
(1)石灰石的物化性质:石灰石颜色有灰白、茶色、褐色等,单纯从色泽不能判断其品质的好坏。
典型的矿石时方解石、大理石,主要成份是碳酸钙,其结晶大部分为六方晶系。
化学分子式为CaCO3。
碳酸钙的分子量 100.09密度 2.711T/M3分解温度 825℃熔点 1339℃石灰石在石灰窑中煅烧,发生CaCO3的分解反应。
生成的CaO称为生石灰,为无色等轴晶系,熔点2372℃,密度3.37 t/m3,在氨碱厂将它用水消化而制得氢氧化钙悬浊液,用于蒸氨反应。
CaO+H2O=Ca(OH)2+65.65KJ/mol 生成的Ca(OH)2称为熟石灰或消石灰,其分子量为74.09,为无色斜方晶系,密度2.24t/m3,无吸湿性,溶解度很小,而且温度越高,溶解度越小。
氢氧化钙与水混合呈白色悬浊液即石灰乳,呈强碱性,用于蒸氨及盐水除镁过程。
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑摩氏硬度值(MOH):3化学分析:二氧化硅0.07%、三氧化二铝0.02%、三氧化二铁0.03%、氧化钙55.22%、氧化镁0.08%、石灰石块状/粉状:烧失量40.79%,硅4.62%,铝1.21%,铁0.52%,钙50.16%,镁1.10%白云石粉/块:硅0.19%,铝0.15%,铁0.17%,钙32.1%,镁21.19%石灰石是生产玻璃的主要原料。
二氧化碳(CO2)能使熟石灰变混浊。
石灰和石灰石大量用做建筑材料,也是许多工业的重要原料。
石灰石可直接加工成石料和烧制成生石灰。
石灰有生石灰和熟石灰。
生石灰的主要成分是CaO,一般呈块状,纯的为白色,含有杂质时为淡灰色或淡黄色。
生石灰吸潮或加水就成为消石灰,消石灰也叫熟石灰,它的主要成分是Ca(OH)2。
熟石灰经调配成石灰浆、石灰膏、石灰砂浆等,用作涂装材料和砖瓦粘合剂。
水泥是由石灰石和粘土等混合,经高温煅烧制得。
玻璃由石灰石、石英砂、纯碱等混合,经高温熔融制得。
炼铁用石灰石作熔剂,除去脉石。
炼钢用生石灰做造渣材料,除去硫、磷等有害杂质。
(2)石灰石的质量指标:石灰石的成份规格:CaCO3 % ≥ 90% ;SiO2≤5.5%;MgCO3 ≤3.5%;R2O3≤ 0.5% (R2O3为铁铝氧化物) 2、石灰石的用量根据反应方程式:CaCO3+2NaCL= CaCL2 +Na2CO3100106X 1000(kg)可求出 X=100×1000/106=943(kg)即每生产1吨纯碱(折100%)理论上需耗用的100% CaCO3约943kg。