肿瘤抗血管生成治疗耐药机制
- 格式:ppt
- 大小:2.18 MB
- 文档页数:18

肿瘤血管生成与抗血管疗法随着科技的不断进步,人们对于肿瘤研究的关注日益增加。
肿瘤血管生成作为肿瘤生长和转移的重要机制之一,已成为肿瘤治疗中的研究热点。
而抗血管疗法作为一种有前景的治疗方法,被广泛关注和研究。
本文将介绍肿瘤血管生成的机制以及抗血管疗法的原理与应用。
肿瘤血管生成,也被称为血管新生,是指在肿瘤生长过程中,由于肿瘤细胞的特殊信号和调节网络,导致周围组织中的血管增生。
这种血管生成机制非常重要,因为肿瘤细胞需要通过供给氧气和养分的血管来维持其快速增殖的能力。
肿瘤血管生成与细胞因子、细胞外基质和肿瘤相关因子等因素密切相关,这些因素共同合作,促进新的血管生成。
肿瘤血管生成的过程主要包括:肿瘤细胞通过释放血管生成因子(如血管内皮生长因子VEGF和基础纤维生长因子bFGF等),诱导周围组织中内皮细胞增殖与迁移,形成原始血管结构。
随后,局部细胞与胶原等细胞外基质所形成的血管壁,开始生长并分化形成完整的血管。
最终,这些新生血管将为肿瘤细胞提供养分和氧气,从而促进肿瘤的生长和转移。
抗血管疗法,是指通过干扰肿瘤血管生成的过程,阻断肿瘤对血液供应的依赖,达到抑制肿瘤生长和转移的目的。
目前,已经开发出多种抗血管疗法,其中最常见的包括抗血管生成抑制剂和抗血管生成破坏剂两种类型。
抗血管生成抑制剂主要通过干扰血管生成因子的信号传导路径来抑制肿瘤血管生成。
其中,抗VEGF抗体和VEGFR激酶抑制剂被广泛用于肿瘤治疗。
这些药物能够结合VEGF或其受体,阻断其在肿瘤血管生成过程中的作用。
此外,还有一些其他的抗血管生成抑制剂,如血管生成抑制素等,也显示出了一定的抗肿瘤活性。
抗血管生成破坏剂则是通过直接破坏肿瘤血管的结构和功能来达到治疗效果。
尽管其机制不同于抗血管生成抑制剂,但同样具有潜力作为肿瘤治疗的研究方向。
常见的抗血管生成破坏剂包括光动力疗法和介入治疗等。
光动力疗法是一种利用光敏剂在特定波长的激光照射下产生的氧化和免疫反应,破坏肿瘤血管的技术。

肿瘤血管生成与抑制的机制和研究方法肿瘤是一种严重的疾病,每年都有数以百万计的人因其失去生命。
随着医学技术的不断发展,越来越多的人对肿瘤的认识也越来越深入。
而在肿瘤治疗领域中,肿瘤血管生成和抑制成为了研究的重点,探索肿瘤血管生成和抑制的机制和研究方法成为了许多学者的研究内容。
本文将结合近年来学术研究,探讨肿瘤血管生成与抑制的机制和研究方法的相关内容。
一、肿瘤血管生成的机制肿瘤血管生成也被称为新生血管生成,是指肿瘤细胞刺激周围正常细胞分泌刺激因子(如血管内皮生长因子和基质金属蛋白酶等),导致周围血管内皮细胞的分裂和增生,形成供给肿瘤的新生血管。
这个过程也被称为血管瘤化。
肿瘤血管生成与肿瘤的生长、扩散和转移密切相关。
在肿瘤中,血管内皮生长因子(VEGF)是血管生成的重要因素。
VEGF在肿瘤的微环境中影响内皮细胞的增殖和迁移,以及生长因子的分泌和下游信号分子的活化,从而形成新的血管。
此外,VEGF也能够促进血管的渗透性,使肿瘤微环境更加容易形成生长因子、细胞因子和代谢废物积累的环境,影响肿瘤蔓延和治疗效果。
肿瘤血管生成的机制是一套复杂的生物学过程,涉及多个因素和信号通路。
研究这些信号通路的表达和调控机制,有助于我们更好地理解肿瘤血管生成机制。
二、肿瘤血管生成抑制的机制肿瘤血管生成的抑制被认为是肿瘤治疗中的重要手段。
在过去的几十年中,研究人员推出了多种方法和药物来抑制肿瘤血管生成,从而减缓肿瘤生长和扩散,以达到治疗目的。
目前肿瘤血管生成抑制的机制包括三种:1.靶向血管生成因子:利用抗血管生成因子的抗体或蛋白,直接靶向和抑制肿瘤血管生成所需的信号,从而抑制肿瘤生长和扩散。
2.抗血管生成药物:一些化学或天然的药物,如阿巴西酮、塞来昔布等,能够抑制受体酪氨酸激酶和血管内皮生长因子参与的血管生成参与过程,从而抑制肿瘤发展。
3.免疫抑制:免疫细胞在肿瘤微环境中富集和发生改变,从而抑制肿瘤血管生成和肿瘤微环境形成,是通过调节免疫细胞功能来实现。

肿瘤药物耐药机制及对策研究进展如何肿瘤是严重威胁人类健康的疾病之一,而肿瘤药物治疗是对抗肿瘤的重要手段之一。
然而,肿瘤细胞对药物产生耐药性是导致肿瘤治疗失败的主要原因之一。
深入研究肿瘤药物耐药机制并寻找有效的对策,对于提高肿瘤治疗效果、改善患者预后具有重要意义。
一、肿瘤药物耐药机制(一)肿瘤细胞内在因素1、药物靶点改变肿瘤细胞可以通过基因突变等方式改变药物作用的靶点,使药物无法有效地与之结合发挥作用。
例如,某些肺癌患者在使用针对表皮生长因子受体(EGFR)的靶向药物治疗后,肿瘤细胞可能会出现新的EGFR 突变,导致药物失效。
2、细胞信号通路异常肿瘤细胞内的信号通路复杂且相互关联。
当一条信号通路被药物抑制时,肿瘤细胞可以激活其他代偿性的信号通路来维持其生存和增殖,从而导致耐药。
例如,PI3K/AKT/mTOR 信号通路在多种肿瘤中异常活跃,当使用针对其中某个节点的药物时,肿瘤细胞可能通过激活其他旁路来逃避药物的作用。
3、药物转运蛋白异常肿瘤细胞表面的药物转运蛋白可以将药物排出细胞外,减少细胞内药物的浓度,从而导致耐药。
例如,P糖蛋白(Pgp)是一种常见的药物外排泵,其过度表达会使肿瘤细胞对多种化疗药物产生耐药性。
4、细胞凋亡抵抗细胞凋亡是肿瘤细胞受到药物作用后的一种常见死亡方式。
然而,肿瘤细胞可以通过改变凋亡相关基因的表达或调控凋亡信号通路,从而抵抗药物诱导的凋亡,导致耐药。
(二)肿瘤细胞外在因素1、肿瘤微环境肿瘤微环境包括肿瘤细胞周围的基质细胞、细胞外基质、血管和免疫细胞等。
肿瘤微环境可以通过分泌细胞因子、生长因子等物质,为肿瘤细胞提供生存和耐药的条件。
例如,肿瘤相关巨噬细胞可以分泌一些因子促进肿瘤细胞的存活和耐药。
2、血管生成肿瘤组织的血管生成异常丰富,为肿瘤细胞提供了充足的营养和氧气供应。
同时,异常的血管结构也影响了药物在肿瘤组织中的分布和渗透,导致药物无法有效地到达肿瘤细胞,从而产生耐药。

抗肿瘤药物的治疗耐药性机制引言肿瘤是世界范围内一大健康问题,对人类的生命造成了巨大威胁。
尽管现代医学取得了重大突破,但肿瘤的治疗仍然面临着困难和挑战。
其中一个主要问题就是抗肿瘤药物的治疗耐药性,即患者在接受抗肿瘤治疗后,药物对肿瘤细胞的有效杀伤作用降低或完全失效。
本文将深入探讨抗肿瘤药物的治疗耐药性机制。
一、遗传性耐药1.1 基因突变基因突变是导致抗肿瘤药物治疗耐药性形成的一个主要机制。
在患者接受化学治疗时,某些癌细胞中会发生基因突变,使得它们对特定抗癌药物失去敏感性。
比如,乳腺癌患者常见的HER2阳性转移癌,在使用赫赛汀进行靶向治疗时,可能会出现激酶结构域的突变,使得药物对HER2蛋白产生失去作用的影响。
1.2 基因放大除了基因突变外,肿瘤细胞中某些重要的抗癌基因也可能发生放大。
这种基因放大能够增加该基因表达,从而提供更多的靶点供抗肿瘤药物作用。
比如,HER2阳性乳腺癌患者往往存在HER2基因的放大现象,这意味着更多的受体可以与抗癌药物结合,从而导致治疗耐药性的发展。
1.3 药物转运通道异常在真核生物细胞中存在许多跨膜转运蛋白质,它们可以通过改变药物在细胞内外间的分布、代谢和泵出来调节抗肿瘤药物的有效浓度。
比如ABCB1 (MDR1/P-gp)是一种常见的跨膜转运蛋白,在肿瘤细胞内过度表达该蛋白后会导致许多结构不同、机制各异的化学类似物降低对该类药物的敏感性,最终导致耐药性的发展。
二、非遗传性耐药2.1 肿瘤微环境的改变除了遗传因素外,肿瘤微环境的改变也对抗肿瘤药物的治疗效果产生重要影响。
肿瘤微环境中存在许多细胞类型,包括肿瘤相关巨噬细胞、免疫细胞和血管内皮细胞等,在治疗过程中这些细胞可能分泌一系列因子与抗肿瘤药物相互作用并改变其药理学特性,从而减轻抗肿瘤药物对癌细胞的杀伤作用。
2.2 癌基因启动子甲基化癌基因启动子甲基化是一种表观遗传调控机制,它通过永久性关闭基因转录来参与肿瘤发生和进展。
在某些情况下,这种启动子甲基化可以影响到一些依赖于该基因转录产物敏感性而发挥作用的抗癌药物。

肿瘤患者化疗药物耐药性的机制与逆转策略一、引言癌症是一种严重威胁人类健康的疾病,而化疗是目前常用的治疗方法之一。
然而,肿瘤患者化疗药物耐药性的问题日益严重,给治疗带来了挑战。
因此,了解肿瘤患者化疗药物耐药性的机制,探讨逆转策略是当前亟待解决的问题。
二、肿瘤患者化疗药物耐药性的机制1. 细胞内膜通道的改变细胞内膜通道的改变是导致肿瘤患者化疗药物耐药性的一个重要机制。
化疗药物通常通过细胞膜通道进入细胞内,而当膜通道发生改变时,化疗药物的进入会受到影响,降低了药物的疗效。
2. 肿瘤干细胞的存在肿瘤干细胞是一类具有自我更新和分化潜能的细胞,它们具有高度的耐药性。
这些肿瘤干细胞可以在化疗过程中幸存下来,导致肿瘤的复发和转移。
3. 细胞凋亡途径的异常细胞凋亡是细胞自我调控的重要途径,而在肿瘤细胞中,由于凋亡途径的异常,导致了细胞对化疗药物的耐受性增加,降低了治疗效果。
4. 肿瘤细胞对药物的代谢途径肿瘤细胞也可以通过改变药物的代谢途径来增强对药物的耐受性,从而降低了药物的浓度和疗效。
5. 肿瘤微环境的影响肿瘤微环境是一种复杂的生态系统,其中包括肿瘤细胞、血管、免疫细胞等。
在肿瘤微环境中,存在着一些因子可以促进肿瘤细胞对化疗药物的耐受性,降低了治疗效果。
三、肿瘤患者化疗药物耐药性的逆转策略1. 结合化疗药物结合多种不同作用机制的化疗药物,可以减少肿瘤细胞对特定药物的耐受性,提高治疗效果。
2. 靶向治疗靶向治疗是一种精准的治疗方法,可以通过干扰肿瘤细胞的特定信号通路,恢复细胞的正常凋亡途径,提高治疗效果。
3. 增加药物浓度增加化疗药物在肿瘤细胞内的浓度,可以有效抑制肿瘤的生长和转移,提高治疗效果。
4. 联合免疫治疗联合免疫治疗可以激活免疫系统,增强机体对肿瘤细胞的杀伤作用,提高治疗效果。
5. 肿瘤相关基因的干预通过干预肿瘤相关基因的表达,可以影响肿瘤细胞的生长和代谢,降低其对化疗药物的耐药性,提高治疗效果。
四、结论肿瘤患者化疗药物耐药性的机制是多方面的,包括细胞内膜通道的改变、肿瘤干细胞的存在、细胞凋亡途径的异常等。




肿瘤免疫治疗的耐药机制前言自从2014年anti-PD-1单抗Opdivo和Keytruda被批准上市以来,肿瘤免疫治疗的热浪席卷全球,取得了空前的成功。
除Opdivo 和Keytruda外,还有anti-CTLA-4单抗Yervoy以及anti-PD-L1单抗Tecentriq获FDA批准上市。
这些免疫检查点抑制剂在黑色素瘤,非小细胞肺癌,肾细胞癌,霍奇金淋巴瘤,膀胱癌等多种癌症中表现出了令人欣喜的疗效,其中Keytruda还在2016年获批一线治疗PD-L1高表达(>50%)的非小细胞肺癌。
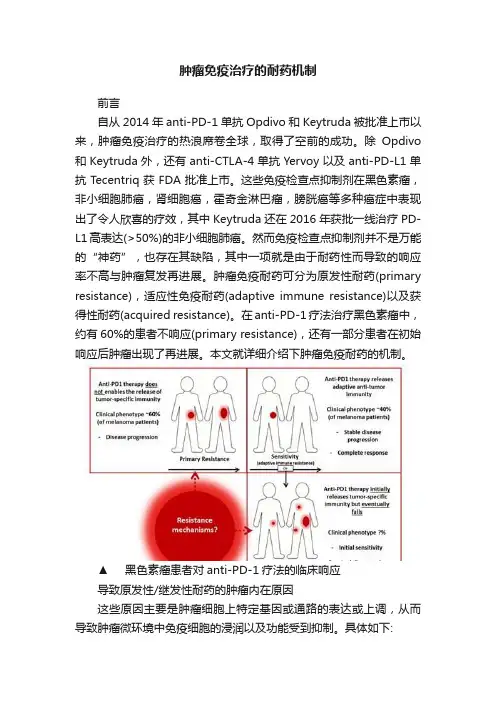
然而免疫检查点抑制剂并不是万能的“神药”,也存在其缺陷,其中一项就是由于耐药性而导致的响应率不高与肿瘤复发再进展。
肿瘤免疫耐药可分为原发性耐药(primary resistance),适应性免疫耐药(adaptive immune resistance)以及获得性耐药(acquired resistance)。
在anti-PD-1疗法治疗黑色素瘤中,约有60%的患者不响应(primary resistance),还有一部分患者在初始响应后肿瘤出现了再进展。
本文就详细介绍下肿瘤免疫耐药的机制。
▲黑色素瘤患者对anti-PD-1疗法的临床响应导致原发性/继发性耐药的肿瘤内在原因这些原因主要是肿瘤细胞上特定基因或通路的表达或上调,从而导致肿瘤微环境中免疫细胞的浸润以及功能受到抑制。
具体如下:▲导致免疫疗法耐药的肿瘤内在原因•MAPK通路的激活与或PTEN表达的缺失而引起的PI3K通路的增强。
癌基因信号通过MAPK通路导致VEGF与IL-8的产生,从而抑制T细胞的招募与功能。
此外,在多种肿瘤中,肿瘤抑制基因PTEN表达缺失从而PI3K通路增强,这与IFNγ,颗粒酶B的基因表达量降低以及肿瘤浸润CD8+ T细胞的数目减少是高度相关的。
•WNT/β-catenin信号通路的持续表达。
癌基因信号通过稳定β-catenin导致WNT信号通路持续激活,从而将T细胞排除在肿瘤之外。

like breast cancer[J].Breast Cancer Res Treat,2008,109(1):123-139.[17]张毅,王燕,李玉军,等.三阴性乳腺癌的临床病理学特点及其预后影响因素[J].临床肿瘤学杂志,2010,8(4):336-340. [18]Rakha EA,E1-Sayed ME,Green AR,et al.Pr ognostic mar ker intr iple-negative br east cancer[J].Ca ncer,2007,109(1):25-32. [19]Dent R,Trudeau M,Pritchard KI,et al.Triple negative breastcancer:clinical featur es and patterns of r ecurr ence[J].ClinCancer Res,2007,13(15Pt1):4429-4434.[20]Herr A,Gluz O,Ting E.Biological char acteristics in triple neg ativehigh r isk br east cancer and their clinca l implications[J].Pr oc AmS oc Clin Oncal,2006,24:20032.[21]Livasy C A,Kara ca G,Nanda R,et al.Phenoty pic evaluation of thebasal-like subty pe of invasive br east carcinoma[J].M od Pathol,2006,19(2):264-271.[22]Thike AA,C heok PY,J ar a-Lazaro AR,et al.Triple-negative br eastcancer.Clinicopa thologica l characteristics and rela tionship w ithbase-like breast cancer[J].M od Pathol,2010,23(1):123-133. [23]Yang WT,Dr yden M,Broglio K,et al.Mammographic featur es oftr iple receptor-negative pr imar y br east cancers in young pr emeno-pausal women[J].Br east Cancer Res Treat,2008,111(3):405-410.[24]Ko ES,Lee BH,Kim HA,et al.Tr iple-negative br east ca ncer:cor-r elation between imaging a nd pathological findings[J].Eur Ra-dial,2010,20(5):1111-1117.[25]王颖芳,李智贤,曾健,等.三阴性乳腺癌超声表现及临床、病理特征[J].中国医学影像技术,2011,27(1):87-90.[26]Uematsu T,Kasami M,Yuen S.Triple-nega tiv e breast cancer:cor-r elation between MR imaging and pathologic findings[J].Radiolo-gy,2009,250(3):638-647.[27]于泽平,李幼生,王少华,等.细针穿刺吸取细胞学检查对乳腺癌的诊断价值[J].医学研究生学报,2006,19(5):474-475.[28]李玉阳,洪凡真,王永胜,等.Mammotome在早期乳腺癌原发肿瘤诊断中的应用[J].中华肿瘤防治杂志,2007,9(5):706-708.[29]朱振新,顾军,于泽平.乳腺癌新辅助化疗的若干进展[J].医学研究生学报,2008,21(2):203-206.[30]Hoorntje LE,Schipper ME,Kaya A,et al.Tumour cell displace-ment after14G brea st biopsy[J].E ur J Surg Oncol,2004,30(5):520-525.[31]Knight R,Horiuchi K,Parker SH,et al.Risk of needle-track see-ding after dia gnostic image-guided cor e needle biopsy in breastcancer[J].J SLS,2002,6(3):207-209.[32]Tsuda H,Takarabe T,H asegawa F,et rge,centr al cellularzones indicating m yoepithelial tumor differ entiation in hig h-gr adeinvasive ductal carcinomas as markers of pr edisposition to lung andbra in metastases[J].Am J S ur g Pathol,2000,24(2):197-202. [33]Rodríguez Pinilla SM,S arr ióD,Honrado E,et al.Prognostic sig-nificance of basal-like phenotype and fascin expression in node-negative invasive breast carcinomas[J].lin Cancer Res,2006,12(5):1533-1539.[34]Liedtke C,M azouni C,Hess KR,et al.Response to neoadjuvantthera py and long-ter m survival in pa tients w ith tr iple-negativebreast cancer[J].J Clin Oncol,2008,26(8):1275-1281.[35]Smid M,Wang Y,Zhang Y,et al.Subtypes of breast cancer showprefer ential site of r elapse[J].Cancer Res,2008,68(9):3108-3114.[36]张建发,路长巨,李克田,等.全身骨显像对乳腺癌骨转移特点的探讨[J].黑龙江医药科学,2008,31(4):79-80.[37]Haffty BG,Yang Q,Reiss M,et al.Locoregional r elapse and distantmetastasis in conservatively managed triple negative early stagebreast cancer[J].J Clin Oncol,2006,24(36):5652-5657.收稿日期:2011-06-17 修回日期:2011-08-30肿瘤抗血管生成治疗耐药的分子机制进展陈赐慧△(综述),花宝金※(审校)(中国中医科学院广安门医院肿瘤科,北京100053)中图分类号:R73 文献标识码:A 文章编号:1006-2084(2011)21-3256-05摘要:血管生成在肿瘤的进展、侵袭和转移中扮演着重要的角色。
病理学中的肿瘤抗血管生成治疗肿瘤抗血管生成治疗是指利用某些物质阻止肿瘤血管生成或破坏已形成的肿瘤血管从而治疗肿瘤的一种治疗方法。
随着分子生物学、遗传学等生命科学的快速发展以及基础研究的深入,人们对肿瘤抗血管生成治疗的认识日益深入。
下面将从肿瘤血管生成的机制、肿瘤抗血管生成治疗的研究进展以及展望未来三个方面进行探讨。
一、肿瘤血管生成的机制
肿瘤血管生成是指新生血管从周围正常血管或者内皮细胞发生变异生成形成肿瘤血管,使肿瘤得以生长、侵袭和转移。
肿瘤血管生成过程中,尤其是金属蛋白酶介导的基质降解和内皮细胞的移行两个环节对血管生成最为关键。
二、肿瘤抗血管生成治疗的研究进展
目前肿瘤抗血管生成治疗是肿瘤治疗中研究最为活跃的领域之一,其临床应用前景十分广泛。
经过多年的研究,人们已经研发出众多抗血管生成药物并进行了许多相关的临床试验。
常用的抗血管生成药物有贝伐单抗、曲妥珠单抗、西妥昔单抗、阿维替康、依维莫司等等。
这些药物中的一些已经被美国FDA批准用于治疗一些肿瘤。
三、展望未来
肿瘤抗血管生成治疗目前仍存在许多问题,在其临床推广和应用上还有许多限制,其中最主要的是耐药性问题。
因此未来的研究需要进一步探究肿瘤血管生成的细胞及分子基础、深入探讨不同的治疗策略
和手段,开发更加高效的抗血管生成药物,并结合其他肿瘤治疗手段
以提高治疗效果。
总之,肿瘤抗血管生成治疗是一种广泛应用于肿瘤治疗的治疗手段,具有较大的临床推广潜力。
在未来的研究中,我们还需要不断深入研
究其机制,并不断探索新的治疗策略和药物以满足患者的需求。
肝癌的抗血管生成治疗和血管转移机制肝癌是一种高度恶性的肿瘤,它具有高发、高死亡率的特点,而肝癌的抗血管生成治疗和血管转移机制是当前研究的热点和难点之一。
本文将重点讨论肝癌抗血管生成治疗和血管转移机制,以便更好地理解和应对这一疾病。
一、肝癌的抗血管生成治疗机制1. 抑制血管生成因子肝癌的生长和转移过程中,血管生成因子起着重要作用。
因此,抑制血管生成因子可以有效地阻断肝癌的生长和转移。
目前,临床上常用的药物包括曲妥珠单抗、贝伐单抗等,它们能够有效地抑制血管生成因子的产生,从而达到治疗肝癌的效果。
2. 干扰血管生成的相关信号通路肝癌的血管生成依赖于多个信号通路的正常功能,因此,干扰这些信号通路可以有效地阻止肝癌的血管生成。
如通过抑制血管内皮生长因子受体、过氧化物酶和细胞周期蛋白等的活性,可以减弱肝癌细胞的血管生成能力,从而达到治疗目的。
二、肝癌的血管转移机制肝癌的血管转移是该疾病具有高度侵袭性的一个特点,它使得肝癌难以治愈和控制。
了解肝癌的血管转移机制对于寻找有效的治疗方法至关重要。
1. 血液中的肝癌细胞血液中存在的肝癌细胞是导致肝癌血管转移的重要原因之一。
肝癌细胞通过进入血液循环系统,逐渐到达远处的器官,形成新的肿瘤。
这种血行转移机制是肝癌远处转移的主要方式。
2. 淋巴系统的参与除了血行转移,肝癌的淋巴转移也是一个重要的转移途径。
肝癌细胞经由淋巴系统侵入到淋巴结和其他淋巴器官,导致远处的转移。
因此,阻断肝癌细胞的淋巴转移也是治疗的一个关键环节。
三、肝癌抗血管生成治疗和血管转移机制的研究进展随着科学技术的不断进步,关于肝癌抗血管生成治疗和血管转移机制的研究也取得了一些重要的进展。
例如,科学家发现了一些新的抗血管生成药物,具有更好的治疗效果,如酪蛋白激酶抑制剂和PI3K抑制剂等。
此外,一些新的分子标记物也被发现,可以用来预测肝癌血管生成和转移。
然而,肝癌的抗血管生成治疗和血管转移机制仍然存在许多未知的领域,需要进一步的研究和探索。
肿瘤血管生成的名词解释当今社会,肿瘤已成为危害人类健康和生命的重大疾病之一。
而肿瘤的快速生长和扩散,很大程度上依赖于血管供应。
肿瘤血管生成是一种复杂而关键的生物过程,它允许肿瘤细胞获取营养和氧气,并向周围伸展和扩散。
本文将对肿瘤血管生成进行名词解释,并探讨其在肿瘤治疗中的重要性。
一、肿瘤血管生成概述肿瘤血管生成,又称为血管新生或血管生成,是指在肿瘤发展过程中形成新的血管网络的过程。
肿瘤细胞通过释放一系列的信号分子来刺激附近的微血管内皮细胞、间质细胞和炎症细胞等,促进新血管的生成和生长。
肿瘤血管生成的成功将为肿瘤提供充足的营养和氧气,从而推动其快速生长和扩散。
二、肿瘤血管生成的机制肿瘤血管生成的过程主要包括血管内皮细胞迁移、增殖、管腔形成和血管稳定等多个阶段。
首先,肿瘤细胞通过释放血管生成诱导因子(例如血管内皮生长因子VEGF)来促进附近血管内皮细胞的迁移和增殖。
接着,这些内皮细胞将形成新的管腔结构,并融入到已有的血管网络中。
最后,细胞外基质和支持细胞将参与血管的增稳和成熟过程。
三、肿瘤血管生成的影响因素肿瘤血管生成受到多种影响因素的调控。
除了肿瘤本身释放的血管生成诱导因子外,炎症反应、缺氧环境、细胞外基质成分以及免疫细胞等都可能对血管生成过程产生影响。
此外,肿瘤的遗传背景和肿瘤微环境的特征也可能为血管生成提供有利条件。
四、肿瘤血管生成与肿瘤治疗肿瘤血管生成在肿瘤治疗中具有重要作用。
正常的血管系统为众多治疗手段(如放疗、化疗、免疫疗法)提供了有效的途径,但肿瘤血管生成的存在却限制了这些治疗效果。
肿瘤血管生成的抑制有助于减弱肿瘤的营养供应和氧气供应,从而抑制其生长和扩散。
因此,抗血管生成疗法成为近年来肿瘤治疗的热点领域之一。
五、抗血管生成疗法的发展针对肿瘤血管生成的抗血管生成疗法主要包括靶向血管生成诱导因子、阻断血管生成信号传导通路和抑制肿瘤血管生成细胞等多个策略。
抗血管生成疗法的研究与发展使得我们能够更好地理解肿瘤的血管生成机制,并为肿瘤治疗提供新的思路和方法。