总胆红素(TBIL) 钒酸盐氧化法
- 格式:doc
- 大小:42.00 KB
- 文档页数:4

钒酸盐氧化法和亚硝酸钠氧化法测定血清总胆红素的方法比较【摘要】目的:对钒酸盐氧化法和亚硝酸钠氧化法测定血清总胆红素进行方法比较。
方法:采用两种方法测定血清总胆红素值,进行比较,同时对两种方法的重复性试验、线性试验、干扰试验以及回收试验进行分析总结。
结果:两种方法有很好的相关性,钒酸盐氧化法和亚硝酸钠氧化法测定总胆红素(TB)批内变异系数分别为低值2.8%、2.0%,高值1.8%、1.3%;批间变异系数低值分别为2.8%、2.5%,高值分别为1.8%、1.4%;平均回收率分别为105%、102%;线性分别达到434.3 μmol/L、500.0 μmol/L;较轻微的溶血、脂浊、维生素C对两种方法测定TB无明显干扰。
结论:亚硝酸钠氧化法与钒酸盐氧化法相比具有较好的重复性和回收率,但对溶血、脂浊、维生素C的抗干扰能力不及钒酸盐氧化法。
【关键词】血清总胆红素;钒酸盐氧化法;亚硝酸钠氧化法1 材料与仪器1.1 试剂:钒酸盐氧化法TB(批号0106113)由四川迈克科技有限责任公司提供,亚硝酸钠氧化法TB(批号R113DGC)由上海蓝怡科技有限公司提供,胆红素标准TB浓度为157 μmol/L(批号R201HGC)由上海蓝怡公司提供。
脂肪乳注射液(C14~24)为华瑞制药有限公司生产,批号为051109001。
维生素C为西南药业有限公司生产,批号为060105002。
1.2 仪器:日立公司生产的H7060全自动生化仪,希森美康公司生产的SF-3000血细胞分析仪。
2 方法与结果2.1 两种方法测定参数:严格按照试剂说明书设定,采用两点终点法检测。
2.2 重复性实验:(1)批内重复性实验:取两份不同病人血清标本混合,分别用钒酸盐氧化法和亚硝酸钠氧化法测定TB,连续重复测定20次,计算变异系数(CV)。
(2)批间重复性实验:取两份不同病人血清标本混合,分装保存后分别用两种方法测定TB,1天测1次,连续测定20天,计算CV。
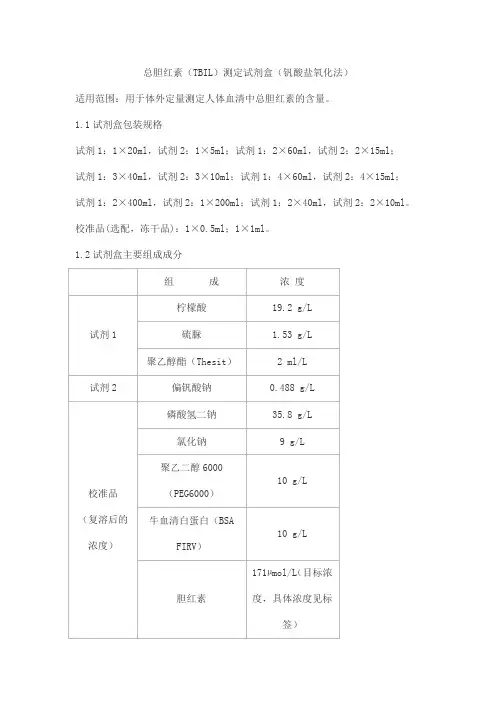
总胆红素(TBIL)测定试剂盒(钒酸盐氧化法)适用范围:用于体外定量测定人体血清中总胆红素的含量。
1.1试剂盒包装规格试剂1:1×20ml,试剂2:1×5ml;试剂1:2×60ml,试剂2:2×15ml;试剂1:3×40ml,试剂2:3×10ml;试剂1:4×60ml,试剂2:4×15ml;试剂1:2×400ml,试剂2:1×200ml;试剂1:2×40ml,试剂2:2×10ml。
校准品(选配,冻干品):1×0.5ml;1×1ml。
1.2试剂盒主要组成成分2.1 外观试剂1:无色澄清液体;试剂2:无色至浅黄绿色澄清液体。
校准品:冻干品,复溶后为黄色至黄褐色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、450 nm波长、1cm光径条件下,试剂空白吸光度应不大于0.05。
2.4 分析灵敏度测定浓度为100µmol/L样本时,吸光度变化值(ΔA)应在(0.1,0.3)范围内。
2.5 线性范围在(2.0,680)µmol/L线性范围内,线性相关系数r应不小于0.995。
在[150,680)µmol/L范围内的线性相对偏差应不大于±10%;在(2.0,150)µmol/L范围内的线性绝对偏差不大于±15µmol/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于6%。
2.8 准确度相对偏差:相对偏差应不超过±10%。
2.9瓶间差(均一性)校准品的瓶间变异系数(CV%)应不大于5%。
2.10含水量(冻干品)校准品的水分含量不大于8%。
2.11 校准品溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至NIST生产的有证参考物质(SRM 916)。


血清总胆红素测定标准操作规程1检验原理:(钒酸盐法)pH 值接近3时,在钒酸盐和表面活性剂的作用下,胆红素被氧化成胆绿素。
此时,胆红素特有的黄色减少,在波长450nm 处通过测定钒酸作用前后的吸光度的差可以求得样品中总胆红素的浓度。
胆红素−−−−−→−表面活性剂钒酸盐/胆绿素 2.试剂主要组成成分3.样本要求 新鲜无溶血血清、勿使用肝素抗凝血浆。
22~25℃保存8小时,2~8℃保48小时,-20℃保存7天,样本不可反复冻融!4.检验方法:仪器法(详见DF-603/DI-600标准操作规程)5.参考范围:6检验结果的解释6.1样本含量超出线性范围时,建议用0.9%(W/V )的氯化钠溶液稀释样本。
通常稀释2倍,当样本浓度较大时提高稀释倍数。
6.2单位换算:mg/dL=umol/L ×0.05857检验方法的局限性7.1结果的准确性依赖于仪器的校正和测定温度、时间的控制。
7.2若试剂浑浊或以水空白在450nm 处吸光度大于0.500时不能使用。
8.产品性能指标8.1线性范围:在给定的样本/试剂比例和条件下测定时,本世纪线性范围可达0-300umol/L 。
8.2试剂空白吸光度:在450nm 处,光径1cm 时,空白吸光度A ≤0.500,△A 空白/分钟≤0.002.8.3准确度:相对偏差≤10%。
8.4精密度8.4.1批内精密度CV≤3%8.4.2批间精密度:R≤10%8.5分析灵敏度:在给定的样本/试剂比例和条件下测定时,1umol/L的总胆红素对应的△A不低于1.5×3108.6干扰试验无明显干扰:添加干扰物后的测定值与初始测定值的相对偏差处于±10%以内。
8.7方法比较:本试剂盒与商品化试剂盒测定40个样本测定结果相关性如下:y=0.997x+1.051;r=0.997。
9.临床意义:胆红素是红细胞正常或非正常降解后在内皮系统形成的有机复合物,检测胆红素有利于监测肝脏疾病以及发现溶血性贫血以及评估黄疸的程度。

总胆红素测定试剂盒(钒酸盐氧化法)原则化操作规程1 目旳规范实验室操作,保证检查工作顺利有效进行特制定此规程。
2 授权操作人经培训且考核通过旳实验室检查人员。
3 合用范畴本试剂合用于体外定量检测人血清或血浆中旳总胆红素旳浓度。
4 检查措施本试剂盒采用钒酸盐氧化法测定总胆红素旳浓度。
5 检查原理pH值接近3时,在钒酸盐、加速剂和表面活性剂旳作用下,总胆红素被氧化成胆绿素,胆红素在450nm处旳特异性吸光度下降。
通过测定钒酸盐氧化前后吸光度旳变化,即可计算出样品中总胆红素旳含量。
6 检查标本规定6.1标本类型: 使用新鲜血清样本,不要使用溶血及乳糜血样本。
6.2原则运送:室温条件下运送。
7 试剂及配套品7.1试剂来源长春迪瑞医疗科技股份有限公司总胆红素试剂盒(钒酸盐氧化法)7.2试剂构成7.3试剂旳稳定性与贮存:7.3.1试剂在2˚C ~8˚C条件下,干燥、避光、密封贮存,有效期12个月。
7.3.2开封后在2~8℃可稳定30天。
8 实验仪器及性能指标8.1 实验仪器迪瑞CS系列全自动生化分析仪8.2试剂性能指标8.2.1试剂空白:试剂空白吸光度A≤0.0508.2.2分析敏捷度:测试1μmol/L被测物时,吸光度变化△A<-0.0002。
8.2.3线性范畴: 0~684.0μmol/L,线性有关系数r值≥0.9900;线性范畴在0~187.0μmol/L时,绝对偏差应不超过±28.05μmol/L;线性范畴在187.0~684.0μmol/L时,相对偏差应不超过±15%。
8.2.4精确度:相对偏差应在±10%。
8.2.5精密度:反复性:CV≤5.0%批间差: R≤6.0%9 校准9.1校准品来源长春迪瑞医疗科技股份有限公司生产旳临床化学校准血清9.2校准品旳构成:人血清9.4校准品使用注意事项9.4.1 若该复溶血清受细菌污染,将会减少许多成分旳稳定性。
9.4.2 不同批号旳校准血清不能交叉使用,由于批号于批号之间旳赋值不同。

总胆红素操作程序1.目的规范总胆红素(TBIL)检测试验,确保检测结果准确性和重复性。
2.范围本操作规程适用于生化室工作人员、实习人员、进修人员的操作前培训。
3.术语4.测定原理4.1测定方法:钒酸盐法4.2 测定原理:在特定条件下(PH3.0),血清中胆红素与钒酸反应,生成胆绿素,其在450nm 处吸光度的下降与血清中总胆红素含量成正比。
5.标本5.1标本种类:新鲜无溶血血清。
5.2标本采集见生化标本采集程序。
6.试剂6.1试剂来源:和光试剂。
6.1.1组成包装规格:R1 540ml×4 R2 135ml×46.1.2试剂准备试剂为液体双试剂,无需配制,开瓶即可使用。
6.1.3试剂稳定性原装试剂在2~8℃避光保存,稳定期12个月。
试剂开瓶载机2~8℃稳定30天。
新打开试剂不宜与已用过的试剂混合在一起,否则易造成试剂稳定性下降。
7.仪器参数设定AU2700参数设定:和光试剂仪器参数设置具体参见试剂厂家提供的相关仪器的检测参数。
8.校准8.校准:具体参见临床生化校准程序8.1 校准条件:8.1.1仪器光路系统经过光路保养或更换光源等重要部件后。
8.1.2仪器经过大保养后。
8.1.3挪动仪器的安装地点。
8.1.4更换试剂批号。
8.1.5室内质控失控。
8.2 AU2700和光试剂系统的校准:8.2.1 准备:和光配套胆红素校准物.8.2.2 保存和稳定性:原校准品在2~8℃保存至有效期,1ml蒸馏水复溶,复溶后在2~8℃可保存7天。
8.2.3保存位置:低温冰箱-20℃。
8.2.4操作步骤:蓝色样本架的1号位置放蒸馏水;黄色样本架的9号位置放和光配套胆红素定标液→仪器主画面[USER] →[Calibration] →[选择校准项目]→[START]→[YES]。
9.室内质控及失控纠正:见临床生化室内质控程序9.1质控物来源:柏乐液体质控(批号:45612/45613)。
9.2质控物储存条件及准备:-15~-20℃保存至有效期,从低温冰箱取出后室温平衡30分钟。

血清总胆红素测定标准操作规程1.检测目的用于定量测定人体血清或血浆中总胆红素的含量2.检测原理钒酸氧化法:在PH3.0左右的缓冲液中,钒酸钠氧化总胆红素为胆绿素,使反应液的黄色减少。
测定胆红素氧化前后吸光度的差,可以计算出样品中总胆红素的浓度。
3.适用范围血清,或用肝素抗凝的血浆4.试剂及仪器1.试剂品:迈瑞公司生产的TBiL试剂盒,各组分如下:2.校准品由迈瑞公司提供的校准液,在更换试剂批号或出现质控漂移;仪器进行保养;仪器重要零件更换后进行校准。
3.仪器迈瑞BS-800型号仪器5.操作装载试剂—→进行校准—→进行质控—→输入标本检测项目—→加载标本—→标本测定—→结果复核—→报告6.注意事项1. 不能测试严重溶血、脂浊、黄疸的标本, 血浆标本可用肝素抗凝,待测样品室温不超过24小时,可于2℃-8℃保存72小时,胸腹水经抗凝取上清液。
2. 不能使用过期的试剂,2℃-8℃保存。
3. 定标液应冰冻保存。
7. 结果计算 c =ΧC O式中:c ——测定总胆红素浓度,umol/L ;A 测定——标本管吸光度;A 标准——标准管吸光度;C O ——校准血清总胆红素浓度,umol/L ;8. 操作性能1 精密度:批内CV ≤ 5.0%,批间CV ≤ 6.0%。
2 准确度:以参考方法定值的血清作为校准品时,本法测定结果与参考方法基本一致。
3 线性范围:2~684 umol/L9. 参考值5.1~19 umol /L(0.3~1.1mg/dL)10. 临床意义胆红素是老化的血红细胞中血红蛋白的代谢产物,血液中总胆红素和直接胆红素的含量测定有利于肝病和黄疸疾病的诊断。
总胆红素增高主要见于各类黄疸肝炎,胆道堵塞,新生儿黄疸。
总胆红素减低见于孕妇,部分冠心病。
11.安全防护A 测定A 标准1.对任何一份标本(包括质控品、标准品及检测试剂等)都应视其为具有传染性,操作人员在工作时应戴乳胶手套、穿工作服。
2.一旦发生标本容器划破手或身体、液体溅进眼睛等粘膜处,应立即用大量的水冲洗,同时向上级医师或科领导报告,必要时施以丙种球蛋白预防。

总胆红素(钒酸盐氧化法)试剂盒标准操作程序1.摘要本试剂盒供医疗机构用于体外定量测定人血清样本中总接胆红素的含量。
2.适用范围程序适用于AU5811自动生化分析仪检测血清样本中总接胆红素的含量。
3.职责使用AU5811自动生化分析仪进行测定总接胆红素浓度的工作人员要严格按照本SOP程序进行,室负责人监督管理;本SOP的改动,可由任一使用本SOP的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4.检测方法上海科华生物工程股份有限公司生产的总接胆红素(钒酸盐氧化法)试剂盒采用的是钒酸盐氧化法。
5.原理pH3.0左右,在起加速剂作用的表面活性剂的条件下,能够增进未结合胆红素的溶解度,样本中的总胆红素被钒酸盐氧化成胆绿素。
与此同时,胆红素特有的黄色也随之消失。
所以通过测定胆红素氧化前后吸光度的变化,就可以计算出样本中的总胆红素的浓度。
−−→胆红素钒酸盐−胆绿素6.仪器AU5811自动生化分析仪7.试剂7.1试剂来源:上海科华生物工程股份有限公司提供7.2试剂瓶内主要成分:R1:枸橼酸盐缓冲液(pH2.6)、表面活性剂;R2:磷酸盐缓冲液、偏钒酸盐7.3试剂稳定性:试剂于2℃-8℃避光保存,有效期为一年8.标准品和质量控制8.1校准程序:使用科华公司的校准品对自动分析仪进行校准。
按照公司标准品使用要求,并以9g/L氯化钠溶液或去离子水为空白,经校准测定,仪器自动对标准品通过合适的数学模型绘制校准曲线。
8.2质控品:罗氏公司提供的生化复合定值质控血清作为室内质控品。
每日在测定前做一次质控加试剂后做一次质控。
该质控品为干粉包装,在2-8℃冰箱可稳定到失效期,使用前用5ml去离子水复溶,待质控物充分溶解(大约30分钟)后使用。
8.3质控数据管理:按程序对检验后的质控后结果进行转换,及时质控数据进行分析处理,如出现失控值,应及时分析失控原因,并填写好相关失控记录。
8.4质控判断规则:按《Westgard多规则质控方法测定标准操作程序》8.5室间质评:分别参加河北省室间质评,对回报的室间质评结果按《室间质量评价程序》进行处理。

肝素抗凝血浆对钒酸盐氧化法测定总胆红素的影响背景介绍总胆红素是新生儿黄疸的主要成分,也是肝功能异常的重要指标。
因此,测定总胆红素的方法非常重要。
而钒酸盐氧化法是常用的测定总胆红素含量的方法之一。
但是,血浆中含有肝素等抗凝物质,这些物质会对测定总胆红素的结果产生一定的影响。
实验目的本次实验的主要目的是探究肝素抗凝血浆对钒酸盐氧化法测定总胆红素的影响,以及分析不同肝素抗凝血浆对总胆红素测定的影响程度。
实验原理钒酸盐氧化法是通过氧化反应的方法测定总胆红素的含量,具体实验原理如下:将待测样品加入氢氧化钠、钒酸钠和双氧水的混合液中,在弱酸性条件下加热反应。
反应后,用双氯酚酞作为指示剂,再用分光光度计测定其吸光度,计算出总胆红素的含量。
肝素抗凝血浆是含有肝素等抗凝成分的血浆,在某些实验中常用于抑制血液凝固。
肝素抗凝血浆中含有的肝素等物质会和钒酸盐氧化法的试剂发生反应,从而影响测定总胆红素的结果。
实验步骤1.准备实验所需的试剂和装置,主要包括氢氧化钠、钒酸钠、双氧水、双氯酚酞等试剂,以及分光光度计等仪器。
2.取适量的肝素抗凝血浆样品,经过离心分离血细胞后,将上清液用氨基甲酸钠处理,加入适量的钒酸钠、双氧水等试剂,在弱酸性条件下进行反应。
3.加入适量的双氯酚酞指示剂,测定反应液的吸光度,计算出总胆红素的含量。
4.重复以上步骤,分别对不同浓度的肝素抗凝血浆样品进行测定,并比较不同浓度肝素抗凝血浆对总胆红素含量测定的影响。
结果分析1.测定各浓度肝素抗凝血浆对总胆红素含量的影响,绘制相应的浓度-吸光度曲线。
2.分析不同浓度肝素抗凝血浆在测定总胆红素时的影响程度,比较其对测定结果的影响作用。
3.通过对比不同浓度肝素抗凝血浆的影响程度,得出抗凝物质浓度增加与总胆红素含量测定值的降低呈线性负相关的结论。
结论肝素抗凝血浆含有肝素等抗凝成分,在钒酸盐氧化法测定总胆红素时,会对测定结果产生一定的影响,表现为测定值的降低。
此影响程度与血浆中抗凝物质的浓度呈线性负相关。

总胆红素测定试剂盒(钒酸盐氧化法)适用范围:本产品用于体外定量测定人血清中总胆红素的含量。
本产品用于体外定量测定人血清中总胆红素的含量。
1.1 规格具体产品规格见下表:1.2组成成分试剂1:柠檬酸缓冲液(pH2.6) 100mmol/L试剂2:磷酸缓冲液(pH7.0) 10mmol/L偏钒酸钠 4mmol/L 2.1 外观2.1.1 外包装完整无破损;2.1.2 试剂1:无色澄清透明液体;2.1.3 试剂2:无色或淡黄色澄清透明液体。
2.2 净含量净含量不低于标示值。
2.3 试剂空白吸光度在主波长450nm、副波长546nm、37℃条件下,试剂空白吸光度不大于0.050。
2.4 线性2.4.1 线性范围[5.0,680.0]μmol/L线性范围内,相关系数r>0.990。
2.4.2 线性偏差(50.0,680.0]μmol/L线性范围内,相对偏差不超过±10%。
[5.0,50.0]μmol/L线性范围内,绝对偏差不超过±10.0μmol/L。
2.5 分析灵敏度检测浓度为221.0μmol/L的样本时,吸光度变化不小于0.01。
2.6 重复性测试不同浓度的样本或质控品,重复测试至少10次,CV不大于5%。
2.7 批间差用三个不同批号的试剂测试同一样本,重复测试3次,相对极差R不大于10%。
2.8 准确度测定360033标准物质水平2,测定结果应不超过标示值的±10%。
2.9 稳定性原包装试剂2~8℃避光储存,有效期12个月。
效期后1个月内产品,应符合2.1、2.3、2.4、2.5、2.6和2.8的要求。

钒酸盐氧化法测定血清胆红素的分析评判【摘要】目的:对测定胆红素的钒酸盐氧化法进行分析评判。
方式:用钒酸盐氧化法测定胆红素,并对其的周密度、稳固性、灵敏度及干扰因素进行分析。
结果:钒酸盐氧化法测定胆红素的批内、批间CV<%,可信检测范围可达:钒酸盐总胆红素(TBil)684 μmol/L,直接胆红素(DBil)342 μmol/L,回收率达到%~%。
用1∶8肝素抗凝,测定直接胆红素明显降低,P<;1∶10肝素抗凝,测定直接胆红素,有轻度的负干扰。
维生素C≤ g/L时,无干扰,而溶血及脂质对钒酸盐氧化法干扰小。
结论:钒酸盐氧化法应用方便,重复性好,灵敏度高,抗干扰性强。
【关键词】胆红素;钒酸盐氧化法;肝素抗凝1993年日本学者Tokuda发表了血清胆红素的钒酸盐氧化测定法。
随着商品化钒酸盐胆红素氧化法试剂的推行,目前国内用户众多[1]。
本文对其周密度、稳固性、灵敏度及干扰因素进行评判和分析。
1 材料和方式试剂和仪器试剂钒酸盐总胆红素(TBil)试剂盒、直接胆红素(DBil)试剂盒由东瓯生物工程提供,临床用20%英脱利匹特脂肪乳由华瑞制药提供,维生素C由湖北中天爱白药业提供,12 500 U/2 ml肝素注射液由天津市生物化学制药厂提供。
血红蛋白液的制备:取1份约3 ml 肝素钠抗凝血,反复加入生理盐水洗涤,最后加入蒸馏水离心取上清液,用KX21N血细胞分析仪测Hb为100 g/L。
仪器日立7060全自动生化分析仪,Sysmex KX21N血细胞分析仪。
统计学处置计量资料数据以±s表示,采纳配对t查验。
P<具有统计学意义,利用SPSS 软件进行统计分析。
测定原理在pH 3周围,表面活性剂和钒酸作用于血清TBil,使之氧化成胆绿素,使胆红素所特有的黄色减少,由此测定钒酸作用前后450 nm吸光度的转变求出血清中TBil的浓度。
在pH 3周围,当试剂中缺少表面活性剂时,钒酸只与血清中结合胆红素作用,使之氧化成胆绿素,现在测定450 nm吸光度下降值求出血清中DBil 的浓度。
项目总胆红素(TBIL)方法钒酸盐氧化法目录1. 检测原理2. 标本采集与处理2.1 受检者的准备2.2 静脉采血2.3 抗凝剂2.4 标本处理3. 试剂3.1 试剂3.2 校准血清3.3 试剂与校准血清的稳定性4. 仪器5. 操作6. 计算7. 操作性能7.1 精密度7.2 准确度7.3 灵敏度7.4 可报告范围7.5 特异性7.6 干扰8. 参考值9. 临床意义附录A: 参数1. 检测原理钒酸盐测定钒酸盐作用前后吸光度差异,可求得样品中的直接胆红素的浓度。
胆红素————胆绿素pH 3.02. 标本采集与处理2.1 受检者的准备:病人空腹12h,不饮酒24h后采集血样。
体检对象抽血前应有两周的的正常状况记录。
注意有无应用影响测试项目的药物。
此外,对于体检者,采血的季节都应做相关记录,因为样本中各项目的含量有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24小时内不做剧烈运动。
2.2 静脉采血:除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带。
2.3 抗凝剂:血浆多主张用EDTANa2(1mg/mL)抗凝。
2.4 标本处理:血标本室温放置30min~45min后离心分离血清或血浆,在两小时内检测完毕;如两小时内不能检测完毕,将离心分离血清或血浆置洁净试管加盖2-8℃保存。
3.试剂3.1 试剂:本科使用湖南永和阳光科技有限责任公司TBIL试剂盒,为液体双试剂,各组分如下:组成浓度R1:柠檬酸缓冲液100mM反应促进剂表面活性剂R2:磷酸缓冲液10mM偏钒酸钠3.2 校准血清:使用湖南永和阳光科技有限责任公司提供的40项校准血清。
校准频次:空白定标:每日需做试剂空白定标。
全点定标:试剂换批号使用时或质控结果超过规定的2SD范围,需要全点定标。
钒酸盐法检测总胆红素(TBIL)干扰1例胆红素测定应用最广泛的化学测定方法是根据Ehrlich在1883年建立的重氮反应方法,但其影响因素多,尤其溶血、脂血对其影响更大,且需在使用时临时配制试剂,比较麻烦[1]。
氧化酶法受溶血影响较大,而钒酸盐法弥补了这些缺点,它具有抗溶血、抗黄疸、抗脂血等优点,能够测定总胆红素(TBIL)和直接胆红素(DBIL);同时该试剂具有良好的稳定性,试剂开瓶稳定性极佳,试剂可室温储藏。
自1993年日本学者Tokuda发表了血清胆红素的钒酸氧化测定方法后,国内众多的文献报道均认为该方法与传统方法(改良J-G法)具有良好的相关性,线性、特异性达到较理想的水平。
最近,笔者在工作中发现一起由于球蛋白异常增高而引起的TBIL(试剂为上海复星长征)检测结果异常,现报告分析如下,以供同行参考。
病例简介:患者女,68岁,以多发性骨髓瘤、肾结石并积水收入我院外骨科住院。
于第二天取空腹静脉血做肝功、肾功、血脂、血糖和电解质检测,最近几天无特殊用药。
静脉血经3000r/min离心后血清呈淡黄色,按操作规程要求在BECKMA COULTER UniCeL DXC 800全自动生化分析仪上进行检测,发现TBIL检测结果异常,结果是380.5umol,与血清颜色严重不符。
为排除检测结果可能存在干扰,采用重氮法在同一仪器重新复检,结果为21.5umol、说明TBIL在检测过程中出现了干扰,导致结果增高。
为观测本例标本在用钒酸盐法检测胆红素的过程中是否存在干扰,在36±1℃的水浴箱内模拟BECKMA COULTER UniCeL DXC 800全自动生化分析仪比色杯内反应过程:取洁净玻璃试管两只,分别加入TBIL试剂R1800uL预温一分钟,时间到加入待检血浆28uL混匀,孵育4分30秒,加入R2400uL混匀,反应液在读数时间内出现乳状混浊,且混浊随着时间延长颗粒变粗。
用其他血浆重复上述步骤,在读数时间内反应液未出现混浊,证明在检测过程中出现干扰,导致检测结果假性增高。
科学研究创新血清总胆红素重氮盐法和钒酸盐氧化法测定方法的比较郭晶晶孟超刘茜(江苏省医疗器械检验所江苏南京210019)摘要:胆红素是血红蛋白的代谢产物,主要涉及肝脏代谢,血清胆红素水平是肝胆疾病的重要诊断指标。
体内的胆红素包括直接胆红素、间接胆红素,二者之和称为总胆红素,临床对胆红素的生化检测有多种方法。
本文使用重氮盐法和钒酸盐法对血清总胆红素进行测定,比较两种方法检测结果的差异。
实验结果发现,两种方法的重复性和准确度均能满足临床要求,钒酸盐法的准确度高于重氮盐法。
关键词:胆红素代谢胆红素测定方法重氮盐法钒酸盐法方法比较中图分类号:R446.1文献标识码:A文章编号:1674-098X(2022)02(a)-0004-03肝脏是人体最大的实质性器官,具有复杂而重要的生理功能,参与代谢是肝脏最主要的功能。
肝脏参与三大营养物质的代谢过程:肝脏可以合成蛋白质,亦可以分解蛋白质。
人体有超过40%的蛋白质是在肝脏合成的,血浆白蛋白则完全由肝脏合成。
肝脏细胞含有蛋白质脱氨酶和转氨酶,从而分解蛋白质,氨进一步转变成尿素排泄。
人体摄入的糖类在肝脏转变为葡萄糖,当血糖浓度升高时,血糖可转变成葡萄糖聚合物以糖原的形式贮存于肝脏;当血糖浓度降低时,肝糖原可以迅速分解成葡萄糖,向人体供能,从而保持血糖的稳定。
当人体摄入的糖类物质较少时,肝脏可以将氨基酸、丙酮酸等非糖类物质转变成肝糖原,以满足机体对葡萄糖的消耗。
肝脏可以合成胆固醇,胆固醇转变成胆汁酸盐,胆汁酸盐使脂肪乳化成微粒,脂肪微粒可被身体吸收。
脂类物质可直接与肝脏中的蛋白质结合成脂蛋白。
肝脏参与维生素的代谢。
一些脂溶性维生素可长期大量储存于肝脏中,如维生素A、维生素D、维生素B12的储存量可满足几个月甚至是一两年的使用。
肝脏中可形成有多种凝血因子,如凝血因子I,同时,肝脏可形成抗凝血因子,如肝素。
由于肝脏的体积大,可以贮存的血量多,因此肝脏也是主要的贮血器官[1]。
总胆红素(TBIL)测定试剂盒(钒酸盐氧化法)适用范围:本产品用于体外定量测定人血清中总胆红素的含量。
1.1 规格试剂1(R1):5×60mL,试剂2(R2):5×15mL;试剂1(R1):4×80mL,试剂2(R2):4×20mL;试剂1(R1):3×40mL,试剂2(R2):3×10mL;试剂1(R1):2×80mL,试剂2(R2):2×20mL;试剂1(R1):2×400mL,试剂2(R2):2×100mL;试剂1(R1):1×20mL,试剂2(R2):1×6mL。
1.2 试剂组成表1 试剂组成2.1 外观液体双试剂:R1为无色澄清液体,R2为浅黄绿色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度在37℃、450 nm波长、1cm光径条件下,试剂空白吸光度应≤0.05 ABS。
2.4 分析灵敏度浓度为100µmol/L时,吸光度变化范围在(0.05-0.2)之间。
2.5 线性范围在[1-680]µmol/L线性范围内,线性相关系数r≥0.995。
在(150–680]µmol/L 范围内的相对偏差≤10%;测定结果[1-150]µmol/L时绝对偏差≤15µmol/L。
2.6 精密度试剂盒测试项目精密度CV≤5%。
2.7 批间差不同批号之间测定结果的相对偏差应< 6%。
2.8 准确度相对偏差:用参考物质配制一定浓度的溶液作为样本进行检测,其测量结果在(101–340)µmol/L范围内的相对偏差≤10%;在(0-100)µmol/L范围内的绝对偏差≤10µmol/L。
2.9 稳定性原包装试剂,在(2-8)℃下有效期为18个月,取失效期的试剂盒检测其外观、空白吸光度、分析灵敏度、线性范围、精密度和准确度试验结果满足2.1、2.3、2.4、2.5、2.6、2.8的要求。
胆红素检测原理钒酸盐氧化法
胆红素是一种重要的生化指标,用于评估肝脏功能和溶血性疾病。
胆红素的检测原理有多种方法,其中钒酸盐氧化法是一种常用
的方法。
钒酸盐氧化法是一种通过氧化反应来检测胆红素含量的方法。
在这个方法中,胆红素与钒酸盐在酸性条件下发生氧化反应,生成
绿色的氧化产物。
这种氧化产物的浓度与胆红素的含量成正比,因
此可以通过测量氧化产物的浓度来间接测定胆红素的含量。
具体来说,钒酸盐氧化法的步骤包括,首先将待测样品与酸性
溶液混合,然后加入钒酸盐溶液。
在酸性条件下,胆红素与钒酸盐
发生氧化反应,生成绿色的氧化产物。
接下来,可以使用分光光度
计等仪器测量氧化产物的吸光度,通过标准曲线来计算胆红素的含量。
钒酸盐氧化法作为一种简便、快速、准确的胆红素检测方法,
被广泛应用于临床实验室和医学研究中。
它不仅可以用于检测肝功
能和溶血性疾病,还可以用于监测黄疸患者的疾病进展和治疗效果。
总的来说,钒酸盐氧化法作为一种胆红素检测原理,为临床诊断和治疗提供了重要的技术支持,为医学研究和临床实践带来了便利和可靠性。
总胆红素测定试剂盒(钒酸盐氧化法)1范围本标准规定了总胆红素测定试剂盒的定义、产品分类、方法原理、要求、检验规则、试验方法、标志、标签、使用说明书、包装、运输和贮存等要求。
本标准适用于由生物化学方法制备的总胆红素测定试剂盒(钒酸盐氧化法)(以下简称试剂盒)质量检定。
本试剂盒用于体外定量检测人血清中总胆红素(TBIL)的含量。
适用于日立7600、雅培C16000、东芝(FR-120/FR-2000)、AU(480/5800)、迈瑞420、西门子2400、贝克曼DXC800全自动生化分析仪器。
2规范性引用文件下列文件中的条款通过本标准的引用而构成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误表的内容)或修改版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
WS/T 124—1999 临床化学体外诊断试剂盒质量检验总则医疗器械产品技术要求编写指导原则3定义本标准采用下列定义:3.1线性范围:是指化学反应中最低检出量与最高测定量之间的范围。
3.2单包装试剂:双试剂单包装由单瓶试剂1(R1)、试剂2(R2)组成。
3.3试剂空白吸光度:是指用蒸馏水调零的空白试剂吸光度。
3.4试剂空白变化率:是指用蒸馏水调零的空白试剂的吸光度在一定时间内的变化。
3.5分析灵敏度:校准曲线的斜率。
3.6批内精密度:是指对同一样品用同一单包装试剂、同一方法在同样条件下多次重复测试,所得各次结果与均值之间的符合程度。
3.7批间精密度:是指用同一份样品,用不同批试剂盒在同样条件进行测试,所得各次结果与均值之间的符合程度。
3.8准确度:是指测试值与理论值(靶值)之间的符合程度。
3.9稳定性:是指试剂盒在规定的贮存条件下、规定的有效期内的质量稳定程度。
4产品分类液体双试剂,由试剂1(R1)、试剂2(R2)组成,其产品规格按用户机型需要而定,具体如下:5方法原理5.1检测原理样本中的总胆红素易被氧化成胆绿素,而一定缓冲体系中间接胆红素不被氧化,通过测 450nm 反应吸光度下降值可求出样本中总胆红素的含量。
目录
1. 检测原理
2. 标本采集与处理
2.1 受检者的准备
2.2 静脉采血
2.3 抗凝剂
2.4 标本处理
3. 试剂
3.1 试剂
3.2 校准血清
3.3 试剂与校准血清的稳定性
4. 仪器
5. 操作
6. 计算
7. 操作性能
7.1 精密度
7.2 准确度
7.3 灵敏度
7.4 可报告范围
7.5 特异性
7.6 干扰
8. 参考值
9. 临床意义
附录A: 参数
1. 检测原理
钒酸盐测定钒酸盐作用前后吸光度差异,可求得样品中的直接胆红素的浓度。
胆红素————胆绿素
pH 3.0
2. 标本采集与处理
2.1 受检者的准备:
病人空腹12h,不饮酒24h后采集血样。
体检对象抽血前应有两周的的正常状况记录。
注意有无应用影响测试项目的药物。
此外,对于体检者,采血的季节都应做相关记录,因为样本中各项目的含量有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24小时内不做剧烈运动。
2.2 静脉采血:
除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带。
2.3 抗凝剂:
血浆多主张用EDTANa2(1mg/mL)抗凝。
2.4 标本处理:
血标本室温放置30min~45min后离心分离血清或血浆,在两小时内检测完毕;如两小时内不能检测完毕,将离心分离血清或血浆置洁净试管加盖2-8℃保存。
3.试剂
3.1 试剂:
本科使用湖南永和阳光科技有限责任公司TBIL试剂盒,为液体双试剂,各组分如下:
3.2 校准血清:
使用湖南永和阳光科技有限责任公司提供的40项校准血清。
校准频次:
空白定标:每日需做试剂空白定标。
全点定标:试剂换批号使用时或质控结果超过规定的2SD范围,需要全点定标。
3.3 试剂与校准血清的稳定性:
原包装试剂储存在2-8℃至标签所示失效日期。
试剂开瓶后,在仪器中至少可保存30天。
试剂储存在18-22℃稳定28天,试剂应避免污染。
试剂R1、R2颜色为无色,当试剂变色,按照试剂失效处理。
多项校准血清在2-8℃储存至标签所示失效日期,复溶后-20℃保存,可稳定一个月,只可冻融一次,避免反复冻融。
参见校准血清说明书。
4.仪器
KONELAB 30型号仪器。
性能:波长450nm,仪器测定吸光度的灵敏度应达到0.001ABS以上。
5.操作
样品为血清或肝素/EDTA抗凝血浆。
本法为终点法。
参数见后附,附录A。
试剂参数设置、定标操作以及样本检测常规操作,见仪器操作规程。
6.计算
ΔA测定
C = ————×C0
ΔA标准
式中:c——测定总胆红素浓度,μmol/L;
ΔA测定——标本管吸光度;
ΔA标准——标准管吸光度;
C O——校准血清中总胆红素浓度,μmol/L;
7.操作性能
7.1 精密度:
批内CV< 0.67%,批间CV<2.97%。
7.2 准确度:
检测结果的相对不准确度≤±10%。
7.3 灵敏度:
总胆红素浓度为:90μmol/L时,显色吸光度A450nm为0.272~0.332。
7.4 可报告范围:
血清与试剂用量之比为1:25时,测定上限为680μmol /L。
7.5 特异性:
测量值在给定值的90%-110%范围内。
7.6 干扰:
内源性干扰物溶血、脂血、黄疸对测试结果无明显影响。
8.参考值
2.0~20.4μmol /L。
9.临床意义
胆红素是老化的血红细胞中血红蛋白的代谢产物,血液中总胆红素和直接胆红素的含量测定有利于肝病和黄疸病的诊断。
附录A: 参数。