溶出度分析的方法验证31页PPT
- 格式:ppt
- 大小:4.71 MB
- 文档页数:31







溶出度检查方法及进展定义:指药物在规定介质中,在一定条件下从片剂或胶囊等固体制剂中溶出的速度和程度。
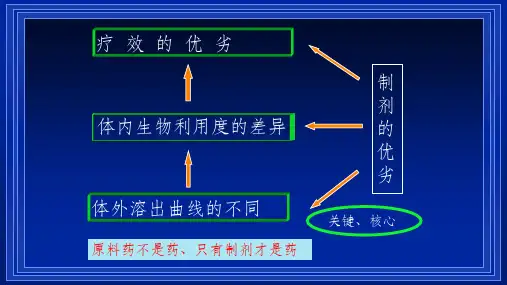
药物溶出度直接影响药物在体内的吸收和利用,是评价药物质量的一个重要内在指标,也是评价制剂品质和工艺水平的一种有效手段,还是评价制剂活性成分生物利用度和制剂均匀度的一种有效标准,能有效区分同一种药物生物利用度的差异,因此是制药工业质量控制必检项目之一。
从理论上讲,药物的体内试验(包括体内药物动力学的研究和临床试验) 才是评价药物最根本和最可靠的依据。
20 世纪80 年代以来,生物利用度成为衡量药品质量的一个重要参数,但生物利用度实验工作量大、成本高,从药物生产的实际情况来看,不可能对每一个药物样品都采用体内实验来筛选评定。
药物溶出度检查是一种模拟口服固体制剂在胃肠中溶出过程的体外实验法。
尽管体内检验和体外检验结果不会完全一致,但具有一定相关性,而且溶出度的体外检验较体内检验简单易行,仍不失为一个经济有效的质量检测、控制手段。
药物制剂发展制剂可分为四代,第一代为一般制剂或常规制剂,在崩解度试验水平,第二代一般为长效缓慢制剂或肠溶制剂,在溶出度试验水平,第三代为精密的控释制剂,药物输送系统,透皮吸收治疗系统,第四代为靶向制剂。
近年来,药物制剂研究向着“三效”(高效、速效、长效)和“三小”(毒性、副作用、剂量)方向发展。
国外药典从70年代就相继收载了溶出检查法,我国在1985年版药典中正式收载了溶出度检查,这些年来,各国药典收载溶出度检查的品种呈上升趋势。
2010年版药典加大了对药物溶出度的检查。
这也本身是对药品质量标准的提高。
也是多数人写论文的一个不错的方向。
溶出度在药品生产检验、临床疗效考察、药品稳定性检验、新药研制、处方筛选、工艺改进等许多方面都要作为考察指标。
在美国、英国、日本,溶出度检查实际是指药物固体制剂按照各国药典规定的方法,在一定时间内从固体制剂溶入介质的累计百分率(以被测试剂标示量计算) 。