安徽高中化学竞赛-结构化学 第九章 离子化合物的结构化学习题
- 格式:doc
- 大小:16.00 KB
- 文档页数:1

天行健,君子以自强不息;地势坤,君子以厚德载物高二化学竞赛试题本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
满分100分。
考试时间90分钟。
可能用到的相对原子质量:H~1 O~16 C~12 N~14 P~31 Na~23 N~14 Si~28第Ⅰ卷(选择题共50分)一、选择题(每小题1分,共10分。
下列每小题所给选项只有一项符合题意)1、下列叙述正确的是()A.分子晶体中的每个分子内一定含有极性共价键B.原子晶体中的相邻原子间只存在非极性共价键C.含有阴离子的化合物一定含有阳离子D.金属晶体的熔点和沸点都很高2、下列各选项所述的两个量,前者一定大于后者的是()①Al原子和N原子的未成对电子数;②Ag+、Cu2+与NH3形成配合物时的配位数;③Al的金属性和Mg的金属性;④F元素和O元素的电负性;⑤N和O元素的第一电离能;⑥H 原子和H+离子的半径A.①④⑤B.②④⑥C.④⑤⑥D.③⑤⑥3、下列事实与氢键有关的是()A.水加热到很高的温度都难以分解B.水结成冰体积膨胀C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高D.HF、HCl、HBr、HI的热稳定性依次减弱4、某元素的电离能(单位:电子伏特)如下表,此元素位于元素周期表的族数是()I1 I2 I3 I4 I5 I6 I714.5 29.6 47.4 77.5 97.9 551.9 666.8A. ⅢAB.ⅣAC.ⅥAD.ⅤA5、下列说法中正确的是()①所有基态原子的核外电子排布都遵循构造原理②同一周期从左到右,元素的第一电离能、电负性都是越来越大③金属键、共价键和氢键都具有相同的特征:方向性和饱和性④所有的配合物都存在配位键,所有含配位键的化合物都是配合物⑤所有含极性键的分子都是极性分子⑥所有金属晶体中都含有金属键⑦所有的金属晶体熔点肯定高于分子晶体A.③⑥⑦B.⑥C.③④⑤D.①②⑥⑦6、有下列离子晶体空间结构示意图:●为阳离子,○为阴离子。


安徽高中化学竞赛-结构化学模拟题六一、单项选择题(每小题2分,共40分)1.一维势箱解的量子化由来:()① 人为假定② 求解微分方程的结果③ 由势能函数决定的④ 由微分方程的边界条件决定的2.氢原子基态电子几率密度最大的位置在r =()处① 0② a 0③ ∞ ④ 2 a 0 3.的简并态有几个(相对H 而言)?( )① 16 ② 9 ③ 7④ 34.对He +离子实波函数和复波函数,下列结论哪个不对?( )① Mz 相同 ② E 相同 ③ M 2相同 ④ 节面数相同 5.He +体系的径向节面数为:( )① 4 ② 1③ 2④ 06.立方势箱中时有多少种状态?( ) ① 11 ② 3 ③ 4④ 27.由类氢离子薛定谔方程到R ,○H ,Φ方程,未采用以下那种手段?( )① 球极坐标变换② 变量分离③ 核固定近似 ④ 线性变分法8.电子自旋是:( )① 具有一种顺时针或逆时针的自转 ② 具有一种类似地球自转的运动③ 具有一种非空间轨道运动的固有角动量 ④ 因实验无法测定,以上说法都不对。
9. σ型分子轨道的特点是:( )① 能量最低 ② 其分布关于键轴呈圆柱形对称 ③ 无节面④ 由s 原子轨道组成 10. 属于下列点群的分子哪个为非极性分子?( )m 43ψpy 2ψ121-ψ321ψ2287m ah E<①D6h②C s③C3v④C∞v11. 分子轨道的含义是:()①分子空间运动的轨迹②描述分子电子运动的轨迹③描述分子空间轨道运动的状态函数④描述分子中单个电子空间运动的状态函数12. 羰基络合物Cr(CO)6中,CO与Cr生产配键以后,CO的键长()①变长②变短③不变④加强13. 一般而言,分子的电子、振动和转动能级差的大小顺序为:()①ΔEe>ΔEv>ΔEr ②ΔEe>ΔEr>ΔEv③ΔEe<ΔEv<ΔEr ④ΔEe<ΔEv>ΔEr14. 若1HCl和2HCl的力常数k e相同,则下列物理量哪个相同(按刚性转子-谐振子模型处理)()①转动常数②特征频率③核间距④以上都不是15. 金属铜采取A1型(ABC)最密堆积,则其点阵型式为()①立方F ②立方I③六方H ④四方底心16. 晶体按其特征对称元素可以划分为多少晶系?()①32 ②8③7 ④1417. 已知金属Cs具有立方体心的晶胞,则其配位数为:()①12 ②8③7 ④1418. AgF属于NaCl型晶体,一个晶胞中含有多少个Ag+?()① 6 ② 4③ 2 ④ 119. CsCl晶体属于什么点阵型式?()①简单立方②面心立方③体心立方④六方20. 有一AB型离子晶体,若r+ / r- =0.57,则正离子的配位数为:()① 4 ② 6③8 ④12二、多项选择题(每小题1分,共5分)1. 下列各电子运动状态中,哪几种不可能存在?( )① ②③ ④⑤2. 下列分子那些不存在离域大π键?()① CH 3CH 2CH 3 ② CO 2③ 丁二烯④ CH 2=CHCH 2CH 2CH=CH 2⑤ 苯3. 下列分子(或离子)中,哪些是顺磁性的?()① F 2② B 2 ③ O 2+④ N 2⑤ CO4. 立方晶系中,下列哪种点阵型式不存在?( )① 立方H ② 简单立方P③ 体心立方I④ 面心立方F⑤ 六方P5. 下列哪些不属于类氢离子?( )① He +② Li 2+③ Be 3+ ④ Li +⑤ Be 2+三、填空题(每空1分,共5分)1. 由于电子是全同粒子,同时电子波函数是___________(对称,反对称)的,因此多电子的波函数需用Slater 行列式波函数来描述。
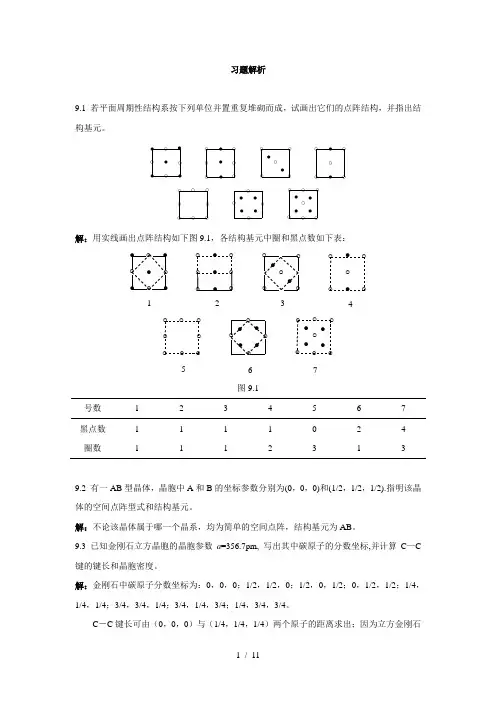
习题解析9.1 若平面周期性结构系按下列单位并置重复堆砌而成,试画出它们的点阵结构,并指出结构基元。
●●●●●●●●●●●●●●●●●●●●○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○解:用实线画出点阵结构如下图9.1,各结构基元中圈和黑点数如下表:●●●●●●●●●●●●●●●●●●●●○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○1234567图9.1号数 1 2 3 4 5 6 7黑点数 1 1 1 1 0 2 4 圈数 1 1 1 2 3 1 39.2 有一AB型晶体,晶胞中A和B的坐标参数分别为(0,0,0)和(1/2,1/2,1/2).指明该晶体的空间点阵型式和结构基元。
解:不论该晶体属于哪一个晶系,均为简单的空间点阵,结构基元为AB。
9.3 已知金刚石立方晶胞的晶胞参数a=356.7pm, 写出其中碳原子的分数坐标,并计算C—C 键的键长和晶胞密度。
解:金刚石中碳原子分数坐标为:0,0,0;1/2,1/2,0;1/2,0,1/2;0,1/2,1/2;1/4,1/4,1/4;3/4,3/4,1/4;3/4,1/4,3/4;1/4,3/4,3/4。
C-C键长可由(0,0,0)与(1/4,1/4,1/4)两个原子的距离求出;因为立方金刚石a=b=c =356.7pmr c-c=×356.7pm = 154.4pm 密度D =ZM/N A V=-1-10323-1812.0g mol (356.710cm)(6.022 10mol )⨯⋅⨯⨯⨯ = 3.51 g·cm -39.4 立方晶系的金属钨的粉末衍射线指标如下:110,200,211,220,310,222,321,400,试问:(a)钨晶体属于什么点阵形式?(b)X-射线波长为154.4pm, 220衍射角为43.62°,计算晶胞参数。
高中化学竞赛专题考试——分子结构1 (路易斯结构式、共振式、VSPER 理论)1.008Zr Nb Mo T cRu Rh Pd Ag Cd In S n S b T e I Hf T a W Re OsIr Pt Au Hg T l Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl S i P Cl S K Ca S c T i V Cr Mn Fe Co Ni Cu Zn G a G e As S e BrRb Cs Fr S r Ba RaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt一. 选择题(每题只有一个正确选项,每题2分,共50分)1. 根据鲍林近似能级图,在多电子原子中,基态时,下列电子均处于一定的能级,其中占据能级最高轨道的电子是: ( )A 2,1,1,+1/2B 3,1,1,+1/2C 3,2,1,+1/2D 4,0,0,1/22. 下列离子的电子构型可以用[Ar]3d 6表示的是 ( )A Mn 2+B Fe 3+C Co 3+D Ni 2+3. 下列离子半径变小的顺序正确的是 ( )A F ->Na +>Mg 2+Al 3+B Na +>Mg 2+>Al 3+>F -C Al 3+>Mg 2+>Na +>F -D F ->Al 3+>Mg 2+>Na +4. 下列元素的原子中,第一电离能最大的是 ( )A BeB BC CD N5. 下列物质中,含极性键的非极性分子是 ( ) A H 2O B HCl C SO 3 D NO 26. 下列分子中,没有配位键的是 ( ) A CO B (BeCl 2)2 C CH 3OBF 3 D N 2H 47. NO 3— 合理的共振式总数为 ( ) A 1 B 2 C 3 D 48.下列分子中,键级等于零的是 ( )A .O 2 B. F 2 C. N 2 D. Ne 29.原子轨道沿两核连线以“肩并肩”方式进行重叠的是 ( )A. б键B. 氢键C. π键D. 离子键10. 下列物种中,键长最短的是 ( ) A O 2 B O 2+ C O 2— D O 22—11. 下列化合物中,极性最大的是 ( ) A CS 2 B H 2O C SO 3 D SnCl 412. 下列物种中,既是路易斯酸,也是路易斯碱的是 ( ) ACCl 4 B SOCl 2 C NH 2— D Hg 2+13. 估计下列分子中,键角最小的是 ( ) ( ) A NH 3 B PH 3 C AsH 3 D SbH 314.估计下列分子或离子中,键角最小的是 ( ) A NH 3 B NO 3— C NF 3 D NCl 315. 几何形状是平面三角形的离子是()A SO-23B SnCl-3C CH-3D NO-316. 下列分子或离子为平面四方构型的是()A ICl4—B ClO4—C BrF4+D SF417. 下列分子或离子中,属于三角锥构型的是()A BCl3B H3O+C BrF3D CH+318. 下列化合物中,可能含有卤桥键的是()A SnCl4B BeCl2C CCl4D NCl319. IF5是共价化合物,但液态IF5是电的良导体,原因是IF5二聚后电离,得到各带一个单位正负电荷的阴阳离子,则在该液体中存在的阳离子的几何构型是()A 三角双锥B 四方锥C 平面四方D 变形四面体20 下列哪一个分子的空间构型为折线型()A N3—B I3—C SO32—D CO32—21.下列分子中,偶极矩不为零的是()A BeCl2B BF3C NF3D CH422. 下列分子或离子中,键角最大的是()A XeF2B NCl3C CO-23D PCl+423 通过测定AB2型分子的偶极距,能够判断:()A分子的空间构型 B 两元素的电负性之差C A—B键的极性D A—B键的键长24. 下列分子中含有两个不同键长的是()A CO2B SO3C SF4D XeF425. 下列分子中,最不容易聚合的是()A N2O5B BeCl2C AlCl3D NO2二、填空题(共50分)26.(粒子σ键π键N2HCNBBr3(CN)2SiCl427.(10分)写出下列物质的Lewis结构(若有多种共振式,请规范写出,注明形式电荷):分子或离子Lewis结构式H2O3(火箭燃料)HOCNNH2OHSbF5N2O328.(20分)填写下列表格分子或离子中心原子孤电子对数价层电子对数理想电子对构型分子或离子空间构型BeCl2PCl5SO2NOClI3—ClO2—XeF4ClO3FXeO3XeO429.(12分)在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。

奥赛真题《结构化学》精析第一题(1999年初赛第三题12分)铬的化学丰富多采,实验结果常出人意料。
将过量30% H 2O 2加入(NH 4)2CrO 4的氨水溶液, 热至50o C 后冷至0o C ,析出暗棕红色晶体A 。
元素分析报告:A 含Cr 31.1%,N 25.1%,H 5.4%。
在极性溶剂中A 不导电。
红外图谱证实A 有N-H 键,且与游离氨分子键能相差不太大,还证实A 中的铬原子周围有7个配位原子提供孤对电子与铬原子形成配位键,呈五角双锥构型。
3-1 以上信息表明A 的化学式为: ;可能的结构式为: 。
3-2 A 中铬的氧化数为: 。
3-3 预期A 最特征的化学性质为: 。
3-4 生成晶体A 的反应是氧化还原反应,方程式是: 。
【解析】此题是利用已经形成的但一般教科书未涉及的知识编制成的探究式试题。
如本文开头所述,属于谜底为新知识的谜语式试题。
此题信息很多,为缕清信息相互关系,最形象的方法是制作一张破案式的线索图,下面只是一例(制作什么样的图并无模式可循,依应试者思维特征不同而异,图也不一定在纸上画出来,在脑中构建也一样可以——这要看应试者脑子清晰不清晰,右脑发达不发达而定):从这个“破案线索图”可以判断出“犯案人”A 只能是含2个过氧团的铬(IV)配合物。
因为过氧团可以从过氧化氢中转移过来,有来源(如果此题没有A 的生成反应的信息,当然也可以假设配合物里存在H 2N —NH 2,同时有—OH 的配体,但生成反应排除了这个“嫌疑犯”);同时也排除1个过氧团或者没有过氧团的可能,因为生成反应是氧化还原反应,在K 2CrO 4中铬的价态(或说氧化态)已经达到最高价,只能发生还原反应,铬的价态必低于+6,因此A 是唯一的。
【解析】3-1 A 的化学式Cr(NH 3)3 O 4 或CrN 3H 9O 4(写成其他形式也可以) (2分)A 的可能结构式如下图: (4分)333and/or1式和/或2式均得满分,但无2个过氧键O —O 者得零分。


中学化学竞赛试题资源库——分子的结构A组1.下列分子中所有原子都满足最外层为8电子结构的是A BeCl2B PCl3C PCl5D N2O2.下列分子结构中各原子的最外层电子都满足8电子稳定结构的是A SF6B XeF2C CS2D CH43.下列分子中,所有原子的最外层均为8电子结的是A BeCl2B H2SC NCl3D SF64.下列分子中所有原子都满足最外层为8电子结构的是A SiCl4B H2OC BF3D PCl55.下列分子中,所有原子都满足最外层为8电子结构的是A BF3B PCl5C HClD CF2Cl26.下列各分子中所有原子都满足最外层为8电子结构的是A C2H4B BeCl2C PCl5D CCl47.下列各分子中,所有原子都满足最外层为8电子结构的是A H2OB BF3C CCl4D PCl58.下列分子中所有的原子都满足最外层8电子结构的是A 次氯酸B 二氟化硫C 三氟化硼D 氯化硫(S2Cl2)9.下列温室气体中,和CO2一样,既是非极性分子,所有的原子又都达到8电子稳定结构的是A N2OB CF2=CF2C CCl2F2D SF610.下列微粒中碳原子都满足最外层为8电子结构的是A 甲基(—CH3)B 碳正离子(CH3+)C 碳负离子(CH3-)D 碳烯(∶CH2)11.下列分子中所有原子都满足最外层8电子结构的是A 六氟化氙(XeF6)B 次氯酸(HClO)C 二硫化碳(CS2)D 三氟化硼(BF3)12.六氧化四磷的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有的共价键的数目是A 10B 12C 24D 2813.具有极性键的非极性分子是A CS2B H2SC Cl2D NH314.下列分子中,具有极性键而不是极性分子的是A H2OB HFC COD CO215.下列分子有极性的是A CH≡CHBC CH3ClD N216.只含极性键的非极性分子是①BF3(平面正三角型分子)②CCl4(正四面体型分子)③NH3④H2O ⑤CH3Cl ⑥CS2A ①②⑥B ①②⑤C ②⑤③D ①②③17.下列物质:①干冰,②石英,③白磷,④氯仿,⑤过氧化钠。

安徽高中化学竞赛-结构化学模拟题一一、单选题 (30)1、下列波函数中量子数n 、l 、m 具有确定值的是( )(A ))3(xz d ϕ (B ))3(yz d ϕ (C ))3(xy d ϕ (D ))3(2z d ϕ 2、如果0E 是一维势箱中电子最低能态的能量,则电子在E 3能级的能量是( )(A )20E (B )40E (C )90E (D )180E 3、化合物CO 2、CO 和(CH 3)2CO 中,碳氧键键长是( )(A )CO 最长,CO 2最短 (B )CO 2最长,(CH 3)2CO 最短 (C )一样长 (D )CO 最短,(CH 3)2CO 最长 4、测不准关系的含义是指( )(A ) 粒子太小,不能准确测定其坐标; (B )运动不快时,不能准确测定其动量(C ) 粒子的坐标的动量都不能准确地测定; (D )不能同时准确地测定粒子的坐标与动量 5、下列状态为氢原子体系的可能状态是( );该体系能量为( ): A 、2ψ310+3ψ41-1 B 、2ψ221+3ψ32-1C 、2ψ21-1+3ψ342+3ψ410D 、3ψ211+5ψ340+5ψ2106、类氢体系的某一状态为Ψ43-1,该体系的能量为( )eV ,角动量 大小为( ), 角动量在Z 轴上的分量为( )。
A 、-R/4B 、-R/16C 、-2R/9、D 、 -h/2πE 、-h/πF 、-2h/2π/2 /2/2H I πππ5、7、 下列算符为线性算符的是:( )A 、sine xB 、d 2/dx 2 D 、cos2x8、通过变分法处理氢分子离子体系,计算得到的体系能量总是:( ) A 、等于真实体系基态能量 B 、大于真实体系基态能量 C 、不小于真实体系基态能量 D 、小于真实体系基态能量9、对于SP 杂化轨道:Ф1=C 11фs +C 12фpx Ф2=C 21фs +C 22фpx 其归一化条件是指:( ) A 、C 112+C 122=1 B 、C 212+C 222 =1C 、αk /βk =1/2D 、C 112+C 212=110、红外光谱由分子内部( )能量跃迁引起。

结构化学课后习题答案结构化化学课后习题答案一、化学键与分子结构1. 选择题a) 正确答案:D解析:选择题中,选项D提到了共价键的形成是通过电子的共享,符合共价键的定义。
b) 正确答案:B解析:选择题中,选项B提到了离子键的形成是通过电子的转移,符合离子键的定义。
c) 正确答案:C解析:选择题中,选项C提到了金属键的形成是通过金属原子之间的电子云重叠,符合金属键的定义。
d) 正确答案:A解析:选择题中,选项A提到了氢键的形成是通过氢原子与高电负性原子之间的吸引力,符合氢键的定义。
2. 填空题a) 正确答案:共价键解析:填空题中,根据问题描述,两个非金属原子之间的键称为共价键。
b) 正确答案:离子键解析:填空题中,根据问题描述,一个金属原子将电子转移到一个非金属原子上形成的键称为离子键。
c) 正确答案:金属键解析:填空题中,根据问题描述,金属原子之间的电子云重叠形成的键称为金属键。
d) 正确答案:氢键解析:填空题中,根据问题描述,氢原子与高电负性原子之间的吸引力形成的键称为氢键。
二、有机化学1. 选择题a) 正确答案:C解析:选择题中,选项C提到了烷烃是由碳和氢组成的,符合烷烃的定义。
b) 正确答案:D解析:选择题中,选项D提到了烯烃是由含有一个或多个双键的碳原子组成的,符合烯烃的定义。
c) 正确答案:B解析:选择题中,选项B提到了炔烃是由含有一个或多个三键的碳原子组成的,符合炔烃的定义。
d) 正确答案:A解析:选择题中,选项A提到了芳香烃是由芳香环结构组成的,符合芳香烃的定义。
2. 填空题a) 正确答案:醇解析:填空题中,根据问题描述,含有羟基(-OH)的有机化合物称为醇。
b) 正确答案:醚解析:填空题中,根据问题描述,含有氧原子连接两个碳原子的有机化合物称为醚。
c) 正确答案:酮解析:填空题中,根据问题描述,含有羰基(C=O)的有机化合物称为酮。
d) 正确答案:酯解析:填空题中,根据问题描述,含有羧基(-COO)的有机化合物称为酯。

第九章离子化合物的结构化学离子化合物是由阴阳离子通过离子键连接而成的化合物。
离子化合物的结构化学主要研究其晶体结构和离子键的特性。
在离子化合物的结构中,离子的排列方式、离子大小和电荷、晶格常数等因素都对化合物的性质产生重要影响。
离子化合物的晶体结构可以通过X射线衍射等方法进行研究。
根据阴阳离子的大小和电荷,离子化合物的晶体结构可以分为离散型和连续型。
离散型的离子化合物晶体结构中,阳离子和阴离子排列在空间中形成一个三维网络,阳离子和阴离子之间通过离子键相互连接。
此外,离散型的离子化合物中阳离子和阴离子的配位数也会对晶体结构产生影响。
例如,钠氯化物(NaCl)是一种典型的离散型离子化合物,其中钠离子和氯离子的配位数均为6、连续型的离子化合物晶体结构中,阳离子和阴离子排列在空间中形成一个连续的正负电荷分布,阳离子和阴离子之间通过离子键相互连接。
常见的连续型离子化合物有铁氰化钾(K4[Fe(CN)6])和硫酸铜(CuSO4)等。
离子键是离子化合物中阴阳离子之间的强相互作用力。
离子键的强度取决于离子的电荷和离子的大小。
通常情况下,离子的电荷越大,离子键的强度越大。
而离子的大小则会影响离子键的长度。
通过离子键的形成,离子化合物的阴阳离子可以达到电中性。
离子化合物的结构化学研究对于理解离子化合物的性质具有重要意义。
例如,结构化学的研究可以揭示离子化合物的稳定性和熔点等物理性质。
此外,结构化学还可以为离子化合物的制备和应用提供指导。
以钠氯化物为例,由于其晶体结构的稳定性和离散型离子连接的特性,钠氯化物在化工领域中被广泛应用于制备其他化合物和材料,如氯化钠溶液的电解制氯等。
总之,离子化合物的结构化学研究对于深入理解离子化合物的性质和应用具有重要意义。
通过研究离子化合物的晶体结构和离子键特性,可以为离子化合物的制备和应用提供理论依据和指导,促进相关领域的发展。
第一章 量子力学基础一、单选题: 1、32/sinx l lπ为一维势箱的状态其能量是:( a ) 22229164:; :; :; :8888h h h hA B C D ml ml ml ml 2、Ψ321的节面有( b )个,其中( b )个球面。
A 、3 B 、2 C 、1 D 、03、立方箱中2246m lh E ≤的能量范围内,能级数和状态数为( b ). A.5,20 B.6,6 C.5,11 D.6,174、下列函数是算符d /dx的本征函数的是:( a );本征值为:( h )。
A 、e 2x B 、cosX C 、loge x D 、sinx 3 E 、3 F 、-1 G 、1 H 、2 5、下列算符为线性算符的是:( c )A 、sine xB 、C 、d 2/dx 2D 、cos2x6、已知一维谐振子的势能表达式为V = kx 2/2,则该体系的定态薛定谔方程应当为( c )。
A [-m 22 2∇+21kx 2]Ψ= E ΨB [m 22 2∇- 21kx 2]Ψ= E Ψ C [-m 22 22dx d +21kx 2]Ψ= E Ψ D [-m 22 -21kx 2]Ψ= E Ψ 7、下列函数中,22dx d ,dxd的共同本征函数是( bc )。
A cos kxB e –kxC e –ikxD e –kx2 8、粒子处于定态意味着:( c )A 、粒子处于概率最大的状态B 、粒子处于势能为0的状态C 、粒子的力学量平均值及概率密度分布都与时间无关系的状态.D 、粒子处于静止状态9、氢原子处于下列各状态 (1)ψ2px (2) ψ3dxz (3) ψ3pz (4) ψ3dz 2 (5)ψ322 ,问哪些状态既是M 2算符的本征函数,又是M z 算符的本征函数?( c )A. (1) (3)B. (2) (4)C. (3) (4) (5)D. (1) (2) (5) 10、+He 离子n=4的状态有( c )(A )4个 (B )8个 (C )16个 (D )20个 11、测不准关系的含义是指( d ) (A) 粒子太小,不能准确测定其坐标; (B)运动不快时,不能准确测定其动量(C) 粒子的坐标的动量都不能准确地测定; (D )不能同时准确地测定粒子的坐标与动量12、若用电子束与中子束分别作衍射实验,得到大小相同的环纹,则说明二者( b ) (A) 动量相同 (B) 动能相同 (C) 质量相同13、 为了写出一个经典力学量对应的量子力学算符,若坐标算符取作坐标本 身,动量算符应是(以一维运动为例) ( a )(A) mv (B) i x ∂∂ (C)222x ∂-∂14、若∫|ψ|2d τ=K ,利用下列哪个常数乘ψ可以使之归一化:( c )(A) K (B) K 2 (C) 1/K15、丁二烯等共轭分子中π电子的离域化可降低体系的能量,这与简单的一维势阱模型是一致的, 因为一维势阱中粒子的能量 ( b )(A) 反比于势阱长度平方 (B) 正比于势阱长度 (C) 正比于量子数16、对于厄米算符, 下面哪种说法是对的 ( b )(A) 厄米算符中必然不包含虚数 (B) 厄米算符的本征值必定是实数(C) 厄米算符的本征函数中必然不包含虚数17、对于算符Ĝ的非本征态Ψ ( c )(A) 不可能测量其本征值g . (B) 不可能测量其平均值<g >.(C) 本征值与平均值均可测量,且二者相等18、将几个非简并的本征函数进行线形组合,结果 ( b )(A) 再不是原算符的本征函数(B) 仍是原算符的本征函数,且本征值不变 (C) 仍是原算符的本征函数,但本征值改变19. 在光电效应实验中,光电子动能与入射光的哪种物理量呈线形关系:( B )A .波长B. 频率C. 振幅20. 在通常情况下,如果两个算符不可对易,意味着相应的两种物理量( A)A .不能同时精确测定B .可以同时精确测定C .只有量纲不同的两种物理量才不能同时精确测定 21. 电子德布罗意波长为(C )A .λ=E /h B. λ=c /ν C. λ=h /p 22. 将几个非简并的本征函数进行线形组合,结果( A ) A .再不是原算符的本征函数B .仍是原算符的本征函数,且本征值不变C .仍是原算符的本征函数,但本征值改变23. 根据能量-时间测不准关系式,粒子在某能级上存在的时间τ越短,该能级的不确定度程度ΔE (B )A .越小 B. 越大 C.与τ无关24. 实物微粒具有波粒二象性, 一个质量为m 速度为v 的粒子的德布罗意波长为:A .h/(mv)B. mv/hC. E/h25. 对于厄米算符, 下面哪种说法是对的 ( B )A .厄米算符中必然不包含虚数B .厄米算符的本征值必定是实数C .厄米算符的本征函数中必然不包含虚数 26. 对于算符Ĝ的非本征态Ψ (A ) A .不可能测得其本征值g. B .不可能测得其平均值<g>.C .本征值与平均值均可测得,且二者相等 27. 下列哪一组算符都是线性算符:( C )A . cos, sinB . x, logC . x d dx d dx,,22二 填空题1、能量为100eV 的自由电子的德布罗依波波长为( 122.5pm )2、函数:①xe ,②2x ,③x sin 中,是算符22dxd 的本征函数的是( 1,3 ),其本征值分别是( 1,—1;)3、Li 原子的哈密顿算符,在( 定核 )近似的基础上是:(()23213212232221223222123332ˆr e r e r e r e r e r e mH +++---∇+∇+∇-= )三 简答题1. 计算波长为600nm(红光),550nm(黄光),400nm(蓝光)和200nm(紫光)光子的 能量。
中学化学竞赛试题资源库——分子的结构A组1.下列分子中所有原子都满足最外层为8电子结构的是A BeCl2B PCl3C PCl5D N2O2.下列分子结构中各原子的最外层电子都满足8电子稳定结构的是A SF6B XeF2C CS2D CH43.下列分子中,所有原子的最外层均为8电子结的是A BeCl2B H2SC NCl3D SF64.下列分子中所有原子都满足最外层为8电子结构的是A SiCl4B H2OC BF3D PCl55.下列分子中,所有原子都满足最外层为8电子结构的是A BF3B PCl5C HClD CF2Cl26.下列各分子中所有原子都满足最外层为8电子结构的是A C2H4B BeCl2C PCl5D CCl47.下列各分子中,所有原子都满足最外层为8电子结构的是A H2OB BF3C CCl4D PCl58.下列分子中所有的原子都满足最外层8电子结构的是A 次氯酸B 二氟化硫C 三氟化硼D 氯化硫(S2Cl2)9.下列温室气体中,和CO2一样,既是非极性分子,所有的原子又都达到8电子稳定结构的是A N2OB CF2=CF2C CCl2F2D SF610.下列微粒中碳原子都满足最外层为8电子结构的是A 甲基(—CH3)B 碳正离子(CH3+)C 碳负离子(CH3-)D 碳烯(∶CH2)11.下列分子中所有原子都满足最外层8电子结构的是A 六氟化氙(XeF6)B 次氯酸(HClO)C 二硫化碳(CS2)D 三氟化硼(BF3)12.六氧化四磷的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有的共价键的数目是A 10B 12C 24D 2813.具有极性键的非极性分子是A CS2B H2SC Cl2D NH314.下列分子中,具有极性键而不是极性分子的是A H2OB HFC COD CO215.下列分子有极性的是A CH≡CHBC CH3ClD N216.只含极性键的非极性分子是①BF3(平面正三角型分子)②CCl4(正四面体型分子)③NH3④H2O ⑤CH3Cl ⑥CS2A ①②⑥B ①②⑤C ②⑤③D ①②③17.下列物质:①干冰,②石英,③白磷,④氯仿,⑤过氧化钠。
离子化合物的结构化学离子键是由正离子与负离子之间的静电相互吸引力形成的一种化学键。
在离子化合物中,金属原子失去一个或多个电子,形成正离子,而非金属原子则获得这些电子,形成负离子。
这种正负电荷的吸引力使得离子之间形成稳定的晶体结构。
离子的结构可以通过离子半径、电荷数、电场效应等因素来解释。
离子半径是指离子的中心到其最外层电子轨道的距离。
正离子的离子半径通常小于其原子半径,因为它们失去了一个或多个电子。
而负离子的离子半径通常大于其原子半径,因为它们获得了一个或多个电子。
这种离子半径的差异导致了离子之间的空间排列方式。
离子的电荷数也会影响离子化合物的结构。
正离子的电荷数越大,其吸引力越大,离子之间的结合越紧密,晶体结构越稳定。
相反,负离子的电荷数越多,其排斥力越大,晶体结构越不稳定。
电场效应是指离子周围的电场对离子结构的影响。
电场中的离子会受到周围离子的电荷吸引和排斥力的影响,从而影响其排列方式。
如果离子的电荷数相同,但大小不同时,较大的离子会被周围的电子云推开,使其晶体结构呈现出空间扩展的特点。
离子化合物的晶体结构通常是由离子排列而成的。
离子可以沿着规则排列的路径组成晶格。
最常见的晶体结构是离子化合物的立方紧密堆积(rock-salt结构)和六方最密堆积(cesium chloride结构)。
在立方密堆结构中,正离子和负离子是以等距离排列的,形成一个规则的晶格。
而在六方密堆结构中,两种离子交替排列,并且每个正离子周围有六个负离子。
离子化合物的结构对其性质有重要影响。
由于离子之间的电荷吸引力,离子化合物通常具有高熔点和高沸点。
它们还具有良好的溶解性,因为水等极性溶剂能够与离子之间的电荷相互作用。
此外,离子化合物还有很高的硬度和脆性,因为其结构中离子的排列方式容易被破坏。
总之,离子化合物的结构化学研究离子之间的相互作用、离子的排列方式以及其性质。
了解离子化合物的结构对于理解其物理和化学性质以及其应用具有重要意义。
结构化学试题及答案一、选择题(每题2分,共20分)1. 以下哪个元素的原子最外层电子数为6?A. 氢B. 碳C. 氧D. 硫答案:B2. 单质分子中,哪个分子的键角不是109.5°?A. 甲烷B. 乙烯C. 乙炔D. 二氧化碳答案:B3. 以下哪个是共价键?A. 离子键B. 金属键C. 范德华力D. 氢键答案:A4. 根据路易斯酸碱理论,以下哪个物质是酸?A. 氨气B. 氢气C. 氢氧化钠D. 二氧化碳5. 以下哪个元素的原子半径最大?A. 锂B. 钠C. 钾D. 铯答案:D6. 以下哪个化合物是离子化合物?A. 二氧化碳B. 氯化氢C. 水D. 氯化钠答案:D7. 以下哪个是分子间作用力?A. 离子键B. 共价键C. 金属键D. 氢键答案:D8. 以下哪个元素属于过渡金属?A. 氦B. 碳C. 铁D. 氖答案:C9. 以下哪个化合物具有平面三角形的分子结构?B. 乙烯C. 乙炔D. 二氧化碳答案:B10. 以下哪个元素的电子排布符合洪特规则?A. 氧B. 氮C. 碳D. 氦答案:B二、填空题(每题2分,共20分)1. 元素周期表中,第IA族的元素最外层电子数为______。
答案:12. 根据分子轨道理论,分子轨道可以分为______和______。
答案:成键轨道;反键轨道3. 金属晶体中,原子间的相互作用力主要是______。
答案:金属键4. 根据路易斯酸碱理论,酸是能够接受______的物质。
答案:电子对5. 元素的电负性越大,其原子半径越______。
答案:小6. 离子化合物中,正负离子之间的相互作用力是______。
答案:离子键7. 氢键是一种比范德华力稍强的______作用力。
答案:分子间8. 过渡金属通常具有______价电子。
答案:多个9. 二氧化碳分子的几何结构是______。
答案:线性10. 根据洪特规则,电子在原子轨道中填充时,优先单独占据______轨道。
答案:不同三、简答题(每题10分,共30分)1. 请简述什么是价层电子对互斥理论,并举例说明。
物质结构竞赛真题汇编【2016年】16.下列分子或离子中,构型不为..直线型的是A.I3+B.I3-C.CS2D.BeCl223.(2分)干冰的晶胞结构如图所示,下列说法正确的是A.每个晶胞含有4个CO2分子B.该晶胞属于面心立方晶胞C.晶胞中正四面体空隙数:正八面体空隙数=1:1D.每个CO2分子周围与之最近且等距离的CO2分子有12个27.(8分)2molSb(CH3)3、2molSb(CH3)2Br和2molSb(CH3)Br2三种化合物进行CH3与Br 的重组反应,生成了空间位阻最小的lmolA2B型离子化合物。
(1)试写出A2B型离子化合物的离子式。
(2)试画出。
A+与B2-离子团的空间几何构型(标出Sb原子上非键电子对)并指出构型中Sb原子的杂化类型。
28.(6分)在的反应中,使用的催化剂是。
(1)指出上述催化剂中Ta的配位数与氧化数。
(2)说明该催化剂不能直接参加催化反应的理由。
(3)试用反应方程式将所给催化剂转变成活性催化剂,并指出该反应的类型。
33.(14分)锂、铝和硅三元化合物中,铝原子以ccp型堆积,硅原子与铝原子之间都以共价键连接。
锂原子占据铝原子围成的所有正八面体空隙。
(1)试画出该三元化合物晶体的晶胞图。
()(2)硅原子占有铝原子围成的何类空隙中?空隙占有率是多少?(3)已知晶胞参数为5.93Å,试求Si与Al之间的共价键长和晶体的密度。
(4)试写出该晶体的结构基元的化学式。
(5)指出该晶体的点阵型式。
26.(6分)完成下列各题:(1)在不增加任何配体以及铼原子之间不存在金属键情况下,[Re(CO)3C1]n服从18电子规则,则n的最小取值为________(2)在N2CO存在的化学结构异构体中,最稳定异构体的结构式是_______________32.(16分)右图是钠铊合金的立方晶系晶胞图,晶胞参数为a=7.488Å(1Å=10-10m)(1)试写出该合金的化学式。
1、 NaCl与CaF
2
晶体的相同之处是:( B)
(A) 结构基元 (B) 负离子堆积方式 (C) 点阵型式
2、 4:4是下列哪一种晶体的CN
+/CN
-
:( C)
(A) CsCl (B) NaCl (C) 六方ZnS
3、对于CaF
2
晶体,“简单立方”一词描述的是它的( B )
(A) 负离子堆积方式 (B) 点阵型式 (C) 正离子堆积方式
4、某种离子晶体AB被称为NaCl型, 这指的是( B)
(A) 它的化学组成 (B) 它的结构型式 (C) 它的点阵型式
5、立方和六方ZnS的CN
+/CN
-
都是4:4: 它们在下列哪一点上不同?
A. 负离子堆积方式
B. 正离子所占空隙种类
C. 正离子所占空隙分数
6、CsCl型与CaF
2
型晶体在哪一点上相同?(B )
+ / CN
-
B.正离子所占空隙种类
C.正离子所占空隙分数
7、正、负离子半径比大于等于0.225、小于0.414时,CN
+
理论值是:(B)
A. 6
B. 4
C. 8
8、在离子晶体中,决定正离子配位数的关键因素是( A )
(A) 正负离子半径比 (B) 正负离子电价比 (C) 正负离子电负性之
9、 4:4是下列哪一种晶体的CN
+/CN
-
:( C)
(A) CsCl (B) NaCl (C) 六方ZnS。