安徽高中化学竞赛结构化学 第六章 配位化合物的结构和性质习题-教育文档
- 格式:doc
- 大小:27.51 KB
- 文档页数:2


结构化学第六章配位化合物结构6001试述正八而体场中,中心离子d轨道的分裂方式6002试用分子轨逍理论阐明X , NH3和CN-的配体场强弱的次序。
6003按配位场理论,在Oh场中没有高低自旋络合物之分的组态是:----------- ()(A)d3 (B)d4 (C) d5 (D) d6 (E) d76004凡是中心离子电子组态为d6的八而体络合物,苴LFSE都是相等的,这一说法是否正确?6005络合物的中心离子的d轨道在正方形场中,将分裂成几个能级:-------------- ()(A) 2 (B)3 (C)4 (D)56006Fe(CN)63-的LFSE= ________________ 「6007凡是在弱场配位体作用下,中心离子d电子一立取高自旋态:凡是在强场配位体作用下,中心离子d电子一立取低自旋态。
这一结论是否正确?6008Fc(CN)6#中,CN-是强场配位体,FJ+的电子排布为心,故LFSE为________________ 。
6009尖晶石的一般表示式为AB2O4,其中氧离子为密堆积,当金属离子A占据正四而体门空隙时,称为正常尖晶石,而当A占据Oh空隙时,称为反尖晶石,试从晶体场稳左化能计算说明NiAl2O4晶体是什么型尖晶石结构(Ni?+为於结构)。
6010在Fe(CN)64-中的F2+离子半径比Fe(H2O)62+中的F2+离子半径大还是小?为什么?6011 作图证明CO是个强配位体。
6012CoFf啲成对能为21? 000cm1,分裂能为13? 000cnr1,试写出:(l)d电子排布⑵LFSE值(3)电子自旋角动捲⑷ 磁矩6013已知ML6络合物中(M%为的,>1,尸20? 000 cm-1, P= 25? 000 cm1,它的LFSE 绝对值等于多少? ----------------------- ()(A)0 (B) 25? 000 cnr1 (C) 54? 000 cnr1 (D) 8000 cnr16014四角方锥可认为是正八而体从z方向拉长,且下端没有配体L的情况。

1.在八面体配位场中,3d轨道分裂成几组(A)二组;(B)三组;(C)四组;(D)五组。
2.在弱八面体场中,具有最大的配位场稳定化能的是下列的哪一个(A) d1(B)d2 (C)d3 (D)d43.配离子[Mn(CN)6]4-中d 能级分裂情况可由下列哪种实验测得(A)核磁共振(B)顺磁共振(C)红外光谱(D)电子能谱4.在正四面体配位场中,d轨道将分裂成几组(A)1 (B)2 (C)3 (D)45.在八面体配合物中,具有下列的哪种电子组态的配合物可能是发生大的畸变(A)t2g5e g2 (B)t2g4e g2 (C)t2g6e g3 (D)t2g4[Fe(CN)6]的磁性是下列的哪一种(A)反磁性(B)顺磁性(C)铁磁性(D)反铁磁性7.四面体配合物大多具有下列那种性质(A)低自旋(B)高自旋(C)反旋(D)铁旋8.在正方形配合物中,若四个配位体分别位于X轴Y轴上,则最高能级的d轨道是()。
(A)d xz (B)d z2(C)d xy (D)d x2-y29.对于配位体CN-和F-各自形成的配位场的强弱比较结果,下列哪种说法正确(A)CN-强于F-(B)F-强于CN-(C)相同(D)无法判断10.配位场理论是理论的发展,其实质是。
答案: 10.略第七章晶体学基础1.对于晶体的空间结构点阵型式的种类,下列哪种说法是正确的(A)7种1.在八面体配位场中,3d轨道分裂成几组?(A)二组;(B)三组;(C)四组;(D)五组。
2.在弱八面体场中,具有最大的配位场稳定化能的是下列的哪一个?(A) d1(B)d2 (C)d3 (D)d43.配离子[Mn(CN)6]4-中d 能级分裂情况可由下列哪种实验测得?(A)核磁共振(B)顺磁共振(C)红外光谱(D)电子能谱4.在正四面体配位场中,d轨道将分裂成几组?(A)1 (B)2 (C)3 (D)45.在八面体配合物中,具有下列的哪种电子组态的配合物可能是发生大的畸变?(A)t2g5e g2 (B)t2g4e g2 (C)t2g6e g3 (D)t2g46.K4[Fe(CN)6]的磁性是下列的哪一种?(A)反磁性(B)顺磁性(C)铁磁性(D)反铁磁性7.四面体配合物大多具有下列那种性质?(A)低自旋(B)高自旋(C)反旋(D)铁旋8.在正方形配合物中,若四个配位体分别位于X轴Y轴上,则最高能级的d轨道是()。

(完整word版)⾼中化学竞赛配位化合物练习配合物选择题:1、(NH4)3[CrCl2(SCN)4]的名称是()A.⼆氯四硫氰酸根合铬(Ⅲ)酸铵B.四硫氰酸根⼆氯合铬(Ⅲ)酸铵C.四异硫氰酸根⼆氯合铬(Ⅲ)酸铵D. ⼆氯四异硫氰酸根合铬(Ⅲ)酸铵2、Ni(CO)4,Ni(CN)42-,Ni(NH3)62+的空间构型分别为()A.正四⾯体,正四⾯体,正⼋⾯体B.平⾯正⽅形,平⾯正⽅形,正⼋⾯体C.正四⾯体,平⾯正⽅形,正⼋⾯体D.平⾯正⽅形,变形⼋⾯体,正⼋⾯体3、某⾦属离⼦在⼋⾯体弱场中的磁矩为4.90B.M,⽽在⼋⾯体强场中的磁矩为0,该离⼦是( )A.Cr3+B. Mn2+C. Fe2+D. Co2+E. Ni2+F. Fe3+4、在配位数为4的Co2+四⾯体配合物与平⾯⽅形配合物(低⾃旋)中,未成对电⼦数分别为()A.2与0B.2与1C.3与0D.3与15、根据有效原⼦序数规则(EAN),下列配合物化学式正确的是()A.Fe(CO)3B. Fe(CO)4C. Fe(CO)5D. Fe(CO)66、在H x Co(CO)4中,x值应为()A.1B.2C.3D.47、已知M为配合物的中⼼原⼦,A、B、C为配体,在具有下列化学式的配合物中,哪⼀个有两种异构体()A.MA5CB.MA6C.MA2B2C2D.MA2BC(平⾯⽅形)8.根据⼗⼋电⼦规则,[(CO)3Ni-Co(CO)3]Z中Z值为A +B 3+C 3-D 09、在下列配离⼦中,存在⼏何异构体的是()A.[Cr(NH4)5Cl]2+B.[Pt(py)BrClNH3]C.[Cr(en)Cl4]-D.Cr(en)33+10、下列配离⼦中,属于反磁性的是()A.Co(CN)63—B.Cu(NH3)42+C.Fe(CN)63—D.Mn(CN)64—11、下列配合物中,除存在⼏何异构体外,还存在旋光异构体的是()A.[Pt(NH3)2Cl2]B.[Co(NH3)4Cl2]ClC.[Co(en)2Cl2]ClD.[PtNH3ClBr(py)]12、按照18电⼦规则,下列各配合物中应当以双聚体存在的是()A.Mn(CO)4NOB.Fe(CO)5C.Cr(CO)6D.Co(CO)413、两种配合物[PtBr(NH3)3]NO2和[PtNO2(NH3)3] Br互为( )A.键合异构B.配位异构C.电离异构D.聚合异构14.已知[Fe(C2O4)3]3-的磁矩⼤于5.75B.M;其空间构型及中⼼离⼦的杂化轨道类型是()。


一、填空题
1. 在氮分子与金属形成配位键M-N≡N时,N2的轨道上的一对电子提供给金属原子空轨道,形成键,另一方面又以轨道与金属d轨道形成键,因此在N2的络合物中由于键的形成,使N2活化了。
二、选择题
1. CO与过渡金属形成羰基配合物时,CO键会( C )
A. 不变
B.加强
C. 削弱
D.段裂
2. 配合物中心离子的d轨道在正方形场中,将分裂成几个能级【C 】
A. 2
B. 3
C. 4
D. 5
3. 物质颜色的产生是由于吸收了【D 】
A. 红外光
B. 微波
C. 紫外光
D. 可见光
4. Ni(3d84s2)与CO形成羰基配合物Ni(CO)n,式中n是【C 】
A. 6
B. 3
C. 4
D. 5
三、回答问题
1. 请分析蔡斯盐K [PtCl3(C2H4)]中乙烯与Pt2+之间的成键情况。
(蓝色),吸水后变为粉红色,试用配位场理论解释2. 硅胶干燥剂中常加入CoCl
2
其原因。
解:Co2+为d7构型,在无水CoCl2中,Co2+受配体Cl-的作用d轨道能级发生分裂,7个d电子按电子排布三原则填充在分裂后的轨道上,当电子发生d-d跃迁时,吸收波长为650~750nm的红光,因而显示蓝色。
但CoCl2吸水后变为[Co(H2O)6]Cl2,即由相对较强的配体H2O取代了相对较弱的配体Cl-,引起d轨道分裂能变大,使d电子发生d-d跃迁时吸收的能量增大,即吸收光的波长缩短(蓝移),[Co(H2O)6]Cl2吸收波长为490~500nm的蓝光,因而呈粉红色。


第6章配位化合物的结构和性质习题答案1、过渡金属配合物与一般以主族元素为中心原子的配合物遵循的规则有何不同?为什么?答:过渡金属配合物一般遵守18电子规则,而一般主族元素为中心原子的配合物遵守8隅律。
一般主族元素的价轨道只有ns、np共四条价轨道,而过渡金属原子则有ns、np、nd共9条价轨道。
二者与配体成键时都是倾向于尽可能完全使用所有价轨道,以使配合物达到最稳定状态。
2、查阅文献得到碳酸酐酶(carbonic anhydrase)和质体蓝素(plastocyanin)的活性中心的结构,说明中心原子的配位情况(配位数、配位原子、配体、空间构型)。
答:碳酸酐酶活性中心质体蓝素活性中心3、CO是惰性分子,为什么能够与过渡金属形成稳定的羰基配合物?CO参与配位时是以C还是O配位,为什么?答:CO 与金属形成配合物时,可以形成协同的σ-π配键,获得显著的稳定化能,从而有利于过渡金属配合物的形成。
CO 的电子组态为22224201234152σσσσπσπ,最高占据轨道5σ主要由C 的原子轨道构成,电荷密度偏向C ,因此,羰基配合物中,配体CO 以C 而不是O 原子与金属配位。
4、 PF 3、PCl 3、PR 3等与过渡金属如Pd (Pd(PF 3)4)、Ni (Ni(PF 3)4)形成配合物时,可以形成类似M-CO 的σ-π 配键,试对其协同成键作用进行分析。
答:PF 3、PCl 3、PR 3中P 是以sp 3不等性杂化轨道与3个F 或Cl 、R 成键,此外P 上还有一对孤对电子。
Pd 、Ni 的价电子组态分别为5d 96s 1、3d 84s 2,价电子数为10。
Pd 、Ni 都采用sp 3杂化,当形成配合物时,中心原子空的sp 3杂化轨道接受4个配体上的孤对电子形成σ配键,而金属原子上的d 电子反馈给P 上的空轨道,形成反馈π键。
如图所示:习题4图5、 在八面体配合物中,中心原子的d 1-d 10电子排布,在强场和弱场时有何不同?答:在八面体场中,d 轨道能级分裂为两组,t 2g 和*eg。
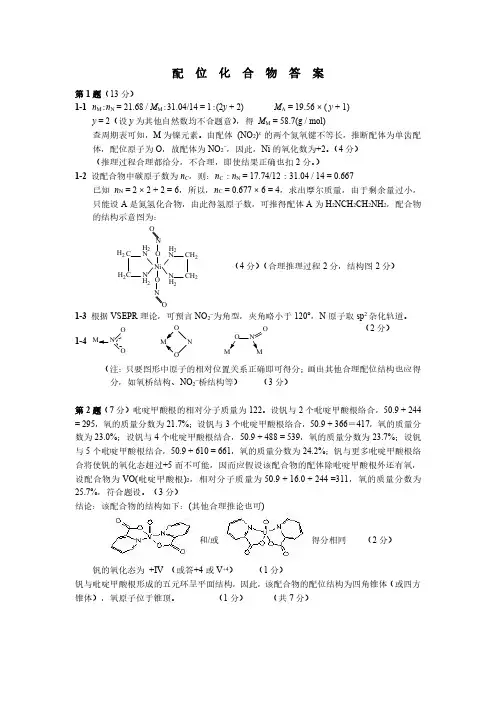
配位化合物答案第1题(13分)1-1n M :n N =21.68/M M :31.04/14=1:(2y +2)M A =19.56×(y +1)y =2(设y 为其他自然数均不合题意),得M M =58.7(g /mol)查周期表可知,M 为镍元素。
由配体(NO 2)x 的两个氮氧键不等长,推断配体为单齿配体,配位原子为O ,故配体为NO 2-,因此,Ni 的氧化数为+2。
(4分)(推理过程合理都给分,不合理,即使结果正确也扣2分。
)1-2设配合物中碳原子数为n C ,则:n C :n N =17.74/12:31.04/14=0.667已知n N =2×2+2=6,所以,n C =0.677×6=4,求出摩尔质量,由于剩余量过小,只能设A 是氮氢化合物,由此得氢原子数,可推得配体A 为H 2NCH 2CH 2NH 2,配合物的结构示意图为:N C CN NC C N H 2H 2H 2H 2H 2H 2H 2H 2Ni NNOO OO(4分)(合理推理过程2分,结构图2分)1-3根据VSEPR 理论,可预言NO 2-为角型,夹角略小于120°,N 原子取sp 2杂化轨道。
1-4O NONOOON O (2分)(注:只要图形中原子的相对位置关系正确即可得分;画出其他合理配位结构也应得分,如氧桥结构、NO 2-桥结构等)(3分)第2题(7分)吡啶甲酸根的相对分子质量为122。
设钒与2个吡啶甲酸根络合,50.9+244=295,氧的质量分数为21.7%;设钒与3个吡啶甲酸根络合,50.9+366=417,氧的质量分数为23.0%;设钒与4个吡啶甲酸根结合,50.9+488=539,氧的质量分数为23.7%;设钒与5个吡啶甲酸根结合,50.9+610=661,氧的质量分数为24.2%;钒与更多吡啶甲酸根络合将使钒的氧化态超过+5而不可能,因而应假设该配合物的配体除吡啶甲酸根外还有氧,设配合物为VO(吡啶甲酸根)2,相对分子质量为50.9+16.0+244=311,氧的质量分数为25.7%,符合题设。

第6章配位化合物的结构和性质习题答案1、过渡金属配合物与一般以主族元素为屮心原子的配合物遵循的规则有何不同?为什么?答:过渡金属配合物一般遵守18电子规则,而一般主族元素为中心原子的配合物遵守8隅律。
一般主族元素的价轨道只有ns、叩共叫条价轨道,而过渡金属原子则有ns、np、nd共9条价轨道。
二者与配体成键吋都是倾向于尽可能完全使用所有价轨道,以使配合物达到最稳足状态。
2、杏阅文献得到碳酸肝酶(carbonic anhydrase)和质体蓝素(plastocyanin)的活性中心的结构,说明巾心原子的配位情况(配位数、配位原子、配体、空间构型)。
答:碳酸酐酶活性中心质体蓝素活性中心中心原子Zn2+Cu2十配位数44配体3个组氨酸的咪唑基,1个水分子两个组氨酸侧链上的咪吨,1个半光氨酸侧链,1个甲硫氨酸侧链配位原子3个N, 1个02个N,2个S空间构型四面体四面体3、CO是惰性分子,力什么能够与过渡金属形成稳定的羰基配合物?CO参与配位时是以C还是0配位,为什么?答:CO 与金属形成配合物时,可以形成协同的G-K 配键,获得显著的稳定化能,从而有 利于过渡金属配合物的形成。
CO 的电子组态为lo 22o 23o 24o 2l7T 45o 227r n ,最高占据轨道5o 主要由C 的原子轨道构成, 电荷密度偏向C ,因此,羰基配合物中,配体CO 以C 而不是O 原子与金属配位。
4、PF 3、PC13、PR 3等与过渡金属如Pd (Pd(PF 3)4)> Ni (Ni(PF 3)4)形成配合物时,可以形成 类似M-CO 的G-K 配键,试对其协同成键作用进行分析。
答:PF 3、PC13、卩^中卩是以sp 3不等性杂化轨道与3个F 或Cl 、R 成键,此外P 上还 有一对孤对电子。
Pd 、Ni 的价电子组态分别为SdYs 1、3d 84s 2,价电子数为10。
Pd 、 Ni 都采用sp 3杂化,当形成配合物时,屮心原子空的sp 3杂化轨道接受4个配体上的 孤对电子形成G 配键,而金属原子上的d 电子反馈给P 上的空轨道,形成反馈7C 键。

配位化合物(全国初赛)第1题(13分)六配位(八面体)单核配合物MA 2(NO 2)2呈电中性;组成分析显示:M 21.68%,N 31.04%,C 17.74%;配体A 含氮不含氧;配体(NO 2)x 的两个氮氧键不等长。
1-1该配合物中心原子M 是什么元素?氧化态多大?给出推论过程。
(2002年第5题)1-2画出该配合物的结构示意图,给出推理过程。
13指出配体(NO 2)x 在“自由”状态下的几何构型和氮原子的杂化轨道类型。
1-4除本例外,上述无机配体还可能以什么方式和中心原子配位?画出三种。
第2题(7分)研究发现,钒与吡啶-2-甲酸根形成的单核配合物可增强胰岛素降糖作用,它是电中性分子,实验测得其氧的质量分数为25.7%,画出它的立体结构,指出中心原子的氧化态。
要给出推理过程。
(2004年第5题)第3题(8分)今有化学式为Co(NH 3)4BrCO 3的配合物。
(2004年第8题)3-1画出全部异构体的立体结构。
3-2指出区分它们的实验方法。
第4题(6分)本题涉及3种组成不同的铂配合物,它们都是八面体的单核配合物,配体为OH -和/或Cl -。
(2005年第4题)4-1PtCl 4·5H 2O 的水溶液与等摩尔NH 3反应,生成两种铂配合物,反应式为:。
4-2BaCl 2·PtCl 4和Ba(OH)2反应(摩尔比2:5),生成两种产物,其中一种为配合物,该反应的化学方程式为:。
第5题(11分)化合物A 是近十年开始采用的锅炉水添加剂。
A 的相对分子质量90.10,可形成无色晶体,能除去锅炉水中溶解氧,并可使锅炉壁钝化。
(2006年第7题)5-1A 是用碳酸二甲酯和一水合肼在70℃下合成,收率80%。
画出A 的结构式。
5-2写出合成A 的反应方程式。
5-3低于135℃时,A 直接与溶解氧反应,生成三种产物。
写出化学方程式。
5-4高于135℃时,A 先发生水解,水解产物再与氧反应。
安徽高中化学竞赛-结构化学模拟题一一、单选题 (30)1、下列波函数中量子数n 、l 、m 具有确定值的是( )(A ))3(xz d ϕ (B ))3(yz d ϕ (C ))3(xy d ϕ (D ))3(2z d ϕ 2、如果0E 是一维势箱中电子最低能态的能量,则电子在E 3能级的能量是( )(A )20E (B )40E (C )90E (D )180E 3、化合物CO 2、CO 和(CH 3)2CO 中,碳氧键键长是( )(A )CO 最长,CO 2最短 (B )CO 2最长,(CH 3)2CO 最短 (C )一样长 (D )CO 最短,(CH 3)2CO 最长 4、测不准关系的含义是指( )(A ) 粒子太小,不能准确测定其坐标; (B )运动不快时,不能准确测定其动量(C ) 粒子的坐标的动量都不能准确地测定; (D )不能同时准确地测定粒子的坐标与动量 5、下列状态为氢原子体系的可能状态是( );该体系能量为( ): A 、2ψ310+3ψ41-1 B 、2ψ221+3ψ32-1C 、2ψ21-1+3ψ342+3ψ410D 、3ψ211+5ψ340+5ψ2106、类氢体系的某一状态为Ψ43-1,该体系的能量为( )eV ,角动量 大小为( ), 角动量在Z 轴上的分量为( )。
A 、-R/4B 、-R/16C 、-2R/9、D 、 -h/2πE 、-h/πF 、-2h/2π/2 /2/2H I πππ5、7、 下列算符为线性算符的是:( )A 、sine xB 、d 2/dx 2 D 、cos2x8、通过变分法处理氢分子离子体系,计算得到的体系能量总是:( ) A 、等于真实体系基态能量 B 、大于真实体系基态能量 C 、不小于真实体系基态能量 D 、小于真实体系基态能量9、对于SP 杂化轨道:Ф1=C 11фs +C 12фpx Ф2=C 21фs +C 22фpx 其归一化条件是指:( ) A 、C 112+C 122=1 B 、C 212+C 222 =1C 、αk /βk =1/2D 、C 112+C 212=110、红外光谱由分子内部( )能量跃迁引起。
高中化学竞赛专题辅导(四)配位化学(含解析)一.(12分)配位化合物A是单核配合物分子,由11个原子组成;微热后失重11.35%得到B;B进一步加热又失重26.66%(相对B)得到金属C;B极难溶于水,不溶于乙醇、乙醚,能溶于盐酸。
A有2种异构体A1、A2,其中A2能与草酸盐反应得到一种式量比A略大的配合物分子D(A1无相似反应)1.写出A、B、C的化学式;2.写出B溶于盐酸后产物的名称;3.试画出A1、A2、D的结构,并比较A1、A2在水中溶解性的大小。
4.A还有若干种实验式相同的离子化合物。
它们每个还满足如下条件:是由分立的、单核的离子配合物实体构成的;仅含1种阳离子和1种阴离子。
(1)符合上述条件的离子化合物的精确的分子式有多少种。
(2)其中1种与AgNO3反应(摩尔比1︰2)得到两种组成不同的配合物,写出反应的化学方程式。
二.(7分)某Ⅷ族不活泼金属A溶于足量的王水生成B的溶液(A的含量为47.60%);将SO2通入B的溶液中,得到C的溶液(A的含量为57.56%)。
已知B、C的组成元素完全相同,且阴离子所带电荷也相同。
1.通过计算推理,确定A的元素符号;2.写出所涉及反应的化学方程式。
3.画出B、C阴离子的空间构型。
三.(11分)太阳能发电和阳光分解水制氮,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面。
下图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带(未充填电子的分子轨道构成的能级最低的能带)与价带(已充填价电子的分子轨道构成的能级最高的能带)之间的能量差ΔE(=E c-E v)称为带隙,图中的e-为电子、h+为空穴。
瑞士科学家最近发明了一种基于上图所示原理的廉价光电化学电池装置,其半导体电极由2个光系统串联而成。
系统一由吸收蓝色光的WO3纳米晶薄膜构成;系统二吸收绿色和红色光,由染料敏化的TiO2纳米晶薄膜构成。
在光照下,系统一的电子(e-)由价带跃迁到导带后,转移到系统二的价带,再跃迁到系统二的导带,然后流向对电极。
中学化学竞赛试题资源库——配位化学A组1.NO的血管舒张作用是由于它和一种含血红素的酶中的铁离子配位而推动一系列变化造成的。
已知配位的NO是CO的等电子体,下列物种中可与铁配位的是A NOB NO+C NO-D N2O22.共价键和配位共价键的区别是什么?在NH4+离子中分别有多少个共价键和配位共价键?如何对其进行区分?3.八面体共有几个面?几个角?具有八面体配位结构的中心离子的配位数是多少?4.在无限稀的溶液中CoBr3·4NH3·2H2O的摩尔电导率为420cm-1·Ω-1,由此推导此配位化合物的组成。
5.求下列配位化合物的中心原子的配位数分别是多少?①[Mo(CN)8]4-中的铜;②Cu(en)22-中的铜(en为乙二胺)6.配平方程式:AgCl(s)+NH3→7.把下列各物质按摩尔电导率递增的顺序排列:①K[Co(NH3)2(NO)4];②[Cr(NH3)3(NO2)3];③[Cr(NH3)5(NO2)]3[Co(NO2)6]2;④Mg[Co(NH3)(NO)5]8.指出下列各金属中心离子的特征配位数:①CuⅠ;②CuⅡ;③CoⅢ;④AlⅢ;⑤ZnⅡ;⑥FeⅡ;⑦FeⅢ;⑧AgⅠ。
9.指出下列各配位离子中金属中心离子的氧化数:①[Cu(NH3)4]2+;②[CuBr4]2-;③[Cu(CN)2]-;④[Cr(NH3)4CO3]+;⑤[PtCl4]2-;⑥[Co(NH3)2(NO2)4]-;⑦Fe(CO)5;⑧[ZnCl4]2-;⑨[Co(en)3]3-。
10.标明下列各配位离子的电荷数:①[FeⅢ(CN)6];②[PtⅣ(NH3)3(H2O)Cl2];③[CrⅢ(NH3)2(H2O)2Cl2];④[PdⅡ(en)Cl2];⑤[Al(H2O)2(OH)4]。
11.试确定下列化学式中圆括号或方括号内配合物离子的电荷数?(1)Na2(MnO4) (2)H4[Fe(CN6)] (3)NaCd2(P3O10) (4)Na2(B4O7)(5)Ca3(CoF6)2(6)Mg3(BO3)2(7)(UO2)Cl2(8)(SbO)2SO412.试判断下列化学式中括号内基团的电荷数:(1)Ca(C2O4) (2)Ca(C7H5O3)2·2H2O (3)Mg3(AsO3)2(4)(MoO)Cl3(5)(CrO2)F2(6)(PuO2)Br (7)(PaO)2S3?13.指出下列各配位离子中金属中心离子的氧化数:①[Co(NH3)6]3+;②Ni(CO)4;③[CuCl4]2-;④[Ag(CN)2]-;⑤[Co(NH3)4(NO2)2]+。
安徽高中化学竞赛结构化学第六章配位化合物的结构和性质习题1、下列互助物最稳固的是( d ):A、[Co(NH3)6]3+B、[Co(H2O)6]3+C、[Ti(H2O)6] +D、[Co(CN)6]3-2、红外光谱由分子内部( d )能量跃迁引起。
A、转动B、电子-振动C、振动D、振动-转动3、Ni与CO可形成羰基互助物Ni(CO)n,此中n为( c ):A、6B、3C、4D、54、下列络离子几多构型偏离正八面体最大的是( a ):A、[Cu(H2O)6]2+B、[Co(H2O)6]2+C、[Fe(CN)6]3-D、[Ni(CN)6]45、下列互助物高自旋的是( b ):A、[Co(NH3)6]3+B、[Co(NH3)6]2+C、[Co(NO2)6]3-D、[Co(CN)6]4-6、在羰基互助物中,配体CO的C—0键键长比自由CO的键长(b )(A)变短了(B)变长了(C)没变化(D)无结论7、下列哪个络合物的磁矩最大?------------------------------ ( d )(A) 六氰合钴(Ⅲ)离子(B) 六氰合铁(Ⅲ)离子(C) 六氨合钴(Ⅲ)离子(D) 六水合锰(Ⅱ)离子8、CO的3σ(HOMO)较大一端在C端。
在金属羰基互助物M(CO)n中,与M配位的是. ( B )A.CO 的O端B.CO 的C端C.CO 的恣意一端二简答题1.导出B4H10可能的styx数, 并写出对应的布局图.答案 1. B4H10可能的styx数(4012), (3103)2.根据式(6-11)求出B5H11, B6H10可能的异构体数目.2. B5H11: (5021), (4112), (3203)B6H10: (4220), (3311), (2402)3.金属团簇M5(M=Li, Na, K)有21种异构体, 试画出它们的拓扑布局.3. 线型, 折线型(5种), W型, V型, T型, Y型,´型, 方形带心, 梯形, 五边形, 四棱锥, 三角形带叉(2种), 菱形带把(2种), 三角双锥, 四面体含心4.谋略下列各团簇的价电子数, 并预测它们的几多构型:Sn44-, Sn3Bi2, Sn3Bi3+, Sn5Bi44. Sn44- 20e , Sn3Bi2 22e 三角双锥,Sn3Bi3+ 26e 八面体,Sn5Bi4 40e 带帽四方反棱柱5.敷衍电子组态位d4的八面体过渡金属离子互助物,试谋略:⑴分别处在高、低自旋基态时的能量;⑵当高、低自旋构型具有相同能量时,电子成对能P和晶体场破裂能10Dq的干系。
一选择题
1、下列配合物最稳定的是( d ):
A、[Co(NH3)6]3+
B、[Co(H2O)6]3+
C、[Ti(H2O)6] +
D、[Co(CN)6]3-
2、红外光谱由分子内部( d )能量跃迁引起。
A、转动
B、电子-振动
C、振动
D、振动-转动
3、Ni与CO可形成羰基配合物Ni(CO)n,其中n为( c ):
A、6
B、3
C、4
D、5
4、下列络离子几何构型偏离正八面体最大的是( a ):
A、[Cu(H2O)6]2+
B、[Co(H2O)6]2+
C、[Fe(CN)6]3-
D、[Ni(CN)6]4
5、下列配合物高自旋的是( b ):
A、[Co(NH3)6]3+
B、[Co(NH3)6]2+
C、[Co(NO2)6]3-
D、[Co(CN)6]4-
6、在羰基配合物中,配体CO的C—0键键长比自由CO的键长(b )
(A)变短了(B)变长了(C)没变化(D)无结论
7、下列哪个络合物的磁矩最大?------------------------------ ( d )
(A) 六氰合钴(Ⅲ)离子(B) 六氰合铁(Ⅲ)离子
(C) 六氨合钴(Ⅲ)离子(D) 六水合锰(Ⅱ)离子
8、CO的3σ(HOMO)较大一端在C端。
在金属羰基配合物M(CO)n中,与M
配位的是. ( B )
A.CO 的O端B.CO 的C端C.CO 的任意一端
二简答题
1.导出B4H10可能的styx数, 并写出对应的结构图.
答案 1. B4H10可能的styx数(4012), (3103)
2.根据式(6-11)求出B5H11, B6H10可能的异构体数目.
2. B5H11: (5021), (4112), (3203)
B6H10: (4220), (3311), (2402)
3.金属团簇M5(M=Li, Na, K)有21种异构体, 试画出它们的拓扑结构.
3. 线型, 折线型(5种), W型, V型, T型, Y型,´型, 方形带心, 梯形, 五边形, 四棱锥, 三角形带叉(2种), 菱形带把(2种), 三角双锥, 四面体含心
4.计算下列各团簇的价电子数, 并预测它们的几何构型:
Sn44-, Sn3Bi2, Sn3Bi3+, Sn5Bi4
4. Sn44- 20e , Sn3Bi2 22e 三角双锥,
Sn3Bi3+ 26e 八面体,
Sn5Bi4 40e 带帽四方反棱柱
5.对于电子组态位d4的八面体过渡金属离子配合物,试计算:
⑴分别处在高、低自旋基态时的能量;
⑵当高、低自旋构型具有相同能量时,电子成对能P和晶体场分裂能10Dq的关系。
5.
()
6. 配合物[C O(NH3)4Cl2]只有两种异构体,若此络合物为正六边型构型有几种异构体?若为
三角柱型时,又有几种异构体?那么到底应是什么构型?
6. 六边形3种异构体
反三棱柱2种异构体
7.卤素离子,NH3,CN-配位场强弱次序怎样?试从分子轨道理论说明其原因。
7. X- < NH3 < CN-
8.尖晶石的化学组成可表示为AB2O4,氧离子紧密堆积构成四面体孔隙和八面体孔隙,当金属离子A占据四面体孔隙时,称为正常的尖晶石;而A占据八面体孔隙时,称为反式尖晶石,试从配位场稳定化能计算结果说明NiAl2O4是何种尖晶石结构。
8. 反尖晶石
9. 判断下列络离子是高自旋还是低自旋,画出d电子的排布方式,说明络离子的磁性,计算晶体稳定化能。
Mn(H2O)62+,Fe(CN)64-,C O(NH3)63+,FeF63-
9.
Mn(H2O)62+Fe(CN)64-Co(NH3)63+FeF63-
自旋 HS LS LS HS
能量 0 2.4D 2.4D0
磁性顺反反顺
10.许多Cu2+的配位化合物为平面四方型结构,试写出Cu2+的d轨道能级排布及电子组态。
10.
11.Ni(CO)4是个毒性很大的化合物
⑴试根据所学的知识说明其几何构型;
⑵用晶体场理论写出基态的电子理论;
⑶能否观察到d-d跃迁谱线?为什么?
11. (1)四面体
(2)
(3) 不能
12. 用18电子规则(电子计数法)推测下列分子的几何结构:
(1)V2(CO)12(2) Cr2(CO)4Cp2(3) [ Mo6(μ3-Cl)8Cl6]2-(4) [Rh6C(CO)15]2-
12. NiCl42-四面体
Ni(CN)42-正方形。