第一节原子结构
- 格式:pptx
- 大小:7.06 MB
- 文档页数:43
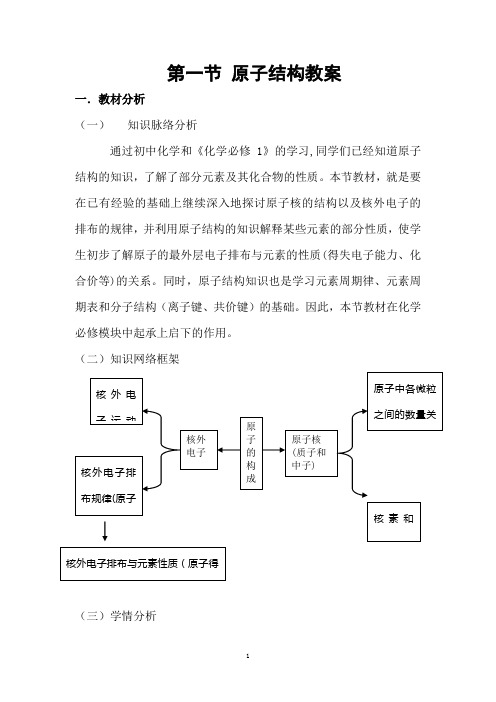
第一节原子结构教案一.教材分析(一)知识脉络分析通过初中化学和《化学必修1》的学习,同学们已经知道原子结构的知识,了解了部分元素及其化合物的性质。
本节教材,就是要在已有经验的基础上继续深入地探讨原子核的结构以及核外电子的排布的规律,并利用原子结构的知识解释某些元素的部分性质,使学生初步了解原子的最外层电子排布与元素的性质(得失电子能力、化合价等)的关系。
同时,原子结构知识也是学习元素周期律、元素周期表和分子结构(离子键、共价键)的基础。
因此,本节教材在化学必修模块中起承上启下的作用。
(二)知识网络框架(三)学情分析学生在初中已学习了原子的简单知识,有一定的知识储备。
新教材(必修)与旧教材相比,删掉了描述核外电子运动特征的电子云;降低了核外电子排布规律的要求;调整了核素、同位素在教材中出现的位置;增加了原子结构示意图,元素的部分化学性质与原子的最外层电子排布的关系。
这种编排更符合知识的逻辑关系,符合学生认识规律。
同时,新教材更注重了让学生自主参与学习,提高了学生学习的主动性,更加注重了学生能力的培养。
二.教学目标(一)知识与技能1.引导学生认识原子核的结构,懂得质量数和 A Z X的含义,掌握构成原子的微粒间的关系;知道元素、核素、同位素的涵义;掌握核电荷数、质子数、中子数、质量数之间的相互关系。
2.引导学生了解原子核外电子的排布规律,使他们能画出1~18号元素的原子结构示意图;了解原子的最外层电子排布与元素的原子得、失电子能力和化合价的关系。
(二)过程与方法通过对构成原子的微粒间的关系和氢元素核素等问题的探讨,培养学生分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。
(三)情感态度与价值观1.通过构成物质的基本微粒的质量、电性的认识,了解微观世界的物质性,从而进一步认识物质世界的微观本质;通过原子中存在电性不同的两种微粒的关系,认识原子是矛盾的对立统一体。
2.通过人类探索原子结构的历史的介绍,使学生了解假说、模型等科学研究方法和科学研究的历程,培养他们的科学态度和科学精神,体验科学研究的艰辛与喜悦。




第一节原子结构二.教学目标:1.A复习原子构成的初步知识,使学生懂得质量数和Z某的含义,掌握构成原子的粒子间的关系。
2.了解关于原子核外电子运动特征和常识。
3.理解电子云的描述和本质。
4.了解核外电子排布的初步知识,能画出1~20号元素的原子结构示意图。
三.教学重点:原子核外电子的排布规律。
四.教学难点:原子核外电子运动的特征,原子核外电子的排布规律。
五.知识分析:复习提问:原子的概念,原子的构成,原子为什么显电中性?(一)原子核1.原子结构:质子原子核中子原子电子(1)原子是由居于原子中心带正电荷的原子核和核外带负电荷的电子构成的。
原子核由质子和中子构成。
所以构成原子的基本粒子是质子、中子和核外电子。
(2)质子带一个单位正电荷,中子呈电中性,因而核电荷数由质子数决定。
核电荷数(Z)=核内质子数=核外电子数(3)原子很小,原子核更小,它的半径约是原子的万分之一,体积只占原子的几千万亿分之一。
2.质量数:1.67261027kg1.0071271.6610kg质子的相对质量=1.67481027kg1.008127中子的相对质量=1.6610kg将原子核内所有的质子和中子的相对质量取近似值整数加起来,所得的数值叫质量数(A)。
质量数(A)=质子数(Z)+中子数(N)练习:用Z某表示原子:1.中性原子的中子数:N=2.阳离子的中子数,某AnA共有某个电子,则N=3.求阴离子的中子数,某An共的某个电子,则N=12164.求中性分子或原子团的中子数,CO2分子中,N=22ngAA5.原子核内有某个中子,其质量数为m,则离子所含电子的物质的量为:6.在RO3的微粒中,共有某个核外电子,R原子的质量数为A,则R核内所含的中子数为(A某n24)7.已知R2n离子的核内有某个中子,R的质量数为M,则agR2离子里含电子的物质的量为([a(M某2)/M]mol)(二)核外电子运动的特征1.核外电子运动的特征:(1)带负电荷,质量很小。

物质结构 元素周期律 第一节原子结构一、原子结构、核素 1.原子的构成 (1)原子的微粒构成(2)原子构成的表示2.原子结构中的微粒关系 (1)原子(2)离子的核外电子数核外电子数⎩⎪⎨⎪⎧阳离子:质子数-电荷数阴离子:质子数+电荷数3.同位素 核素 (1)概念辨析(2)同位素的特征①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)常见的重要核素及其应用※基础小题1.判断正误(正确的打“√”,错误的打“×”)。
(1)所有的原子中都含有质子和中子(×) (2)34S 原子核内中子数为16(×) (3)2H +核外电子数为2 (×)(4)13C 和15N 核内中子数相差1(√)(5)H 3O +和OH -中具有相同的质子数和电子数(×)(6)1H 182O 的摩尔质量为20 g·mol -1(√)(7)质量数就是元素的相对原子质量(×) (8)质子数相同的粒子一定属于同一种元素(×)(9)一种单质中可能含有多种核素,如O 2中含16O 、17O 、18O 三种核素(√)(10)11H +、21H +和31H +互称同位素(×)2.(1)在6Li 、7Li 、23Na 、24Mg 、14C 、14N 六种粒子中,包含___5___种元素,___6_____种核素,其中互为同位素的是____6Li 与7Li____,中子数相等的核素是_____23Na 与24Mg_____。
(2)D 3O +中的质子数为____11____,电子数为___10_____,中子数为____11____。
※常考题例1.下列说法正确的是( ) BA .235 g 核素235 92U 发生裂变反应:235 92U +10n ――→裂变 9038Sr +136 54Xe +1010n ,净产生的中子(10n)数为10N AB .3517Cl 与3717Cl 得电子能力相同C .中子数为146、质子数为92 的铀(U)原子:146 92UD .235 92U 和238 92U 是中子数不同,质子数相同的同种核素例2.中国科学技术名词审定委员会已确定第116号元素Lv的名称为。
教案
多
电
2 8 18 32 ……2n2
子
数
【巩固练习】
1.下列对不同时期原子结构模型提出的时间排列正确的是( )。
①电子分层排布模型②“葡萄干布丁”模型③量子力学模型
④道尔顿原子学说⑤核式模型
A.①③②⑤④
B.④②③①⑤
C.④②⑤①③
D.④⑤②①③
2.下列叙述正确的是( )。
A.能级就是电子层
B.每个能层最多可容纳的电子数是2n2
C.同一能层中的不同能级的能量高低相同
D.不同能层中的s能级的能量高低相同
3、下列能级表示正确(实际存在的)且最多容纳的电子数按由少到多的顺序排列的是( )。
A.1s、2p、3d
B.1s、2s、3s
C.2s、2p、2d
D.3p、3d、3f
4.钙原子的结构示意图为
请回答下列问题:(1)钙原子核外有个能层填充电子。
(2)钙原子M层有个能级填充电子。
(3)钙原子能层上的电子能量最高。
【能力提升】
1.下列说法不正确
...的是(n表示能层序数)()。
A.各能层含有的能级数与能层序数相同
B.各能层的能级都是从s能级开始至f能级结束
C.1s、2s、3s的能量不同
D.s、p、d、f 4个能级最多容纳的电子数分别是2、6、10、14
2.氯原子核外能量最高的电子填充在()。
A.4s能级
B.3p能级
C.3d能级
D.3s能级。