石灰钙镁含量自动计算
- 格式:xlsx
- 大小:16.19 KB
- 文档页数:1

电位滴定法测定石灰石中钙和镁含量马兵兵【摘要】石灰石是建筑行业的重要材料,也是氧化铝生产中的重要原料之一。
目前,在分析石灰石中钙、镁含量时仍多沿用传统的化学分析方法目视滴定法。
即在有掩蔽剂三乙醇胺(1+4)溶液存在下,调整试液pH值为12~13,使用钙指示剂,用EDTA标准溶液滴定钙;在另一份试液中,加pH10的氨水一氯化铵缓冲溶液,以铬黑T为指示剂,用EDTA标准溶液滴定钙、镁合量,差减法计算氧化镁的含量。
【期刊名称】《理化检验-化学分册》【年(卷),期】2012(048)012【总页数】3页(P1492-1493,1495)【关键词】滴定法测定;钙指示剂;镁含量;石灰石;EDTA标准溶液;电位;化学分析方法;氧化铝生产【作者】马兵兵【作者单位】中国铝业重庆分公司,南川408403【正文语种】中文【中图分类】O655.2石灰石是建筑行业的重要材料,也是氧化铝生产中的重要原料之一[1]。
目前,在分析石灰石中钙、镁含量时仍多沿用传统的化学分析方法目视滴定法[2-3]。
即在有掩蔽剂三乙醇胺(1+4)溶液存在下,调整试液pH值为12~13,使用钙指示剂,用EDTA标准溶液滴定钙;在另一份试液中,加pH10的氨水-氯化铵缓冲溶液,以铬黑T为指示剂,用EDTA标准溶液滴定钙、镁合量,差减法计算氧化镁的含量。
该法虽然结果可靠,但工作量大,且肉眼辨别颜色存在一定困难。
本工作提出了改用电位滴定法以此代替指示剂确定终点,用于测定石灰石中氧化钙和氧化镁。
1 试验部分1.1 仪器与试剂T 70型全自动电位滴定仪,配100mL专用塑料滴定杯;DMi141-SC汞化电极。
EDTA标准溶液:0.008 92mol·L-1,以基准物质氧化锌标定。
氢氧化钠溶液:100g·L-1。
pH10的氨水-氯化铵缓冲溶液:称取氯化铵67.5g,溶于200mL去离子水中,加入900g·L-1氨水570mL,稀释至1L。
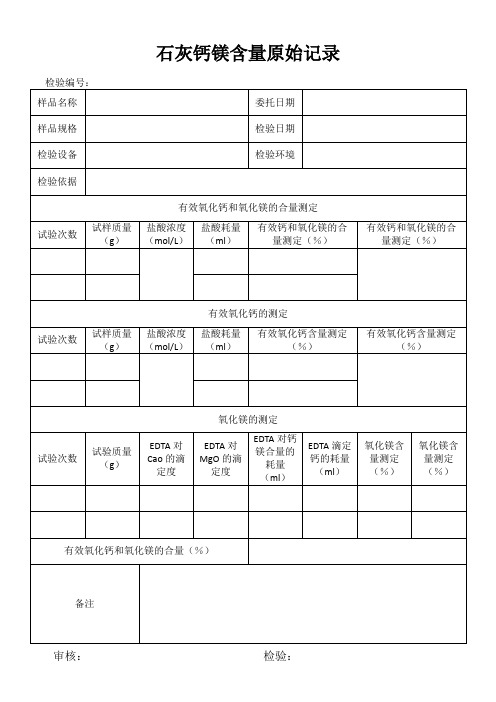

石灰、石灰石、白云石CaO、MgO的测定---过80目筛,孔径0.2mm一、试剂:1、盐酸(1+1)2、氯化铵:20%3、氨水:浓4、三乙醇胺:1:15、 PH=10的氨性缓冲溶液:67.5g氯化铵,570ml氨水,溶解后稀释至1000ml。
6、钙指示剂:称取钙指示剂1g氯化钠20g研细混匀。
7、镁指示剂:称取萘酚绿B0.5g酸性铬兰K0.4g于20gNaCl混合研细。
(或者1g铬黑T于20g氯化钠混合研细。
)二、操作步骤:称取0.2g试样,置于250ml烧杯中,用少许水润湿,加20ml盐酸,与电炉上溶解至清亮,加水50ml,加15ml氯化铵,加热近沸,取下用氨水调至大量铁铝沉淀(白色絮状,或者棕色颗粒状)出现,过量1-2ml,加热煮沸2-3分钟,取下冷却,过滤于200ml容量瓶中,稀释至刻度摇匀。
氧化钙的测定:吸取母液20ml置于300ml锥形瓶中,加水80ml,加1:1三乙醇胺5ml,加氢氧化钾20ml,钙指示剂少许,用EDTA滴定至纯兰色为终点。
氧化镁的滴定:吸取20ml 母液置于300ml 锥形瓶中,加水80ml ,加5ml 三乙醇胺,20ml 氨性缓冲溶液,镁指示剂少许,用EDTA 滴定至纯兰色为终点。
四、计算:1、 CaO%=100*20020*2.005608.0*11v m MgO%=100*20020*2.004032.0*)12(V V M式中:V1—滴定氧化钙时消耗EDTA 的体积。
V2—滴定氧化镁时消耗EDTA 的体积。
M —滴用EDTA 的摩尔浓度。
0.05608,0.04032—分别为CaO,MgO 的毫克分子量。
G —参加反应的试样量(g )五、注意事项1、每加一种试剂均需摇匀2、滴定钙镁时速度不宜过快,在接近终点应慢滴避免过量。

如何能准确地测定石灰有效钙镁含量及灰剂量[摘要] 结合试验规程及实践经验,阐述一下试验原理,关键点、注意点及公式的由来等,以便提高试验的准确性。
[关键词] 准确测定石灰有效钙镁含量灰剂量1 概述众所周知,石灰能改善土的工程性质,便于施工,也易达到规范要求,并且成本低,故越来越广泛地被应用于公路工程中,在京哈高速公路盘锦段,由于其低势低洼,常年积水、土质复杂、承载力极差,CBR值在1%—3%之间,路基施工极为困难,但自掺人了约6%的白灰后使其土的工程性能大大改观,土的塑性降低,含水量降低,提高了土的强度和稳定性,并大大地缩短了施工周期。
在京沪高速公路沧县段,由于其土质复杂,有高液限粘土、粉质土、砂性土,高液限粘土含水量大约在35%左右,水份难以蒸发,粉质土的强度及稳定性又极差,为了保证路基工程的质量,路基部分掺人了约3%的石灰后,不但保证了工程质量,而且大大加快了施工进度。
为了有效地控制灰土的质量,就必须能准确地对石灰的有效钙、镁含量和灰剂量进行测定,而在实际检测中,常出现以下几种异常现象:(1)试验人员对自己的试验结果不自信,如平行试验差值较大,做完后也不知是合格还是不合格;(2)石灰的有效钙镁含量或灰剂量实际已超出设计要求,可是做出的试验结果却不合格;(3)石灰的有效钙镁含量或灰剂量达不到设计要求,可做出试验结果合格,这样势必会给企业造成经济损失;如劣质石灰进场,灰剂量超标或灰剂量不够而造成质量隐患,要解决以上几个问题,我们除了要严格按试验规程认真试验外,还要对灰土的强度形成原理、试验原理及计算公式的由来进行充分的理解,只有这样才能知道试验的关键点,并且在试验过程中,会解决出现的反常问题,知道注意那些问题。
从而提高试验的准确性。
2 测试原理及方法由于测定石灰有效钙镁含量和灰剂量的试验方法很多,我仅对结合《公路工程无机结合料稳定材料试验规程》(JTJ057—94)中的几个常用试验加以剖析。
2.1 有效氧化钙的测定(T08011—94)2.1.1 测试原理:利用石灰中的氧化钙能溶于蔗糖中,并能与盐酸反应生成蔗糖钙,而氧化镁则与蔗糖反应缓慢的原理,来测定氧化钙的含量。


试验11石灰石中钙镁含量的测定在化学分析领域,准确测定石灰石中钙镁的含量具有重要意义。
石灰石作为一种常见的矿物质,其钙镁含量的测定对于评估其质量、确定其用途以及在工业生产中的合理应用都起着关键作用。
接下来,让我们详细探讨一下石灰石中钙镁含量的测定方法。
测定石灰石中钙镁含量的方法有多种,常见的包括络合滴定法和原子吸收光谱法等。
络合滴定法是一种经典且应用广泛的方法,其原理基于钙、镁离子与特定的络合剂发生定量反应。
首先,我们来了解一下实验所需要的试剂和仪器。
试剂方面,需要准备盐酸溶液、三乙醇胺溶液、氢氧化钾溶液、钙指示剂、EDTA 标准溶液等。
仪器则包括分析天平、移液管、容量瓶、滴定管等。
实验前的准备工作至关重要。
要将石灰石样品研磨至细小均匀的粉末,以确保样品的代表性和反应的充分性。
称取一定量的样品置于烧杯中,加入适量的盐酸溶液使其溶解。
溶解过程中要注意搅拌均匀,并适当加热以加速溶解。
溶解完成后,将溶液冷却至室温,转移至容量瓶中定容。
然后,吸取一定量的溶液置于锥形瓶中,加入三乙醇胺溶液以掩蔽干扰离子。
接着,加入氢氧化钾溶液调节溶液的 pH 值,使钙镁离子能够与络合剂更好地反应。
对于钙含量的测定,加入钙指示剂,用 EDTA 标准溶液进行滴定。
滴定过程中,溶液颜色由红色变为蓝色即为终点。
记录消耗的 EDTA标准溶液的体积,通过计算得出钙的含量。
测定镁含量时,在上述测定钙后的溶液中,再加入一定量的缓冲溶液,然后继续用 EDTA 标准溶液滴定至终点,计算出镁的含量。
在实验过程中,需要注意一些操作要点和误差控制。
例如,试剂的配制要准确,移液和滴定操作要规范,以减少误差。
同时,要对实验结果进行多次平行测定,以提高数据的准确性和可靠性。
实验数据的处理也非常重要。
通过计算得出钙镁的含量后,要对数据进行合理的分析和评估。
如果数据存在较大偏差,需要检查实验操作是否存在问题,或者重新进行测定。
此外,为了确保测定结果的准确性,还需要对实验所用的仪器进行定期校准和维护。
实验10 建筑材料石灰中钙镁含量测定教学目的与要求:1.学习盐酸直接滴定法测定钙镁含量的原理和方法;2.了解络合滴定法测定钙镁含量的原理和方法;3.让学生熟练掌握移取,称量,配制一定浓度标准溶液等操作;4.进一步熟练掌握滴定操作;5.学会如何合理的设计实验并培养学生的动手操作能力及创新意识。
教学重点与难点:重点:1.盐酸直接滴定法测定钙镁含量的原理和方法;2.培养学生的动手操作能力及创新意识。
难点:1.盐酸直接滴定法测定钙镁含量的原理和方法;2.盐酸直接滴定中反应条件的控制。
教学方法与手段:板书,学生操作,现场指导。
学时分配:3学时。
教学内容:898℃问题1:石灰有哪些用途?首先,概括一下在建筑、农业、工业上的用途,其中的熟石灰功不可没。
建筑:三合土、石灰浆(Ca(OH)2+CO2=CaCO3↓+H2O)。
农业:配制波尔多液作为农药(Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓)。
将适量的熟石灰加入土壤,可以中和酸性,改变土壤的酸碱性。
工业:制氢氧化钠(Ca(OH)2+Na2CO3=CaCO3↓+2NaOH)。
配制价格低廉的漂白粉(Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O)。
问题2:石灰的主要成分有哪些?石灰的主要成分是氧化钙(CaO),其次为氧化镁(MgO)。
问题3:建筑用石灰有哪些?建筑用石灰有:生石灰(块灰),生石灰粉,熟石灰粉(又称建筑消石灰粉、消解石灰粉、水化石灰)和石灰膏等几种形态。
问题4:测定石灰中钙镁含量的意义?根据石灰中钙、镁含量的高低,可以判断石灰的质量等级,并根据其含量计算其参加量,有效地利用资源。
问题5:测定石灰中钙镁含量的方法有哪些?测钙的方法:配位滴定法、酸碱滴定法(返滴定法和直接滴定法)、间接滴定法。
配位滴定法:酸碱滴定法:1、返滴定法:用过量的盐酸标准溶液直接滴在碳酸钙样品上,剩余的盐酸用标准氢氧化钠溶液滴定;2、直接滴定法:T0811-1994.(p35)间接滴定法:将CaCO3转化为CaC2CO4后,用H2SO4溶解,再用KMnO4标准溶液滴定,把C2O42-氧化为CO2,当把C2O42-氧化完全后,滴入的KMnO4溶液不再褪色。
石灰石中钙、镁含量的测定一. 实验目的1. 掌握配位滴定法测定石灰石中钙、镁含量的原理和方法。
2. 巩固配位滴定法中指示剂的选择和应用。
3. 进一步熟练滴定操作。
二. 实验原理石灰石的主要成分为CaCO3,同时还含有一定量的MgCO3、SiO2及Al、Fe、Si等杂质。
试样的分解可采用碱熔融的方法,制成溶液,分离除去SiO2和Fe3+、Al3+等杂质,然后测定钙和镁,这样手续太繁。
若试样中含酸不溶物较少,通常用酸溶解试样,不经分离直接用EDTA标准溶液进配位滴定,测定Ca2+、Mg2+含量,简便快速。
试样经酸溶解后,Ca2+、Mg2+离子共存于溶液中,Fe3+、Al3+等干扰离子,可用酒石酸钾钠或三乙醇胺掩蔽。
调节溶液的酸度至pH ≥12,使Mg2+生成氢氧化物沉淀。
加入钙示剂(蓝色)后先与Ca2+配位呈红色,滴定时,EDTA先与游离Ca2+配位,然后夺取已和指示剂配位的Ca2+使溶液的红色变成蓝色为终点,从EDTA标准溶液用量可计算CaO的含量。
另取一份试液,用酒石酸钾钠或三乙醇胺将Fe3+、Al3+等干扰离子掩蔽后,调节pH =10时,以铬黑T为指示剂,用EDTA滴定。
铬黑T(天蓝色)先与部分Mg2+配位为MgIn(酒红色)。
而当EDTA滴入时,EDTA首先与Ca2+和Mg2+配位,然后夺取MgIn中的Mg2+,使铬黑T游离,达到终点时,酒红色变成天蓝色,从EDTA 用量,计算样品中CaO、MgO总量。
三. 仪器与试剂仪器:电子分析天平(0.1mg)、移液管(25mL)、容量瓶250mL试剂:EDTA 标准溶液(0.02 mol·L−1),NaOH(10%),HCl(1:1 ),三乙醇胺水溶液(1:2),NH3·H2O-NH4Cl 缓冲溶液(pH =10),钙指示剂(1%),铬黑T(1%)。
四. 实验步骤1. 试液的制备准确称取试样0.25~0.30g 于250mL 烧杯中,加少量水湿润,盖上表面皿,从烧杯嘴中滴加1:1 HCl 4~6mL 至试样全部溶解。
石灰有效氧化钙和氧化镁含量步骤简易法仅供地方道路或工程量不大的工程采用。
标准法,石灰有效氧化钙含量分析天平0.0001g精度,滴定管50ml0.1ml精度,干燥箱,电炉,干燥器,三角瓶,研钵,表面皿,玻璃珠,漏斗,棕色广口瓶,托架天平0.1g,大肚移液管,玻璃棒,洗耳球,试剂勺。
试剂蔗糖,酚酞指试剂,0.1%甲基橙水溶液,0.5N盐酸标准溶液,碳酸钠。
称取0.800-1.000g在180℃烘干2h的碳酸钠,置于250ml三角瓶加100ml水完全溶解,加2-3滴甲基橙指示剂,用盐酸标准溶液滴定至黄色变为橙红色。
当量浓度N=Q/(V*0.053)NN为盐酸当量,Q为碳酸钠质量,V滴定消耗盐酸体积ml。
0.5g准确至0.0005g,放入干燥具塞三角瓶,取5g蔗糖,投入15粒玻璃珠,迅速加入新煮沸并冷却的蒸馏水50ml,震荡15min,用水冲洗瓶颈及瓶塞,加入2-3滴酚酞指示剂,以0.5N盐酸滴定,每秒2-3滴为宜,至粉红色消失,30s不复现。
有效氧化钙百分含量Xi=(0.028*V*N/G)*1000.028氧化钙毫克当量,V消耗盐酸体积,N盐酸当量浓度,G试样质量。
对同一石灰样品至少应做两次测定,平均值代表最终结果。
结果在30%之内时平行误差0.40%,30%-50%时平行误差0.50%,大于50%时平行误差0.60%。
标准法,石灰有效氧化镁含量试剂:盐酸,氢氧化铵,氯化铵,酸性铬蓝K,萘酚绿B,硝酸钾,EDTA二钠标,碳酸钙,氢氧化钠,钙试剂羟酸钠,硫酸钾,酒石酸钾钠,三乙醇胺。
1:10盐酸将1体积盐酸密度1.19,以10体积蒸馏水稀释。
氢氧化铵-氯化铵缓冲剂:67.5g氯化铵溶于300ml无二氧化碳蒸馏水加浓氨水(0.90)570ml,用水稀释至1000ml。
酸性铬蓝K-萘酚绿B(1:2)混合指示剂:称取0.3g酸性铬蓝K 和0.75g萘酚绿B与50g已在105℃烘干的硝酸银混合研细,并保存于棕色广口瓶。