应用电化学-4-1-金属电沉积和电镀原理讲课教案
- 格式:ppt
- 大小:4.32 MB
- 文档页数:34






〖第四节 金属的电化学腐蚀与防护〗之小船创作[明确学习目标] 1.了解金属腐蚀及其危害。
2.了解金属电化学腐蚀的原因及反应原理。
3.了解金属防护的一般方法,特别是电化学防护的方法。
一、金属的电化学腐蚀1.金属的腐蚀 金属腐蚀是指金属与周围的□01气体或液体物质发生□02氧化还原反应而引起损耗的现象。
一般可分为□03化学腐蚀和□04电化学腐蚀。
2.钢铁的电化学腐蚀二、金属的电化学防护1.牺牲阳极的阴极保护法 应用□01原电池原理,让被保护金属作□02正极,另找一种活泼性较强的金属作□03负极。
如图所示:2.外加电流的阴极保护法 利用□04电解原理,把被保护的钢铁设备作为□05阴极,用□06惰性电极作为辅助阳极,两者均在电解质溶液(海水)里,接外加□07直流电源。
3.牺牲阳极的阴极保护法的实验按如图所示连接好装置,往Fe 电极区滴入2滴K 3[Fe(CN)6](铁氰化钾)溶液(已知Fe 2+与[Fe(CN)6]3-反应生成蓝色沉淀),可以看到电压表指针□08发生偏转,Fe 电极上有□09气泡产生,没有蓝色沉淀生成,说明溶液中不含□10Fe 2+,Fe 受到□11保护。
1.家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑是如何形成的,其主要成分是什么?提示:铁锅中含有碳元素,在潮湿环境中生锈属于吸氧腐蚀,在腐蚀过程中,负极:Fe -2e -===Fe 2+,正极(C):2H 2O +O 2+4e -===4OH -,总反应为2Fe +2H 2O +O 2===2Fe(OH)2,Fe(OH)2极易被氧化,发生反应4Fe(OH)2+O 2+2H 2O===4Fe(OH)3。
Fe(OH)3进一步反应生成铁锈Fe 2O 3·n H 2O 。
2.结合金属腐蚀的本质,分析如何进行金属防护。
提示:金属腐蚀的本质是被氧化剂氧化变成金属阳离子。
金属防护的基本思路是:①防止金属与氧化性介质直接接触;②防止金属表面形成电解质溶液;③改善金属的内部结构;④利用电化学原理进行防护。



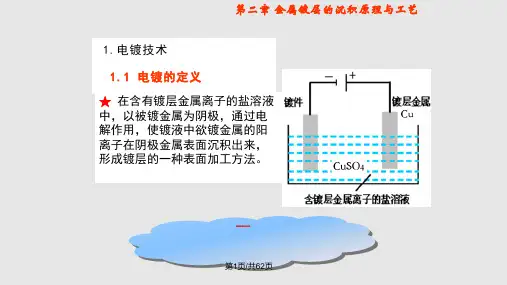
金属电沉积理论一.研究概况在电化学中,金属的电化学沉积学是一种最古老的学科。
在电场的作用下,金属的电沉积发生在电极和电解质溶液的界面上,沉积过程含有相的形成现象。
首先,在金属的电化学沉积实验的研究时间要追溯到19世纪,并且在引进能产生直流电的电源以后,电镀很快成为一种重要的技术。
电镀被用来制造各种不同的装饰性和功能性的产品,尽管在开始的早期,电镀技术的发展和应用建立是在经验的基础上。
金属电沉积的基本原理就是关于成核和结晶生长的问题。
1878年,Gibbs在他的著名的不同体系的相平衡研究中,建立了成核和结晶生长的基本原理和概念。
20世纪初,Volmer、Kossel、Stransko、Kaischew、Becker和Doring用统计学和分子运动模拟改进了基本原理和概念。
按照这些早期的理论,成核步骤不仅要求一个新的三维晶体成核,而且完美单晶表面的层状二维生长。
对于结晶理论的一个重要改进是由Avrrami提出的结晶动力学,他认为在成核和生长过程中有成核中心的重复碰撞和相互交迭。
在1949年,Frank提出在低的过饱和状态下的一个单一晶面成长会呈螺旋状生长。
Cabrera和Frank等考虑到在成长过程中吸附原子的表面表面扩散作用,完善了螺旋成核机理。
.20世纪二三十年代,Max、Volmer等人对电化学结晶进行了更为广泛的基础研究。
Erday-gruz和Volmer是第一次认识到过饱和度与过电位,稳态电流密度和由电荷转移引起的电结晶过电位之间的关系。
20世纪三四十年代,Finch和他的同事做了大量的关于多晶电化学沉积的实验,研究了决定结晶趋向与金属薄膜的组织结构的主要因素。
在这一时期,Gorbunova还研究了底层金属与电解质溶液组成对电结晶过程的影响,并发现了由于有有机添加剂的吸附作用可能导致金属晶须的生长。
1945年,Kaischew对电结晶理论做了重大改进。
考虑到单一晶体表面上金属原子的结合和分开的频率,可利用分子运动学模拟电化学结晶过程。

电化学沉积和电泳沉积电化学沉积和电泳沉积是两种常用的表面涂层技术,它们在材料科学、化学工程等领域有着广泛的应用。
下面将详细介绍这两种技术的原理、特点和应用。
1. 电化学沉积电化学沉积是一种利用电化学原理将金属离子还原成金属沉积在电极表面的技术。
在电化学沉积过程中,通常会将金属离子溶解在电解液中,通过外加电压使金属离子在电极表面还原成金属沉积。
电化学沉积具有以下特点:- 可控性强:通过调节电解液成分、电极材料和电压等参数,可以控制沉积层的厚度、结构和性质。
- 沉积速度快:电化学沉积的速度通常比化学气相沉积等传统涂层技术快。
- 可以实现均匀涂层:由于金属离子在电极表面还原成金属沉积,可以实现均匀的涂层。
电化学沉积在材料科学、电子器件制造等领域有着广泛的应用,例如制备导电薄膜、防腐蚀涂层等。
2. 电泳沉积电泳沉积是一种利用电场作用将带电颗粒沉积在电极表面的技术。
在电泳沉积过程中,通常会将颗粒悬浮在电解质溶液中,通过外加电压使颗粒在电场作用下沉积在电极表面。
电泳沉积具有以下特点:- 可以实现均匀分布:由于颗粒在电场作用下沉积,可以实现均匀分布在电极表面。
- 可以沉积复杂形状:由于颗粒在电场作用下运动,可以沉积复杂形状的涂层。
- 可以沉积多种材料:电泳沉积不仅可以用于金属颗粒的沉积,还可以用于陶瓷、聚合物等材料的沉积。
电泳沉积在材料科学、生物医学等领域有着广泛的应用,例如制备纳米颗粒、生物传感器等。
综上所述,电化学沉积和电泳沉积是两种重要的表面涂层技术,它们在材料科学、化学工程等领域有着广泛的应用,可以满足不同领域对涂层性能的要求。
在未来的研究中,这两种技术将继续发挥重要作用,推动材料科学和化学工程的发展。
电化学是从研究电能与化学能之间的相互转化开始的,目前已发展为一门重要的边沿学科,它与化学领域中的其他学科、物理、生物、电子等学科的紧密联系,出现电分析化学、有机电化学、催化电化学、量子电化学、半导体电化学、生物电化学等交叉学科,这些学科涉及能源、交通、材料、生命以及环境等重大问题的研究,推动着国民经济和科学技术的发展。
电极反应是电化学中的主要研究对象,是指在电子导体与离子导体界面上发生的有电子参加的氧化还原反应。
电极本身既是传递电子的介质,又是电极反应的场所。
通常将电流通过电极与溶液界面时所发生的一连串变化的总和,称为电极过程。
按反应类型来说,电极反应属于氧化还原反应,然而,由于这种反应是在电极表面上进行的,是特殊的异相氧化还原反应,它与一般的氧化-还原反应又有许多不同。
①分区进行。
由于反应中涉及的电子能通过电极和外电路传递,氧化反应和还原反应可以分别在阳极和阴极进行。
电极表面作为“反应地点”,起着相当于异相催化反应中催化剂表面的作用。
②电极表面上存在的双电层和表面电场(电极反应的特殊性)。
虽然在一般催化剂表面上也存在表面力场和电场,但电极表面的特点是我们可以在一定范围内任意地和连续地改变表面上电场的强度和方向,因而就可以在一定范围内随意地和连续地改变电极反应的活化能和反应速度。
换言之,在电极表面上我们有可能随意地控制反应表面的“催化活性”与反应条件。
根据电极反应的性质,电极过程可以分为阴极过程和阳极过程。
根据电极过程的研究对象的不同大致可分为以下三类:①金属电极过程,包括金属电沉积和金属溶解,例如Ni2++2e-=Ni(镀镍的阴极过程)和Cu(粗铜)=Cu2++2e-(铜电解精炼的阳极过程);②气体电极过程。
例如氢氧燃料电池中的两个电极反应:H2=2H++ 2e-和O2+2H2O+4e-=4OH-;③电解氧化还原,其实所有在电极上进行的反应都是氧化反应或还原反应,这里指的是除金属电极过程和气体电极过程以外的电极过程,而且其反应物和产物通常都是可溶的。
《金属的电化学腐蚀与防护》学历案一、学习目标1、理解金属电化学腐蚀的原理,包括吸氧腐蚀和析氢腐蚀。
2、掌握金属电化学防护的方法,如牺牲阳极的阴极保护法和外加电流的阴极保护法。
3、能够通过实验探究和分析,解释生活中常见的金属腐蚀现象,并提出相应的防护建议。
二、学习重难点1、重点(1)金属电化学腐蚀的原理。
(2)金属电化学防护的方法。
2、难点(1)吸氧腐蚀和析氢腐蚀的电极反应式书写。
(2)理解牺牲阳极的阴极保护法和外加电流的阴极保护法的工作原理。
三、知识回顾1、原电池的工作原理(1)原电池的构成条件:具有不同的电极材料、电解质溶液、形成闭合回路、自发进行的氧化还原反应。
(2)原电池的电极判断:较活泼的金属为负极,较不活泼的金属或能导电的非金属为正极。
(3)电极反应式的书写:负极发生氧化反应,正极发生还原反应。
2、电解池的工作原理(1)电解池的构成条件:外接电源、电解质溶液、形成闭合回路。
(2)电解池的电极判断:与电源正极相连的为阳极,与电源负极相连的为阴极。
(3)电极反应式的书写:阳极发生氧化反应,阴极发生还原反应。
四、新课导入在日常生活中,我们经常会看到金属制品生锈、腐蚀的现象,比如铁制的栏杆生锈、自行车的链条生锈等。
这些金属的腐蚀不仅影响了物品的外观和使用寿命,还可能造成安全隐患。
那么,金属为什么会发生腐蚀呢?又该如何防护金属的腐蚀呢?今天我们就来一起学习金属的电化学腐蚀与防护。
五、知识讲解1、金属的电化学腐蚀(1)定义金属的电化学腐蚀是指金属在电解质溶液中发生原电池反应而引起的腐蚀。
(2)分类①吸氧腐蚀在中性或弱酸性环境中,金属发生吸氧腐蚀。
例如,钢铁在潮湿的空气中生锈。
电极反应式:负极(Fe):Fe 2e⁻= Fe²⁺正极(C):O₂+ 2H₂O + 4e⁻= 4OH⁻总反应:2Fe + O₂+ 2H₂O = 2Fe(OH)₂②析氢腐蚀在酸性较强的环境中,金属发生析氢腐蚀。
例如,钢铁在酸洗时发生的腐蚀。