第二节 燃烧热 能源
- 格式:docx
- 大小:570.47 KB
- 文档页数:4

第一章 化学反应与能量第二节 燃烧热 能源1.木炭、氢气、酒精等燃料的燃烧均属于放热反应。
2.1mol H 2在O 2中充分燃烧生成液态水时,放出285.8 kJ 的热量,则该反应中表示生成1mol H 2O(l)的热化学方程式为H 2(g)+12O 2(g)===H 2O(l) ΔH =-285.8 kJ/mol 。
3.等质量的碳在氧气中完全燃烧比不完全燃烧放出的热量多(填“多”或“少”)。
4.化石燃料主要包括:煤、石油、天然气,它们均属于不可再生(填“可再生”或“不可再生”)能源。
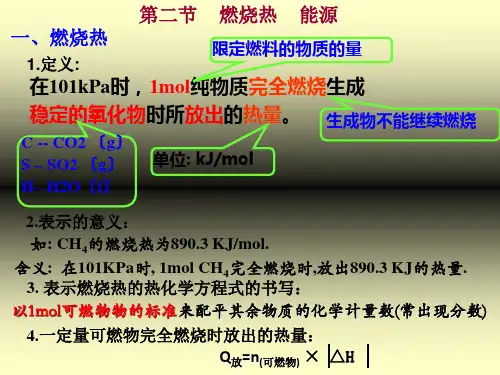
【学习新知】一、燃烧热1.定义25 ℃、101 kPa 时,1mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量。
2.单位燃烧热属于反应热的一种,单位为kJ/mol(或kJ·mol -1)。
3.意义25 ℃、101 kPa 时甲烷的燃烧热ΔH =-890.31 kJ/mol ,热化学方程式为CH 4(g)+2O 2(g)===CO 2(g)+2H 2O(l) ΔH =-890.31 kJ/mol 。
说明:1 mol 甲烷完全燃烧生成CO 2(g)和H 2O(l)时放出890.31 kJ 的热量。
[自我诊断]1.判断正误:(1)1 mol 可燃物在任何条件下完全燃烧生成稳定氧化物时放出的热量即为该可燃物的燃烧热。
(×)(2)燃烧热随化学方程式前的化学计量数的改变而改变。
(×)(3)1 mol H 2完全燃烧生成水蒸气放出的热量叫H 2的燃烧热。
(×)(4)12 g 碳在O 2中燃烧产生稳定的CO 气体,放出的总热量为碳的燃烧热。
(×)[探究释疑]1.对燃烧热的理解(1)外界条件:25 ℃、101 kPa 。
(2)可燃物用量:1 mol 。
(3)燃烧结果:C→CO 2(g)、H→H 2O(l)、S→SO 2(g)。
(4)表示方法:燃烧热是反应热的一种,ΔH 均小于零,文字叙述燃烧热时用“正值”或ΔH 表示,如甲烷的燃烧热为890.31 kJ/mol 或ΔH =-890.31 kJ/mol 。

第一章化学反应与能量第二节燃烧热能源教学目标:1.了解燃烧热概念,并能进行简单的计算。
2.知道化学反应中能量转化的原因,能说出常见的能量转化形式。
3.通过查阅资料说明能源是人类生存和发展的重要基础,了解化学在解决能源危机中的重要作用。
知道节约能源、提高能量利用效率的实际意义。
教学重点、难点:燃烧热概念及相关计算。
课时划分:一课时。
教学过程:[引言]复习热化学方程式的意义,书写热化学方程式的注意事项,引入新课。
[[板书]第二节燃烧热能源一、燃烧热[讲述]反应热种类:燃烧热、中和热、溶解热等[板书]1.定义:在25℃, 101 kPa时,lmol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
[学生讨论、归纳概念要点](1)在25℃,101 kPa时,生成稳定的氧化物。
如C完全燃烧应生成CO2(g),而生成CO(g)属于不完全燃烧。
又如H2燃烧生成液态 H2O,而不是气态水蒸气。
(2)燃烧热通常是由实验测得的。
(3)可燃物以lmol作为标准进行测量。
(4)计算燃烧热时,热化学方程式常以分数表示。
例:H2(g)十21O2(g)=H2O(l);△H=-285.8kJ/mol[板书]2.研究物质燃烧热的意义了解化学反应完成时产生热量的多少,以便更好地控制反应条件,充分利用能源。
[投影][思考与交流]应根据什么标准来选择燃料?[汇报]1、根据物质的燃烧热、燃料的储量、开采、储存的条件、价格、对生态环境的影响等综合考虑。
2、表中较理想的燃料是:氢气、甲烷、甲醇等。
[板书]3.有关燃烧热的计算[投影]例:10 g 硫磺在 O 2中完全燃烧生成SO2气体,放出的热量能使 500 g H 2O温度由18℃升至62.4℃,则硫磺的燃烧热为 ,热化学方程式为 。
[分析讨论]10 g 硫磺燃烧共放出热量为:Q = m ·C(t 2-t 1)=500 g × 4.18 × 10-3kJ/(g ·℃)(62.4-18) ℃= 92.8kJ ,则lmol(32g)硫磺燃烧放热为gmol g kJ 10328.921-⋅⨯=-297 kJ/mol ,硫磺的燃烧热为297 kJ/mol ,热化学方程式为:S(s) + O 2(g) = SO 2(g);△H=-297 kJ/mol[板书]二、能源[指导学生阅读教材]我国能源状况[回答]能源就是____________,它包括____________。








第二节 燃烧热 能源一、知识归纳1.燃烧热⑴在101KPa 时,1mol 物质完全燃烧生成稳定的氧化物时所放出的热量,为该物质的燃烧热。
⑵在理解物质燃烧热的定义时,要注意以下几点:①研究条件: 25℃ ,101 kPa②反应程度:完全燃烧,产物是稳定的氧化物。
③燃烧物的物质的量:1 mol④研究内容:放出的热量。
(ΔH<0,单位kJ/mol )⑤在未有特别说明的情况下,外界压强一般指25℃ ,101 kPa.所谓完全燃烧也是完全氧化,它是指物质中的下列元素完全转变成对应的稳定物。
如: C→CO 2(g)、H → H 2O (l )、S → SO 2 (g )如:25℃、101 kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol 、285.8 kJ/mol 、890.3 kJ/mol 、2800 kJ/mol,热化学方程式如下: C(s)+21O 2(g) = CO 2(g);△H = -393.5 kJ/mol H 2(g) +12O 2(g) = 2H 2O(l);△H = -285.8 kJ/mol CH 4(g) + 2O 2(g) = CO 2(g) + 2H 2O(l);△H = -890.3 kJ/molC 6H 12O 6(s) + 6O 2(g) = 6CO 2(g) + 6H 2O(l);△H = -2800 kJ/mol2.中和热在稀溶液中,强酸和强碱发生中和反应生成1mol H 2O 时所放出的热量。
H +(aq )+ OH -(aq )= H 2O (1) ΔH = -57.3KJ ·mol -13.能源1)能源分类①化石燃料(煤、石油、天然气)、阳光、风力、流水、潮汐以及柴草等。
②新能源:太阳能、氢能、风能、地热能、海洋能和生物能。
2)节约能源的重要措施:科学地控制燃烧反应,使燃料充分燃烧,提高能源的利用率。
3)化石燃料气解决的办法:即开发新能源,节约现有能源,提高能源的利用率。
二、例题[例1]已知H +(aq)+OH -(aq)=H 2O(l);△ H=-57.3kJ/mol ,求下列中和反应中放出的热量。
(1)用20gNaOH 配稀溶液跟足量稀盐酸反应放出____________ kJ 的热量。
(2)用2molH 2SO 4配稀溶液跟足量稀NaOH 反应,放出____________kJ 的热量。
[例2]已知热化学方程式:① H 2 (g) + O.5 O 2 (g) == H 2O (g) ΔH= - 241.8 kJ ·mol -1② 2H 2 (g) + O 2 (g) == 2H 2O (g) ΔH= - 483.6 kJ ·mol -1③ H 2 (g) + O.5 O 2 (g) == H 2O (l) ΔH= - 285.8 kJ ·mol -1④ 2H2 (g) + O2 (g) == 2H2O (l) ΔH= - 571.6 kJ·mol-1则氢气的燃烧热为()A.241.8 kJ·mol-1B.483.6 kJ·mol-1C.285.8 kJ·mol-1D.571.6 kJ·mol-1[例3]常见的热化学方程式①CaCO3(s)=CaO+CO2(g);ΔH=177.7kJ②C(g)+H2O(g)=CO(g)+H2(g);ΔH=-131.3kJ/mol③0.5H2SO4(l)+NaOH(l)=0.5Na2SO4(l)+H2O(l);ΔH=-57.3kJ/mol④C(s)+O2(g)=CO2(g);ΔH=-393.5kJ/mol⑤CO(g)+1/2O2(g)=CO2(g);ΔH=-283kJ/mol⑥HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l);ΔH=-57.3kJ/mol⑦2H2(g)+O2(g)=2H2O(l);ΔH=-571.6kJ/mol(1)上述热化学方程式中,不正确的有,不正确的理由分别是:。
(2)根据上述信息,写出C转化为CO的热化学方程式:。
(3)上述反应中,表示燃烧热的热化学方程式有(),表示中和热的热化学方程式有()。
三、课堂练习1.已知:OH-(aq)+ H+(aq)==== H2O(l);△H=-57.3kJ/mol 有以下4个化学方程式①2NaOH(aq)+ H2SO4(aq)====Na2SO4(aq)+ 2H2O(l)②Ba(OH)2(aq)+ H2SO4(aq)====BaSO4↓+ 2H2O(l)③NH·H2O(aq)+ HCl(aq)NH4Cl(aq)+ H2O(l)3·H2O(aq)+ CH3COOH(aq)CH3COONH4(aq)+ H2O(l)④NH3其中反应热为-57.3kJ/mol的是( )A.①②B.③C.④D.以上均不是2.已知充分燃烧a g乙炔气体生成1molCO2气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()A.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-2b kJ/molB.C2H2(g)+5/2O2(g) 2CO2(g)+H2O(l);△H=+2b kJ/molC.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-4b kJ/molD.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=+b kJ/mol3.根据热化学方程式:S(s)+O2(g) =SO2(g);△H=-297.23 kJ/mol ,下列说法正确的是()A.1molSO2 (g)的能量总和大于1molS(s)和1mol O2(g)的能量总和B.1molSO2(g)的能量总和小于1molS(s)和1molO2(g)的能量总和C.S(g)+O2(g) =SO2(g);△H=-Q kJ/mol ;Q的值大于297.23D .S(g)+O 2(g) = SO 2(g);△H = -Q kJ/mol ; Q 的值等于297.234.25℃、101 k Pa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol 、285.8 kJ/mol 、890.3 kJ/mol 、2800 kJ/mol ,则下列热化学方程式正确的是 ( )A .C(s)+21O 2(g)=CO(g);△H =-393.5 kJ/mol B .2H 2(g)+O 2(g)=2H 2O(g);△H =+571.6 kJ/molC .CH 4(g)+2O 2(g)=CO 2(g)+2H 2O (g);△H =-890.3 kJ/molD .1/2 C 6H 12O 6(s )+3O 2(g)=3CO 2(g)+3H 2O(l);△H =-1400 kJ/mol四、课后练习1.甲醇属于再生能源,可代替汽油作为汽车燃料。
下列能正确表示甲醇燃烧热的热化学方程式为( )A .CH 3OH(l)+23O 2(g)=CO 2(g)+2H 2O(l);△H =+763.3kJ ·mol -1 B .CH 3OH(l)+23O 2(g)=CO 2(g)+2H 2O(l);△H =-763.3kJ ·mol -1 C .CH 3OH(l)+23O 2(g)=CO 2(g)+2H 2O(g);△H =-675.3kJ ·mol -1 D .2CH 3OH(l)+3O 2(g)=2CO 2(g)+4H 2O(l);△H =-1526.6kJ·mol -12.已知:H +(aq)+OH -(aq)H 2O(l);ΔH =-57.3 kJ ·mol -1,计算下列中和反应中放出的热量。
(1)用20 g NaOH 配成稀溶液跟足量的稀盐酸反应,能放出 kJ 的热量。
(2)用0.1 mol Ba(OH)2配成稀溶液跟足量的稀硝酸反应,能放出 kJ 的热量。
(3)用1.00 L 1.00 mol ·L -1醋酸溶液与2.00 L 1.00 mol ·L -1 NaOH 溶液反应,放出的热量(填大于、小于或等于) 57.3 kJ 理由是:。
3.下列热化学方程式中△H 的绝对值能表示可燃物的燃烧热的是( )A .H 2(g )+Cl 2(g )=2HCl (g ); △H=-184.6kJ/molB .CH 4(g )+2O 2(g )=CO 2(g )+2H 2O (g );△H=-802.3kJ/molC .2H 2(g )+O 2(g )=2H 2O (l ); △H=-571.6kJ/molD .CO (g )+1/2O 2(g )=CO 2(g ); △H=-283kJ/mol4.已知31g 白磷变成红磷放出18.39kJ 热量,下列两反应中:( )4P (白、S )+5O 2(g )=2P 2O 5(s ),△H=Q 1 KJ/mol4P (红、S )+5O 2(g )=2P 2O 5(s ),△H=Q 2 KJ/mol则Q 1和Q 2的关系是:A .Q 1>Q 2B .Q 1=Q 2C .Q 1<Q 2D .无法确定 5.20世纪30年代,Eyring 和Pelzer 在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。
分析图中信息,回答下列问题:(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:。
在反应体系中加入催化剂,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”),对反应热是否有影响?_______________,原因是_________。
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。
根据图二回答下列问题:① P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式。
PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式。
② P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2______△H1(填“大于”、“小于”或“等于”),原因是。
图一图二。