快速体外分离、长期培养人Th17细胞
- 格式:doc
- 大小:25.50 KB
- 文档页数:2


快速体外分离、长期培养人Th17细胞方法1.Subject全血2.CD4+T细胞浓缩采用RosetteSep(StemCell Technologies,Canada)进行阴性选择得到浓缩CD4+T细胞。
建立标准密度梯度离心,分离出淋巴细胞3.CD4+T细胞刺激将浓缩的CD4+T细胞悬浮在RPMI1640培养基中(Sigma),包含青霉素/链霉素,L-谷氨酰胺,HEPES缓冲液和10%小牛血清(R10),浓度为1×106个细胞/ ml.含 3×106个细胞的3mlR10,在15ml Falcon管中,用每毫升含4μL(1mg/ml)PMA和2μL(1mg/ml)伊沃诺霉素(AG Scientific,San Diego,CA)的细胞溶液刺激。
继而加入总量3μL的包含CD49d (1mg/ml)和CD28(0.5mg/ml)的共刺激抗体(BD Biosciences)。
随后细胞在37℃、5%CO2条件下孵化3个半小时。
阴性对照采用相似方法,但用R10替换PMA和伊沃诺霉素。
为了用细胞内细胞因子标记法测量IL-17产量,浓缩的CD4+T细胞用10μL Brefeldin A(1mg/ml)刺激。
4.IL-17捕捉复合物的准备IL-17捕捉复合物由2个生物素标记的抗体组成,2个抗体通过一个抗生物素蛋白分子连接。
直接连在T细胞表面CD45分子的抗体与IL-17抗体配对。
2μL生物素标记的CD45抗体(clone H130)(Caltag,Invirtrogen,CA)和20μL生物素标记的IL-17抗体(0.5mg/ml)(clone:eBio64DEC17)(ebiosciences,CA)混合加入eppendorf管,并彻底漩涡。
然后,加入2μL未作标记的5mg/ml的生物素(Invitrogen,CA),并立即充分混匀。
复合物在室温下孵化10分钟,使用前再次漩涡。
5.IL-17体外捕获分析被刺激过的细胞用含有2%小牛血清(2%FCS/PBS)的冰冻PBS(Cellgro ,Mediatech,V A),冲洗,以500×克离心10分钟成小球,上清液被完全吸出。

Th17细胞、调节性T细胞、Th1细胞平衡失调与As病情活动度的关系张海龙;张俊英;晋学英;牛敬宪;黎珍娟;张凤兰【摘要】Objective To investigate the relationship of immune imbalance with Ankylosing Spondylitis ( AS) patients with disease activity ( ASDAS) of Th17 cells,Th1 cell,regulatory T cells ( Treg) . Methods The cell tstions of blood CD4 + Th17, CD4 + Th1 and CD4 + CD25 + Treg of ASpatients(n=60)and control group(n=60)were detected with flow cytometry. The levels of interleukin -6, IL-8, IL-17, IL-23, (IL-6, IL-8, IL-17, IL-23) and tumor necrosis fact orα (TNFα) were Measured with ELISA. The relation-ship of immune imbalance of Th1,Th17 and Treg cell between ASDAS were analyzed. Results The levels of CD4 + Th1 and CD4 + CD25 + Treg cell of AS group were lower than control group(P<0. 05). The lev-els of IL-6,IL-17, IL-23 and TNFαof AS group were higher than control group(P<0. 05). The levels of CD4 +Th17,IL-6,IL-17,IL-23 and TNFαof severe group (ASDAS≥2. 1) were higher than stable disease ( ASDAS <1. 3) group and moderate disease activity group (1. 3≤ASDA S<2. 1) . and the levels of CD4 +Th1, CD4 + CD25 + Treg cells of severe group (ASDAS≥2. 1) were lower than stable disease (ASDAS <1. 3) group and moderate disease activity group (1.3≤ASDAS<2. 1),the differences were all statistically significant (P<0. 05). By Pearson correlation analysis shows, IL-6 (r = 0. 412, P = 0. 000), IL-17 (r= 0.396, P = 0.000), IL-23 (r = 0.384, P = 0.000) and TNFα(r = 0.318, P = 0.004) were positively correlated with ASDAS. Conclusion AS presence of Th1 cellsin patients , Th17 cells and Treg cell immune imbalance, and has a close relationship with the degree of ASDAS AS patients, can provide guidance for the prevention and treatment of AS.%目的:探讨效应CD4+T细胞分泌的Th1细胞、Th17细胞及调节性T细胞( Treg)免疫平衡失调与强直性脊柱炎( AS)患者强直性脊柱炎疾病活动评分( ASDAS)的关系。

特应性皮炎的细胞、皮肤模型构建方法研究进展邵钲超,魏明镜,万昊悦,王奕恒,陈文琦南京医科大学附属南京医院南京市第一医院皮肤科,南京210006摘要:特应性皮炎(AD)是一种常见的慢性炎症性皮肤病,表皮屏障破坏和辅助性T细胞2免疫反应失调被认为在该疾病发病中发挥重要作用。
体外疾病模型已成为研究AD越来越流行的方法,最简单的模型是单细胞培养模型,可揭示不同细胞类型在AD病理过程中的参与程度、调节网络和信号通路,有助于理解AD的发病机制和病理生理过程。
二维共培养模型将不同类型的细胞在二维培养基质上共同培养以模拟表皮细胞与免疫细胞的相互作用。
三维模型则提供了更为复杂与真实的生理环境,在三维空间中模仿人类皮肤特征,再现细胞因子与药物在真实皮肤组织中的输送和分布。
随着对神经—免疫—皮肤相互作用在AD炎症反应中作用的认识不断加深,一种芯片上皮肤系统装置正在开发中。
目前还没有一种体外疾病模型能够完全模拟AD的整体特征。
在进行AD相关研究时需要考虑多种可用模型优缺点的平衡。
关键词:特应性皮炎;皮肤模型;细胞模型;芯片上皮肤;人体皮肤等效物doi:10.3969/j.issn.1002-266X.2024.08.028中图分类号:R751 文献标志码:A 文章编号:1002-266X(2024)08-0111-05特应性皮炎(AD)是由辅助性T细胞2(Th2)驱动的慢性炎症性疾病,为充分了解其炎症过程,研究者们常选用小鼠、豚鼠、犬等动物作为实验对象。
目前动物模型的构建方法主要包括自发性AD模型、致敏剂诱导AD模型及基因方法建立AD模型,但都无法避免动物和人类在解剖、生理和免疫系统方面的差异[1-2]。
尽管动物模型能够模拟AD的一些特征如皮肤炎症、角化异常和免疫细胞浸润,但可能无法完全模拟AD的过敏性变态反应的复杂性和慢性过程。
此外,由于药物代谢差异,在动物模型中观察到的药物效果未必能准确预测人体应用效果,导致研究成果的转化性较差。

2023神经酰胺及神经酰胺合成酶在哮喘中的作用摘要神经酰胺是鞘脂代谢的中心,也是一种重要的信号分子,参与细胞分化、增殖、凋亡和迁移等多种生物功能。
神经酰胺合成酶介导神经酰胺的合成。
哮喘是一种以气流阻塞、气道高反应性和肺部炎症为特征的慢性气道疾病,极大地影响了患者的生活质量,是重要的公共卫生问题。
研究表明,神经酰胺在哮喘的病理生理发展中发挥重要作用。
本文重点讨论神经酰胺对参与哮喘发病的多种细胞的影响,以及不同种类神经酰胺作用的差异性,以期为人们更好地了解哮喘及寻找哮喘潜在治疗靶点提供理论基础。
关键词:哮喘;神经酰胺类;综述文献(主题)支气管哮喘严重影响人们的生活质量及健康状况。
我国20岁及以上人群哮喘患病率为4.2%,患者总数达4570万例,处于高患病率、低治疗率、低控制率的阶段。
哮喘在全球造成残疾生活年限的主要疾病中排名第16位,在疾病负担的主要疾病中排名第28位,是重大公共卫生问题。
哮喘是一种以慢性气道炎症和气道高反应性(airwayhyperreactivity z AHR)为特征的异质性疾病,主要表现为反复发作的喘息、气急、胸闷或咳嗽等。
哮喘的发病由多种炎症细胞、炎症介质和细胞因子共同参与。
鞘脂是一类复杂的脂质,是细胞膜的重要结构成分,参与细胞内外信号转导,涉及细胞的增殖、分化、凋亡、转移及血管生成、免疫细胞转运等多种生物学效应。
迄今为止,鞘脂已经在多种人类疾病中进行了研究,表现出极大的结构和功能多样性。
神经酰胺是鞘脂代谢的中心,由神经鞘氨醇长链碱基和可变长链的脂肪酸组成。
神经酰胺主要有3种合成途径:(1)从头合成途径:由丝氨酸棕桐酰转移酶(Serinepa1mitoy1transferase,SPT)将1-丝氨酸和棕楣酰-CoA缩合为3-酮二氢鞘氨醇为起始步骤,之后经一系列酶的作用下生成神经酰胺;(2)鞘磷脂酶途径:鞘磷脂酶将鞘磷脂水解生成神经酰胺;(3)补救途径:先将复杂的鞘脂转化为鞘氨醇,然后通过鞘氨醇的再酰化生成神经酰胺。
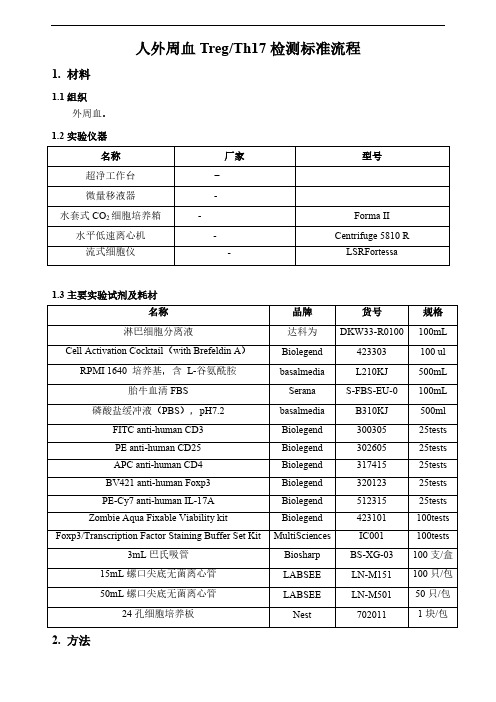
人外周血Treg/Th17检测标准流程1.材料1.1组织外周血。
1.2实验仪器名称厂家型号超净工作台-微量移液器-水套式CO2细胞培养箱-Forma II 水平低速离心机-Centrifuge 5810 R流式细胞仪-LSRFortessa1.3主要实验试剂及耗材名称品牌货号规格淋巴细胞分离液达科为DKW33-R0100 100mL Cell Activation Cocktail(with Brefeldin A)Biolegend 423303 100 ul RPMI 1640 培养基,含L-谷氨酰胺basalmedia L210KJ 500mL 胎牛血清FBS Serana S-FBS-EU-0100mL 磷酸盐缓冲液(PBS),pH7.2 basalmedia B310KJ 500ml FITC anti-human CD3 Biolegend 300305 25testsPE anti-human CD25 Biolegend 302605 25testsAPC anti-human CD4 Biolegend 317415 25testsBV421 anti-human Foxp3 Biolegend 320123 25testsPE-Cy7 anti-human IL-17A Biolegend 512315 25tests Zombie Aqua Fixable Viability kit Biolegend 423101 100tests Foxp3/Transcription Factor Staining Buffer Set Kit MultiSciences IC001 100tests 3mL巴氏吸管Biosharp BS-XG-03 100支/盒15mL螺口尖底无菌离心管LABSEE LN-M151 100只/包50mL螺口尖底无菌离心管LABSEE LN-M501 50只/包24孔细胞培养板Nest 702011 1块/包2.方法2.1外周血准备EDTA-K2抗凝外周血2~4mL。
中国组织工程研究与临床康复第15卷第44期 2011–10–29出版Journal of Clinical Rehabilitative Tissue Engineering Research October 29, 2011 Vol.15, No.44 ISSN 1673-8225 CN 21-1539/R CODEN: Z LKHAH8285 1ReproductiveMedical Center,Renmin Hospital of Wuhan University, Wuhan 430060,Hubei Province, China; 2Departmentof Nephrology, Tongji Hospital, TongjiMedical College, Huazhong Universityof Science and Technology, Wuhan 430030, Hubei Province, ChinaYin Tai-lang☆,Studying for doctorate, Reproductive Medical Center, Renmin Hospital of Wuhan University, Wuhan 430060, Hubei Province, China reproductive@126.comCorrespondence to: Yang Jing, Doctor, Professor, Chief physician, Reproductive Medical Center, Renmin Hospital of Wuhan University, Wuhan 430060, Hubei Province, China Correspondence to:He Fan, Doctor, Lecturer, Departmentof Nephrology, Tongji Hospital, TongjiMedical College, Huazhong Universityof Science and Technology, Wuhan 430030, Hubei Province, China Received:2011-07-25 Accepted:2011-09-13三种不同方法体外诱导CD4+T细胞向Th17细胞分化与增殖的效率☆尹太郎1,邹宇洁1,杨菁1,何凡2,李赛姣1,吴庚香1,李星1,王雅琴1,罗金1,李维1,徐望明1Comparison of differentiation and proliferation efficiency from CD4+ cells to Th17 cells induced by three different methodsYin T ai-lang1, Zou Yu-jie1, Yang Jing1, He Fan2, Li Sai-jiao1, Wu Geng-xiang1, Li Xing1, Wang Ya-qin1, Luo Jin1, Li Wei1, Xu Wang-ming1AbstractBACKGROUND: Th17 cells participate in the occurrence of many inflammatory diseases, but their induced differentiationefficiency remains poorly clear.OBJECTIVE: To compare the differentiation and proliferation efficiency from CD4+ cells to Th17 cells induced by three differentmethods.METHODS: Three methods to induce Th17 cells in vitro are as follows: (1) stimulation with CD3 and CD28 antibodies followed byaddition of interleukin (IL)-6 and transforming growth factor-β (TGF-β) in the culture medium and finally culture for 3 days; (2)based on method (1), addition of extra IL-1β and tumor necrosis factor-α (TNF-α) and culture for 3 days; (3) based on method (2),washing out previous cytokines on the 3rd day, culture for 2 days, stimulation with CD3 and CD28 antibodies again, addition ofIL-23 and finally culture for 3 days.RESULTS AND CONCLUSION: The proportion of Th17 cells in CD4+T cells was (8.5±2.8)%, (26.9±4.3)%, and (44.3±5.5)% afterinduced by three above-mentioned methods, respectively, with significant difference among these three methods (P < 0.01).These findings suggest that addition of IL-1β, TNF-α and IL-23 into the culture medium facilitates the induced differentiation fromCD4+ cells to Th17 cells.Yin TL, Zou YJ, Yang J, He F, Li SJ, Wu GX, Li X, Wang YQ, Luo J, Li W, Xu WM. Comparison of differentiation and proliferationefficiency from CD4+ cells to Th17 cells induced by three different methods. Zhongguo Zuzhi Gongcheng Yanjiu yu LinchuangKangfu. 2011;15(44): 8285-8288. [ ]摘要背景:研究认为Th17细胞参与了许多炎症性疾病的发生,但其体外诱导分化效率尚不明确。
Th2表达的细胞因子(如IL-4、IL-5、IL-9及IL-13)在其免疫应答过程中发挥重要作用。
近年来,人们对IL-9在Th2型免疫应答中作用给与了更多的关注。
过去人们一直认为IL-9属于Th2类细胞因子,最近,在《NatureImmunology》上先后登载了两篇独立鉴定出“Th9”细胞(即分泌IL-9的Th细胞)的文章,可能为已有的Th细胞亚群又添新成员。
1IL-9的结构IL-9最初被认为是一种T淋巴细胞生长因子,人IL-9mRNA全长591bp,小鼠IL-9mRNA全长536bp。
人和小鼠的IL-9基因结构类似,均含5个外显子,其蛋白质水平有55%的氨基酸同源性。
IL-9受体(IL-9R)属共Y链的细胞因子受体家族,由一条特异性的a链(IL-9R a)和一条Y链组成⑴。
IL-9与其受体结合后,可激发JAK1、JAK3相互磷酸化,进而促使STAT磷酸化,形成STAT1-STAT3异源二聚体、STAT1同源二聚体和STAT5同源二聚体并进入细胞核内,启动一系列相关基因转录表达,发挥相应的生物学作用[2]。
2IL-9的细胞来源2.1Th2细胞研究发现,小鼠Th2细胞亚群可分泌高水平的IL-9,IL-9的表达水平与Th2细胞的扩增程度相关。
Th2细胞亚群分泌IL-9的水平与IL-4正相关,阻断IL-4后,Th2细胞表达IL-9的水平下降[3]。
Chang等[4]报道,体外Th2细胞亚群共表达IL-4和IL-9,但体内实验尚未证实Th2细胞亚群能同时表达IL-4和IL-9。
2.2Th9细胞2008年底,Stockinger实验室和Kuchroo实验室同时发现了一群新的效应T细胞亚群Th9,以分泌细胞因子IL-9和IL-10为典型特征[5,6]。
Th9细胞分泌IL-9受IL-25的调控,Angkasekwinai发现,小鼠哮喘模型中,IL-25能增强Th9细胞分泌IL-9,反之,阻断IL-25则降低IL-9的表达水平⑺。
骨髓间充质干细胞对重症哮喘患儿外周血Th17/Treg 的免疫调节作用黄雪琼;檀卫平;吴葆菁;蓝丹;吴海飞;麦贤弟【摘要】目的:探讨骨髓间充质干细胞( MSCs )在体外对重度哮喘患儿外周血辅助性T细胞17( Th17)和CD4+CD25+调节性T细胞(Treg)的免疫调节作用。
方法:体外分离、培养和鉴定MSCs。
MSCs经丝裂霉素处理后按不同比例(1∶1、1∶2、1∶10和1∶20)与哮喘患儿外周血T淋巴细胞(TLC)直接接触共培养,检测各组MSCs 对TLC的增殖调节作用。
选取上述1∶2比例共培养体系和单独TLC培养体系,ELISA法分别检测Th17的效应分子白细胞介素17( IL-17)和Treg效应分子转化生长因子β( TGF-β)水平,qRT-PCR法检测转录因子维甲酸相关孤儿核受体(RORC)及叉头框蛋白3(Foxp3)mRNA表达水平。
结果:MSCs 可显著抑制重度哮喘患儿TLC增殖,且随着MSCs数量的增加,抑制作用增强。
MSCs +TLC共培养组Th17转录因子RORC mRNA和效应因子IL-17表达较TLC组下降,同时TGF-β表达增高,而Treg细胞调控基因Foxp3 mRNA表达无明显改变。
结论: MSCs在体外可能通过抑制Th17分化及IL-17的分泌,同时上调TGF-β的表达,进而有效改善哮喘患儿的Th17/Treg失衡状态。
%AIM: To investigate the regulatory function of bone marrow-derived mesenchymal stem cells (MSCs) on T helper 17 cells (Th17) and regulatory T cells (Treg) in peripheral blood of severe asthmatic children . METHODS:MSCs were isolated , cultured and identified in vitro.MSCs digested with mitomycin were cocultured with T lymphocytes (TLC) at different ratios (1∶1, 1∶2, 1∶10 and 1∶20) from severe asthmatic c hildren for 72 h.The prolifera-tion of TLC was measured by CCK-8 method.In thecoculture system of the 1∶2 ratio and the single TLC system , the super-natant levels of interleukin-17 (IL-17) and transforming growth factor-β(TGF-β) were measured by ELISA.Th e mRNA expression of retinoic acid-related orphan nuclear receptor C (RORC) and forkhead box protein 3 (Foxp3) in TLC was de-tected by qRT-PCR.RESULTS:After cocultured with MSCs , the proliferation of TLC decreased significantly in a dose-dependent manner (P<0.05).It also showed decreases in IL-17 (3 799 ±441 vs 4 890 ±373, P<0.05) and RORC mRNA level (1.21 ±0.14 vs 3.85 ±0.48, P<0.05), while an increase in TGF-βlevel (209 ±32 vs 117 ±26, P<0.05) was observed.No influence on the mRNA expression of Foxp3 was found (P>0.05).CONCLUSION: MSCs suppresses Th17 polarization of naive peripheral blood CD 4 +T cells and matures Th17 cells secreting IL-17, which may ef-fectively revise Th17/Treg imbalance of asthma .【期刊名称】《中国病理生理杂志》【年(卷),期】2014(000)009【总页数】5页(P1694-1697,1702)【关键词】间充质干细胞;哮喘;Th17细胞;调节性T细胞【作者】黄雪琼;檀卫平;吴葆菁;蓝丹;吴海飞;麦贤弟【作者单位】中山大学孙逸仙纪念医院儿科,广东广州510120; 中山大学附属第一医院儿童重症监护室,广东广州510080;中山大学孙逸仙纪念医院儿科,广东广州510120;中山大学孙逸仙纪念医院儿科,广东广州510120;中山大学孙逸仙纪念医院儿科,广东广州510120;中山大学孙逸仙纪念医院儿科,广东广州510120;中山大学孙逸仙纪念医院儿科,广东广州510120【正文语种】中文【中图分类】R725.6哮喘是儿童常见的气道慢性炎症性疾病。
综述Th17细胞生物学功能及与心血管疾病关系的研究进展崔瑶秦明照传统上CD4+T 细胞分为辅助性T 细胞(Th)1和Th2细胞亚群。
Th1产生干扰素(IFN )和白细胞介素(I L)2,活化巨噬细胞介导细胞免疫;Th2产生IL 4、I L 5和I L 13,活化嗜酸性粒细胞介导体液免疫。
但是,IFN缺陷鼠或IFN R 缺陷鼠无IFN 信号,仍可发生自身免疫病。
这说明还有另一Th 细胞亚群参与诱导自身免疫,此亚群细胞产生I L 17、IL 6和肿瘤坏死因子(T NF ),被称为Th17细胞亚群[1],在自身免疫性疾病,某些细菌、病毒和寄生虫等感染性疾病及肿瘤中起着重要的调节作用。
近年来越来越多试验发现Th17可能参与动脉粥样硬化(AS)斑块不稳定和急性冠状动脉综合征(ACS )的发病。
在此拟就Th17的分化和生物学功能,细胞因子调控和心血管疾病做一综述。
一、Th17的分化和生物学功能近期已能在健康人外周血中分离出Th17,Th17占CD4+T 细胞的05%。
Th17分泌的细胞因子有IL 17、IL 22、I L 23、TNF 、I L 6、粒细胞集落刺激生物因子(G M CSF ),其中I L 17为Th17分泌的代表性细胞因子。
I L 17家族由A F 6个成员组成(IL 17A F )。
IL 17与受体结合后,通过活化促分裂原活化蛋白(MAP )激酶和转录因子NFB 发挥其生物学活性[1]。
IL 17协同IL 18、T NF 、IFN 、CD40L 刺激I L 6、一氧化氮(NO)及前列腺素E2(PGE2),促进炎性反应,在中性粒细胞募集方面具有重要作用[2]。
近年研究发现在不稳定性心绞痛(UA)和急性心肌梗死(A M I)患者中IL 17、IL 6、I L 8活性增高,表明IL 17驱动炎症反应在临床表现不稳定的ACS 患者中起促进作用[3]。
二、Th17分化的细胞因子调节Ve l dhoen 等[4]发现,初始T 细胞可以在树突细胞或调节T 细胞及其产生的炎性因子转化生长因子(TGF )和IL 6的作用下分化成Th17表型。
快速体外分离、长期培养人Th17细胞方法
1.Subject
全血
2.CD4+T细胞浓缩
采用RosetteSep(StemCell Technologies,Canada)进行阴性选择得到浓缩CD4+T细胞。
建立标准密度梯度离心,分离出淋巴细胞
3.CD4+T细胞刺激
将浓缩的CD4+T细胞悬浮在RPMI1640培养基中(Sigma),包含青霉素/链霉素,L-谷氨酰胺,HEPES缓冲液和10%小牛血清(R10),浓度为1×106个细胞/ ml.含 3×106个细胞的3mlR10,在15ml Falcon管中,用每毫升含4μL(1mg/ml)PMA和2μL(1mg/ml)伊沃诺霉素(AG Scientific,San Diego,CA)的细胞溶液刺激。
继而加入总量3μL的包含CD49d (1mg/ml)和CD28(0.5mg/ml)的共刺激抗体(BD Biosciences)。
随后细胞在37℃、5%CO2条件下孵化3个半小时。
阴性对照采用相似方法,但用R10替换PMA和伊沃诺霉素。
为了用细胞内细胞因子标记法测量IL-17产量,浓缩的CD4+T细胞用10μL Brefeldin A(1mg/ml)刺激。
4.IL-17捕捉复合物的准备
IL-17捕捉复合物由2个生物素标记的抗体组成,2个抗体通过一个抗生物素蛋白分子连接。
直接连在T细胞表面CD45分子的抗体与IL-17抗体配对。
2μL生物素标记的CD45抗体(clone H130)(Caltag,Invirtrogen,CA)和20μL生物素标记的IL-17抗体(0.5mg/ml)(clone:eBio64DEC17)(ebiosciences,CA)混合加入eppendorf管,并彻底漩涡。
然后,加入2μL未作标记的5mg/ml的生物素(Invitrogen,CA),并立即充分混匀。
复合物在室温下孵化10分钟,使用前再次漩涡。
5.IL-17体外捕获分析
被刺激过的细胞用含有2%小牛血清(2%FCS/PBS)的冰冻PBS(Cellgro ,Mediatech,V A),冲洗,以500×克离心10分钟成小球,上清液被完全吸出。
然后细胞被悬浮在100μL2%的FCS/PBS,将20μL捕获的IL-17复合体加入。
冰上孵化15分钟后,加入9mlR10。
将试管放入转动器,在37℃和5%CO2条件下额外孵化1个半小时。
6.IL-17+细胞分选
被捕获的IL-17细胞可以用2种技术分选:一种是FACS Aria细胞分选器(BD),另一种是磁珠技术(Miltenyi,Germany)。
FACS Aria细胞分选器,细胞被一种太平洋蓝活性胺标记来区分活的和死的细胞。
然后用FACS/PBS冲洗细胞,细胞表面用10μL的CD3-FITC,5μL的CD4-Alexa700(BD BIOsciences)和20μL(0.25μg)IL-17A-PE(clone:eBio64CAP17)抗体标记。
细胞在暗室诗文条件下孵化15分钟,分析前用2%FCS/PBS冲洗一次。
磁珠法捕获的细胞用IL-17A-PE标记15分钟。
用2%FCS/PBS冲洗一次将多余的抗体移除,然后参看说明将细胞在4℃条件下加抗-PE磁珠孵化。
简而言之,再次冲洗细胞并使之悬浮在500μL缓冲液中。
悬浮液用洗液管加入MS柱(Miltenyi,German)并放到磁体上,用500μL的PBS洗3次。
将虑柱从磁体上拿下,被选择的细胞收集在一个15mL的Falcon管。
被选择的细胞再次通过磁性分离进一步浓缩。
Aria分选或磁珠净化得到的Th17细胞,培养在包含50单位的人IL-2(NIH/Roche,switzerland)(R10-50)的R10培养基,. 2天后,细胞被250.000照射feeders(3000 rad)和抗-CD3/抗-CD8双特异性单克隆抗体(1μg)刺激。
每3周细胞被照射feeders(3000 rad)
和抗-CD3/抗-CD8双特异性单克隆抗体再刺激。
培养基每2-3天更换一次。