扫描电镜制样技巧
- 格式:ppt
- 大小:7.75 MB
- 文档页数:45

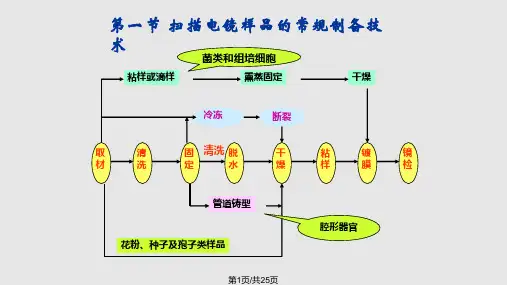
扫描电子显微镜(SEM)常规样品制备技术SEM常规制样方法(一)——试样的取材、固定、脱水和置换一、实验目的掌握扫描电镜制样过程:从取材、固定、脱水、置换、干燥、喷涂这一过程中样品怎样保持生活状态,从而得出接近生活状态的样品。
二、实验原理不论动物或植物组织,要求取材时操作必须快速,组织表面要清洁,必要时需超声波清洗,原理同TEM取材,但需强调的是SEM观察表面结构,所以应注意表面结构的清洁、完整和电镜下反应真实的形貌。
取材时动作要快、轻、准、大小在1mm-1cm之间,所用的器械要锋利、洁静,避免任何牵拉和挤揉样品表面的损伤,常用的固定剂有2-4%戊二醛和1%锇酸。
三、实验器材样品(动物或植物)、双面刀片、培养皿、l.5ml离心管、牙签、2-4%戊二醛、1%锇酸、0. 1M PBS缓冲液,乙醇、乙酸异戊酯。
四、实验步骤1、取材要求动作轻、迅速、准确,为了保持生活状态,应在固定前清洗掉表面杂质,即,迅速将标本放在PBS缓冲液中冲洗,也可超声波器中超10s-30s,使样品所带的污物除去(如:气管内壁上的粘液、植物叶上的灰尘等)。
2、固定(前固定)经过清洗的样品迅速投入2-4%戊二醛囤定液中,间歇振荡且室温固定约2-4小时即可。
样品固定的目的:使样品细胞的微细结构完整真实地保存下来。
如果样品没有很好地固定,那么样品在脱水时可能变形,破坏了样品的生活状态,也就是说,固定不好的材料,电镜下不能反映真实结构,所以这一步很重要。
3、冲洗0. 1M PH7.2 PBS缓冲液洗:30分钟中间换3-4次,因戊二醛与锇酸反应生成细微的沉淀,所以在后固定之前,用0. IM PBS缓冲液洗去多余的戊二醛之后,样品才可能进入锇酸固定液。
4、后固定:1%四氧化锇后固定1-2小时。
5、冲洗:重蒸水冲洗30分钟中间换3-4次,因四氧化锇与乙醇反应,所以在脱水前充分洗去残留的四氧化锇,样品才能进行脱水。
6、脱水脱水剂为乙醇,室温进行为了减少人工损伤,需要梯度脱水:30%、50%、70%、80%、90%、95%、100%,每级15-20分钟,如果是动物样品,脱水时间可5-10分钟,脱水要充分完全地进行直到除尽样品中的水份为止,最后100%乙醇要重复2-3次,保证样品绝对无水。

扫描电镜样品制备扫描电子显微镜生物样品制备技术无论是透射电镜或是扫描电镜,样品均处于电镜镜筒的真空之中。
而大多数的生物样品都是柔软而且含大量水分的。
因此,也和透射电镜的样品一样,在进行扫描电镜观察前,必须对生物样品作相应的处理。
扫描电镜的功能很多,不同的功能对样品的要求不同。
例如二次电子像与背散射电子像和吸收电子像对样品的要求基本相同,而与X射线微区分析对样品的要求相差较远。
我们首先介绍二次电子像的生物样品制备技术。
此外,由于样品的性质不同,其处理方法和程序也有不同。
主要分两大类,一类为含水量少的硬组织,如毛发、牙齿及植物的花粉、孢子、种子等。
此类样品一般含硅质、钙质,角质,砝琅质和纤维素等成份,所以通常只经过表面清洁、装台(粘胶)、导电处理等简单过程即可进行观察。
如要观察其断面或内部结构时,经断裂、解剖或酶消化、蚀刻等再装台、镀膜处理,即可进行观察拍照。
另-类为含水分较多的软组织,如大多数的动植物器官、组织及细菌等均属此类。
对于此类样品,在金属镀膜前,一般都需经过固定、脱水、干燥等处理,如不经处理或处理不当,就会造成样品损伤和变形,出现各种假像,因此对每一处理步骤都应给予重视。
但是,不管是那一类样品的制备,都应达到以下要求:∙尽可能保持样品活体时的形貌和结构,以便如实地反映样品本来面目。
∙在样品的干燥过程尽可能减少样品变形。
∙样品表面应有良好导电性能和二次电子发射率,以防止和减少样品的荷电效应。
样品的前期处理扫描电镜样品的前期处理主要包括表面清洁、固定、漂洗和脱水等过程。
而每一过程的处理方法基本上都是沿用透射电镜样品的处理方法的,所以,这里不一一再作详述。
但是,由于两种电镜观察的要求不同,因此,在处理中也有不同之处:1. 透射电镜主要研究样品的内部结构要求内部结构保存好,因而样品宜尽可能小使固定液能迅时渗入固定。
扫描电镜观察表面形貌,而且为了操作方便选取较大样品。
一般在8~10mm2左右,高度可达5mm。

sem制样方法及注意事项以SEM制样方法及注意事项为标题,我将介绍SEM制样方法的基本原理和操作步骤,并提供一些在实践中需要注意的事项。
SEM(扫描电子显微镜)是一种常用的表面形貌观察和分析技术,可以在纳米至微米尺度下观察样品的形貌和结构。
SEM制样是实施SEM观察的前提,它的目的是将样品制备成适合SEM观察的形式。
一、SEM制样方法1. 样品选择:首先需要确定要观察的样品类型,包括材料、形状、尺寸等。
不同样品可能需要不同的制样方法。
2. 样品固定:根据样品的特性和尺寸,选择合适的固定方法。
常见的固定方法包括化学固定、机械固定和冷冻固定等。
3. 前处理:根据需要,对样品进行预处理,如去除杂质、修整表面等。
这一步骤可以改善SEM观察的效果。
4. 制备导电层:由于SEM需要对样品进行电子束照射,所以样品表面需要制备导电层以避免电荷积累。
常用的导电层材料有金属薄膜、碳薄膜和导电胶等。
5. 制备薄片:将样品制备成适合SEM观察的薄片。
常用的制备方法有机械剥离、切割、研磨和离心等。
制备薄片的目的是获得样品的横截面或断面信息。
6. 脱水和干燥:对于水溶性样品,需要进行脱水处理以避免SEM 观察时的水蒸气干扰。
常用的脱水方法有自然蒸发、冷冻干燥和真空脱水等。
7. 导入SEM:将制备好的样品放入SEM中进行观察。
在导入过程中要注意样品的定位和对焦,以确保观察的准确性和清晰度。
二、SEM制样注意事项1. 样品处理时要注意避免污染和损坏。
使用无尘室或洁净台进行制样操作,避免灰尘和其它杂质的污染。
对于易损样品,要采取适当的操作方法和保护措施。
2. 制备导电层时要注意均匀涂覆和适当厚度。
导电层的均匀性和良好的导电性能对于SEM观察结果的准确性和清晰度非常重要。
3. 制备薄片时要控制厚度和平整度。
薄片的厚度和平整度对于SEM 观察的分辨率和细节展示有着重要影响。
制备过程中要小心操作,避免样品的破损和变形。
4. 脱水和干燥过程中要避免过度处理。


细胞扫描电镜制样方法:
1.清洗:某些生物材料表面常附血液、细胞碎片、消化道内的食物残渣、细菌、淋巴
液及粘液等异物,掩盖着要观察的部位,因而,需要在固定之前用生理盐水或等渗缓冲液等把附着物清洗干净。
亦可用5%碳酸钠冲洗或酶消化法去除这些异物。
2.固定:通常采用醛类(主要是戊二醛和多聚甲醛)与四氧化锇双固定,也可用四氧
化锇单固定。
四氧化锇固定不仅可良好地保存组织细胞结构,而且能增加材料的导电性和二次电子产额,提高扫描电子显微图象的质量。
为增强这种效果,可用四氧化锇-单宁酸或是四氧化锇-珠叉二胼等反复处理材料,使其结合更多的重金属锇,这就是导电染色。
3.干燥:固定后通常采用临界点干燥法。
其原理是:适当选择温度和压力,使液体达
到临界状态(液态和气相间界面消失),从而避免在干燥过程中由水的表面张力所造成的样品变形。
对含水生物材料直接进行临界点干燥时,水的临界温度和压力不能过高(37.4℃,218帕)。
通常用乙醇或丙酮等使材料脱水,再用一种中间介质,如醋酸戊酯,置换脱水剂,然后在临界点干燥器中用液体或固体二氧化碳、氟利昂13以及一氧化二氮等置换剂置换中间介质,进行临界干燥。
4.喷镀金属:将干燥的样品用导电性好的粘合剂或其他粘合剂粘在金属样品台上,然
后放在真空蒸发器中喷镀一层50~300埃厚的金属膜,以提高样品的导电性和二次电子产额,改善图象质量,并且防止样品受热和辐射损伤。
如果采用离子溅射镀膜机喷镀金属,可获得均匀的细颗粒薄金属镀层,提高扫描电子图象的质量。


扫描电镜的样品制备
扫描电镜(Scanning Electron Microscope,SEM)是一种高分辨率的显微镜,对于复杂的样品结构、微观形态和表面形貌的分析非常有用。
然而,要获得良好的扫描电镜显像效果,样品的制备至关重要。
下面将介绍几种常用的扫描电镜样品制备技术。
1. 金属喷涂法
金属喷涂法是扫描电镜样品制备的经典方法。
该方法使用金属喷涂仪将金属颗粒喷在样品表面,使其形成一层均匀、导电性良好的金属膜,以便在扫描电镜中观察样品的表面结构。
该方法适用于非导电样品,如细胞、生物组织、聚合物等。
2. 离子切割法
离子切割法利用离子切割机将样品切割成纤细的薄片,以便于在扫描电镜中观察。
这种方法适用于非常薄的样品,如材料薄片、芯片等。
它可以提供非常高分辨率的图像,并且可以通过纵向切割获得样品的三维结构。
3. 冷冻切片法
冷冻切片法是一种用于生物样品的扫描电镜制备方法。
该方法使用超低温技术将样品冻结,并使用超薄刀片切割成极薄的切片,通常为50~200纳米。
这可以保留样品的水感性和原始形态,并使其在扫描电镜中观察更加清晰。
4. 化学蚀刻法
化学蚀刻法是用于金属样品的扫描电镜制备方法。
该方法使用酸或碱对样品表面进行蚀刻,以去除不需要观察的材料,形成清晰的样品结构。
该方法适用于金属薄膜、晶体和合金等金属材料。
总之,良好的扫描电镜样品制备是获得高品质扫描电镜图像的关键。
每种样品都有其独特的制备方法,为了获得最好的结果,在选择合适的制备方法时需要谨慎选择。

扫描电镜使用技巧
扫描电镜是一种高分辨率的显微镜,被广泛用于表面形态、颗粒大小及其分布等的观测。
下面是一些扫描电镜使用的技巧:
1. 样品的制备:
在观察前,需要对样品进行制备以提高扫描电镜观察的质量。
首先,样品应该尽量纯净,避免杂质的干扰。
其次,样品需要被固定在导电性的基底上,以便进行导电镀膜。
一种常用的导电基底是碳薄膜。
最后,样品需要被干燥,以免过高的水分干扰电子束的透射。
2. 系统的准备:
在使用扫描电镜之前,需要先对仪器进行一些准备工作。
首先,检查仪器的真空度是否达到要求,以确保电子束的稳定性和样品表面的清晰度。
其次,根据样品的要求,选择合适的加速电压和放大倍数。
最后,确保电子束的聚焦和对准,以获得更好的图像质量。
3. 观察的技巧:
在进行观察时,需要注意一些技巧以获得更好的图像。
首先,选择一个合适的工作距离,以获得所需的放大倍数和深度。
其次,调整电子束的亮度和对比度,以获得清晰的图像。
最后,在观察过程中尽量减少样品的移动,以避免图像模糊。
4. 数据的分析:
扫描电镜观察得到的图像通常是黑白的,可以通过图像处理软件进行颜色增强和对比度调整。
此外,如果需要精确的测试样
品的尺寸和形态,可以使用扫描电镜配套的测量工具进行测量。
总结起来,扫描电镜使用的技巧包括样品制备、系统准备、观察技巧和数据分析。
通过正确地操作和调整仪器,并注意一些细节和技巧,可以获得高质量的扫描电镜图像,从而更好地观察和分析样品的微观结构和形态。

3。
1 试样制备技术试样制备技术在电子显微术中占有重要的地位,它直接关系到电子显微图像的观察效果和对图像的正确解释。
如果制备不出适合电镜特定观察条件的试样,即使仪器性能再好也不会得到好的观察效果.和透射电镜相比,扫描电镜试样制备比较简单。
在保持材料原始形状情况下,直接观察和研究试样表面形貌及其它物理效应(特征),是扫描电镜的一个突出优点。
扫描电镜的有关制样技术是以透射电镜、光学显微镜及电子探针X射线显微分析制样技术为基础发展起来的,有些方面还兼具透射电镜制样技术,所用设备也基本相同。
但因扫描电镜有其本身的特点和观察条件,只简单地引用已有的制样方法是不够的.扫描电镜的特点是:①观察试样为不同大小的固体(块状、薄膜、颗粒),并可在真空中直接进行观察。
②试样应具有良好的导电性能,不导电的试样,其表面一般需要蒸涂一层金属导电膜。
③试样表面一般起伏(凹凸)较大。
④观察方式不同,制样方法有明显区别。
⑤试样制备与加速电压、电子束流、扫描速度(方式)等观察条件的选择有密切关系。
上述项目中对试样导电性要求是最重要的条件.在进行扫描电镜观察时,如试样表面不导电或导电性不好,将产生电荷积累和放电,使得入射电子束偏离正常路径,最终造成图像不清晰乃至无法观察和照相。
3。
1。
1 块状试样制备1.导电性材料导电性材料主要是指金属,一些矿物和半导体材料也具有一定的导电性。
这类材料的试样制备最为简单.只要使试样大小不得超过仪器规定(如试样直径最大为φ25mm,最厚不超过20mm等),然后用双面胶带粘在载物盘,再用导电银浆连通试样与载物盘(以确保导电良好),等银浆干了(一般用台灯近距离照射10分钟,如果银浆没干透的话,在蒸金抽真空时将会不断挥发出气体,使得抽真空过程变慢)之后就可放到扫描电镜中直接进行观察。
但在制备试样过程中,还应注意:①为减轻仪器污染和保持良好的真空,试样尺寸要尽可能小些。
②切取试样时,要避免因受热引起试样的塑性变形,或在观察面生成氧化层。

sem制样方法及注意事项SEM(扫描电子显微镜)是一种常用的表征和分析材料表面形貌和结构的高分辨率显微镜。
在SEM制样过程中,样品的制备方法和注意事项是非常重要的,直接关系到SEM观察结果的准确性和可靠性。
一、SEM制样方法1. 样品的制备:首先,需要选择合适的样品进行制备。
常见的样品包括金属、陶瓷、聚合物、生物材料等。
对于不同类型的样品,制备方法也有所不同。
一般来说,样品需要进行切割、打磨、抛光等处理,以获得光滑的表面。
对于生物样品,还需要进行固定、脱水、干燥等处理。
2. 真空处理:SEM操作需要在真空环境中进行,因此在制样过程中需要对样品进行真空处理。
这可以通过将样品放入真空室中,然后抽取空气,以确保SEM观察时不会受到气体干扰。
3. 导电涂层:SEM观察需要样品具有良好的导电性,因此对于非导电样品,需要进行导电涂层。
常用的导电涂层材料有金、铂、碳等。
涂层方法可以通过溅射、蒸镀等技术进行。
4. 操作参数调整:在SEM观察之前,需要根据样品的特性和观察目的调整SEM的操作参数。
包括加速电压、放大倍数、探针电流等。
这些参数的选择需要根据样品的性质和所需的分辨率来确定。
二、SEM制样注意事项1. 样品的选择:样品的选择要考虑样品的性质和目的。
对于非导电样品,需要进行导电涂层处理;对于易挥发性样品,需要进行冷冻固化等特殊处理。
2. 制备过程中的污染:在制备样品的过程中,要注意避免污染的引入。
尽量避免手指接触样品表面,使用洁净的工具和实验室条件进行操作。
3. 制备的均匀性:样品的制备要保证表面的均匀性,以避免观察结果的误差。
在导电涂层过程中,要保证涂层的均匀性和厚度的一致性。
4. 真空处理的时间:在将样品放入SEM中进行观察之前,需要进行真空处理。
真空的抽取时间要足够,以确保SEM观察时不会受到气体的干扰。
5. 操作参数的选择:SEM的操作参数对于观察结果的准确性和分辨率有很大影响。
在选择参数时,要根据样品的特性和观察目的进行调整,以获得最佳的观察效果。
扫描电镜样品制备方法一、取材组织块小于3立方毫米(单细胞培养或收集展片于盖玻片或滤膜上)。
二、固定前固定:2.5%戊二醛(磷酸缓冲液配制)固定2小时或更长时间。
用0.1M pH7.4磷酸盐缓冲液漂洗三次,每次10分钟。
三、脱水*脱水在4度冰箱内进行,所有脱水步骤建议在专用的冷冻干燥杯中进行,冷冻干燥杯请于实验前一天到电镜室领取。
*整个过程,样品不要暴露于空气。
1.乙醇脱水,每一级10-20分钟:30%乙醇—50%乙醇—70%乙醇—90%乙醇—95%乙醇—100%乙醇;2.然后从乙醇逐步过渡到叔丁醇,纯叔丁醇每次10分钟,3次以上;此系列操作均在25度环境中进行;3.纯叔丁醇4度冰箱过夜,样品结晶。
四、冷冻干燥*需事先预约冷冻干燥时间;第二天上午八点半讲冷冻结冰的样品用冰盒送至电镜室进行冷冻干燥。
五、喷金附件1:细菌类样品的前处理方法1.盖玻片泡酸,清洗,烘干。
用剪刀剪碎,挑出5mm*5mm大小玻片备用。
玻片过大或者过厚影响观察效果。
2.菌液或样品悬液离心,需要可进行清洗,加入固定液,吹散固定,于4度冰箱固定2小时左右。
3.固定结束后,去固定液,加入PBS浸泡清洗,10分钟。
离心去PBS,固体沉淀根据量多少,加入适量PBS,制成浓度较高的悬液(目测较混浊)。
样品浓度对后期吸附有较大影响,浓度过低可能吸附量会很少。
4.取鸡蛋清,稀释3-5倍(一定要稀释!蛋清过浓会包裹样品),之前准备好的玻片放入液体内蘸一下,取出晾干至触摸感觉有点黏的状态(快干的状态)。
将第3步取得的悬液滴在玻片上,吸附30秒到1分钟,用滤纸吸去多余液体。
(样品悬液在玻片上停留时间过长将导致样品被蛋清完全包裹而无法观察)。
5.在玻片上滴加固定液,固定10分钟,固定后用PBS浸泡清洗10分钟,放入干燥杯开始进行脱水。
磷酸盐缓冲液(PBS)a.磷酸盐缓冲液(0.2M)甲液:0.2M的磷酸氢二钠溶液乙液:0.2M的磷酸二氢钠溶液Na2HPO42H2O 35.61g (Na2HPO47H2O) 53.65g (Na2HPO412H2O) 71.64g NaH2PO4H2O 27.60g ( NaH2PO42H2O) 31.21g加蒸馏水溶解成1000ml 加蒸馏水溶解成1000ml按下表混合甲、乙两液既得所需pH的0.2M缓冲液0.2M磷酸盐缓冲液的配制将溶液用蒸馏水1:1稀释,则配得0.1M的缓冲液。
扫描电镜样品制备及图像质量影响因素分析①扫描电镜是一种非常重要的分析工具,它可以用来观察微观颗粒和组织结构。
在使用扫描电镜进行观察时,样品的制备和图像的质量是非常重要的因素。
本文将介绍扫描电镜样品制备的方法,以及影响图像质量的因素,帮助读者更好地理解和掌握扫描电镜的应用。
一、扫描电镜样品制备的方法扫描电镜样品制备是观察样品的第一步,样品的制备质量直接影响到后续观察结果的准确性和可靠性。
目前扫描电镜样品制备的方法主要有化学固定法、膜支撑法以及冷冻切片法等。
1. 化学固定法化学固定法是通过用冰醋酸、乙醛等物质将样品固定在样品架上,使得样品的结构保持原状。
这种方法适用于大多数的样品,而且固定后的样品可以保存很长时间,方便后续的操作。
但是在使用化学固定法时需要注意,要避免过量的固定剂,以免对样品的形态产生破坏。
2. 膜支撑法膜支撑法是在样品的表面涂覆一层聚合物薄膜,使得样品表面平整并且增加样品的机械强度。
这种方法适用于软脆的样品,可以有效避免在样品处理过程中出现的形变和损坏。
但是在使用膜支撑法时需要注意,选择合适的薄膜材料和合适的涂覆方法,以免对样品造成干扰。
3. 冷冻切片法冷冻切片法是将样品冷冻并且切成很薄的切片,然后在扫描电镜中直接观察。
这种方法适用于生物样品或者含水样品的制备,可以有效保持样品的生物活性和结构完整性。
但是在使用冷冻切片法时需要注意,样品的冷冻和切片过程中必须迅速,并且要避免在样品表面生成冰晶,以免影响观察结果。
二、图像质量影响因素分析扫描电镜的图像质量是反映样品观察效果的重要指标,图像质量的好坏直接影响到对样品结构和特征的分析。
在扫描电镜图像质量的影响因素中,主要包括电镜参数、样品处理以及图像处理等几个方面。
1. 电镜参数电镜参数是影响扫描电镜图像质量的重要因素,主要包括电压、放大倍数和孔径等。
较高的电压可以提高电子束的穿透能力,对于较厚的样品可以选择较高的电压,而对于较薄的样品可以选择较低的电压。
扫描电镜测试生物样品制备技术大多数生物样品都含有水分,而且比较柔软,因此,在进行扫描电镜观察前,要对样品作相应的处理。
扫描电镜样品制备的主要要求是:尽可能使样品的表面结构保存好,没有变形和污染,样品干燥并且有良好导电性能。
一.样品的初步处理(一取材样品面积可为8mm×8mm,厚度可为5mm。
对于易卷曲的样品如血管、胃肠道粘膜等,可固定在滤纸或卡片纸上,以充分暴露待观察的组织表面。
(二样品的清洗用扫描电镜观察的部位常常是样品的表面,即组织的游离面。
由于样品取自活体组织,其表面常有血液、组织液或粘液附着,这会遮盖样品的表面结构,影响观察。
因此,在样品固定之前,要将这些附着物清洗干净。
清洗的方法有以下几种:1.用等渗的生理盐水或缓冲液清洗;2.用5%的苏打水清洗;3.用超声震荡或酶消化的方法进行处理。
例如清洗肠粘膜表面的粘液,可用下面的方法:清洗液配方:透明质酸酶300 (gα—糜蛋白酶 10 mg生理盐水 100 ml清洗液的pH为5.5~6。
清洗的方法是将样品浸泡在配好的清洗液中,边浸泡边震荡30分钟,最后用双蒸水洗3次。
无论用哪种清洗方法,注意在清洗时不要损伤样品。
(三固定固定样品的常用试剂为戊二醛及锇酸双固定。
由于样品体积较大,固定时间应适当延长。
也可用快速冷冻固定。
(四脱水样品经漂洗后用逐级增高浓度的酒精或丙酮脱水,然后进入中间液,一般用醋酸异戊酯作中间液。
二.样品的干燥扫描电镜观察样品要求在高真空中进行。
无论是水或脱水溶液,在高真空中都会产生剧烈地汽化,不仅影响真空度、污染样品,还会破坏样品的微细结构。
因此,样品在用电镜观察之前必须进行干燥。
干燥的方法有以下几种:(一空气干燥法空气干燥法又称自然干燥法,就是将经过脱水的样品,让其暴露在空气中使脱水剂逐渐挥发干燥。
这种方法的最大优点是简便易行和节省时间;它的主要缺点是在干燥过程中,组织会由于脱水剂挥发时表面张力的作用而产生收缩变形。
扫描电镜常规制样方法方法一:植物叶片单固定扫描电镜制样方法1.取材将叶子切成5-10mm长方形6-10片。
2.固定放入2.5%戊二醛+2%多聚甲醛固定液中进行抽气(样品无气泡产生,全部沉于底部即可),固定12小时以上。
3.脱水用乙醇逐级脱水30%→50%→70%→80%→90%乙醇,每20 分钟更换一次(70%以前放置4°C冰箱内),100%乙醇每20分钟一次,共5次(70%乙醇以后放置室温脱水)。
4.替换将乙醇倒掉,换叔丁醇,每20分钟一次,共5次。
第5次浸过样品即可,放置冰箱冷冻层(-20°C左右)30分钟或过夜。
5.干燥用JFD-310冷冻干燥仪进行干燥。
6.粘台将上下表皮分别粘在具有双面胶带的样品台上。
7.镀膜用JFC-1600离子溅射镀铂金膜厚约10nm。
8.观察并拍照利用JSM-6360LV扫描电子显微镜进行观察并拍照。
注明:此方法适合植物根、茎样品方法二:植物叶片单固定扫描电镜制样方法1..取材将叶子切成5-10mm长方形6-10片。
2预固定放入2.5%戊二醛+2%多聚甲醛固定液中进行抽气(样品无气泡产生,全部沉于底部即可),固定12小时以上。
3.冲洗0.1M磷酸缓冲液进行冲洗3次,每40分钟一次。
4.双固定用1%四氧化锇(OsO4)进行固定2.5-3小时。
5.冲冼0.1M磷酸缓冲液进行冲洗3次,每5分钟一次。
6.脱水7.用乙醇逐级脱水30%→50%→70%→80%→90%乙醇,每20 分钟更换一次(70%以前放置4°C冰箱内),100%乙醇每20分钟一次,共5次(70%乙醇以后放置室温脱水)。
8.替换将乙醇倒掉,换叔丁醇,每20分钟一次,共5次。
第5次浸过样品即可,放置冰箱冷冻层(-20°C左右)30分钟或过夜。
9.干燥用JFD-310冷冻干燥仪进行干燥。
9.粘台将上下表皮分别粘在具有双面胶带的样品台上。
10.镀膜用JFC-1600离子溅射镀铂金膜厚约10nm。