食品中大肠菌群计数——第二法检测程序步骤.
- 格式:ppt
- 大小:4.53 MB
- 文档页数:18
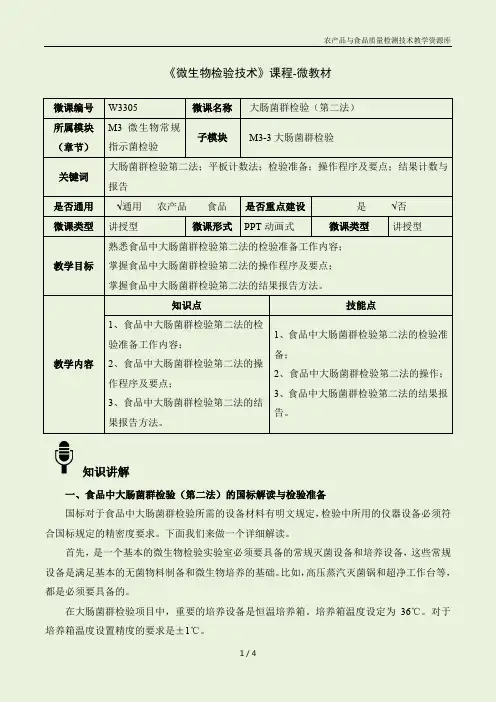
《微生物检验技术》课程-微教材微课编号W3305 微课名称 大肠菌群检验(第二法) 所属模块(章节)M3 微生物常规指示菌检验 子模块 M3-3大肠菌群检验 关键词大肠菌群检验第二法;平板计数法;检验准备;操作程序及要点;结果计数与报告 是否通用√通用 农产品 食品 是否重点建设 是 √否 微课类型 讲授型 微课形式 PPT 动画式微课类型 讲授型 教学目标 熟悉食品中大肠菌群检验第二法的检验准备工作内容;掌握食品中大肠菌群检验第二法的操作程序及要点;掌握食品中大肠菌群检验第二法的结果报告方法。
教学内容 知识点技能点 1、食品中大肠菌群检验第二法的检验准备工作内容;2、食品中大肠菌群检验第二法的操作程序及要点;3、食品中大肠菌群检验第二法的结果报告方法。
1、食品中大肠菌群检验第二法的检验准备; 2、食品中大肠菌群检验第二法的操作; 3、食品中大肠菌群检验第二法的结果报告。
知识讲解一、食品中大肠菌群检验(第二法)的国标解读与检验准备国标对于食品中大肠菌群检验所需的设备材料有明文规定,检验中所用的仪器设备必须符合国标规定的精密度要求。
下面我们来做一个详细解读。
首先,是一个基本的微生物检验实验室必须要具备的常规灭菌设备和培养设备,这些常规设备是满足基本的无菌物料制备和微生物培养的基础。
比如,高压蒸汽灭菌锅和超净工作台等,都是必须要具备的。
在大肠菌群检验项目中,重要的培养设备是恒温培养箱。
培养箱温度设定为36℃。
对于培养箱温度设置精度的要求是±1℃。
在大肠菌群检验的实际工作中,冰箱也是必不可少的,可以对样品和各类需要冷藏试剂及培养基,进行妥善保存。
恒温水浴锅在大肠菌群检验中的作用,是用于将融化的结晶紫中性红胆盐琼脂培养基保持在46℃。
感量为0.1g的天平,通常放置在无菌室,用于准确称取固体检验样品。
均质器用于处理固体样品,如果是做液体样品的检测,那么就不需要用到均质器了。
均质器有两种,一种是拍击式,另一种是旋刃式。

大肠杆菌菌落总数检测步骤大肠杆菌是一种常见的肠道细菌,在环境卫生、食品安全等领域中具有重要意义。
因此,对大肠杆菌和细菌总数的检测非常重要,以下是大肠杆菌和菌落总数检测的详细步骤:1.试样采集:首先,需要进行试样采集。
根据实际需要,可以使用不同的方法采集试样,如直接采集水样、食品样品或其他样品,或者通过培养基进行采样。
试样采集应注意保持无菌环境,并避免样品污染。
2.试样预处理:试样采集后,需要进行预处理。
根据试样的不同特点,可以选择不同的预处理方法。
例如,对于食品样品,可以使用加热、超声波或化学处理等方法,以杀灭或抑制其他细菌的生长,保留大肠杆菌。
3.分离培养:预处理后的试样需要进行分离培养。
将试样分离到含有LB(Luria-Bertani)培养基或EC(Escherichia coli)培养基等富含葡萄糖和其他营养物质的培养基中。
将培养基倒入含有试样的培养皿中,并进行搅拌均匀。
然后,将培养皿盖好,使用适当的培养条件,如37℃温度和24小时培养时间,培养大肠杆菌。
4.鉴定大肠杆菌:在培养后,可以使用不同的方法鉴定大肠杆菌。
例如,可以通过形态学特征,如菌落形状、大小、颜色等,进行初步的鉴定。
然后,可以进一步进行生理和生化试验。
比如,可以使用氧化酚红在培养基中进行试验,观察菌落颜色变化,进行鉴定。
此外,还可以使用PCR方法进行分子鉴定,通过特定的引物和扩增反应,鉴定大肠杆菌的DNA序列。
5.菌落总数检测:除了检测大肠杆菌,还需要检测样品中的菌落总数。
菌落总数是指一定体积的试样中所有菌落的数量。
菌落总数可以用于评估样品的卫生状况和细菌污染程度。
检测菌落总数的方法包括传统的平板计数法和现代的膜过滤法。
6.平板计数法:平板计数法是最常用的菌落总数检测方法之一、方法是将试样平均分布在含有琼脂的培养皿中,然后在恰当的条件下培养细菌。
培养后,可以使用计数板或显微镜对菌落进行计数。
最后,根据计数结果和稀释倍数,计算出菌落总数。



食品大肠菌群、粪大肠菌群和大肠杆菌检测步骤一、培养基制备1、生理盐水氯化钠 8.5g蒸馏水 1000.0ml将氯化钠溶于蒸馏水中,搅拌均匀后用量筒量取225ml分装到各个广口瓶中,1210C高压灭菌15min,备用。
2、月桂基硫酸盐胰蛋白胨肉汤称取37克放入烧杯,将各成分溶解于1000ml蒸馏水中,放电炉子上加热并搅拌均匀,分装于装有倒立发酵管的试管中,每管10ml,装完盖帽,1210C高压灭菌15min,双料培养基除蒸馏水不变外,其余成分加倍。
3、样品制备(在无菌室中进行)(1)固体或半固体样品无菌操作称取样品25g置于装有225ml生理盐水的广口瓶中,充分振摇、混匀,制成1:10的样品稀释液备用。
(2)液体样品以无菌吸管吸取样品25g置于装有225ml生理盐水的广口瓶中,充分混匀,制成1:10的样品稀释液备用。
4、样品稀释用1ml无菌吸管或微量移液器吸取1:10样品匀液1ml,沿管壁缓慢注于盛有9ml 生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管混匀,制成1:100的样品匀液。
按照该操作程序,可制备1:1000,1:10000。
等10倍系列稀释样品匀液,每递增稀释一次,换用1次1ml无菌吸管或吸头。
根据对样品污染状况的估计,选择2-3个适宜稀释度的样品匀液(液体样品可包括原液),在进行10倍递增稀释时,吸取1ml样品匀液于无菌平皿内,每个稀释度做两个平皿。
同时分别吸取1ml空白稀释液加入两个无菌平皿内作空白对照。
二、大肠菌群的测定(MPN法)1、选取适宜的三个连续稀释度的样品匀液,每个稀释度均接种三管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接种1ml。
360C+10C培养24h-48h后,观察倒管内是否有气泡产生,并记录24h和48h内产气的LST肉汤管数。
对未产气的试管,可以轻敲试管壁的方式观察是否有较细小的气泡从管底逸出,如果所有LST肉汤管均未产气,可按。
报告结果;如果LST管有产气,则按下面步骤作证实试验。



一、编制目的为规范本中心食品中大肠菌群测定的检验方法,特编制本指导书。
二、适用范围本作业指导书适用于食品中大肠菌群( Coliforms)计数的方法。
本作业指导书第一法适用于大肠菌群含量较低的食品中大肠菌群的计数;第二法适用于大肠菌群含量较高的食品中大肠菌群的计数。
三、编制依据GB/T 4789.3—2016 《食品安全国家标准食品卫生微生物学检验大肠菌群计数》。
四、实验原理4.1 MPN法 MPN法是统计学和微生物学结合的一种定量检测法。
待测样品经系列稀释并培养后,根据其未生长的最低稀释度与生长的最高稀释度,应用统计学概率论推算出待测样品中大肠菌群的最大可能数。
4.2平板计数法大肠菌群在固体培养基中发酵乳糖产酸,在指示剂的作用下形成可计数的红色或紫色,带有或不带有沉淀环的菌落。
五、仪器和试剂5.1设备与材料5.1.1冰箱:2℃~5℃;5.1.2恒温培养箱:36℃±1℃;5.1.3恒温水浴锅:46℃±1℃5.1.4显微镜:10×~100×;5.1.5灭菌乳钵、灭菌玻璃珠:直径约5mm;5.1.6 天平:感量0.1g;5.1.7灭菌吸管:1mL(具0.01mL刻度)、10 mL(具0.1mL刻度)或微量移液器及吸头;5.1.8灭菌培养皿:直径90ml、灭菌锥形瓶:500mL;5.1.9灭菌刀、剪子、镊子等。
5.2培养基和试剂5.2.1月桂基硫酸盐胰蛋白胨胨(lauryl sulfate tryptose,LST)肉汤将胰蛋白胨或胰酪胨20.0g、氯化钠 5.0g、乳糖 5.0g、磷酸氢二钾2.75g、磷酸二氢钾2.75g,溶于蒸馏水1000mL中,校正PH至6.8±0.2,分装到有玻璃小倒管的试管中,每管10ml。
121℃高压灭菌15min。
5.2.2煌绿乳糖胆盐(brilliant green lactose bile,BGLB)肉汤将蛋白胨10.0g、乳糖10.0g溶于约500ml蒸馏水中,加入牛胆粉(oxgall或oxbile)200ml溶液((将20.0g脱水牛胆粉溶于200mL蒸馏水中,调节pH至7.0~7.5),用蒸馏水稀释到975ml,调节PH7.2±0.1,再加入0.1%煌绿水溶液13. 3mL,用蒸馏水补足到1000mL,用棉花过滤后,分装到有玻璃小倒管的试管中,每管 10mL。

食品公司玉米淀粉大肠菌群的检测作业指导书执行标准:GB4789.3—2010食品安全国家标准食品微生物学检验大肠菌群计数1 设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:恒温培养箱(36 ℃±1 ℃)、冰箱(2 ℃~5 ℃)、恒温水浴箱(46 ±1 ℃)、天平(感量 0.1 g)、均质器、振荡器、无菌吸管[1 mL(具 0.01 mL 刻度)、10 mL(具 0.1 mL 刻度)或微量移液器及吸头]、无菌锥形瓶(容量 500 mL)、无菌培养皿(直径 90 mm)、pH计或 pH比色管或精密 pH试纸、菌落计数器2 培养基和试剂2.1 月桂基硫酸盐胰蛋白胨(Lauryl Sulfate Tryptose,LST)肉汤:见附录 A中 A.1。
2.2 煌绿乳糖胆盐(Brilliant Green Lactose Bile,BGLB)肉汤:见附录 A中 A.2。
2.3 结晶紫中性红胆盐琼脂(Violet Red Bile Agar,VRBA):见附录 A中 A.3。
2.4 磷酸盐缓冲液:见附录 A中 A.4。
2.5 无菌生理盐水:见附录 A中 A.5。
2.6 无菌 1 mol/L NaOH:见附录 A中 A.6。
2.7 无菌 1 mol/L HCl:见附录 A中 A.7。
第一法大肠菌群MPN计数法3 检验程序大肠菌群MPN计数的检验程序见图1。
图1 大肠菌群 MPN计数法检验程序6 操作步骤6.1 样品的稀释6.1.1 固体和半固体样品:称取 25 g 样品,放入盛有225 mL 磷酸盐缓冲液或生理盐水的无菌均质杯内,8000 r/min~10000 r/min 均质 1 min~2 min,或放入盛有 225 mL 磷酸盐缓冲液或生理盐水的无菌均质袋中,用拍击式均质器拍打 1 min~2 min,制成 1:10 的样品匀液。
6.1.2 液体样品:以无菌吸管吸取 25 mL样品置盛有225 mL 磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成 1:10 的样品匀液。
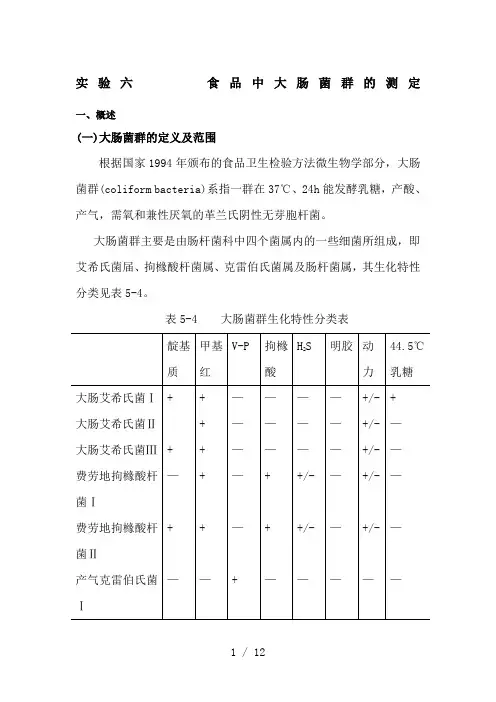
实验六食品中大肠菌群的测定一、概述(一)大肠菌群的定义及范围根据国家1994年颁布的食品卫生检验方法微生物学部分,大肠菌群(coliform bacteria)系指一群在37℃、24h能发酵乳糖,产酸、产气,需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。
大肠菌群主要是由肠杆菌科中四个菌属内的一些细菌所组成,即艾希氏菌届、拘橼酸杆菌属、克雷伯氏菌属及肠杆菌属,其生化特性分类见表5-4。
表5-4 大肠菌群生化特性分类表注:+,表示阳性;—,表示阴性;+/-,表示多数阳性,少数阴性。
由上表可以看出,大肠菌群中大肠艾希氏菌I型和Ⅲ型的特点是,对靛基质、甲基红、v-P和拘橼酸盐利用四个生化反应分别为“十十一一”,通常称为典型大肠杆菌;而其他类大肠杆菌则披称为非典型大肠杆菌。
(二)大肠菌群的测定意义1、粪便污染的指标细菌早在1892年,沙尔丁格(Schardinger)氏首先提出大肠杆菌作为水源中病原菌污染的指标菌的意见,因为大肠杆菌是存在于人和动物的肠道内的常见细菌。
一年后,塞乌博耳德“斯密斯(Theobold.Smith)氏指出,大肠杆菌因普遍存在于肠道内,若在肠道以外的环境中发现,就可以认为这是由于人或动物的粪便污染造成的;从此,就开始应用大肠杆菌作为水源中粪便污染的指标菌。
据研究发现,成人粪便中的大肠菌群的含量为:108个/g一109个/g。
若水中或食品中发现有大肠菌群,即可证实已被粪便污染,有粪便污染也就有可能有肠道病原菌存在。
根据这个理由,就可以认为这种含有大肠菌群的水或食品供食用是不安全的。
所以目前为评定食品的卫生质量而进行检验时,也都采用大肠菌群或大肠杆菌作为粪便污染的指标细菌。
当然,有粪便污染,不一定就有肠道病原菌存在,但即使无病原菌,只要被粪便污染的水或食品,也是不卫生的,不受人喜欢的。
2.粪便污染指标菌的选择作为理想的粪便污染的指标菌应具备以下几个特性,才能起到比较正确的指标作用。
①存在于肠道内持有的细菌,才能显示出指标的特异性。

食品中大肠菌群的检验简介大肠菌群是指含有大肠菌属(Escherichia coli)和奇异变形杆菌属(Coliform bacteria)的细菌群体。
它们存在于人和动物的肠道中,也可以存在于环境中,如土壤、水体和食品中。
食品中的大肠菌群是导致食品中毒的主要病原体之一。
因此,对食品中大肠菌群的检验非常重要,以确保食品的卫生和安全。
本文将介绍食品中大肠菌群的检验方法和操作流程。
方法和步骤1. 样品采集样品采集是食品中大肠菌群检验的第一步。
根据需要检验的食品种类,选择合适的采样方法。
常见的食品样品包括水果、蔬菜、肉类和乳制品等。
采集样品时,应使用干净无菌的容器,并避免污染。
确保样品的代表性,避免极端状况下的取样,如选择已烂的水果或有明显变质的食品。
2. 样品处理样品处理是为了提取样品中的菌群以进行后续的检测。
处理过程应在无菌条件下进行,以避免外部的污染。
常见的样品处理方法包括:•加入盐水:将样品加入含有氯化钠的缓冲液中,以便菌群的释放。
•搅拌和均质:使用搅拌器或者均质器将样品搅拌均匀,以确保菌群的均匀分布。
•过滤:通过滤膜将样品过滤,以分离固体物质和悬浮物。
3. 培养基选择选择适当的培养基是进行大肠菌群检验的关键。
常用的培养基包括马铃薯葡萄糖琼脂(Plate Count Agar,PCA)、大肠杆菌选择琼脂(MacConkey Agar)、经典蓝琼脂(Eosin Methylene Blue Agar)等。
不同的培养基适用于不同目的的检验。
PCA适用于总菌群计数,MacConkey Agar适用于大肠菌群的选择性检测,Eosin Methylene Blue Agar适用于大肠杆菌的计数和鉴别。
4. 培养和孵育将样品处理后的培养基平板进行孵育。
孵育的时间和温度根据菌群的生长特性而定。
一般情况下,孵育时间为24小时,温度为37摄氏度。
培养过程中,需要注意避免交叉污染。
每个样品应使用独立的培养基平板进行孵育,且标记清楚以区分不同样品。
大肠菌群计数检验步骤第一法大肠菌群MPN 计数操作步骤6.1、样品的稀释6.1.1、固体和半固体样品:称取25g 样品,放人盛有225ml磷酸盐缓冲液或生理盐水的无菌均质杯内,8 00or/min-10 000r/min 均质1 min-2 min ,或放人盛有225ml磷酸盐缓冲液或生理盐水的无菌均质袋中,用拍击式均质器拍打1 min-2 min ,制成1:10 的样品匀液。
6.1.2、液体样品:以无菌吸管吸取25ml样品,置盛有225ml磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分棍匀,制成1:10 的样品匀液。
6.1.3、样品匀液的pH 值应在6.5-7.5 之间,必要时分别用1mol/L 氢氧化钠(NaOH )或1 mol/L 盐酸(HCI )调节。
6.1.4、用1ml无菌吸管或微量移液器吸取1:10 样品匀液1ml,沿管壁缓缓注人9ml磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1 支1ml无菌吸管反复吹打,使其混合均匀,制成1:100 的样品匀液。
6.1.5、根据对样品污染状况的估计,按上述操作,依次制成10 倍递增系列稀释样品匀液。
每递增稀释1 次,换用1 支1ml无菌吸管或吸头。
从制备样品匀液至样品接种完毕,全过程不得超过15 min 。
6.2、初发酵试验每个样品,选择3 个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3 管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接种1ml(如接种量超过1ml,则用双料LST肉汤), 36℃±1℃培养24h±Zh ,观察倒管内是否有气泡产生,如未产气则继续培养至48h±2h 。
记录在24h 和48h 内产气的LST 肉汤管数。
未产气者为大肠菌群阴性,产气者则进行复发酵试验。
6.3、复发酵试验用接种环从所有48h±2h 内发酵产气的LST 肉汤管中分别取培养物l环,移种于煌绿乳糖胆盐( BGLB)肉汤管中,36℃±1℃培养48h±2h ,观察产气情况。
大肠菌群检验程序
大肠菌群检验程序如下:
1. 取25克样品与225毫升稀释液混合均质。
2. 进行10倍系列稀释。
3. 选择3个适宜的连续稀释度样品匀液,接种月桂基硫酸盐胰蛋白胨(LST)肉汤发酵管,36摄氏度培养48小时。
4. 取产气的LST肉汤发酵管,接种煌绿乳糖胆盐(BGLB)肉汤发酵管,36摄氏度培养48小时。
5. 根据发酵管的产气情况,判定大肠菌群阴阳性。
6. 查阅MPN表并报告结果。
大肠菌群检验可分为样品的稀释和初发酵试验、复发酵试验两个步骤。
在进行检验时,需要严格按照相关规定和标准进行操作,确保实验结果的准确性和可靠性。
食品中大肠菌群计数测定的标准操作规程1.目的本标准操作规程的目的是为了能够准确、快速地测定食品中大肠菌群的数量,以便于对食品的卫生状况进行评估。
2.应用范围该操作规程适用于各种食品样品,如肉、鱼、蔬菜、水果等。
3.实验器材和试剂3.1器材:(1)无纤维纸滤纸或滤膜或滤布等过滤介质。
(2)LED 灯或紫外灯。
(3)培养皿、移液器、无毒胶带和显微镜。
(4)电子天平。
(5)水槽和蒸馏水。
3.2试剂:(1)胆盐琼脂培养基。
(2)大肠埃希菌ANTISERUM(可以根据需要添加,如:O157等)。
(3)含有氯化钠、肉汤和酚红的PB(NaCl、pH值7.2±0.2、菜心草浸提液)培养基。
4.操作流程4.1样品的准备样品应当是新鲜的、无病变的,如为肉类样品则需要去除肉骨、制成均匀的细碎物;如为水果蔬菜,则需将其冲洗干净削皮去籽核、制成较小的碎片。
如果是液体样品,需要摇匀,取少量样品进行分析。
(1)将胆盐琼脂培养基先膜切成适当的大小,放置在无菌的培养皿中,静置至凝固(温度约35℃)后,置于4℃左右冷藏备用。
(2)PB培养基的制备:每升PB(NaCl、pH值7.2±0.2、菜心草浸提液)培养基中加入10克肉汤粉和0.01克酚红,用蒸馏水充分搅拌均匀,灭菌后置于4℃左右。
4.3分析程序(1)取样品约10g,加入90mLPB(NaCl、pH值7.2±0.2、菜心草浸提液)中,用搅拌器搅拌1分钟,摇匀后放置2分钟(2分钟后即是样品液体)。
(2)取上述处理好的样品液1mL,加入9mL的PBS(NaCl、pH7.2±0.2)中均匀悬浮。
去除上清后再次悬浮,充分均匀。
(3)取上述悬浮液,利用无菌的吸管分别在胆盐琼脂培养基上均匀涂布(充分在滤纸上滤过),然后进行相应的实验测定:a.在培养皿边缘涂上大肠埃希菌ANTISERUM(注意稀释)。
b.在光照充足的环境下,在37℃下培养16-18小时。
食品大肠菌群、粪大肠菌群和大肠杆菌检测步骤一、培养基制备1、生理盐水氯化钠 8.5g蒸馏水 1000.0ml将氯化钠溶于蒸馏水中,搅拌均匀后用量筒量取225ml分装到各个广口瓶中,1210C高压灭菌15min,备用。
2、月桂基硫酸盐胰蛋白胨肉汤称取37克放入烧杯,将各成分溶解于1000ml蒸馏水中,放电炉子上加热并搅拌均匀,分装于装有倒立发酵管的试管中,每管10ml,装完盖帽,1210C高压灭菌15min,双料培养基除蒸馏水不变外,其余成分加倍。
3、样品制备(在无菌室中进行)(1)固体或半固体样品无菌操作称取样品25g置于装有225ml生理盐水的广口瓶中,充分振摇、混匀,制成1:10的样品稀释液备用。
(2)液体样品以无菌吸管吸取样品25g置于装有225ml生理盐水的广口瓶中,充分混匀,制成1:10的样品稀释液备用。
4、样品稀释用1ml无菌吸管或微量移液器吸取1:10样品匀液1ml,沿管壁缓慢注于盛有9ml 生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管混匀,制成1:100的样品匀液。
按照该操作程序,可制备1:1000,1:10000。
等10倍系列稀释样品匀液,每递增稀释一次,换用1次1ml无菌吸管或吸头。
根据对样品污染状况的估计,选择2-3个适宜稀释度的样品匀液(液体样品可包括原液),在进行10倍递增稀释时,吸取1ml样品匀液于无菌平皿内,每个稀释度做两个平皿。
同时分别吸取1ml空白稀释液加入两个无菌平皿内作空白对照。
二、大肠菌群的测定(MPN法)1、选取适宜的三个连续稀释度的样品匀液,每个稀释度均接种三管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接种1ml。
360C+10C培养24h-48h后,观察倒管内是否有气泡产生,并记录24h和48h内产气的LST肉汤管数。
对未产气的试管,可以轻敲试管壁的方式观察是否有较细小的气泡从管底逸出,如果所有LST肉汤管均未产气,可按。
报告结果;如果LST管有产气,则按下面步骤作证实试验。