清华大学化学反应原理
- 格式:doc
- 大小:985.00 KB
- 文档页数:5

化学选修化学反应原理知识点总结化学反应原理是化学课程的核心内容之一,涵盖了化学反应的基本原理、化学平衡及其影响因素、速率论、化学动力学以及电化学等方面的知识。
下面将对这些知识点进行详细总结。
1.化学反应的基本原理化学反应指的是物质之间发生化学变化的过程。
化学反应的基本原理包括:(1)反应物与生成物的质量守恒定律:在封闭系统中,反应物质的质量与生成物质的质量之和保持不变;(2)能量守恒定律:化学反应过程中,能量的总量保持不变;(3)化学键的断裂和形成:化学反应过程中,化学键断裂和形成是不可避免的。
2.化学平衡及影响因素化学平衡是指化学反应在一定条件下,反应物和生成物之间的浓度或者物质量保持不变的状态。
在平衡状态下,正向反应和逆向反应的速率相等。
影响化学平衡的因素包括温度、压力及浓度。
(1)Le Chatelier原理:当系统在平衡状态下受到外界条件改变时,系统会通过一系列的调整来抵抗这种变化,以维持原有的平衡状态。
例如,如果在平衡状态下增加了反应物的浓度,系统会相应地减少生成物的浓度,从而保持平衡。
(2)平衡常数(K):平衡常数是一个用于表示平衡体系中反应物与生成物之间浓度比例关系的定量指标。
对于一般的化学平衡反应,平衡常数表达式可以用麦克斯韦方程或者根据反应的化学方程式和平衡式推导出。
3.速率论速率论是研究化学反应速率的理论体系。
化学反应的速率可以由生成物浓度的变化速率来表示。
速率实验与速率方程是速率论的两个重要内容。
(1)速率实验:通过控制其中一反应物的初始浓度,观察在不同时间点上反应物的浓度变化情况,从而确定反应速率。
速率实验还可以由反应物的消失速率或者生成物的生成速率来表示。
(2)速率方程:速率方程用于描述反应速率与反应物浓度之间的关系。
速率方程可以由反应的反应机理、实验数据和反应物浓度之间的对应关系来确定。
4.化学动力学化学动力学是研究化学反应速率与反应条件(如温度、浓度、催化剂等)之间的关系的一个学科。

化学选修化学反应原理知识点总结化学反应原理是指化学反应发生的原理和规律。
化学反应是化学物质之间发生的变化过程,它是由分子、离子或原子之间的键的断裂和形成所引起的。
了解化学反应原理可以帮助我们理解和解释化学现象、推断和预测反应产物、优化化学过程、设计新的化学反应等。
下面是化学反应原理的一些重要知识点总结。
1.反应速率和反应的速率方程:反应速率是指单位时间内反应物浓度的变化量。
反应的速率方程描述了反应速率与反应物浓度的关系。
一般情况下,反应速率与浓度成正比,可以用速率常数k来表示。
反应速率还可以由反应物的摩尔反应系数与常数k相结合表示。
2. 反应平衡:当一个反应达到一定的条件下,反应速率的前后变化趋势相同,称为反应达到平衡。
在平衡时,反应物和产物的摩尔浓度不再改变,但是反应仍然在进行。
平衡常数Keq描述了反应物和产物摩尔浓度的关系,它是反应物和产物浓度比的乘积的比值。
3.平衡常数与反应热力学:平衡常数与反应热力学分析有关。
在常温常压下,反应物和产物之间的能量变化可以通过反应焓变ΔH来描述。
根据反应焓变ΔH的正负,可以判断反应是放热反应还是吸热反应。
平衡常数与ΔH之间有关系,当ΔH为正时,平衡常数较小时反应向产物方向偏移,反之,当ΔH为负时,平衡常数较大,反应向反应物方向偏移。
4.化学平衡与莱沃留斯定律:莱沃留斯定律描述了化学反应中浓度变化对平衡常数的影响。
它指出,在一定温度和压强下,当反应达到平衡后,反应物和产物浓度的比值的乘积的倒数等于平衡常数。
当改变反应物浓度或产物浓度时,反应会重新达到平衡,而平衡常数不变。
5.反应速率与反应机理:反应速率与反应机理密切相关。
反应机理是指反应中发生的一系列微观步骤,每个步骤都有一个速率常数。
反应机理包括起始物质的反应、中间物的生成和中间物的反应等步骤。
反应速率决定于速率控制步骤的速率常数。
通常情况下,反应速率与活化能有关,活化能越低,反应速率越快。
温度的升高可以提高反应速率,因为它提供了更多的能量以克服反应的活化能。
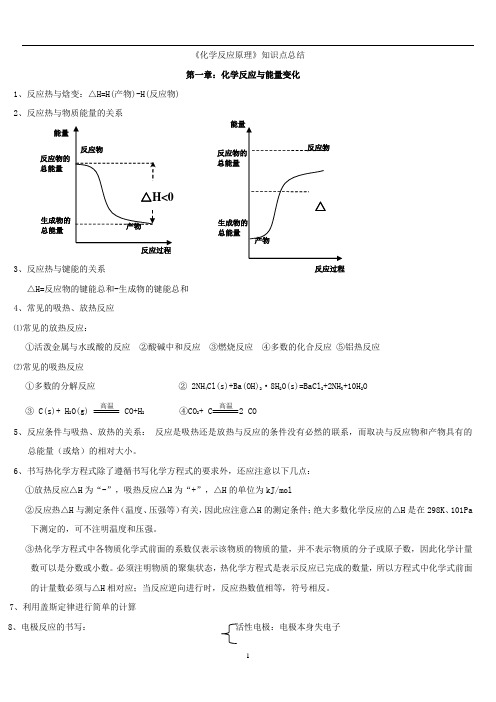
《化学反应原理》知识点总结第一章:化学反应与能量变化1、反应热与焓变:△H=H(产物)-H(反应物)2、反应热与物质能量的关系3、反应热与键能的关系△H=反应物的键能总和-生成物的键能总和4、常见的吸热、放热反应⑴常见的放热反应:①活泼金属与水或酸的反应 ②酸碱中和反应 ③燃烧反应 ④多数的化合反应 ⑤铝热反应⑵常见的吸热反应①多数的分解反应 ② 2NH 4Cl(s)+Ba(OH)2·8H 2O(s)=BaCl 2+2NH 3+10H 2O③ C(s)+ H 2O(g) 高温 CO+H 2 ④CO 2+ C 高温2 CO5、反应条件与吸热、放热的关系: 反应是吸热还是放热与反应的条件没有必然的联系,而取决与反应物和产物具有的总能量(或焓)的相对大小。
6、书写热化学方程式除了遵循书写化学方程式的要求外,还应注意以下几点:①放热反应△H 为“-”,吸热反应△H 为“+”,△H 的单位为kJ/mol②反应热△H 与测定条件(温度、压强等)有关,因此应注意△H 的测定条件;绝大多数化学反应的△H 是在298K 、101Pa 下测定的,可不注明温度和压强。
③热化学方程式中各物质化学式前面的系数仅表示该物质的物质的量,并不表示物质的分子或原子数,因此化学计量数可以是分数或小数。
必须注明物质的聚集状态,热化学方程式是表示反应已完成的数量,所以方程式中化学式前面的计量数必须与△H 相对应;当反应逆向进行时,反应热数值相等,符号相反。
7、利用盖斯定律进行简单的计算8、电极反应的书写:活性电极:电极本身失电子能量 反应物的总能量 生成物的总能量 反应过程 总能量 总能量⑴电解:阳极:(与电源的正极相连)发生氧化反应惰性电极:溶液中阴离子失电子(放电顺序:I->Br->Cl->OH-)阴极:(与电源的负极相连)发生还原反应,溶液中的阳离子得电子(放电顺序:Ag+>Cu2+>H+)注意问题:①书写电极反应式时,要用实际放电的离子.......来表示②电解反应的总方程式要注明“通电”③若电极反应中的离子来自与水或其他弱电解质的电离,则总反应离子方程式中要用化学式表示⑵原电池:负极:负极本身失电子,M→Mn+ +ne-① 溶液中阳离子得电子Nm++me-→N正极:2H++2e-→H2↑②负极与电解质溶液不能直接反应:O2+4e-+2H2O→4OH-(即发生吸氧腐蚀)书写电极反应时要注意电极产物与电解质溶液中的离子是否反应,若反应,则在电极反应中应写最终产物。

化学书选修一化学反应原理化学反应原理是化学学科的重要内容之一,它研究了化学反应的基本规律和机制。
化学反应是物质发生变化的过程,其背后隐藏着丰富的化学知识和原理。
本文将从反应速率、反应热力学和化学平衡三个方面介绍化学反应原理的相关内容。
一、反应速率反应速率是化学反应中最基本的指标之一,用来描述反应物消失和生成物出现的速度。
反应速率受多种因素影响,如温度、浓度、催化剂等。
其中温度是影响反应速率最重要的因素之一。
根据化学动力学理论,随着温度的升高,反应速率将会增加。
这是因为温度的升高会增加反应物的分子动能,使得反应物分子更容易发生碰撞并产生化学反应。
浓度和催化剂也能够影响反应速率,浓度的增加会增加反应物分子的碰撞频率,而催化剂则能够提高反应物分子的活化能,使反应速率加快。
二、反应热力学反应热力学研究了反应的热效应,即反应过程中释放或吸收的热量。
根据热力学第一定律,能量守恒,反应物和生成物之间的能量差即为反应释放或吸收的热量。
反应热力学可以帮助我们了解反应的放热或吸热性质,并进一步推导出反应的热力学方程。
热力学方程是描述反应物和生成物之间能量变化关系的数学表达式,它可以帮助我们预测反应的热效应,并进一步研究反应的热力学性质。
三、化学平衡化学平衡是化学反应达到稳定状态的情况。
在化学平衡状态下,反应物和生成物的浓度保持不变。
化学平衡受到反应物浓度、压力和温度的影响。
根据Le Chatelier原理,当系统受到外界干扰时,系统会偏离平衡状态,但会通过反应的方式重新达到平衡。
例如,当反应物浓度增加时,平衡反应会向生成物的方向移动,以减少反应物的浓度差异。
同样地,当温度升高时,平衡反应会向吸热方向移动,以吸收多余的热量。
化学反应原理涉及反应速率、反应热力学和化学平衡三个方面。
通过研究这些原理,我们可以深入了解化学反应的基本规律和机制。
化学反应原理的研究对于新材料的开发、新药物的研制以及环境保护等领域具有重要意义。

《选修4化学反应原理》知识点总结(2)(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(《选修4化学反应原理》知识点总结(2)(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为《选修4化学反应原理》知识点总结(2)(word版可编辑修改)的全部内容。
一、焓变、反应热要点一:反应热(焓变)的概念及表示方法化学反应过程中所释放或吸收的能量,都可以用热量来描述,叫做反应热,又称焓变,符号为ΔH,单位为kJ/mol,规定放热反应的ΔH为“—”,吸热反应的ΔH为“+"。
特别提醒:(1)描述此概念时,无论是用“反应热"、“焓变”或“ ΔH”表示,其后所用的数值必须带“+"或“—”。
(2)单位是kJ/mol,而不是kJ,热量的单位是kJ。
(3)在比较大小时,所带“+”“-”符号均参入比较。
要点二:放热反应和吸热反应1.放热反应的ΔH为“—”或ΔH<0 ;吸热反应的ΔH为“+”或ΔH >0∆H=E(生成物的总能量)-E(反应物的总能量)∆H=E(反应物的键能)- E(生成物的键能)2.常见的放热反应和吸热反应①放热反应:活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应。
②吸热反应:多数的分解反应、氯化铵固体与氢氧化钡晶体的反应、水煤气的生成反应、炭与二氧化碳生成一氧化碳的反应3.需要加热的反应,不一定是吸热反应;不需要加热的反应,不一定是放热反应4.通过反应是放热还是吸热,可用来比较反应物和生成物的相对稳定性。
如C(石墨,s) C(金刚石,s)△H3= +1.9kJ/mol,该反应为吸热反应,金刚石的能量高,石墨比金属石稳定。

《选修4_化学反应原理》知识点总结整理1.化学反应基本概念-化学反应:指一种或多种物质之间发生物质或能量转化的过程。
-反应物:参与反应的起始物质。
-生成物:反应物转化为的新的物质。
-反应物质的种类:元素、化合物、离子等。
-反应物质在反应中的相对反应程度:反应速率。
2.化学平衡-化学平衡:指反应物与生成物之间浓度、压力、温度等不再发生可观测的变化的状态。
- 平衡原理:Le Chatelier原理,认为当外界条件改变时,系统会调整以抵消这种改变。
-平衡常数:用于描述反应物浓度和生成物浓度之间的关系。
-平衡常数与反应方程式:Kc表示在一定温度下,反应物浓度与生成物浓度之间的关系;Kp表示在一定温度下,反应物分压与生成物分压之间的关系。
3.化学反应速率-反应速率:反应物消失或生成物产生的速率。
-反应速率与反应物浓度之间的关系:浓度越高,反应速率越快。
-反应速率与温度之间的关系:温度升高,反应速率增加。
-反应速率与催化剂之间的关系:催化剂可以加快反应速率,但不参与反应本身。
4.化学平衡与反应速率的关系-平衡常数与反应速率:平衡常数越大,反应速率越快。
-平衡与速率之间的平衡条件:在平衡状态下,反应物的浓度、生成物的浓度以及反应速率保持不变。
5.化学反应的方向性-正向反应:从反应物转化为生成物的反应过程。
-反向反应:从生成物转化为反应物的反应过程。
-反应的方向性与平衡常数之间的关系:平衡常数大于1,正向反应偏向生成物;平衡常数小于1,正向反应偏向反应物。
6.化学反应的影响因素-温度:温度升高,反应速率增加,化学反应更快进行。
-反应浓度:浓度越高,反应速率越快。
-催化剂:能够降低反应活化能,加快反应速率。
7.化学反应类型-双反应:A+B→C+D。
-多反应:A+B→C,C→D。
-逆反应:反应物和生成物之间存在正向反应和反向反应。
以上是《选修4_化学反应原理》课程中的主要知识点总结。
通过学习这部分内容,可以了解化学反应的基本概念、化学平衡的原理、化学反应速率的影响因素以及化学平衡与反应速率之间的关系。
化学选修化学反应原理知识点化学反应原理是化学一个重要的考点,关于它的原理你都掌握了多少?接下来店铺为你整理了化学选修化学反应原理知识点,一起来看看吧。
化学选修化学反应原理知识点化学反应与能量一、化学反应的热效应1、化学反应的反应热(1)反应热的概念:当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热。
用符号Q表示。
(2)反应热与吸热反应、放热反应的关系。
Q>0时,反应为吸热反应;Q<0时,反应为放热反应。
(3)反应热的测定测定反应热的仪器为量热计,可测出反应前后溶液温度的变化,根据体系的热容可计算出反应热,计算公式如下:Q=-C(T2-T1)式中C表示体系的热容,T1、T2分别表示反应前和反应后体系的温度。
实验室经常测定中和反应的反应热。
2、化学反应的焓变(1)反应焓变物质所具有的能量是物质固有的性质,可以用称为“焓”的物理量来描述,符号为H,单位为kJ·mol-1。
反应产物的总焓与反应物的总焓之差称为反应焓变,用ΔH表示。
(2)反应焓变ΔH与反应热Q的关系。
对于等压条件下进行的化学反应,若反应中物质的能量变化全部转化为热能,则该反应的反应热等于反应焓变,其数学表达式为:Qp=ΔH=H(反应产物)-H(反应物)。
(3)反应焓变与吸热反应,放热反应的关系:ΔH>0,反应吸收能量,为吸热反应。
ΔH<0,反应释放能量,为放热反应。
(4)反应焓变与热化学方程式:把一个化学反应中物质的变化和反应焓变同时表示出来的化学方程式称为热化学方程式,如:H2(g)+O2(g)=H2O(l);ΔH(298K)=-285.8kJ·mol-1书写热化学方程式应注意以下几点:①化学式后面要注明物质的聚集状态:固态(s)、液态(l)、气态(g)、溶液(aq)。
②化学方程式后面写上反应焓变ΔH,ΔH的单位是J·mol-1或kJ·mol-1,且ΔH后注明反应温度。
《化学反应原理》知识点归纳第一章化学反应与能量一、焓变反应热1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量。
2.焓变(△H)的意义:在恒压条件下进行的化学反应的热效应。
⑴符号——△H;⑵单位——kJ/mol。
3.产生原因:化学键断裂——吸热;化学键形成——放热。
键能越大,物质所含能量越低,物质越稳定;键能越小,物质所含能量越高,物质越不稳定。
放热反应——反应物的总能量高于生成物的总能量(放出的热量>吸收的热量);△H为“-”或△H<0。
吸热反应——反应物的总能量低于生成物的总能量(吸收的热量>放出的热量)△H为“+”或△H>0。
常见的放热反应:①所有的燃烧反应②酸碱中和反应③大多数的化合反应④金属与酸的反应⑤生石灰和水反应⑥钠与水的反应常见的吸热反应:①晶体Ba(OH)2·8H2O与NH4Cl ②大多数的分解反应③以H2、CO、C为还原剂的氧化还原反应④盐的水解二、热化学方程式1.能表示参加反应物质的量和反应热的关系的化学方程式,叫热化学方程式。
2.书写热化学方程式注意要点:⑴热化学方程式必须标出能量变化。
⑵热化学方程式中必须标明反应物和生成物的聚集状态(g、l、s分别表示固态、液态、气态,水溶液中溶质用aq表示)。
⑶热化学反应方程式要指明反应时的温度和压强(对于25℃、101 kPa时进行的反应可以不注明)。
⑷热化学方程式中的化学计量数可以是整数,也可以是分数。
⑸各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变。
三、燃烧热1.概念:25 ℃,101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
燃烧热的单位用kJ/mol表示。
2.注意点:⑴研究条件:25 ℃,101 kPa。
⑵反应程度:完全燃烧,产物是稳定的化合物。
⑶燃烧物的物质的量:1 mol。
⑷研究内容:放出的热量。
(△H<0,单位kJ/mol)四、中和热1.概念:在稀溶液中,酸跟碱发生中和反应而生成1mol H2O,这时的反应热叫中和热。
一、填空与选择题(60 percent ,其中9、23小题为5point, 11小题为6 point ,其余小题为2分)1. 按照配位化合物的命名法给下列化合物命名:① [Co(NO 2)3(NH 3)3]___________三硝基三氨合钴(III )_______________________ ② [CrCl(NH 3)(en)2]SO 4________硫酸一氯一氨二(乙二胺)合铬(III )_________2. 下列关于晶体的表述中正确的是_______③______⑤____________________。
① 晶体不一定有清晰的X-射线衍射图。
② 完美晶体的熵与温度无关。
③ 在离子晶体中正负离子依靠静电力结合在一起。
④ 在金属晶体中金属原子依靠范德华力结合在一起。
⑤ 在等径球的最密堆积中存在两种空隙即四面体空隙和八面体空隙。
3. [Cr(NH 3)4]Cl 3与K 2Cr 2O 7均有特征颜色但是它们颜色产生的微观机理不同[Cr(NH 3)4]Cl 3的颜色来源于_d-d 跃迁_,K 2Cr 2O 7的颜色来源于__从配体(O 2-)到中心离子Cr 6+的电荷(电子)转移跃迁__。
4. OF 2、NF 5、XeF 4中不可能存在的是________NF 5__________,可存在的分子的几何构型分别为____角形(V 形)、___平面正方形________________________。
5. LiF 、LiCl 中在水中溶解度较小的是_LiCl _。
Br -、F -中可与Al 3+生成较稳定配合物的是_F -_。
6. TlCl 和TlCl 3中比较稳定的是__TlCl __。
Ga 和In 中熔点较高的是___In ___。
Li 和Be 中与Mg 性质相近的元素是____Li ____。
Au 和Hg 中金属键较弱的是___Hg ___。
7. 请具体写出对二甲苯和乙醇混合溶液中所存在的分子间相互作用力:________氢键________、 ________取向力_______、_______诱导力________、_______色散力_______。
8. 请按照熔点由低到高的顺序重新排列下列晶体_____④__③__②__①__⑤_____。
① NaCl ② MgCl 2 ③ AlCl 3 ④ SiCl 4 ⑤ SiO 29. ① 液态NH 3和PH 3中沸点较高的是_______NH 3_________。
② HBr 和HCl 中分子偶极矩较大的是_______HCl _________。
③ 苯与乙炔中C-H 键较长的是_______苯_________。
④ COCl 2和HCHO 中R-C-R(R = Cl 、H)键角较大的是________HCHO ________。
⑤ 钠和铝导电性较强的是_______铝_________。
10. Be 2+的离子半径为43pm ,S 2-的离子半径为180pm ,因此可以判定该离子晶体中阳离子的配位数为______4________,晶格类型为_____立方面心(立方ZnS 型)_____。
11. [FeF 6]3-、[Fe(CN)6]4-配离子中金属离子的价层电子排布分别为____3d 5____、____3d 6____。
按晶体场理论中心离子的d 轨道分裂为两组轨道____e g ____、____t 2g _____,其中能级高的是_____e g ____轨道。
在分裂后的轨道中金属离子的d 电子排布分别为___(t 2g )3(e g )2___、___(t 2g )6__。
配离子的磁距分别为_____5.92μB _____、_____0____。
属于反磁性的配离子是_[Fe(CN)6]4-_。
属于高自旋的配离子是_[FeF 6]3-_。
易与吡啶反应的配离子是__[FeF 6]3-_。
12. 金属Ni为面心立方密堆积结构,晶胞参数a = 352 pm。
金属Ni原子配位数为_____12______,晶胞中原子数为______4______,金属Ni的原子半径为____124 pm ____。
13. 已知W属立方晶系,其晶胞参数a = 315.7 pm,密度ρ= 1.90×104kg/m3,分子量M = 183.92则该晶体的结构属于_____体心立方_______密堆积。
14. Li+、Cl-、Ca2+、S2-、Al3+、Mg2+、Br-、Na+的半径由大到小的顺序为_ Br- > S2- > Cl- > Ca2+≈ Na+ > Mg2+≈ Li+ > Al3+_。
15.原子与分子体系中具有饱和性与方向性的作用力为____②___⑤___⑥______________。
①金属键 ②配位键 ③ 分子间作用力④ 离子键⑤ 氢键⑥共价键16.分子轨道是由原子轨道通过__线性组合__而形成的,由原子轨道形成分子轨道所必须遵循的三个基本原则是①__对称性匹配__;②__能量相近__;③__最大重叠__。
17.σ键的特点是①__由原子轨道沿键轴方向以“头碰头”方式重叠形成__;②_关于键轴呈圆柱形对称_。
π键的特点是①_由原子轨道垂直于键轴方向以“肩并肩”方式重叠形成_;②_存在一个通过键轴的反对称镜面_。
18.按分解温度从高到低的顺序排列下列化合物:____④___②___③___⑤___①____。
① H2CO3 ② CaCO3 ③ PbCO3④ BaCO3⑤ BeCO319. 氯的氧化物中具有顺磁性的是:____________②_______________。
① Cl2O ② ClO2 ③ Cl2O4④ Cl2O6⑤ Cl2O720. 下列分子或离子中存在三重键的是___①__⑥___,不含π键的有____⑤___⑦____。
① CO ② CO2 ③ C2H4④ C6H6⑤ BH4-⑥ CN-⑦ PH4+⑧ P2O5⑨ HCHO21. 下列分子中除__④___⑧__⑨__外都具有永久偶极矩。
① N2O ② NO2 ③ C2Cl4④ C6H6⑤ CH2I2⑥ N2H4⑦ PCl3⑧ PCl5⑨ SF622. [NiCl4]2-、[Ni(CN)4]2-、Ni(CO)4、[PdCl4]2-的几何构型分别为_正四面体_、_平面正方形_、_正四面体_、_平面正方形_,中心原子的轨道杂化方式分别为_sp3_、_dsp2_、_sp3_、_dsp2_。
23.①吡啶(C6H5N)和氨(NH3)中碱性较强的是__C6H5N__。
②苯酚(C6H5OH)和苯甲醇(C6H5CH2OH)中酸性较强的是__C6H5OH__。
③苯基氯甲烷(C6H5CH2Cl)与环己基氯甲烷(C6H11CH2Cl)易水解生成醇的是_C6H5CH2Cl_。
④ CCl4和SiCl4易水解的是__SiCl4__。
⑤ NO+、O2-、CO、O2+、N2+中键长最长的是___O2-___。
24.按沸点降低的顺序排列下列分子____③__④__⑤__②__①____。
①丙烷 ②正丁烷 ③ 正戊烷④ 异戊烷⑤ 新戊烷25.为了说明分子的形成与结构,__③__提出了价键理论;__①_建立了杂化轨道理论;_②_④_提出了分子轨道理论。
① L. Pauling ② R. S. Mulliken ③ G. N. Lewis ④ F. Hund ⑤ W. Heitler二、(20 percent,其中1、2小题为2分,3、4小题为4point, 5小题为8 point)1. 请用VSEPR理论画出 I3-和 IF4-的分子构型并指出中心原子的杂化轨道类型。
解:I3-中心原子sp3d杂化[I-I-I]-IF4-中心原子sp3d2杂化IF FFF2. 请画出B2的分子轨道能级图并写出B2的分子轨道式。
分子轨道式:(σ1s)2(σ*1s)2(σ2s)2(σ*2s)2(π2py)1(π2pz)13. 请画出HNO3分子的空间结构并指出中心原子的杂化方式以及可能的π键形式。
解:HNO3空间结构NO OH中心原子N 采取sp2杂化,分子中存在π34,大π键。
4. [Co(en)2F2]+存在的空间异构体共有__3____个,画出其结构图,并指出各异构体的类型。
5. 请画出O 3-、O 3、O 3+、O 32+分子的空间结构,指出中心原子的杂化方式以及可能的π键形式,并比较其键长与键角的大小。
解: 空间结构分别为:O OOOOOOOOOOO2O 3-: 中心原子杂化方式 sp 2;π35; O 3: 中心原子杂化方式 sp 2;π34; O 3+: 中心原子杂化方式 sp 2;π34; O 32+: 中心原子杂化方式sp ;两个π34; 键长:O 3->O 3>O 3+>O 32+ 键角:O 3-<O 3<O 3+<O 32+三、(6 percent ) 已知钒的密度为5.79 gcm -3, 原子量为50.94,立方晶胞边长为308 pm 。
试求(1) 单位晶胞中钒原子个数;(2) 确定钒晶体的晶格类型;(3) 钒的金属半径。
四、(8 percent) 经X 射线分析鉴定某一离子晶体属于立方晶系其晶胞参数a = 403.1 pm ,晶胞中顶点位置为Ti 4+所占体心位置为Ba 2+所占所有棱心位置为O 2-所占请据此回答或计算(1) 写出该晶体的化学式; (2) 分别指出Ti 4+和Ba 2+的配位氧原子的个数; (3) O 2-半径为140pm ,计算两种正离子半径值; (4) 如果将O 2-和Ba 2+视为等同则它们联合构成何种形式的密堆积。
五、(6 percent ) 下图分别是TiO2与ZnS的晶胞,指出(1)它们所属的晶格类型;(2)晶胞中所含有的阴阳离子数目;(3) 阴阳离子的配位数。