ds区金属铜银锌镉汞
- 格式:pdf
- 大小:127.49 KB
- 文档页数:4

铜、银、锌、镉、汞实验目的1.试验并了解ds 区元素的氢氧化物(或氧化物)的酸碱性及对热稳定性2.了解铜、银、锌、镉、汞的金属离子形成配合物的特征3.了解Cu(Ⅱ)与Cu(Ⅰ),Hg(Ⅱ)与Hg(Ⅰ)的相互转化条件4.了解铜、银、锌、镉、汞的离子鉴定实验提要ds区元素包括铜、银、锌、镉和汞。
它们的价电子层结构分别为(n-1)d10ns1和(n-1)d10ns2。
在化合物中常见的氧化值。
铜为+2 和+1,银为+1,锌和镉为+2,汞为+2 和+1。
这些元素的简单阳离子具有或接近18e的构型。
在化合物中与某些阳离子有较强的相互极化作用,成键的共价成分较大。
多数化合物较难溶于水,对热稳定性较差,易形成配位化合物,化合物常显不同的颜色。
例如,这些元素的氢氧化物均较难溶于水,且易脱水变成氧化物。
银和汞的氢氧化物极不稳定。
常温下即失水变成Ag2O(棕黑色)和HgO(黄色)。
黄色HgO加热则生成桔红色HgO变体。
Cu(OH)2、Zn(OH)2和Cd(OH)2在常温下较稳定,但受热亦会失水成氧化物。
浅蓝色Cu(OH)2在80℃失水成棕黑色CuO,白色Zn(OH)2在125℃开始失水成黄色(冷后为白色)的ZnO,白色Cd(OH)2在250℃变成棕红色的CdO。
Zn(OH)2呈典型的两性氢氧化物,Cu(OH)2呈较弱的两性(偏碱),Cd(OH) 2和Hg(OH)2(HgO)呈碱性,而AgOH为强碱性。
Cu2+、Ag+、Zn2+、Cd2+、Hg2+与Na2S溶液反应都生成难溶的硫化物,即CuS(黑色),Ag2S(黑色),ZnS(白色),CdS (黄色)和HgS(黑色)。
其中HgS可溶于过量的Na2S,与S2−生成无色的HgS22−配离子。
若在此溶液中加入盐酸又生成黑色HgS沉淀。
此反应可作为分离HgS的方法。
根据ZnS、CdS、Ag2S、CuS和HgS溶度积大小,ZnS可溶于稀酸,CdS溶于6mol•L−1HCl 溶液,Ag S和2 CuS溶于氧化性的HNO3,而HgS溶于王水。
1ds区元素1.1 本章学习要求(1)掌握铜和银的重要化合物的性质,Cu(Ⅰ)和Cu(Ⅱ)的相互转化。
(2)掌握锌和汞的重要化合物的性质,Hg(Ⅰ)和Hg(Ⅱ)的相互转化。
(3)了解镉的重要化合物性质。
(4)了解含汞、镉废水的处理。
ds区元素包括铜族元素(铜、银、金)和锌族元素(锌、镉、汞)。
这两族元素原子的价电子构型与其它过渡元素有所不同,为(n-1)d10n s1~2。
由于它们的次外层d能级有10个电子(全满结构),而最外层的电子构型又和s区相同,所以称为ds区。
1.2 铜族元素通性和单质1.2.1概述ⅠB族元素包括铜(Cu)、银(Ag)、金(Au)三种元素,通常称为铜族元素。
铜族元素原子的价电子构型为(n-1)d10n s1。
最外层与碱金属相似,只有1个电子,而次外层却有18个电子(碱金属有8个电子)。
因此与同周期的ⅠA族元素相比,铜族元素原子作用在最外层电子上的有效核电荷较多,最外层的s电子受原子核的吸引比碱金属元素原子要强得多,所以铜族元素的电离能比同周期碱金属元素显著增大,原子半径也显著减小,铜族元素单质都是不活泼的重金属,而相应的碱金属元素的单质都是活泼的轻金属。
表 1.2-1 碱金属与铜族元素比较自然界的铜、银主要以硫化矿存在,如辉铜矿(Cu2S),黄铜矿(CuFe S2),孔雀石[Cu2(OH)2C O3]等;银有闪银矿(Ag2S);金主要以单质形式分散在岩石或沙砾中,我国江南、甘肃、云南、新疆、山东和黑龙江等省都蕴藏着丰富的铜矿和金矿。
铜族元素密度较大,熔点和沸点较高,硬度较小,导电性好,延展性好,尤其是金。
1克金可抽3公里长的金丝,可压成0.1微米的金箔,500张的总厚度比头发的直径还薄些。
金易生成合金,尤其是生成汞齐。
铜是宝贵的工业材料,它的导电能力虽然次于银,但比银便宜得多。
目前世界上一半以上的铜用在电器、电机和电讯工业上。
铜的合金如黄铜(Cu-Zn)、青铜(Cu-Sn)等在精密仪器、航天工业方面都有广泛的应用。



无机化学实验报告以下是给大家整理收集的无机化学实验报告,仅供参考。
无机化学实验报告1Ds区元素(铜、银、锌、镉、汞)【学习目标】认知目标:把握铜、银、锌、镉、汞的氢氧化物或氧化物的酸碱性,硫化物的溶解性及配位性。
技能目标:把握Cu+ \ Cu2+及Hg22+\ Hg2+相互转化条件,正确使用汞;思想目标:培养学生观察现象、思考题目的能力。
【教学安排】一课时安排:3课时二实验要点:1、铜、银、锌、镉、汞氢氧化物或氧化物的天生和性质;2、锌、镉、汞硫化物的天生和性质;3、铜、银、锌、汞的配合物;4、铜、银、汞的氧化还原性。
【重点、难点】Cu+ \ Cu2+及Hg22+\ Hg2+相互转化条件;这些元素的氢氧化物或氧化物的酸碱性,硫化物的溶解性及配位性。
【教学方法】实验指导、演示、启发【实验指导】一、铜、银、锌、镉、汞氢氧化物或氧化物的天生和性质1、铜、锌、镉操纵:0.5mL 0.2 mol;L-1MSO4;2 mol;L-1NaOH;; ;2 mol;L-1H2SO4; ;;2 mol;L-1 NaOH指导:离子Cu2+实验现象H2SO4NaOH溶解释及原理Cu2+ +OH-=Cu(OH)2; Cu(OH)2+2H+=Cu2++2H2O Cu(OH)2++OH-=[Cu(OH)4]2-Zn2+ +OH-=Zn(OH)2;方程式同上溶溶浅蓝; 溶Zn2+Cd2+结论白; 白; 溶不溶Cd2+ +OH-=Cd(OH)2; Zn(OH)2、Cu(OH)2具有两性,以碱性为主,能溶于浓的强碱中天生四羟基合M(Ⅱ)酸根配离子。
Cd(OH)2碱性比Zn(OH)2强,仅能缓慢溶于热浓强碱。
2、银、汞氧化物的天生和性质操纵::0.5 mL 0.1 mol;L-1 AgNO3 ;2 mol;L-1NaOH;;;+ 2 mol;L-1HNO3(2 mol;L-1 NH3;H2O):0.5 mL 0.2 mol;L-1 Hg(NO3)2 ; 2 mol;L-1NaOH;;;+ 2 mol;L-1HNO3(40% NaOH) 指导:离子实验现象解释及原理Ag+Ag2O褐;HNO3溶溶无色氨水溶NaOH 不溶Ag2O+ 4NH3 + H2O =2Ag(NH3)2+ +2OHHgO + 2H+=Hg2+ +H2O-Hg2+HgO 黄;结论AgOH、Hg(OH)2沉淀极不稳定,脱水天生成碱性的Ag2O、HgO。


实验名称:ds区金属(铜,银,锌,镉,汞)实验日期:温度:气压:
一、实验目的
1.了解铜,银,锌,镉,汞氢氧化物或氧化物的酸碱性,硫化物的溶解性;
2.掌握铜(1+)和铜(2+)重要化合物的性质及相互转化条件;
3.试验并熟悉铜,银,锌,镉,汞的配位能力,以及Hg22+和Hg2+的转化。
二、实验内容
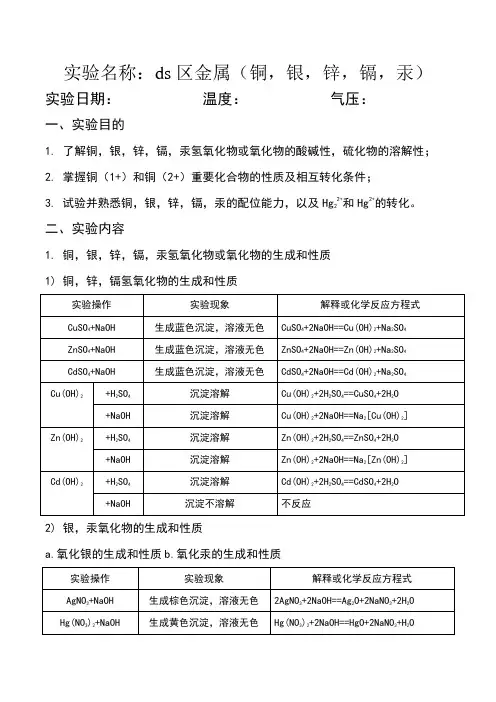
1.铜,银,锌,镉,汞氢氧化物或氧化物的生成和性质
1)铜,锌,镉氢氧化物的生成和性质
2)银,汞氧化物的生成和性质
a.氧化银的生成和性质
b.氧化汞的生成和性质
2.锌,镉硫化物的生成和性质
根据实验现象并查阅有关数据,填充下表,并对铜,银,锌,镉,汞硫化物的溶解情况作出结论,并写出有关反应方程式。
3.铜,银,锌,汞的配合物1)氨合物的生成
2)汞配合物的生成和性质
4.铜,银,汞的氧化还原性1)氧化亚铜的生成和性质
2)氯化亚铜的生成和性质
3)碘化亚铜的生成和性质
4)汞(2+)和汞(1+)的相互转化
a.Hg2+的氧化性+转化为Hg22+和Hg2+的歧化反解。


实验二十一ds区金属一、实验目的1、掌握铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性;2、掌握Cu (Ⅰ)、Cu (Ⅱ)重要化合物的性质及相互转化条件;3、试验铜、银、锌、镉、汞的配位能力以及亚汞离子和汞离子的转化。
二、实验内容(一)、铜、银、锌、镉、汞氢氧化物或氧化物的生成和性质:1 、铜、锌、镉氢氧化物的生成和性质(1)Ag2O的生成和性质:Ag++OH-===AgOH↓白色→Ag2O+H2OAg2O+2HNO3===2AgNO3+H2OAg2O+2NH3.H2O==2[Ag(NH3)2]++2OH-+H2OAg2O微溶于水,溶液呈微碱性。
它的△f H m﹩很小,不稳定,加热易分解,具有氧化性。
(2)HgO的生成和性质Hg2++2OH-==Hg(OH)2==HgO↓+H2OHgO+2HNO3==Hg(NO3)2+H2OHgO+NaOH(40℅)-----不溶HgO 有黄色和红色变体,结构相同,颜色差别完全是由于其颗粒的大小不同所致,黄色HgO晶粒较细小,红色颗粒较大。
(二)、铜、银、锌、镉、汞硫化物的生成和溶解说明:1.生成的CdS中,个别学生得到的沉淀是黄色中夹有白色沉淀,有可能是CdS晶形不一样,或有可能是生成Cd(OH)2白色沉淀。
补充:CdS沉淀颜色变化与溶液的酸度及温度有很大关系。
在冷氨性、中性或弱酸性溶液中,其沉淀为淡黄;若H+浓度增大,则沉淀将加变为深黄色。
2.在Hg(NO3)2中加入Na2S,开始生成白色沉淀,再加Na2S后变黑。
对白色沉淀再加热也不会再变化。
个别学生得到白中带有黄色的沉淀。
在中性或酸性汞盐溶液中加入S2-,即首先形成一个白色的复合物(HgCl2·2HgS):3Hg2++2Cl-+2S2-====HgCl2·2HgS若再加S2-,则白色沉淀→ 黄色→ 棕色→ 黑色:2HgCl·2HgS+S2-====3HgS+2Cl-此沉淀不溶与其它,只溶于王水、Na2S。
ds区金属:铜 银 锌 镉 汞一、实验目的l.熟悉铜、银、锌、镉、汞氢氧化物的酸碱性质和热稳定性;2.熟悉铜、银、锌、镉、汞配合物的性质和应用;3.掌握Cu(I)、Cu(II)重要化合物的性质和相互转化条件;4.熟悉Hg22+、Hg2+的转化,了解锌、镉、汞离子的鉴定反应。
二、实验原理铜、银、锌、镉、汞,分别属于ds区IB和ⅡB簇,常见水合离子有Cu2+、Ag+、Zn2+、Cd2+、Hg2+、Hg22+。
Cu(I)在高温或干态时表现稳定,在水溶液中只以一些配离子形式存在。
室温下,Cu2+、Ag+、Zn2+、Cd2+、Hg2+与适量NaOH反应,分别形成Cu(OH)2、Ag2O、Zn(OH)2、Cd(OH)2、HgO,Cu(OH)2在加热时分解生成黑色的CuO。
这些(氢)氧化物中,Zn(OH)2为典型的两性;Cu(OH)2也呈两性,但其碱性大于酸性;Cd(OH)2则主要呈碱性反应,仅缓慢溶于热的浓强碱液中;Ag2O与HgO基本上呈碱性。
Cu2+、Ag+、Zn2+、Cd2+与适量氨水反应时,Cu2+生成相应的碱式盐沉淀。
Ag+生成AgO沉淀,Zn2+、Cd2+生成Zn(OH)2、Cd(OH)2,它们与过量的NH3·H2O 反应都生成氨配合物。
与此不同,在氨水作用下,氯化汞生成氯化氨基汞盐沉淀物,硝酸汞则生成硝酸氨基氧汞。
在有大量铵盐存在时硝酸氨基氧汞可溶于过量NH3·H2O形成氨配合物,但HgNH2Cl不溶于过量NH3·H2O。
HgCl2+2NH3 =Hg(NH2)Cl↓(白色)+NH4Cl2Hg(NO3)2+4NH3+ H2O = HgO·Hg(NH2)NO3↓(白色)+3NH4NO3 Hg22+与过量氨水反应时,同时发生歧化反应,生成氨基汞化合物和汞。
2Hg2(NO3)2+4NH3+H2O = HgO·Hg(NH2)NO3↓+2 Hg↓+ 3NH4NO3Cu2+与I-反应即生成CuI白色沉淀。
Revise-实验20-铜、银、锌、镉、汞ds区元素(铜、银、锌、镉、汞)一、实验目的与要求:1.了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性。
2. 掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件。
3. 熟悉铜、银、锌、镉、汞的配位能力,以及Hg22+和Hg2+的转化。
二、教学重点与难点:了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性,熟悉铜、银、锌、镉、汞的配位能力,以及Hg22+和Hg2+的转化;掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件,三、教学方法与手段:讲授法;演示法四、教学课时: 4课时五、课的类型:实验课一、铜、银、锌、镉、汞氧化物或氢氧化物的生成和性质1、铜、锌、镉氧化物的生成和性质向三支试管分别盛有0.5ml 0.2mol.L-1CuSO4、ZnSO4、CdSO4溶液的试管中滴加新配制的2mol.L-1NaOH溶液,观察溶液颜色及状态。
将沉淀分成两份, 一份加硫酸另一份加NaOH溶液,观察现象。
Cu2++2OH-===Cu(OH)2↓ (蓝色沉淀)蓝色沉淀,溶解于酸,微溶于过量的碱,得到深蓝色溶液[Cu(OH)4]2-。
Cu(OH)2两性偏碱,所以需强碱使之生成配离子。
Zn2++2OH-=== Zn(OH)2↓ (白色沉淀)白色沉淀, 溶解于酸和过量的碱,典型的两性化物。
Cd 2++2OH-===Cd(OH)2↓白色沉淀,溶于酸, 不溶于碱。
Cd(OH)2 + NaOH (6M)= 不反应(Cd(OH)碱性)22. 银、汞氧化物的生成和性质(1)、氧化银的生成和性质取0.5ml 0.1mol.L-1AgNO3溶液,滴加新配制的2mol.L-1的NaOH溶液,观察沉淀的颜色和状态。
洗涤并离心,将沉淀分成两份,一份加入HNO3,另一份加入氨水,观察现象。
Ag++OH-===AgOH↓白色沉淀2AgOH===Ag2O+H2O 黑色沉淀Ag2O+2HNO3===2AgNO3+H2OAg2O+2NH3.H2O==2[Ag(NH3)2]++2OH-+H2O氢氧化银不稳定,很容易被氧化成黑色的Ag2O,此黑色沉淀溶于硝酸得到银离子,加入氨水得到银氨络合溶液。
实验名称:ds区金属(铜,银,锌,镉,汞)实验日期:温度:气压:
一、实验目的
1.了解铜,银,锌,镉,汞氢氧化物或氧化物的酸碱性,硫化物的溶解性;
2.掌握铜(1+)和铜(2+)重要化合物的性质及相互转化条件;
3.试验并熟悉铜,银,锌,镉,汞的配位能力,以及Hg22+和Hg2+的转化。
二、实验内容
1.铜,银,锌,镉,汞氢氧化物或氧化物的生成和性质
1)铜,锌,镉氢氧化物的生成和性质
2)银,汞氧化物的生成和性质
a.氧化银的生成和性质
b.氧化汞的生成和性质
2.锌,镉硫化物的生成和性质
根据实验现象并查阅有关数据,填充下表,并对铜,银,锌,镉,汞硫化物的溶解情况作出结论,并写出有关反应方程式。
3.铜,银,锌,汞的配合物
1)氨合物的生成
2)汞配合物的生成和性质
4.铜,银,汞的氧化还原性1)氧化亚铜的生成和性质
2)氯化亚铜的生成和性质
3)碘化亚铜的生成和性质
4)汞(2+)和汞(1+)的相互转化
a.Hg2+的氧化性
b.Hg2+转化为Hg22+和Hg2+的歧化反解。
d区元素化合物的性质实验报告Ds区元素重要化合物的性质实验ds区元素(铜、银、锌、镉、汞)的性质一、实验目的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的生成和性质; 6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理IB IIBCu Zn Cu(,2,,1) Zn(+2) Ag Cd Ag(,1) Cd(+2)Au Hg Au(,1,,3) Hg(+2,,1)蓝色的Cu(OH)呈现两性,在加热时易脱水而分解为黑色的CuO。
AgOH在常温下极易脱水而转化为棕2色的AgO。
Zn(OH)呈两性,Cd(OH)显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色222的HgO(I)。
2易形成配合物是这两副族的特性,Cu、Ag、Zn、Cd与过量的氨水反应时分别生成[Cu(NH)]、342++2+2+2+[Ag(NH)]、[Zn(NH)]、[Cd(NH)]。
但是Hg和Hg323434+2+2+2+2+2与过量氨水反应时,如果没有大量的NH存在,4+并不生成氨配离子。
如:HgCl, 2NH, Hg(NH)Cl?白, 2 NHCl2324HgCl, 2NH, Hg(NH)Cl?白, Hg?黑,NHCl(观察为灰色)22324Cu具有氧化性,与I反应,产物不是CuI,而是白色的CuI: 22+,Cu2+, I, 2CuI?白, I2,-将CuCl溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl] 的溶液。
将溶液稀释,得白色CuCl22沉淀:Cu , Cu,2+, 4Cl, 2[CuCl]2,,,[CuCl]?稀释?CuCl?白,Cl2卤化银难溶于水,但可利用形成配合物而使之溶解。
例如: AgCl, 2NH, [Ag(NH)],Cl332+-红色HgI难溶于水,但易溶于过量KI中,形成四碘合汞(II)配离子:2HgI, 2I, [HgI]24-2,黄绿色HgI与过量KI反应时,发生歧化反应,生成[HgI]和Hg: 2242,HgI, 2I, [HgI], Hg?黑224-2-三、实验内容1、氧化物的生成和性质 (1)Cu2O的生成和性质Cu2+, 2OH-,Cu(OH)2? 蓝色 Cu(OH)2, 2OH- = [Cu(OH)4]-2-蓝色2[Cu(OH)4]2-, C6H12O6 (葡萄糖) ,Cu2O?(红), 4OH-,C16H12O7,2H2O 或:2Cu2+ + 5OH- +C6H12O6 = Cu2O?+ C6H11O7- + 3H2O (须加热) 分析化学上利用此反应测定醛,医学上利用此反应检查糖尿病。
实验 ds 区金属(铜、银、锌、镉、汞)一、实验目的:1、了解铜、银、锌、镉、汞的氧化物或氢氧化物的酸碱性、硫化物的溶解性。
2、掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件。
3、试验并熟悉铜、银、锌、镉、汞的配位能力,以及Hg2 2+ 和Hg 2+ 的转化。
二、实验用品:仪器:试管、烧杯、离心机、离心试管固体药品:碘化钾、铜屑液体药品: HCl(2mol/L、 浓)、 H2SO4(2mol/L)、 HNO3(2mol/L、 浓)、 NaOH(2mol/L、 6mol/L、 40%)、氨水(2mol/L、浓)、CuSO4(0.2mol/L)、ZnSO4(0.2mol/L)、CdSO4(0.2mol/L)、 CuCl2(0.5mol/L) 、 Hg(NO3)2(0.2mol/L) 、 SnCl2(0.2mol/L) 、 AgNO3(0.1mol/L) 、 Na2S(0.1mol/L)、KI(0.2mol/L)、KSCN(0.1mol/L)、Na2S2O3(0.5mol/L)、NaCl(0.2mol/L)、 金属汞、葡萄糖溶液(10%)材料:pH试纸、玻璃棒三、实验内容:(一)铜、银、锌、镉、汞氧化物或氢氧化物的生成和性质1、铜、锌、镉氢氧化物的生成和性质在分别装有 0.5mL0.2mol/L CuSO4、ZnSO4、CdSO4 溶液的三支试管中滴加新配制 的2mol/L NaOH溶液,观察溶液颜色及状态。
将各沉淀分成两份:分别加入2mol/L H2SO4 和2mol/L NaOH,观察现象。
CuSO4 + 2NaOH === Cu(OH)2↓(兰)+ Na2SO4ZnSO4 + 2NaOH === Zn(OH)2↓(白) + Na2SO4CdSO4 + 2NaOH === Cd(OH)2↓(白)+ Na2SO4Cu(OH)2 + H2SO4 === CuSO4 + 2H2OCu(OH)2 + 2NaOH === Na2[Cu(OH)4]Zn(OH)2 + H2SO4 === ZnSO4 + 2H2OZn(OH)2 + 2NaOH === Na2[Zn(OH)4]Cd(OH)2 + H2SO4 === CdSO4 + 2H2OCd(OH)2 酸性特别弱,不易溶于强碱中,只缓慢溶于热、浓的强碱中。
2、银、汞氧化物的生成和性质(1)氧化银的生成和性质AgNO3(0.5mL0.1mol/L)→加入NaOH(2mol/L新配制)→观察沉淀的颜色和状态→离 心分离→沉淀分成两份→一份加氨水(2mol/L),另一份加HNO3(2mol/L)→观察现象 AgNO3 + NaOH === AgOH + NaNO32AgOH === Ag2O↓(棕) + H2OAg2O + 2HNO3 ===AgNO3 + 2H2OAg2O + 4NH3 + H2O === 2Ag(NH3)2 + + 2OH —(2)氧化汞的生成和性质Hg(NO3)2(0.5mL0.2mol/L)→滴入NaOH(2mol/L新配制)→观察沉淀的颜色和状态→ 离心分离→沉淀分成两份→一份加NaOH (40%),另一份加HNO3(2mol/L)→观察现象 Hg(NO3)2 + 2NaOH === HgO↓(黄)+ 2NaNO3 + H2OHgO + 2HNO3 === Hg(NO3)2 + 2H2OHgO + NaOH → 不溶(二)锌、镉、汞硫化物的生成和性质往三支分别盛有0.5mL0.2mol/L ZnSO4、CdSO4、Hg(NO3)2 溶液的离心试管中滴加 Na2S(0.1mol/L),观察沉淀的生成和颜色。
将沉淀离心分离、洗涤,然后将各沉淀分成三份:一份加入 HCl(2mol/L),另一份 加浓盐酸,第三份加王水,分别水浴加热,观察沉淀溶解情况。
ZnSO4 + Na2S === ZnS↓(白) + Na2SO4CdSO4 + Na2S === CdS↓(黄)+ Na2SO4Hg(NO3)2 + Na2S=== HgS↓(黑) + 2NaNO3ZnS + 2HCl === ZnCl2 + H2S ZnS能溶于0.1mol/L HClCdS + 2HCl === CdCl2 + H2S CdS不溶于稀酸,但能溶于浓酸中3HgS + 12HCl+ 2HNO3 === 3H2[HgCl4] + 3S↓+ 2NO↑+ 4 H2O HgS不溶于浓酸,在浓硝酸中也难溶,但它能溶于王水。
(三)铜、银、锌、汞的配合物1、氨合物在分别盛有 CuSO4、AgNO3、ZnSO4、Hg(NO3)2 溶液的试管中滴加氨水(2mol/L)。
观察沉淀的生成,继续滴加过量氨水,出现何现象?2CuSO4 + 2NH3·H2O === Cu2(OH)2SO4↓(兰) + (NH4)2SO4Cu2(OH)2SO4 + 8NH3 === [Cu(NH3)4]SO4 + [Cu(NH3)4](OH)22AgNO3 + 2NH3·H2O === Ag2O↓(棕) + 2NH4NO3 + H2OAg2O + 4NH3 + H2O=== 2[Ag(NH3)2](OH)ZnSO4 + 2NH3·H2O === Zn(OH)2↓(白) + (NH4)2SO4Zn(OH)2 + 4NH3 === [Zn(NH3)4](OH)22Hg(NO3)2 + 4NH3·H2O=== HgO·HgNH2NO3↓(白) + 3NH4NO3 + 3H2O HgO·HgNH2NO3 + NH3·H2O → Hg(NH3)2 2+ + NO3 — + H2O 溶解,但溶解不很好2、汞配合物的生成(1)Hg(NO3)2 (0.5mL0.2mol/L)→滴加 KI(0.2mol/L)→有桔红色沉淀生成→再加少量碘 化钾固体→充分振荡→沉淀溶解(注意 KI 固体不易加太多)溶液为无色→滴加 NaOH(40%)和氨水→又出现棕红色沉淀Hg(NO3)2 + 2KI === HgI2↓(桔红) + 2KNO3HgI2 + 2KI === K2[HgI4]2HgI4 2— + 4OH — + NH4 + === HgO·HgNH2I↓(棕红) + 7I — + 3H2O(2)Hg(NO3)2 (0.5mL0.2mol/L)→逐滴加 KSCN(0.1mol/L)→白色沉淀生成→继续滴加 KSCN溶液→沉淀溶解,溶液为无色→滴加 ZnSO4(0.2mol/L)→又出现白色沉淀 Hg(NO3)2 + 2KSCN === Hg(SCN)2↓(白) + 2KNO3Hg(SCN)2 +2KSCN === K2[Hg(SCN)4]K2[Hg(SCN)4] + ZnSO4 === Zn[Hg(SCN)4]↓(白) + K2SO4(四)铜、银、汞的氧化还原性1、氧化亚铜的生成和性质CuSO4(0.5mL0.2mol/L)→滴加过量 NaOH(6mol/L) →先有蓝色沉淀后又消失成深 蓝色溶液→加葡萄糖溶液(1mL10%)→混匀加热→沉淀产生(由黄→红)→离心分离 →洗涤→沉淀分成两份:沉淀→加H2SO4(1mL2mol/L)→静止一会→观察沉淀变化→加热→观察现象沉淀→加浓氨水(1mL) →振荡→静止一会→观察现象Cu(OH)2 + 2NaOH === Na2[Cu(OH)4]2[Cu(OH)4] 2— + C6H12O6 === Cu2O↓(红) + CH2OH(CHOH)4COOH + 4OH — + 2H2O Cu2O晶粒大小各异,能呈现多种颜色,如:黄、桔黄、鲜红、深棕。
Cu2O + H2SO4 === Cu2SO4 + H2OCu2SO4 === CuSO4 + Cu↓(红)Cu2O + 4NH3·H2O === 2[Cu(NH3)2] + (无色) + 2OH — + 3H2O2[Cu(NH3)2] + + 4NH3·H2O + 1/2O2 === 2[Cu(NH3)4] 2+ + 2OH — + 3H2O2、氯化亚铜的生成和性质CuCl2(10mL0.5mol/L) →加入HCl(3mL浓)和铜屑→加热沸腾→溶液变成深棕色 →取几滴溶液→加到水(10ml)中→出现白色沉淀,则迅速将全部棕色溶液倒入水 (100mL)中→洗涤白色沉淀至无蓝色→沉淀分成两份沉淀→加浓氨水(3mL)→沉淀溶解→溶液由无色变为深蓝色沉淀→加浓盐酸(3mL)→沉淀溶解CuCl2 + Cu === CuClCuCl + HCl === H3CuCl4加浓盐酸的目的是:CuCl是不溶于水的,生成的CuCl很容易附着在铜的表面上, 这样反应不久就会停止,为使反应能继续进行,利用CuCl能溶于浓盐酸的性质,加浓 盐酸后能保证反应进行彻底,当把反应得到的棕色溶液倒入大量的水中时,浓盐酸的 浓度大大降低,反应会向左进行,CuCl沉淀析出CuCl+ 2NH3 === [Cu(NH3)2]Cl3、碘化亚铜的生成和性质CuSO4(0.2mol/L)+ KI(0.2mol/L)(注:边加边振荡)→观察到的沉淀产生,溶液为 棕黄色→加Na2S2O3(0.5mol/L)→溶液变成无色,此时观察到沉淀为白色Cu 2+ + 4I — === 2CuI↓(白)+ I2I2 +2Na2S2O3 === Na2S4O6 +2NaI4、汞(Ⅱ)与汞(Ⅰ)的相互转化(1)Hg 2+ 的氧化性Hg(NO3)2(0.5ml0.2mol/L)+ SnCl2(0.2mol/L)(注:逐滴加入) →沉淀由白色变为灰色 再变成黑色2Hg 2+ + SnCl2 === Hg2Cl2↓(白) + Sn 4+Hg2Cl2 + SnCl2 === 2Hg↓(黑) + SnCl4(2)Hg 2+ 转化为Hg2 2+ 和Hg2 2+ 的歧化分解Hg(NO3)2(0.5ml0.2mol/L)+Hg→充分振荡→用滴管将清液转移到两支试管中(余下 汞回收)→一支加NaCl(0.2mol/L)→另一支加氨水(2mol/L) →观察现象Hg(NO3)2 + Hg === Hg2(NO3)2Hg2(NO3)2 + 2NaCl=== Hg2Cl2↓(白) + 2NaNO3Hg2(NO3)2 + H2O === Hg2(OH)NO3↓(白) + HNO3 加氨水促进水解四、实验指导1、实验过程中指导学生结合理论课学习预测实验现象,然后验证预测的结果,以进一步加深所学的知识。
2、指导学生使用汞时的注意事项(用普通滴管吸取时的方法、汞不慎撒落时的处理方法等等)。