铜、银、锌、镉、汞
- 格式:pdf
- 大小:170.90 KB
- 文档页数:6

无机化学实验报告-DS区元素实验11 ds 区元素(铜、银、锌、镉、汞)的性质一、实验目的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的生成和性质; 6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理IB IIBCu Zn Cu (+2,+1) Zn(+2) Ag Cd Ag (+1) Cd(+2) Au Hg Au (+1,+3) Hg(+2,+1) 蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO 。
AgOH 在常温下极易脱水而转化为棕色的Ag 2O 。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg 2O(I)。
易形成配合物是这两副族的特性,Cu 2+、Ag +、Zn 2+、Cd 2+与过量的氨水反应时分别生成[Cu(NH 3)4]2+、[Ag(NH 3)2]+、[Zn(NH 3)4]2+、[Cd(NH 3)4]2+。
但是Hg 2+和Hg 22+与过量氨水反应时,如果没有大量的NH 4+存在,并不生成氨配离子。
如:HgCl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ 2 NH 4Cl Hg 2Cl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ Hg↓黑+NH 4Cl(观察为灰色)Cu 2+具有氧化性,与I -反应,产物不是CuI 2,而是白色的CuI :Cu2++ I - = 2CuI↓白 + I 2将CuCl 2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl 2]-的溶液。
将溶液稀释,得白色CuCl 沉淀:Cu + Cu2++ 4Cl - = 2[CuCl 2]-[CuCl 2]-←稀释→CuCl↓白 + Cl -卤化银难溶于水,但可利用形成配合物而使之溶解。
例如:AgCl + 2NH 3 = [Ag(NH 3)2]++ Cl -红色HgI 2难溶于水,但易溶于过量KI 中,形成四碘合汞(II)配离子:HgI 2 + 2I -= [HgI 4]2-黄绿色Hg 2I 2与过量KI 反应时,发生歧化反应,生成[HgI 4]2-和Hg :Hg 2I 2+ 2I - = [HgI 4]2-+ Hg↓黑三、实验内容 1、氧化物的生成和性质(1) C u 2O 的生成和性质Cu 2+ + 2OH - =Cu(OH)2↓ 蓝色 Cu(OH)2 + 2OH - = [Cu(OH)4]-2- 蓝色2[Cu(OH)4]2-+ C 6H 12O 6 (葡萄糖) =Cu 2O↓(红) + 4OH -+C 16H 12O 7+2H 2O或:2Cu 2+ + 5OH - +C 6H 12O 6 = Cu 2O↓+ C 6H 11O 7- + 3H 2O (须加热)分析化学上利用此反应测定醛,医学上利用此反应检查糖尿病。

铜、银、锌、镉、汞发表日期:2009年6月8日【编辑录入:admin】一、教学要求1. 试验并掌握Cu2+、Ag+、Zn2+、Cd2+、Hg2+与NaOH及氨水的反应。
2. 试验某些配合物的生成与性质。
3. 试验Cu(I)和Cu(II),Hg(I)和Hg(II)的相互转化的条件。
4. 试验Ag+、Hg2+等离子的沉淀条件与分离方法。
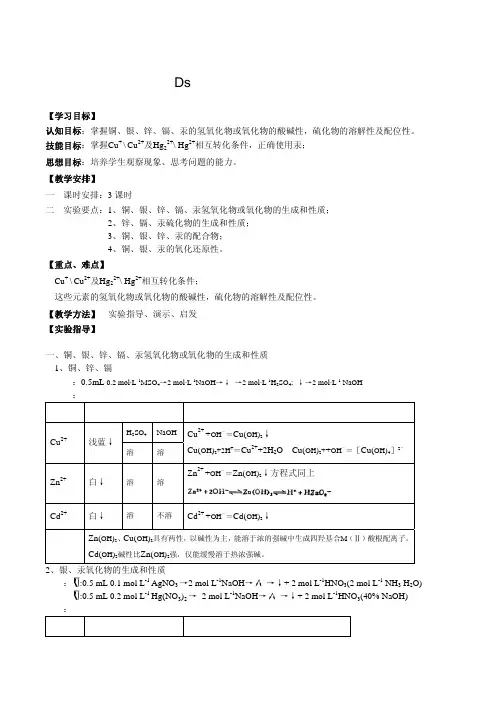
二、实验仪器及药品恒温水浴、离心机、离心试管、试管、试管夹、酒精灯、洗瓶、滴管pH试纸、浓H2SO4、H2SO4(2mol.L-1)、HNO3 (6mol.L-1)、NH3 (6mol.L-1)、浓NH3、浓HCl 、HCl (2mol.L-1)、NaOH(2mol.L-1)、NaOH(6mol.L-1) CuCl2(0.2mol.L-1)、CuSO4(0.2mol.L-1)、AgNO3(0.1mol.L-1)、ZuSO4(0.2mol.L -1)、Cd(NO3)2 (0.2 mol.L-1)、HgCl2 (0.2 mol.L-1)、Hg2(NO3)2 (0.2 mol.L-1)、0.5%淀粉、1%葡萄糖、KSCN(0.2mol.L-1)、KI(0.2mol.L-1)、Na2SO4 (0.2mol.L-1)、Na2S2O3 (0.5mol.L-1)、K4[Fe(CN)6](0.2mol.L-1)、K2[Hg(SCN)4](0.2mol.L-1)、、三、实验现象及有关化学反应式()(一)与NaOH的反应Cu(OH)2及CuO的生成和性质,CuSO4溶液滴入NaOH。
(硫酸铜:无水CuSO4为白色粉未,CuSO4·5H2O为蓝色结晶。
)1. Cu2+ + 2OH-→ Cu(OH)2↓ 浅蓝色↓a Cu(OH)2+H2SO4 = CuSO4 + H2O 沉淀溶解b Cu(OH)2 + 2OH-→ [Cu(OH)4]2-[浓碱(6mol.L-1NaOH)反应,留存下用](Cu(OH)2两性偏碱,所以需强碱使之生成配离子。

铜银锌镉汞实验报告
实验目的:通过观察和比较铜、银、锌、镉、汞这五种金属在不同条件下的性质和反应,了解它们的化学特性和应用价值。
实验原理:铜、银、锌、镉和汞都是金属元素,其化学性质不同,会在不同的条件下发生不同的化学反应。
本实验针对这五种金属分别进行了以下实验:
1.铜的性质:将几片铜片放入酸性溶液中,观察铜的腐蚀现象。
铜在酸性溶液中会发生氧化反应,生成二氧化硫和水,在反应过程中铜会逐渐腐蚀而消失。
5.汞的性质:将汞液加热至其汽化并生成蒸气,利用紫外线照射汞蒸气,观察汞的光谱现象。
汞蒸气通过紫外线激发,会发生原子发光和激发发光现象,产生不同波长的光谱线。
实验步骤:
1.铜的实验
将几片铜片放入小烧杯中,加入适量的稀酸性溶液,观察铜的腐蚀现象,记录下变化过程。
实验结果:
1.铜的实验:铜在酸性溶液中发生了氧化反应,逐渐腐蚀而消失。
2.银的实验:银在氧化银溶液中发生了还原反应,生成纯银和氧化物。
5.汞的实验:汞蒸气通过紫外线激发,产生多种不同波长的光谱线。
实验分析:
1.铜、锌、镉作为常见的金属元素,其腐蚀性都比较强,能够在酸性环境下发生氧化反应。
而银和汞的化学性质则较为特殊,银在氧化银溶液中通过还原反应得到纯银,汞的蒸汽能够被紫外线激发产生原子发光和激发发光现象。
2.铜、锌、镉和银都是重要的工业金属元素,广泛应用于化学工业、电子工业、医药工业等领域。
铜、银、锌和镉还可以被用于制作家居饰品、珠宝饰品等日用品。
而汞的应用范围较为狭窄,由于其毒性较大,现在已经很少被使用。

哪些重金属对人体有危害?化学上跟据金属的密度把金属分成重金属和轻金属,常把密度大于5g/cm3的金属称为重金属,如:金、银、铜、铅、锌、镍、钴、铬、汞、镉等大约45种。
其中,对人体危害最大的有5种:如铅、汞、铬、砷、镉等。
这些重金属在水中不能被分解,与水中的其他毒素结合生成毒性更大的有机物。
其他对对人体有危害的还有:铝、钴、钒、锑、锰、锡、铊等。
重金属对人体的伤害常见的有:铅:伤害人的脑细胞,致癌致突变等。
汞:食入后直接沉入肝脏,对大脑神精视力破坏及大。
天然水每升水中含0.01毫克,就会强烈中毒。
铬:会造成四肢麻木,精神异常。
砷:会使皮肤色素沉着,导致异常角质化。
镉:导致高血压,引起心脑血管疾病;破坏骨钙,引起肾功能失调。
铝:积累多时,对儿童造成智力低下;对中年人造成记忆力减退;对老年人造成痴呆等。
钴:能对皮肤有放射性损伤。
钒:伤人的心、肺,导致胆固醇代谢异常。
锑:与砷能使银手饰变成砖红色,对皮肤有放射性损伤。
硒:超量时人会得踉跄病。
铊:会使人得多发性神精炎。
锰:超量时会使人甲状腺机能亢进。
锡:与铅是古代巨毒药‘鸠’中的重要成分,入腹后凝固成块,坠人至死。
——————————金银铜铁锡对人体有什么影响2.2 微量元素与人体健康在人体组织中含量极少,少于体重的万分之五的叫微量元素,或者痕量元素。
目前发现的有铁、铜、碘、锌、锰、钴、钼、硒、铬、氟、镍、硅、锡、钒等。
最近发现的微量元素新星是有机锗。
金属锗是最早应用于高技术的支撑材料。
近来不少学者在人参、枸杞子、甘草、蘑菇、当归、灵芝、茶叶、大蒜、葡萄干、绿豆、决明子、地黄等植物中发现有机锗的存在,并发现其具有强壮、滋补、抗癌作用。
1967年合成了水溶性有机锗。
我国已开始将其用于抗癌和低浓度饮料生产中。
有机锗的功能,一是促进生理功能正常化,如对高血压病人有明显降压作用,但不会使血压低于正常水平,可促进身体生理、生化功能恢复正常;二是可治疗肿瘤和促进身体产生抗癌因子,不仅疗效显著,而且无毒无副作用;三是能提高人体免疫机能,防治多种疾病;四是有机锗加入食品中对抗衰老大有裨益。

无机化学实验第四版实验二十一:ds区金属(铜,银,锌,镉,汞)实验名称:ds区金属(铜,银,锌,镉,汞)实验日期:温度:气压:一、实验目的1.了解铜,银,锌,镉,汞氢氧化物或氧化物的酸碱性,硫化物的溶解性;2.掌握铜(1+)和铜(2+)重要化合物的性质及相互转化条件;3.试验并熟识铜,银,锌,镉,汞的配位能力,以及hg22+和hg2+的转变。
二、实验内容1.铜,银,锌,镉,汞氢氧化物或氧化物的分解成和性质1)铜,锌,镉氢氧化物的分解成和性质实验操作cuso4+naohznso4+naohcdso4+naohcu(oh)2zn(oh)2cd(oh)2+h2so4+naoh+h2so4+naoh+h2so 4+naoh实验现象生成蓝色沉淀,溶液无色生成蓝色沉淀,溶液无色生成蓝色沉淀,溶液无色沉淀溶解沉淀溶解沉淀溶解沉淀溶解沉淀溶解沉淀不溶解解释或化学反应方程式cuso4+2naoh==cu(oh)2+na2so4znso4+2naoh==zn(oh)2+na2so4cdso4+2naoh==cd(oh)2+na2 so4cu(oh)2+2h2so4==cuso4+2h2ocu(oh)2+2naoh==na2[cu(oh)2]zn(oh)2+2h2so4==znso4+ 2h2ozn(oh)2+2naoh==na2[zn(oh)2]cd(oh)2+2h2so4==cdso4+2h2o不反应2)银,汞氧化物的生成和性质a.氧化银的分解成和性质b.氧化汞的分解成和性质实验操作agno3+naohhg(no3)2+naoh洗ag2o+hno3涤+氨水离心hgo+hno3实验现象生成棕色沉淀,溶液无色生成黄色沉淀,溶液无色沉淀溶解沉淀溶解沉淀溶解解释或化学反应方程式2agno3+2naoh==ag2o+2nano3+2h2ohg(no3)2+2naoh==hgo+2nano3+h2oag2o+2hno3==2agno3 +h2oag2o+4nh3h2o==2[ag(no3)2]+2oh-hgo+2hno3==hg(no3)2+h2o+氨水沉淀不溶解不反应2.锌,镉硫化物的生成和性质实验操作方式znso4+na2scdso4+na2shg(no3)2+na2s将浮zns+hcl淀离+浓hcl心分+王水距冲洗分后cds+hcl为三+浓hcl份+王水(水浴加hgs+hcl热)+浓hcl+王水实验现象分解成白色结晶分解成黄色结晶分解成黑色结晶结晶熔化结晶熔化结晶熔化结晶不熔化结晶熔化结晶熔化结晶不熔化结晶不熔化结晶可溶解表述或化学反应方程式znso4+na2s==zns+na2so4cdso4+na2s==cds+na2so4hg(no3)2+na2s==hgs+2nano3zns+2hcl= =zncl2+h2szns+2hcl(淡)==zncl2+h2szns+6hcl+2hno3==3zncl2+2no+3s+4h2o不反应cds+2hcl==cdcl2+h2scds+6hcl+2hno3==cdcl2+2no+3s+4h2o不反应不反应3hgs+12hcl+2hno3==h2(hgcl2)+2no+3s+4h2o根据实验现象并查询有关数据,充填下表中,并对铜,银,锌,镉,汞硫化物的熔化情况做出结论,并写下有关反应方程式。


ds区金属:铜 银 锌 镉 汞一、实验目的l.熟悉铜、银、锌、镉、汞氢氧化物的酸碱性质和热稳定性;2.熟悉铜、银、锌、镉、汞配合物的性质和应用;3.掌握Cu(I)、Cu(II)重要化合物的性质和相互转化条件;4.熟悉Hg22+、Hg2+的转化,了解锌、镉、汞离子的鉴定反应。
二、实验原理铜、银、锌、镉、汞,分别属于ds区IB和ⅡB簇,常见水合离子有Cu2+、Ag+、Zn2+、Cd2+、Hg2+、Hg22+。
Cu(I)在高温或干态时表现稳定,在水溶液中只以一些配离子形式存在。
室温下,Cu2+、Ag+、Zn2+、Cd2+、Hg2+与适量NaOH反应,分别形成Cu(OH)2、Ag2O、Zn(OH)2、Cd(OH)2、HgO,Cu(OH)2在加热时分解生成黑色的CuO。
这些(氢)氧化物中,Zn(OH)2为典型的两性;Cu(OH)2也呈两性,但其碱性大于酸性;Cd(OH)2则主要呈碱性反应,仅缓慢溶于热的浓强碱液中;Ag2O与HgO基本上呈碱性。
Cu2+、Ag+、Zn2+、Cd2+与适量氨水反应时,Cu2+生成相应的碱式盐沉淀。
Ag+生成AgO沉淀,Zn2+、Cd2+生成Zn(OH)2、Cd(OH)2,它们与过量的NH3·H2O 反应都生成氨配合物。
与此不同,在氨水作用下,氯化汞生成氯化氨基汞盐沉淀物,硝酸汞则生成硝酸氨基氧汞。
在有大量铵盐存在时硝酸氨基氧汞可溶于过量NH3·H2O形成氨配合物,但HgNH2Cl不溶于过量NH3·H2O。
HgCl2+2NH3 =Hg(NH2)Cl↓(白色)+NH4Cl2Hg(NO3)2+4NH3+ H2O = HgO·Hg(NH2)NO3↓(白色)+3NH4NO3 Hg22+与过量氨水反应时,同时发生歧化反应,生成氨基汞化合物和汞。
2Hg2(NO3)2+4NH3+H2O = HgO·Hg(NH2)NO3↓+2 Hg↓+ 3NH4NO3Cu2+与I-反应即生成CuI白色沉淀。

含铬、汞、镉、铅、锌、锰、铜、银等金属和重金属离子的废液处理规程1 目的为了使化验室分析检验过程产生的有毒有害的废液达标排放,制定本规程。
2 适用范围本规程适用于化验室产生的含铬、汞、镉、铅、锌、锰、铜、银等金属和重金属离子的废液的处理,通过处理使这些废液达到GB8978《污水综合排放标准》的要求。
3 规程来源本规程根据《现代实验室安全与劳动保护手册》编制。
4 含铬废液的处理4.1 处理方法原理将含铬废液pH值调至3以下,加入亚硫酸氢钠,使其中的Cr(Ⅵ)还原成Cr(Ⅲ),调节废液pH值在7.5~8.5之间,使Cr(Ⅲ)形成Cr(OH)3沉淀析出(如果废液中还含有汞、银等金属离子,用Ca(OH)2制成石灰乳,调节废液pH值在8~9之间,使Cr(Ⅲ)形成Cr(OH)3沉淀,再加入NaHS,使汞、银生成硫化物析出)。
(1)……(2)4.2 操作步骤4.2.1 于废液桶中加入浓硫酸,充分搅拌,调整溶液pH值在3以下(采用pH试纸或pH计测定)。
如果溶液已是酸性物质,不必调整pH值。
4.2.2 分次少量、边搅拌边加入固体亚硫酸氢钠,至溶液由黄色变为绿色为止。
4.2.3 如果溶液只含铬离子时,加入50 g/L的氢氧化钠溶液,调节溶液pH值7.5~8.5使Cr(Ⅲ)形成沉淀(注意:pH值过高沉淀会再溶解)。
废液放置一夜,将沉淀滤出(如果滤液为黄色时,要再次进行还原)、烘干并妥善保管。
滤液按《水和废水监测分析方法》(国家环保局编)检验总铬和六价铬,达到GB8978《污水综合排放标准》后直接排放下水道。
4.2.4 如果溶液中还含有汞、银等金属离子(如测定COD的废液),在用亚硫酸氢钠还原六价铬后加入制成石灰乳的氢氧化钙,充分搅拌使溶液的pH值为8~9,溶液澄清后加入适量硫氢化钠(以摩尔数表示的加入量相当于其中含有的可沉淀的金属离子的摩尔数),充分搅拌,保持溶液的pH值8~9废液放置一夜,将沉淀滤出、烘干并妥善保管。

铜、银、锌、镉、汞实验目的1.试验并了解ds 区元素的氢氧化物(或氧化物)的酸碱性及对热稳定性2.了解铜、银、锌、镉、汞的金属离子形成配合物的特征3.了解Cu(Ⅱ)与Cu(Ⅰ),Hg(Ⅱ)与Hg(Ⅰ)的相互转化条件4.了解铜、银、锌、镉、汞的离子鉴定实验提要ds区元素包括铜、银、锌、镉和汞。
它们的价电子层结构分别为(n-1)d10ns1和(n-1)d10ns2。
在化合物中常见的氧化值。
铜为+2 和+1,银为+1,锌和镉为+2,汞为+2 和+1。
这些元素的简单阳离子具有或接近18e的构型。
在化合物中与某些阳离子有较强的相互极化作用,成键的共价成分较大。
多数化合物较难溶于水,对热稳定性较差,易形成配位化合物,化合物常显不同的颜色。
例如,这些元素的氢氧化物均较难溶于水,且易脱水变成氧化物。
银和汞的氢氧化物极不稳定。
常温下即失水变成Ag2O(棕黑色)和HgO(黄色)。
黄色HgO加热则生成桔红色HgO变体。
Cu(OH)2、Zn(OH)2和Cd(OH)2在常温下较稳定,但受热亦会失水成氧化物。
浅蓝色Cu(OH)2在80℃失水成棕黑色CuO,白色Zn(OH)2在125℃开始失水成黄色(冷后为白色)的ZnO,白色Cd(OH)2在250℃变成棕红色的CdO。
Zn(OH)2呈典型的两性氢氧化物,Cu(OH)2呈较弱的两性(偏碱),Cd(OH) 2和Hg(OH)2(HgO)呈碱性,而AgOH为强碱性。
Cu2+、Ag+、Zn2+、Cd2+、Hg2+与Na2S溶液反应都生成难溶的硫化物,即CuS(黑色),Ag2S(黑色),ZnS(白色),CdS (黄色)和HgS(黑色)。
其中HgS可溶于过量的Na2S,与S2−生成无色的HgS22−配离子。
若在此溶液中加入盐酸又生成黑色HgS沉淀。
此反应可作为分离HgS的方法。
根据ZnS、CdS、Ag2S、CuS和HgS溶度积大小,ZnS可溶于稀酸,CdS溶于6mol•L−1HCl 溶液,Ag S和2 CuS溶于氧化性的HNO3,而HgS溶于王水。

重金属对身体有啥危害重金属指比重大于4或5的金属,约有45种,如铜、铅、锌、铁、钻、镍、锰、镉、汞、钨、钼、金、银等。
尽管锰、铜、锌等重金属是生命活动所需要的微量元素,但是大部分重金属如汞、铅、镉等并非生命活动所必须,而且所有重金属超过一定浓度都对人体有毒。
如汞中毒的临床表现有,全身症状为头痛、头昏、乏力、发热。
口腔及消化道症状表现为齿龈红肿酸痛、糜烂出血、牙齿松动、龈槽溢脓,口腔有臭味,并有恶心、呕吐、食欲不振、腹痛、腹泻。
皮肤接触可出现红色斑丘疹,以四肢及头面部分布较多。
少数患者可有肾损害,个别严重者可有咳嗽、胸痛、呼吸困难、绀紫等急性间质性肺炎的表现。
重金属中毒会使体内的蛋白质凝固,如果轻微中毒,就大量喝牛奶,牛奶中的蛋白质会和重金属反应,这样不会损伤到你自身的身体机能,喝了以后马上就医在环境污染方面所说的重金属主要是指汞(水银)、镉、铅、铭以及类金属砷等生物毒性显著的重元素。
重金属不能被生物降解,相反却能在食物链的生物放大作用下,成千百倍地富集,最后进入人体。
重金属在人体内能和蛋白质及酶等发生强烈的相互作用,使它们失去活性,也可能在人体的某些器官中累积,造成慢性中毒。
轻则发生怪病(水俣病、骨痛病等),重者就会死亡。
铅污染是可在人体和动物组织中积蓄的有毒金属。
主要来源于各种油漆、涂料、蓄电池、冶炼、五金、机械、电镀、化妆品、染发剂、釉彩碗碟、餐具、燃煤、膨化食品、自来水管等。
它是通过皮肤、消化道呼吸道进入体内与多种器官亲和,主要毒性效应是贫血症、神经机能失调和肾损伤,易受害的人群有儿童、老人、免疫低下人群。
铅对水生生物的安全浓度为0.16mg/L,用含铅0.1〜4.4mg/L的水灌溉水稻和小麦时,作物中铅含量明显增加镉污染不是人体的必要元素。
镉的毒性很大,可在人体内积蓄,主要积蓄在肾脏,引起泌尿系统的功能变化;镉主要来源有电镀、采矿、冶炼、燃料、电池和化学工业等排放的废水;废旧电池中镉含量较高、也存在于水果和蔬菜中,尤其是蘑菇,在奶制品和谷物中也有少量存在,镉能够取代骨中钙,使骨骼严重软化,骨头寸断,会引起胃脏功能失调,干扰人体和生物体内锌的酶系统,导致高血压症上升。
ds区元素(铜、银、锌、镉、汞)一、实验目的与要求:1.了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性。
2. 掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件。
3. 熟悉铜、银、锌、镉、汞的配位能力,以及Hg22+和Hg2+的转化。
二、教学重点与难点:了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性,熟悉铜、银、锌、镉、汞的配位能力,以及Hg22+和Hg2+的转化;掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件,三、教学方法与手段:讲授法;演示法四、教学课时: 4课时五、课的类型:实验课一、铜、银、锌、镉、汞氧化物或氢氧化物的生成和性质1、铜、锌、镉氧化物的生成和性质向三支试管分别盛有0.5ml 0.2mol.L-1CuSO4、ZnSO4、CdSO4溶液的试管中滴加新配制的2mol.L-1NaOH溶液,观察溶液颜色及状态。
将沉淀分成两份, 一份加硫酸另一份加NaOH溶液,观察现象。
Cu2++2OH-===Cu(OH)2↓ (蓝色沉淀)蓝色沉淀,溶解于酸,微溶于过量的碱,得到深蓝色溶液[Cu(OH)4]2-。
Cu(OH)2两性偏碱,所以需强碱使之生成配离子。
Zn2++2OH-=== Zn(OH)2↓ (白色沉淀)白色沉淀, 溶解于酸和过量的碱,典型的两性化物。
Cd 2++2OH-===Cd(OH)2↓白色沉淀,溶于酸, 不溶于碱。
碱性)Cd(OH)2 + NaOH (6M)= 不反应(Cd(OH)22. 银、汞氧化物的生成和性质(1)、氧化银的生成和性质取0.5ml 0.1mol.L-1AgNO3溶液,滴加新配制的2mol.L-1的NaOH溶液,观察沉淀的颜色和状态。
洗涤并离心,将沉淀分成两份,一份加入HNO3,另一份加入氨水,观察现象。
Ag++OH-===AgOH↓白色沉淀2AgOH===Ag2O+H2O 黑色沉淀Ag2O+2HNO3===2AgNO3+H2OAg2O+2NH3.H2O==2[Ag(NH3)2]++2OH-+H2O氢氧化银不稳定,很容易被氧化成黑色的Ag2O,此黑色沉淀溶于硝酸得到银离子,加入氨水得到银氨络合溶液。
实验4 铜、银、锌、镉、汞一、实验目的1.了解铜、银、锌、镉、汞的氧化物、氢氧化物的生成和性质2.了解铜、锌、镉、汞的配合物的形成和性质3.试验并掌握Cu(I)、Cu(II)重要化合物的性质及相互转化的条件二、实验原理IB IIBCu Zn Cu(+2,+1)Zn(+2)Ag Cd Ag(+1)Cd(+2)Au Hg Au(+1,+3) Hg(+2,+1)蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO。
AgOH在常温下极易脱水而转化为棕色的Ag2O。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg2O(I)。
易形成配合物是这两副族的特性,Cu2+、Ag+、Zn2+、Cd2+与过量的氨水反应时分别生成[Cu(NH3)4]2+、[Ag(NH3)2]+、[Zn(NH3)4]2+、[Cd(NH3)4]2+。
但是Hg2+和Hg22+与过量氨水反应时,如果没有大量的NH4+存在,并不生成氨配离子。
如:HgCl2+ 2NH3= Hg(NH2)Cl↓白+ 2 NH4ClHg2Cl2+ 2NH3= Hg(NH2)Cl↓白+ Hg↓黑+NH4Cl (观察为灰色)Cu2+具有氧化性,与I-反应,产物不是CuI2,而是白色的CuI:Cu2++I-= 2CuI↓白+I2将CuCl2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl2]-的溶液。
将溶液稀释,得白色CuCl沉淀:Cu + Cu2++ 4Cl-= 2[CuCl2]-[CuCl2]-←稀释→CuCl↓白+ Cl-卤化银难溶于水,但可利用形成配合物而使之溶解。
例如:AgCl + 2NH3= [Ag(NH3)2]++ Cl-红色HgI2难溶于水,但易溶于过量KI中,形成四碘合汞(II)配离子:HgI2+ 2I-= [HgI4]2-黄绿色Hg2I2与过量KI反应时,发生歧化反应,生成[HgI4]2-和Hg:Hg2I2+ 2I-= [HgI4]2-+ Hg↓黑三、实验内容1.铜的化合物(1)氢氧化铜和氧化铜的生成和性质Cu2++ 2OH-=Cu(OH)2↓蓝色絮状Cu(OH)2+H2SO4 = CuSO4 + H2O 沉淀溶解Cu(OH)2+ 2NaOH(浓) = Na2[Cu(OH)4] 沉淀溶解Cu(OH)2=80-90℃= CuO↓黑色+H2OCuO+ 2HCl = CuCl2+H2OCu(OH)2两性偏碱,所以需强碱使之生成配离子。
铜银锌镉汞实验报告1. 掌握铜、银、锌、镉和汞的一些基本性质;2. 了解铜银锌镉汞的化学反应特点,如氧化性、还原性等;3. 通过实验,观察和比较不同金属的反应性能。
实验仪器和试剂:1. 实验仪器:试管、试管夹、玻璃棒、显微镜;2. 试剂:铜片(Cu)、银片(Ag)、锌片(Zn)、镉片(Cd)、汞片(Hg)、稀硝酸(HNO3)、盐酸(HCl)、硫酸(H2SO4)、氯化钠(NaCl)、二氧化硫(SO2)。
实验步骤:1. 用试管夹夹住铜片,放入试管中加热,观察反应现象;2. 同样的方法加热银片、锌片、镉片和汞片,观察反应现象;3. 将铜片分别与盐酸、硫酸进行反应,观察反应现象;4. 将铜片分别与氯化钠、硝酸进行反应,观察反应现象;5. 将银片、锌片、镉片和汞片分别与盐酸、硫酸、氯化钠、硝酸进行反应,观察反应现象。
实验结果与分析:1. 铜片被加热后,表面出现黑色氧化物。
2. 银片被加热后,表面出现明显的火花和白色氧化物。
3. 锌片被加热后,表面出现明显的火花和白色氧化物。
4. 镉片被加热后,表面出现明显的火花和白色氧化物。
5. 汞片被加热后,没有明显的反应现象。
6. 铜片与盐酸反应,产生气泡和生成蓝绿色溶液。
7. 铜片与硫酸反应,产生气泡和生成蓝色溶液。
8. 铜片与氯化钠反应,没有明显的反应现象。
9. 铜片与硝酸反应,产生气泡和生成蓝绿色溶液。
10. 银片与盐酸反应,产生气泡和生成白色沉淀。
11. 银片与硫酸反应,没有明显的反应现象。
12. 银片与氯化钠反应,产生气泡和生成白色沉淀。
13. 银片与硝酸反应,产生气泡和生成白色沉淀。
14. 锌片与盐酸反应,产生气泡和产生明亮的火花。
15. 锌片与硫酸反应,产生气泡和产生明亮的火花。
16. 锌片与氯化钠反应,没有明显的反应现象。
17. 锌片与硝酸反应,产生气泡和产生明亮的火花。
18. 镉片与盐酸反应,产生气泡。
19. 镉片与硫酸反应,产生气泡。
20. 镉片与氯化钠反应,没有明显的反应现象。
有关“d区元素性质实验”思考题的解答有关“d区元素性质实验”思考题的解答与P区元素性质实验相比较,学生对d区元素性质实验问题的回答,多感觉有一些把握不准。
这是因为大家对这些化合物接触及了解的都少,且其不遵守所谓“规律性”的现象也较多的缘故。
因而,这部分内容也是一个学习上的难点。
一、“铭、锰、铁、钻、镍实验”思考题1.试总结铭、锰、铁、钻、镍氢氧化物的酸碱性和氧化还原性。
在低价的Cr(OH)3、Mn(OH)2、Fe(OH)2、Co(OH)2、Ni(OH)2 中,只有Cr(OH)3有显著的两性,其余都表现为碱性(只与酸反应,而不与NaOH反应)。
比较他们的还原性,其中Fe(OH)2和Mn(OH)2的还原性最强(能被空气中的氧气氧化)。
对高价的H2CrO4、HMnO4、Fe(OH)3、Co(OH)3、Ni2O3 ・H2O 来说,前两个H2CrO4和HMnO4表现为酸性,后3个通常表现为碱性。
这些高价的化合物都有氧化性,但其中Fe(OH)3的氧化性最弱、H2CrO4、HMnO4 次之(已相当强)、Co(OH)3、Ni2O3 H2O 的氧化性最强。
2.在Co(OH)3中加入浓HCl,有时会生成蓝色溶液,加水稀释后变为粉红色,试解释之。
Co(OH)3与浓HCl的反应并不只是一个简单的酸碱反应。
由于Co3有强氧化性,能被Cl-离子还原成Co2,而Co2离子又以配离子[CoCl6]4-的形式在溶液中存在。
所以反应方程式为:2Co(OH)3 6H14Cl- = 2[CoCl6]4- Cl2 6H2O。
其中的配离子[CoCl6]4-为蓝色。
由于配离子[CoCl6]4-并不稳定,加水稀释使溶液中Cl-离子浓度降低时,又有[Co(H2O)6]2配离子(粉红色)生成。
反应为,[CoCl6]4-6H2O = [Co(H2O)6]2 6Cl-。
这就是溶液又变成粉红色的原因。
3.在K2Cr2O7溶液中分别加入Pb(NO3)2和AgNO3溶液会发生什么反应?由于Cr2O72-在水溶液中实际存在有下述平衡,Cr2O72- H2O = 2 CrO42- 2H。
铜、银、锌、镉、汞实验目的1.试验并了解ds 区元素的氢氧化物(或氧化物)的酸碱性及对热稳定性2.了解铜、银、锌、镉、汞的金属离子形成配合物的特征3.了解Cu(Ⅱ)与Cu(Ⅰ),Hg(Ⅱ)与Hg(Ⅰ)的相互转化条件4.了解铜、银、锌、镉、汞的离子鉴定实验提要ds区元素包括铜、银、锌、镉和汞。
它们的价电子层结构分别为(n-1)d10ns1和(n-1)d10ns2。
在化合物中常见的氧化值。
铜为+2 和+1,银为+1,锌和镉为+2,汞为+2 和+1。
这些元素的简单阳离子具有或接近18e的构型。
在化合物中与某些阳离子有较强的相互极化作用,成键的共价成分较大。
多数化合物较难溶于水,对热稳定性较差,易形成配位化合物,化合物常显不同的颜色。
例如,这些元素的氢氧化物均较难溶于水,且易脱水变成氧化物。
银和汞的氢氧化物极不稳定。
常温下即失水变成Ag2O(棕黑色)和HgO(黄色)。
黄色HgO加热则生成桔红色HgO变体。
Cu(OH)2、Zn(OH)2和Cd(OH)2在常温下较稳定,但受热亦会失水成氧化物。
浅蓝色Cu(OH)2在80℃失水成棕黑色CuO,白色Zn(OH)2在125℃开始失水成黄色(冷后为白色)的ZnO,白色Cd(OH)2在250℃变成棕红色的CdO。
Zn(OH)2呈典型的两性氢氧化物,Cu(OH)2呈较弱的两性(偏碱),Cd(OH) 2和Hg(OH)2(HgO)呈碱性,而AgOH为强碱性。
Cu2+、Ag+、Zn2+、Cd2+、Hg2+与Na2S溶液反应都生成难溶的硫化物,即CuS(黑色),Ag2S(黑色),ZnS(白色),CdS (黄色)和HgS(黑色)。
其中HgS可溶于过量的Na2S,与S2−生成无色的HgS22−配离子。
若在此溶液中加入盐酸又生成黑色HgS沉淀。
此反应可作为分离HgS的方法。
根据ZnS、CdS、Ag2S、CuS和HgS溶度积大小,ZnS可溶于稀酸,CdS溶于6mol•L−1HCl 溶液,Ag S和2 CuS溶于氧化性的HNO3,而HgS溶于王水。
ds区元素阳离子都有较强的接受配体的能力,易与H2O、NH3、X−、CN−、SCN−和en等形成配离子。
例如Cu(en)22+、Ag(SCN)2−、Zn(H2O)42+、Cd(NH3)42+和HgCl42−等。
Hg2+与I−反应先生成桔红色HgI2沉淀,加入过量的I−则生成无色的HgI42−配离子,它和KOH的混合溶液称为奈斯勒试剂,该试剂能有效地检验铵盐的存在。
Cu2+、Ag+、Zn2+、Cd2+与氨水反应生成Cu(NH3)42+(深蓝)、Ag(NH3)2+(无色),Zn(NH3)42+(无色),Cd(NH3)42+(无色)等配离子。
Hg2+只有在过量的铵盐存在下才与NH3生成配离子。
当铵盐不存在时,则生成氨基化合物沉淀。
如:HgCl2+2NH3=HgNH2Cl↓+NH4ClHg22+在NH3•H2O中不生成配离子,而发生歧化反应。
2Hg2(NO3)2+4NH3+H2O=HgO•HgNH2NO3↓+2Hg↓+3NH4NO3难溶物和配合物的形成,可以改变元素的电极电位,影响元素的性质。
以铜为例加以说明。
铜的部分电位图为:在水溶液中,Cu+难于存在,它易发生歧化2Cu+=Cu+Cu2+要使上述平衡向左移动,可使Cu+生成难溶盐或配合物在CuSO4 溶液中加入过量的Na2SO3 溶液能将Cu2+ 还原为Cu+ ,同时形成Cu(SO3)35−配离子:如果移去Cu+难溶盐的阴离子或配合物的配体,Cu+又发生歧化分解。
Hg2+与Hg22+在一定条件下能相互转化。
它们有如下平衡:Hg2++Hg=Hg22+ K=166反应的方向将取决于对反应条件的控制。
例如,在配位剂存在下或当pH≥3 时,Hg22+发生歧化反应:若Hg2+形成难溶沉淀物或稳定的配合物,上述平衡右移,Hg22+发生歧化。
离子的鉴定Cu2+:Cu2+与黄血盐K4[Fe(CN)6]反应,生成红棕色Cu2[Fe(CN)6]沉淀,方法灵敏。
Fe3+有干扰。
Zn2+:Zn2+与硫氰合汞酸铵(NH4)2[Hg(SCN)4]生成白色的Zn[Hg(SCN)4]沉淀。
Cd2+:Cd2+与S2−生成黄色沉淀。
若要消除其它金属离子的干扰,可在KCN存在时鉴定。
Hg2+和Hg22+:Hg2+可被SnCl2分步还原,还原产物由白色(Hg2Cl2)变为灰色或黑色(Hg)沉淀。
仪器和药品(除特别注明外,试剂浓度单位为mol•L−1)离心机,点滴板CuSO4(0.1),AgNO3(0.1),ZnSO4(0.1),CdSO4 (0.1),Hg(NO3)2(0.1),Na2S(0.1),Na2SO3(0.5),NaCl(0.1),KBr(0.1),KI(0.1),Na2S2O3(0.1),CuCl2(饱和),NaOH(2、6),HCl(浓),NH3•H2O(2,6,浓),H2SO4(1,2),HNO3(1,浓),乙二胺(0.1),EDTA(0.1),K4[Fe(CN)6](0.1),KSCN(25%,m),葡萄糖(10%,m),汞,Cu片,TAA。
实验内容请用表格报告实验结果。
解释实验现象时,若涉及化学反应,均要求写出反应方程式。
实验废液回收在指定容器中。
1.氢氧化物(或氧化物)的生成和性质在数滴CuSO4溶液中,滴加适量的2mol•L−1NaOH溶液,生成沉淀后离心分离。
将沉淀分成3 份,其中1 份加热,试验其对热的稳定性;其它2份分别试验沉淀在6mol•L−1NaOH和2mol•L−1H2SO4溶液中溶解的情况。
分别用ZnSO4、CdSO4、AgNO3和Hg(NO3)2溶液代替CuSO4溶液,将制得的沉淀分别试验其对热、对稀酸和强碱作用的情况。
2.配合物(1)氨合物:在AgNO3溶液中滴加2mol•L−1NH3•H2O,观察沉淀的生成与溶解。
再用沉淀溶解后的溶液试验其对热稳定性和与酸、碱作用的情况。
分别用CuSO4、ZnSO4和CdSO4溶液代替AgNO3溶液重复上述实验。
(2)铜的其它配合物①取几滴CuSO4溶液于试管中,先滴加2mol•L−1NH3•H2O至使生成的沉淀溶解,转加乙二胺溶液,观察溶液颜色的变化,再滴加EDTA溶液,溶液颜色又有何变化?比较以上3 种铜的配合物的稳定性并解释之。
②试验CuSO4溶液与K4[Fe(CN)6]溶液的作用,观察沉淀的颜色。
此反应常用于鉴定Cu2+离子。
(3)配合反应与沉淀反应:利用实验提供的下列试剂:AgNO3、NaCl、KBr、KI、Na2SO3和2mol•L−1NH3•H2O等溶液设计试管实验,比较AgCl、AgBr、AgI的溶解度和Ag(NH3)2−、Ag(S2O3)23−稳定性的大小。
3.Cu(Ⅱ)与Cu(I)的相互转化(1)氧化亚铜的生成和性质:在数滴CuSO4溶液中加入过量的6mol•L−1NaOH溶液,使生成的沉淀溶解后再加入数滴葡萄糖溶液。
摇匀,水浴微热,观察现象。
将沉淀离心分离,弃去清液,沉淀用蒸馏水洗涤后加入2mol•L−1H2SO4溶液,水浴加热,观察沉淀溶解的情况,溶液的颜色,剩余沉淀是何物?(2)碘化亚铜的形成:取数滴CuSO4溶液于离心试管中,滴加KI溶液,观察现象。
CuI是什么颜色?如何消除I2颜色的干扰?(3)CuCl的形成:在小烧杯中,加入约1mL饱和的CuCl2溶液和约2mL浓HCl,再加入少许铜屑,小火加热片刻,此时溶液颜色加深,继续加热微沸片刻,待溶液颜色由深变浅时,将溶液倾入约100mL水中,观察产物的颜色和状态。
4.汞的化合物(1)HgS的生成与性质:于两支离心试管中,各加入2 滴Hg(NO3)2溶液,分别滴加TAA溶液,观察沉淀的颜色。
离心分离,弃去清液,将沉淀洗涤后,于一支试管加入Na2S溶液,观察现象。
于另一支试管加入几滴6mol•L−1HNO3溶液,搅匀、观察沉淀是否溶解?若不溶解再滴加几滴王水(HNO3:浓HCl=1:3)搅匀,此时有何变化?(2)Hg2+配合物的生成及其应用①在2滴Hg(NO3)2溶液中,逐滴加入KI溶液,观察沉淀的颜色。
继续加入KI,观察沉淀的溶解,再加入几滴2mol•L−1NaOH溶液并摇匀。
然后试验上述溶液与NH4Cl溶液作用的情况。
②取2 滴Hg(NO3)2溶液于试管中,加入数滴KSCN溶液,观察现象。
将溶液分成两份,分别试验该溶液与硫酸锌溶液和氯化钴溶液作用的情况。
此反应常用来鉴定Zn2+和Co2+。
5.Hg(II)和Hg(I)的相互转化(1)取2 滴Hg(NO3)2溶液于试管中,加入数滴NaCl溶液,观察现象。
再加入2mol•L−1NH3•H2O有何变化?(2)取4 滴Hg(NO3)2溶液于试管中,加入l滴汞(小心取用,切勿洒出瓶外!),振荡试管。
将清液转移至另外两支试管(余下的汞要回收!),于其中一支加入数滴NaCl溶液,观察现象。
于另一支加入几滴2mol•L−1NH3•H2O,观察现象。
并与(1)实验作比较。
选做部分(1)用下列试剂设计Cu+的歧化和反歧化实验。
CuSO4(0.1mol•L−1),Na2SO3(0.5mol•L−1),H2SO4(2mol•L−1)和浓NH3•H2O。
(2)现有Cu2+、Ag+、Zn2+和Hg2+等4 种离子的混合液,根据氯化物和硫化物的性质,将它们分离并检出。
混合液取0.1mol•L−1的下列试剂:CuSO4、AgNO3、ZnSO4和Hg(NO3)2溶液各3滴配成。
问题与讨论(1)久置的[Ag(NH3)2]+碱性溶液,有产生氮化银Ag3N的危险,应采用什么办法来破坏[Ag(NH3)2]+。
(2)Hg和Hg2+有剧毒,试验时应注意些什么?(3)总结Cu2+- Cu+,Hg2+- Hg22+相互转化的条件。
(4)有两位学生(A,B)做HgS的溶解实验,他们都以HgCL2溶液与TAA反应制得HgS沉淀。
当试验沉淀与HNO3作用时,学生A制得的HgS不溶解于HNO3,而学生B 制得的HgS却可溶于HNO3。
试分析两位学生的实验产生不同结果的原因。
从中可得到什么启发?(5)试分析为什么在CuSO4溶液中加入KI即产生CuI沉淀,而加入KCl溶液时却不出现CuCl沉淀。