实验差热热重
- 格式:doc
- 大小:493.00 KB
- 文档页数:4

实验八差热、热重分析一、目的要求1. 了解差热分析法的一般原理和差热分析仪的基本构造;2. 掌握差热仪的使用方法;3.测定草酸钙的差热谱图,并根据所得到的差热谱图分析样品在加热过程中所发生的化学变化。
二、实验原理许多物质在被加热或冷却的过程中,会发生物理或化学等的变化,如相变、脱水、分解或化合等过程。
与此同时,必然伴随有吸热或放热现象。
当我们把这种能够发生物理或化学变化并伴随有热效应的物质,与一个对热稳定的、在整个变温过程中无热效应产生的基准物(或叫参比物)在相同的条件下加热(或冷却)时,在样品和基准物之间就会产生温度差,通过测定这种温度差可了解物质变化规律,从而确定物质的一些重要物理化学性质,称为差热分析(Differential Thermal Analysis,DTA)。
差热分析是在程序控制温度下,试样物质S和参比物R的温度差与温度关系的一种技术。
差热分析原理如图8-1所示。
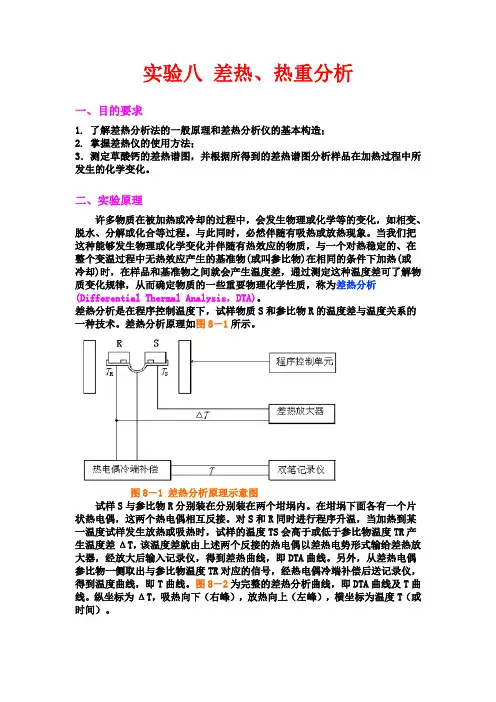
图8-1 差热分析原理示意图试样S与参比物R分别装在分别装在两个坩埚内。
在坩埚下面各有一个片状热电偶,这两个热电偶相互反接。
对S和R同时进行程序升温,当加热到某一温度试样发生放热或吸热时,试样的温度TS会高于或低于参比物温度TR产生温度差ΔT,该温度差就由上述两个反接的热电偶以差热电势形式输给差热放大器,经放大后输入记录仪,得到差热曲线,即DTA曲线。
另外,从差热电偶参比物一侧取出与参比物温度TR对应的信号,经热电偶冷端补偿后送记录仪,得到温度曲线,即T曲线。
图8-2为完整的差热分析曲线,即DTA曲线及T曲线。
纵坐标为ΔT,吸热向下(右峰),放热向上(左峰),横坐标为温度T(或时间)。
图8-2 差热分析曲线现代差热分析仪器的检测灵敏度很高,可检测到极少量试样所发生各种物理、化学变化,如晶形转变、相变、分解反应、交联反应等。
图8-3是一种高聚合物典型的差热分析曲线,即ΔT- t曲线。
图上反应了该高聚合物玻璃化温度转变、结晶放热峰、熔融吸热峰、氧化放热峰、若分解吸热峰。
实验二热重-差热分析法一、实验目的1.掌握热重和差热分析的基本原理。
2.学习热重和差热分析仪的操作。
3.学会定性解释差热谱图。
4.用差热仪测定绘制CuSO4·5H2O的DTA曲线,分析其水分子的脱去顺序。
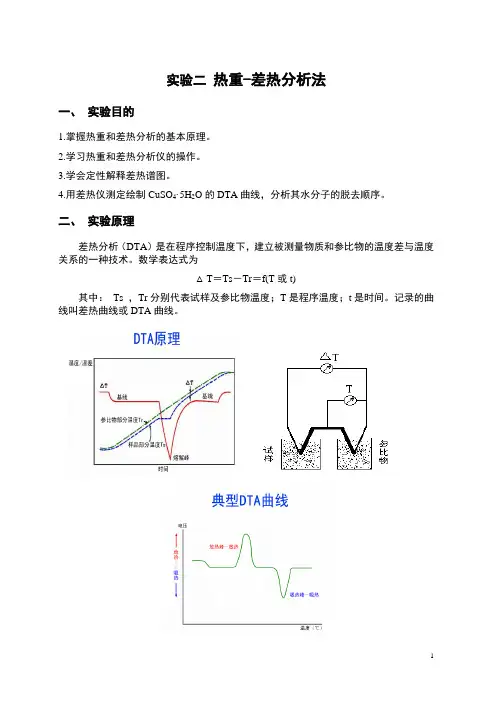
二、实验原理差热分析(DTA)是在程序控制温度下,建立被测量物质和参比物的温度差与温度关系的一种技术。
数学表达式为△T=Ts-Tr=f(T或t)其中:Ts ,Tr分别代表试样及参比物温度;T是程序温度;t是时间。
记录的曲线叫差热曲线或DTA曲线。
本实验以α – Al2O3作为参比物质,记录CuSO4·5H2O的DTA曲线,从而考察其失去五分子结晶水的情况。
物质受热时,发生化学变化,质量也就随之改变,测定物质质量的变化也就随之改变,测定物质质量的变化就可研究其变化过程,热重法(TG)是在程序控制温度下,测量物质质量与温度关系的一种技术,热重法实验得到的曲线称为热重曲线(TG曲线)。
三、实验仪器:差热分析仪由加热炉、试样容器、热电偶、温度控制系统及放大、记录系统等部分组成。
四、实验步骤:1.依次开启稳压电源、工作站、气体流量计、主机(开关均在后面)、电脑,打开氮气瓶,使之压力为0.5MP。
2.打开炉子,手动在左右两个陶瓷杆放入铝坩埚容器,关好炉子,在操作界面上调零,仪器自动扣除了空坩埚的重量。
3.打开炉子取出样品坩埚容器将约5-10mg的样品研成粉末放入铝坩埚容器。
4.打开软件TA-60WS Collection Monitor 点击measure,出现measure parameter,在这里我们可以设置所需要的程序温度,然后点击Start,要我们文件保存在哪里。
5.单击Start。
6.仪器测定结束。
四、结果处理1.仪器结束后,打开软件TA60,找到要保存的结果文件。
2.依次找到重量线,热线,程序升温线。
3.首先从热线中分析出样品的吸热峰和放热峰。
从重量线上分析出样品重量的损失(单击重量线,点击Analysis,出现Weigh loss,然后分析)。



《物理化学基础实验》差热分析实验一、实验目的1.用差热-热重分析仪绘制CuSO4·5H2O的差热图谱。
2.了解差热-热重分析仪的工作原理及使用方法。
二、实验原理物质在受热或冷却过程中,当达到某一温度时,往往会发生熔化、凝固、晶型转变、分解、化合、吸附、脱附等物理或化学变化,并伴随着有焓的改变,因而产生热效应,其表现为物质与环境(样品与参比物)之间有温度差。
差热分析(Differentiai Thermal Analysis,简称DTA)就是通过温差测量来确定物质的物理化学性质的一种热分析方法。
记录时间-温度(温差)的图就称为差热图谱。
从差热图谱上可清晰地看到差热峰的数目、位置、方向、宽度、高度、对称性以及峰面积等。
峰的数目表示物质发生物理化学变化的次数;峰的位置表示物质发生变化的转化温度;峰的方向表明体系发生热效应的正负性;峰面积说明热效应的大小:相同条件下,峰面积大的表示热效应也大。
在相同的测定条件下,许多物质的差热图谱具有特征性:即一定的物质就有一定的差热峰的数目、位置、方向、峰温等,因此,可通过与已知的差热谱图的比较来鉴别样品的种类、相变温度、热效应等物理化学性质。
因此,差热分析广泛应用于化学、化工、冶金、陶瓷、地质和金属材料等领域的科研和生产部门。
理论上讲,可通过峰面积的测量对物质进行定量分析,但影响因素较多。
本实验仅做定性分析。
三、仪器和试剂仪器:差热-热重分析仪(HCT-2型) 、坩埚、药匙药品:CuSO4·5H2O(分析纯)、α-Al2O3(分析纯)四、实验步骤1. 打开仪器电源,预热30 min,接通冷却水。
2. 装样品:在干净的坩埚内装入约1/2~2/3坩埚高度的CuSO4·5H20粉末并将其颠实,准确称量样品质量。
将其放在样品托的右托盘上。
另取一只坩埚装入等量的α-Al2O3,将其放在样品托的左托盘上,盖好保温盖。
3.打开热分析软件,点击新采集,将升温速率设定为10 ℃·min-1,最高温度450 ℃,填好样品相关信息,点击确定,开始升温。

差热-热重综合热分析一、实验目的1.了解差热-热重分析仪的原理、仪器装置及使用方法。
2.掌握差热-热重分析基本原理、测试技术及影响测量准确性的因素。
3.掌握差热-热重曲线定性和定量处理方法,对实验结果做出解释。
二、实验原理热分析技术主要用于研究物质的物理、化学性质与温度的关系。
温度本身是一种量度,它几乎影响到物质所有的物理和化学常数,因此,热分析就是对材料热转变机理和物理化学变化的热力学的过程的研究。
1.差热分析(DTA)在物质加热或冷却的过程中发生物理化学变化,往往伴随有吸热放热现象,记录试样温度随时间的变化曲线,可以直观的反映出试样是否发生物理或化学变化,这就是经典的热分析法。
但是这种方法很难显示热效应很小的变化,为此逐步发展形成了差热分析(Differ ential Thermal Analysis,DTA)。
DTA是在程序控温下,测量试样与参比物之间的温度差与温度或时间关系的一种技术。
试样随温度变化而发生吸热或放热的现象,表明试样内部产生了热效应。
如:凝固、熔化、晶型转变、晶格结构破坏、分解、化合、吸附、脱附等物理化学变化。
一般来说,相转变、脱氢还原和一些分解反应产生吸热效应;而结晶、氧化等反应产生放热效应。
DTA的原理如图1所示。
将两只尺寸完全相同的Al2O3坩埚,一只装参比物(要求在测量温度范围内不发生任何热效应的物质,如α-Al2O3或MgO),另一只装待测样,同时置于加热炉中,然后以一恒定的速率升温,试样和参比物温度线性升高。
当试样没有焓变时,试样和参比物的温差△T=0;当试样发生吸热时,试样温度比参比物低,温差△T<0,反之,试样放热则△T>0。
采用两个同极串联差热热电偶检测△T的变化,放大后输入计算机进行处理,绘制DTA 曲线。
当△T=0,两电偶电势相同、方向相反,DTA曲线为水平线;当△T≠0,DTA曲线为峰形曲线,向下为吸热,向上为放热。
不同物质热性质不同,其DTA曲线的峰的位置、峰的形状、面积及个数都不同,因此可以根据物质的DTA曲线对物质进行定性和定量分析。

差热热重分析实验报告一、实验目的差热热重分析(Differential Thermal Analysis Thermogravimetric Analysis,简称 DTATGA)是一种常用的热分析技术,通过同时测量样品在加热或冷却过程中的质量变化(热重分析,TGA)和热效应(差热分析,DTA),可以获取有关样品的热稳定性、组成、相变等重要信息。
本次实验的目的是利用差热热重分析仪对给定的样品进行测试,深入了解其热性能,并对实验结果进行分析和讨论。
二、实验原理(一)热重分析(TGA)热重分析是在程序控制温度下,测量物质质量与温度关系的一种技术。
当样品在加热过程中发生物理或化学变化(如挥发、分解、氧化等)导致质量减少时,通过记录质量随温度的变化曲线(TGA 曲线),可以确定样品的质量损失情况,并计算出相应的质量损失率。
(二)差热分析(DTA)差热分析是在程序控制温度下,测量样品与参比物之间的温度差随温度或时间变化的一种技术。
当样品发生物理或化学变化时,会吸收或放出热量,导致样品与参比物之间产生温度差。
通过记录温度差随温度的变化曲线(DTA 曲线),可以确定样品的相变温度、反应起始和终止温度等热效应信息。
三、实验仪器与材料(一)实验仪器本次实验使用的是_____型差热热重分析仪,仪器主要由加热炉、温度控制系统、质量测量系统、差热测量系统和数据采集与处理系统组成。
(二)实验材料实验所用样品为_____,其纯度为_____。
四、实验步骤(一)样品制备将待测试的样品研磨成粉末状,以确保样品受热均匀。
称取适量的样品(一般为 5 10 mg),放入氧化铝坩埚中。
(二)仪器准备打开差热热重分析仪,设置实验参数,包括升温速率(_____℃/min)、终止温度(_____℃)、气氛(如氮气、空气等)及其流速等。
(三)实验操作将装有样品的坩埚放入加热炉中,启动实验程序。
仪器会按照设定的参数自动进行加热,并实时记录样品的质量变化和温度差。

差热热重分析实验报告差热热重分析(DSC-TGA)是一种热分析技术,可以同时测量材料的热性质和重量变化。
本实验中,我们使用了一台METTLER TOLEDO的DSC-TGA设备,探究了不同样品的热性质和重量变化。
以下是实验报告:实验目的:1. 了解DSC-TGA技术的基本原理和实验操作;2. 测量几种材料的热性质和重量变化,并分析其相关性质,以确定材料的性能和应用;3. 建立样品的热性质和重量变化曲线。
实验步骤:1. 将DSC-TGA设备预热至所需温度(本实验中为室温至1000°C);2. 取一定质量的样品(本实验中为聚丙烯、聚苯乙烯、硅橡胶、KBr和艾拉橙染料),放置样品台上;3. 通过PC机设定实验过程,包括温度升降速率、样品温度范围、气氛气体种类和流量等参数;4. 进行实验,记录DSC-TGA设备输出的数据,包括样品的热性质曲线和重量变化曲线。
实验结果:通过DSC-TGA实验,我们得到了下列结果:1. 聚丙烯图1为聚丙烯的热性质曲线和重量变化曲线。
热性质曲线显示了聚丙烯在240°C处有一个峰值,这可能是由于聚丙烯发生部分熔融,而重量变化曲线显示了聚丙烯在400°C左右开始分解,这可能是由于长时间孔隙不停产生于样品内部,然后引起聚合物发生热分解。
这个过程会产生碳的固体。
3. 硅橡胶4. KBr5. 艾拉橙染料结论:通过DSC-TGA实验,我们可以了解到材料在高温下的热性质和重量变化情况。
我们可以通过分析样品的热性质曲线和重量变化曲线,确定样品的特性,以确定材料的应用场景。
在本实验中,我们得到了聚丙烯、聚苯乙烯、硅橡胶、KBr和艾拉橙染料的热性质和重量变化曲线。
我们可以看到,不同材料具有不同的热特性,这实际上与材料的化学组成和结构有关。
例如,聚合物在一定温度下会发生熔化和分解反应,而KBr会产生氧化反应。
一般来说,通过差热热重分析,我们可以更好地了解材料,以确定材料的性能和应用。

实验5 热重、差热分析实验一.实验目的与基本要求1.在固相反应中,通过对材料基本性质的了解,利用其基本性质参数,试设计出一条合理的温度曲线,利用综合热分析仪(ZRY-1P、ZRY-2P)对其进行测试分析,通过对比,得到最优烧结方案。
2.理解热重分析和差热分析的基本原理。
3.了解高温综合热分析仪(ZRY-2P)的组成及组成各系统的基本工作原理。
4.掌握高温综合热分析仪的具体测量方法。
5.当各种固体氧化物、盐类发生熔融、相变、分解、化合、脱水、凝固、蒸发、升华等特定过程时,对其进行热重分析和差热分析。
6.对实验数据进行处理,根据得到的一系列热重曲线(TG)、微分热重曲线(DTG)和差热曲线(DTA),对物质发生的具体过程进行热分析。
二.实验原理与温度曲线的设计固相反应是一系列合金、传统硅酸盐材料以及新型无机功能材料生产过程中的基础反应。
固相反应是固体参与直接化学反应并起化学变化,同时至少在固体内部或外部的一个过程中起控制作用的反应。
固相反应除固体间的反应外也包括有气、液相参与的反应。
例如金属氧化、碳酸盐、硝酸盐和草酸盐等的热分解反应、粘土矿物的脱水反应以及煤的干馏等反应。
固相反应的共同特点有:首先,固体质点(原子、离子或分子)间具有很大的作用键力,故固态物质的反应活性通常较低,速度较慢。
其次,在低温时固体在化学上一般是不活泼的,因而固相反应通常需在高温下进行。
而且由于反应发生在非均一系统,传热和传质过程都对反应速度有重要影响。
而伴随反应的进行,反应物和产物的物理化学性质将会变化,并导致固体内部温度和反应物浓度分布及其物性的变化,这都可能对传热、传质和化学反应过程产生影响。
在具体的反应中为了得到预定的产物,使反应向着希望的方向进行,各种固体氧化物、盐类发生熔融、相变、分解、化合、脱水、凝固、蒸发、升华等特定过程需要适当的温度和持续时间,在对具体反应物基本性质的了解,利用其基本性质参数的基础上,试设计出一条适宜的温度曲线,利用高温综合热分析仪(ZRY-2P)对其进行测试,通过对实验结果的分析比较,得到最优温度方案。
差热-热重分析法测定硫酸铜的热分析图谱一、实验目的1.了解差热分析法、热重分析法的基本原理。
2.了解差热热重同步热分析仪的基本构造并掌握使用方法。
3.正确控制实验条件,并学会对热分析谱图进行定性分析和定量处理。
二、实验原理1.差热分析法(Differential Thermal Analysis,DTA)差热分析是在程序控制温度下,测量试样与参比物(一种在测量温度范围内不发生任何热效应的物质)之间的温度差与温度关系的一种技术。
许多物质在加热或冷却过程中会发生熔化、凝固、晶型转变、吸附、脱附等物理转变及分解、化合、氧化还原等化学反应。
这些变化在微观上必将伴随体系焓的改变,从而产生热效应,在宏观上表现为该物质与外界环境之间有温度差。
选择一种对热稳定的物质作为参比物,将其与试样一起置于可按设定速率升温的热分析仪中,分别记录参比物的温度以及试样与参比物间的温度差。
以温差对温度作图就可以得到差热分析曲线,简称DTA曲线。
2. 热重法(Thermogravimetry,TG)热重法是在程序控制温度下,测量物质的质量变化与温度关系的一种技术,其基本原理是热天平。
热天平分为零位法和变位法两种。
变位法,就是根据天平梁的倾斜度与质量变化呈比例的关系,用差动变压器等检知倾斜度,并自动记录。
零位法,是采用差动变压器法、光学法或电触点法测定天平梁的倾斜度,并用螺线管线圈对安装在天平系统中的永久磁铁施加力,使天平梁的倾斜复原。
由于对永久磁铁所施加的力与质量变化呈比例,这个力又与流过螺线管的电流呈比例,因此只要测量并记录电流,便可得到质量变化的曲线,以质量对温度作图就可以得到热重曲线,简称TG曲线。
三、实验用品1.仪器日本SHIMADZU DTG-60差热-热重同步热分析仪(TA-60工作站),镊子,坩埚,研钵。
2.药品参比物:α-AL2O3(A.R,原装进口)试样:CuSO4·5H2O(A.R)四、操作步骤1、熟悉差热-热重同步热分析仪的组成及相应旋钮的作用。
差热与热重分析作为常见的物料分析技术,对于物料的热稳定性、热分解过程等方面提供了重要的信息。
本文将从差热与热重分析技术的基本原理、实验流程与数据分析、应用前景等方面进行详细讲解。
一、差热与热重分析的原理差热与热重分析是通过对物料样品升温过程中在不同温度下的热变化进行量化分析,来研究物料稳定性、热分解特性等方面的技术。
其中,差热分析技术主要是通过测量样品与对比样品在同一温度程序下的热力学参数差异来推断样品的热性质;而热重分析则是通过测量样品在升温过程中的质量变化来分析其热分解过程。
两者均能通过对样品在升温过程中的热变化进行量化来获取物料特性信息。
差热与热重分析的实验步骤主要包括样品制备、实验设计、实验操作、数据处理等环节。
其中,样品制备是最重要的一步,样品的性质与制备方式对于实验结果具有重要影响。
实验设计中,需要确定所要研究的参数,包括升温速率、升温程序、取样方式等;实验操作中,需要关注实验过程中的环境条件(如气氛氧化还原程度)以及实验装置的准备与检测。
在数据处理方面,需要根据实验所得数据进行曲线拟合、峰面积积分、峰温浓度计算等操作,以获取样品的热稳定性、热分解过程等信息。
二、差热与热重分析实验流程与数据处理2.1 差热分析流程差热分析技术所用仪器为热差示仪,其基本原理为:将样品和对比样品同时加热,测量两者热力学参数(如焓值、热流量)的差异,通过计算或绘图等方式展现出来,从而推断样品的热性质。
差热分析的操作流程如下:(1)样品制备样品应选取足量、均匀的样品颗粒,并将其粉碎至样品颗粒粒径<200目的要求,并保证样品在升温过程中的稳定性、均匀性。
(2)实验装置准备差热分析中常用的热差示仪一般包括热源、样品、对比样品、检测系统、温度控制系统等组件。
其中热源为差热分析的核心部件,样品、对比样品应储存在专用样品舱内以保证实验精度。
检测系统可选用红外线探测器等手段,温度控制系统则可用PID或脉冲宽度调制等方式进行温度控制。
差热分析与热重分析计划学时:2学时本实验通过DTA研究物质BaCl2.2H2O在加热过程中所发生的物理化学变化,绘制相应曲线,确定其变化的实质。
【实验目的】(1) 掌握DTA热分析仪的原理和实验技术。
(2) 测量化学分解反应过程中的分解温度。
(3) 测量物质在加热过程中所发生的物理化学变化,绘制相应曲线,从而研究材料的反应过程。
【实验原理】热分析是物理化学分析的基本方法之一。
综合热分析研究物质在加热过程中发生相变或其他物理化学变化时所伴随的能量、质量和体积等一系列的变化,可以确定其变化的实质或鉴定矿物。
DSC和DTA研究物质在加热过程中内部能量变化所引起的吸热或放热效应。
1. 差热分析DTA原理差热分析(Differential Thermal Analysis 简称DTA )是指在程序控制温度下,测量物质和参比物之间的温度差与温度(或时间)关系的一种技术。
用数学式表达为△T= Ts—Tr ( T 或t )式中Ts ,Tr ——分别代表试样及参比物温度;T ——程序温度;t ——时间。
试样和参比物的温度差主要取决于试样的温度变化。
DTA 仪由以下几部分组成:(1) 样品支持器。
(2) 程序控温的炉子。
(3) 记录器。
(4) 检测差热电偶产生的热电势的检测器和测量系统。
(5) 气氛控制系统。
若将呈热稳定的已知物质(即参比物)和试样一起放入一个加热系统中,并以线性程序温度对它们加热。
在试样没有发生吸热或放热变化,且与程序温度间不存在温度滞后时,试样和参比物的温度与线性程序温度是一致的。
即Ts—Tr(△T)为零时,两温度线重合,在△T 曲线上则为一条水平基线。
若试样发生放热变化,由于热量不可能从试样瞬间导出,于是试样温度偏离线性升温线,且向高温方向移动。
而参比物的温度始终与程序温度一致,△T >0,在△T 曲线上是一个向上的放热峰。
反之,在试样发生吸热变化时,由于试样不可能从环境瞬间吸收足够的热量,从而使试样温度低于程序温度。
热重/差热连用(TG/DTA)热分析实验(预习)一、实验原理热重法(TG)是在程序升温下,测量试样的质量与温度的关系的热分析法。
热重分析的原理是靠电磁作用力使因质量变化而倾下的天平梁恢复到原来平衡的位置,施加的电磁力与质量变化成正比,而电磁力的大小与方向是通过调节转换系统中线圈中的电流实现的,因此检测此电流值即可知质量变化。
通过连续记录质量与温度的变化,就可获得热重曲线TG。
差热分析(DTA)是在程序控制温度条件下,测量样品与参比物(基准物,是在测量温度范围内不发生任何热效应的物质,如α−Al2O3,MgO等)之间的温度差随温度变化的一种热分析方法。
测试时将试样与参比物分别放在两只坩埚内,样品和参比物同时进行升温,当样品未发生物理或化学状态变化时,测它与参比物的温差∆T=0。
当样品发生物理或化学变化而发生放热或吸热时,样品的温度高于或低于参比物温度,产生温差∆T,相应的温差热电势讯号经放大后由微机实时采集,从而可获得DTA曲线。
一般样品产生的放热或吸热转变过程,如晶型转变、结晶与熔融、固化、交联等物理反应以及氧化、降解等化学反应,都会在DTA曲线上表现出放热峰或吸热峰。
而对于玻璃化转变,虽然不伴随放热和吸热现象,但由于比热容发生变化使升温过程中所需热量发生变化,在DTA曲线上表现为基线的偏移。
热重/差热联用分析是结合TG及DTA的同步分析技术,可同时获得测试样品的重量变化及热效应。
影响TG-DTA联用热分析实验的因素主要有以下三点:a)升温速率的影响:升温速率是一个重要的程序变量,对热重曲线有明显的影响。
提高升温速率是TG曲线向高温推移,升温速率越大,炉壁与试样温度梯度增加,导致热重曲线上的起始分解温度和终止分解温度偏高。
升温速率也是影响差热曲线的重要因素。
一般当升温速率提高时,DTA曲线的峰温上升,峰面积与峰高也有一定上升,尤其对于高分子转变的松弛过程(如玻璃化转变),升温速率的影响更大。
b)样品因素:试样的用量、粒度和形状以及装填方式都会影响热重曲线。
实验5 热重、差热分析实验
一.实验目的与基本要求
1.在固相反应中,通过对材料基本性质的了解,利用其基本性质参数,试设计出一条合理的温度曲线,利用综合热分析仪(ZRY-1P、ZRY-2P)对其进行测试分析,通过对比,得到最优烧结方案。
2.理解热重分析和差热分析的基本原理。
3.了解高温综合热分析仪(ZRY-2P)的组成及组成各系统的基本工作原理。
4.掌握高温综合热分析仪的具体测量方法。
5.当各种固体氧化物、盐类发生熔融、相变、分解、化合、脱水、凝固、蒸发、升华等特定过程时,对其进行热重分析和差热分析。
6.对实验数据进行处理,根据得到的一系列热重曲线(TG)、微分热重曲线(DTG)和差热曲线(DTA),对物质发生的具体过程进行热分析。
二.实验原理与温度曲线的设计
固相反应是一系列合金、传统硅酸盐材料以及新型无机功能材料生产过程中的基础反应。
固相反应是固体参与直接化学反应并起化学变化,同时至少在固体内部或外部的一个过程中起控制作用的反应。
固相反应除固体间的反应外也包括有气、液相参与的反应。
例如金属氧化、碳酸盐、硝酸盐和草酸盐等的热分解反应、粘土矿物的脱水反应以及煤的干馏等反应。
固相反应的共同特点有:首先,固体质点(原子、离子或分子)间具有很大的作用键力,故固态物质的反应活性通常较低,速度较慢。
其次,在低温时固体在化学上一般是不活泼的,因而固相反应通常需在高温下进行。
而且由于反应发生在非均一系统,传热和传质过程都对反应速度有重要影响。
而伴随反应的进行,反应物和产物的物理化学性质将会变化,并导致固体内部温度和反应物浓度分布及其物性的变化,这都可能对传热、传质和化学反应过程产生影响。
在具体的反应中为了得到预定的产物,使反应向着希望的方向进行,各种固体氧化物、盐类发生熔融、相变、分解、化合、脱水、凝固、蒸发、升华等特定过程需要适当的温度和持续时间,在对具体反应物基本性质的了解,利用其基本性质参数的基础上,试设计出一条适宜的温度曲线,利用高温综合热分析仪(ZRY-2P)对其进行测试,通过对实验结果的分析比较,得到最优温度方案。
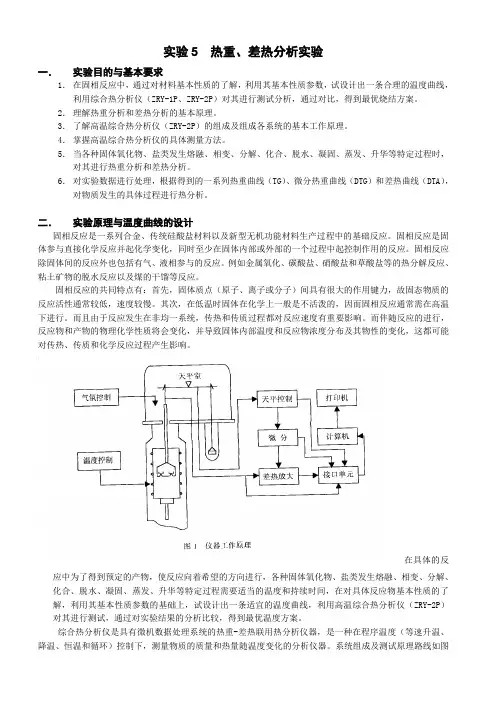
综合热分析仪是具有微机数据处理系统的热重-差热联用热分析仪器,是一种在程序温度(等速升温、
降温、恒温和循环)控制下,测量物质的质量和热量随温度变化的分析仪器。
系统组成及测试原理路线如图1。
1.热重分析原理
在天平测量系统中,当物质被加热时,随着温度的增高,物质内部在某一特定温度下产生物理变化或化学变化,此时常常伴随着物质质量的变化。
热重分析的原理是,在设定温度范围内将不同温度下被加热试样的质量(或重量)变换成电流,用电流的大小来代表质量的大小,从而得到物质的热重曲线TG(即质量-温度曲线,如图2),然后微分系统对TG 进行一次微分运算,得到DTG微分热重曲线(如图3)。
2.差热分析原理
差热分析(DTA)是在程序温度控制下测量物质与参比物之间温度差随温度变化的一种技术。
差热信号的测量是通过样品支架实现的,其基本结构如图4。
测试时将试样与参比物(α-氧化铝)分别放在两只坩埚内,加热炉以一定速率升温,如果试样没有热反应,则它与参比物的温差ΔT=0;如果试样在某一温度范围内有吸热(或放热)反应,则试样温度将停止(或加快)上升,试样与参比物之间产生温差ΔT,把ΔT热电偶放大后经微机实时采集,得到图5的峰形曲线(即DTA)。
3.其它组成部分原理
3.1 温度控制系统
温度控制系统由程序温度控制单元、控温热电偶及加热炉组成。
由程序温度控制单元编程模拟复杂的温度曲线,给出毫伏信号。
当控温热电偶的热电势与该毫伏值有偏差时,说明炉温偏离给定值,由偏差信号调
整加热炉功率,使炉温很好地跟踪设定值,符合理想的温度控制。
3.2 气氛系统
气氛系统包括导气管及输入气体。
输入气体可用氮气、氧气、净化空气以及它们的混合气体。
气氛系统的使用是为了保护样品,并且防止加热炉升温后热量进入天平室,影响天平的精度。
三.实验设备
ZRY-2P型高温综合热分析仪,包括差热放大单元、天平控制单元、微分单元、气氛控制单元、数据处理接口单元、计算机、打印机等部分。
四.实验步骤
1.准备工作
1.1 检查电源线、信号线、通气管是否接好,正确无误后,打开各单元电源,预热30分钟。
注意:开机后,温控单元中设置温度sv显示必须为“STOP”,否则,长按“Λ”(STOP键),使其恢复到STOP状态。
1.2 气氛控制单元:打开N2钢瓶上的压力表,调节减压阀手柄,是压力表指针指示在2~4Kg/cm2位置;将气路切换开关拨向N2处,调节流量计使流量保持在40ml/min,压力表在0.2MPa。
2.样品称重
2.1天平调零开机20分钟后,对天平进行零位调整。
先选择适当的量程,一般TG设置为1×10(量程×倍率);DTG量程为×5(一般可选×5,×10);DTA量程为±100μV。
将两个坩埚放在样品支架上(试样加热温度在600℃以下时,可用铝坩埚;超过600℃则需用α-Al2O3坩埚),左边坩埚放入参比物α-Al2O3粉末,右边坩埚空置。
然后调节电减码(从大到小减),使电压值保持在0~0.30以下,用以减去样品器皿的重量,在计算机里进行采样设置后,按下调零结束。
2.2加样将预测样品放入样品坩埚内。
样品加入量要适当,加入后电压显示应小于 5.00V(一般~4.50V)。
3.温控设置
3.1根据具体的试样设计合适的温度曲线根据材料中所含有具体物质的性质,物质的相变条件以及相互之间可能发生反应所需的具体温度等,设计出预温度曲线。
温度曲线的程序编排统一采用温度-时间-温度-时间------格式。
其定义为:从当前段设置温度,经过该段设置的时间到达下一温度。
温度单位为℃,时间为分钟。
(加热速率一般为10~20℃/min,高温区一般为20℃/min,防止因加热过慢,Pt电阻丝高温区蒸发。
)
3.2升温升温前,设置温度sv显示必须为“STOP”,然后按“∨”运行/暂停键,sv显示为“run”时松键,开始进行程序升温。
注意:开始运行后,若sv显示值到2后,电炉的电压表不指向零点,则立即按“∨”运行/暂停键暂停,sv 显示“hold”,仪表进入放电等待。
当电压降回零伏后,再按“∨”运行/暂停键运行,sv显示“run”时松键,此时进入程序升温,按下电炉电源绿键(开)。
3.3关电炉升温结束后,先按“Λ”(STOP键)终止运行,再按下电炉电源红键(关)。
4.取样
设置采样的起始温度和结束温度(取样点结束温度要比温度设置的最终温度低60~100℃)。
计算机在设置温度范围内自动采集2000个点,作出曲线。
5.数据处理
利用软件对曲线进行热重数据处理和差热数据处理,打印出结果。
五.思考题
1.根据TG、DTG和DTA曲线,分析样品在升温过程中发生的变化。
2.为什么实际取样点结束温度要比温度设置的最终温度低60~100℃?
将原烧结曲线与实验结果进行对比,分析二者之间的区别。