纯碱制烧碱的化学方程式
- 格式:docx
- 大小:10.61 KB
- 文档页数:3

第十单元 常见的酸和碱第一节生活中的酸和碱一、如何识别酸和碱1.识别酸和碱的方法(1)通常用 指示剂 来检验溶液的酸碱性。
(显色规律——口诀: 石蕊酸红碱蓝中不变,酚酞酸无碱红中不变 。
)①石蕊:遇酸性溶液显 红 色、遇碱性溶液显 蓝 色。
②酚酞:遇酸性溶液显 无 色、遇碱性溶液显 红 色。
(2)用石蕊试纸检验溶液的酸碱性。
①红色石蕊试纸遇碱性溶液显 蓝 色。
②蓝色石蕊试纸遇酸性溶液显 红 色。
(3)用PH 试纸既可则酸碱性,也可测酸碱度。
二、溶液酸碱性的强弱程度2.溶液的酸碱度是指 溶液的酸碱性的强弱程度 ,通常用 PH 表示,其范围在 0~14之间。
中性酸性增强 碱性增强①当PH=7时,溶液呈 中 性;当PH ﹥7时,溶液呈 碱 性,PH 越大,碱性越 强 ;当PH ﹤7时,溶液呈 酸 性,PH 越小,酸性越 强 。
②测溶液酸碱度的方法: 用玻璃棒蘸取待测液滴到PH 试纸上,显色后与标准比色卡比较读数 。
3.电离时生成的 阳离子 全部是 H + 的化合物叫做酸。
【酸= H + + 酸根离子 】酸性溶液能使石蕊试液变 红 的本质原因是其中都含有 H + 。
4.电离时生成的 阴离子 全部是OH --的化合物叫做碱。
【碱=金属离子 + OH -- 】碱性溶液能使石蕊试液变 蓝 、酚酞变 红 的本质原因是其中都含有 OH -- 。
三、酸和碱对生命活动的意义5.酸雨:正常雨水的PH 约为 5.6~7 ,只有PH ﹤5.6 的雨水才称为酸雨。
第二节 中和反应一、酸和碱之间发生什么反应1.定义: 酸 跟 碱 作用生成 盐 和 水 的反应叫做中和反应。
2.中和反应的实质:H + + OH -- = H 2O 。
3.特点:中和反应是 放热 (填“吸热”或“放热”)反应;基本类型属于 复分解 反应。
二、中和反应的应用4.应用(写出化学方程式):(1)农业生产中:酸性(含硝酸)土壤可以用熟石灰[Ca(OH)2]来中和改良。

纯碱和烧碱的区别纯碱和烧碱的区别你知道在哪里吗?一起来了解一下吧。
下面是店铺给大家整理的纯碱和烧碱的区别,供大家参阅!纯碱和烧碱的区别1,名称及化学式的区别:(1)纯碱为:碳酸钠,化学式Na₂CO₃。
(2)烧碱为:氢氧化钠,化学式为NaOH。
2,理化性质的区别:(1)纯碱:属于盐类,含十个结晶水的碳酸钠为无色晶体,结晶水不稳定,易风化,变成白色粉末Na2CO3,为强电解质,具有盐的通性和热稳定性,易溶于水,其水溶液呈碱性。
(2)烧碱:为一种具有很强腐蚀性的强碱,一般为片状或颗粒形态,易溶于水(溶于水时放热)并形成碱性溶液,另有潮解性,易吸取空气中的水蒸气。
3,用途上的区别:(1)纯碱:是重要的化工原料之一, 用于制化学品、清洗剂、洗涤剂、也用于照像术和制医药品。
(2)烧碱:用途极广。
用于造纸、肥皂、染料、人造丝、制铝、石油精制、棉织品整理、煤焦油产物的提纯,以及食品加工、木材加工及机械工业等方面。
烧碱和纯碱使用上不同烧碱氢氧化钠(NaOH)的用途极广。
用于生产纸、肥皂、染料、人造丝,冶炼金属、石油精制、棉织品整理、煤焦油产物的提纯,以及食品加工、木材加工及机械工业等方面。
我国《食品添加剂使用卫生标准》(GB 2920-1996)规定:可作加工助剂,按生产需要适量使用。
氢氧化钠可以被广泛使用于下列生产过程:容器的清洗过程;淀粉的加工过程;羧甲基纤维素的制备过程;谷氨酸钠的制造过程。
纯碱碳酸钠是重要的化工原料之一,广泛应用于轻工日化、建材、化学工业、食品工业、冶金、纺织、石油、国防、医药等领域,用作制造其他化学品的原料、清洗剂、洗涤剂,也用于照相术和分析领域。
其次是冶金、纺织、石油、国防、医药及其它工业。
玻璃工业是纯碱的最大消费部门,每吨玻璃消耗纯碱0.2吨。
在工业用纯碱中,主要是轻工、建材、化学工业,约占2/3:其次是冶金、纺织、石油、国防、医药及其他工业。
氢氧化钠,化学式为NaOH,俗称烧碱、火碱、苛性钠,为一种具有强腐蚀性的强碱,一般为片状或块状形态,易溶于水(溶于水时放热)并形成碱性溶液,另有潮解性,易吸取空气中的水蒸气(潮解)和二氧化碳(变质),可加入盐酸检验是否变质。

碳酸钠的化学式怎么写今天小编在这给大家整理了碳酸钠的化学式,接下来随着小编一起来看看吧!中文名碳酸钠外文名Sodium Carbonate俗名苏打、纯碱、洗涤碱化学式Na2CO3密度2.532g/cm?熔点851℃分解温度1744℃分子量105.99CAS号497-19-8EINECS号207-838-8;231-867-5沸点1600℃简介在人工合成纯碱之前,古代就发现某些海藻晾晒后,烧成的灰烬中含有碱类,用热水浸取、滤清后可得褐色碱液用于洗涤。
大量的天然碱来自矿物,以地下埋藏或碱水湖为主。
以沉积层存在的天然碱矿品位最高,分布甚广。
最早发明人工合成纯碱方法是18世纪末,法国路布兰用芒硝加石灰石和煤在高温下还原并进行碳酸化,得到以含Na2CO3为主的粗制品-黑灰,经过浸取、蒸发、精制、再结晶、烘干,获得纯度约为97%的重质纯碱。
1861年,比利时E.索尔维独自发明了纯碱并获得过专利。
由于技术秘密保护一直未能大范围应用,20世纪20年代才从美国突破,尤其是中国著名的化工专家侯德榜于1932年出版了《纯碱制造》一书,将保密70年,索尔维法公布于世。
侯德榜还与1939-1942创建了侯氏制碱法,并在四川建立了中试车间。
1952年在大连化工厂设立了联合制碱车间。
日本旭硝子公司推出的NA法,实质上是联碱和氨碱的折中法。
可随意调节纯碱与氯化铵的比例。
物理性质性状碳酸钠常温下为白色无气味的粉末或颗粒。
有吸水性,露置空气中逐渐吸收1mol/L水分(约=15%)。
其水合物有Na2CO3·H2O,Na2CO3·7H2O和Na2CO3·10H2O。
溶解性碳酸钠易溶于水和甘油。
20℃时每一百克水能溶解20克碳酸钠,35.4℃时溶解度最大,100克水中可溶解49.7克碳酸钠,微溶于无水乙醇,难溶于丙醇。
溶液显碱性,能使酚酞变红。
化学性质碳酸钠的水溶液呈强碱性(pH=11.6)且有一定的腐蚀性,能与酸发生复分解反应,也能与一些钙盐、钡盐发生复分解反应。
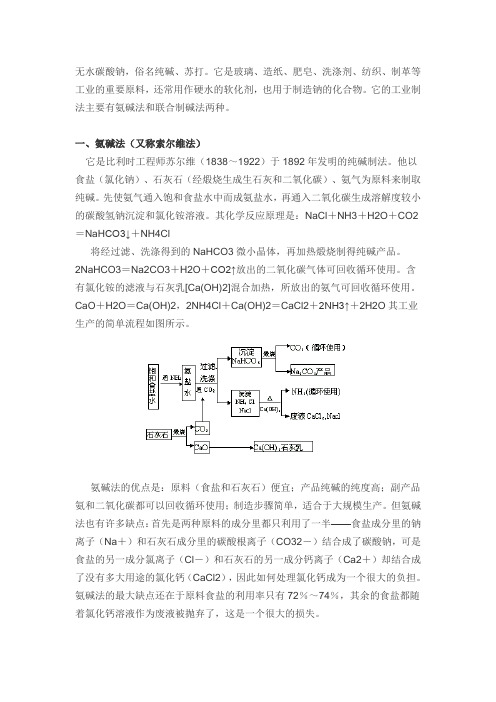
无水碳酸钠,俗名纯碱、苏打。
它是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,还常用作硬水的软化剂,也用于制造钠的化合物。
它的工业制法主要有氨碱法和联合制碱法两种。
一、氨碱法(又称索尔维法)它是比利时工程师苏尔维(1838~1922)于1892年发明的纯碱制法。
他以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl+NH3+H2O+CO2=NaH CO3↓+NH4Cl将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3=Na2CO3+H2O+CO2↑放出的二氧化碳气体可回收循环使用。
含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用。
CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O其工业生产的简单流程如图所示。
氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半——食盐成分里的钠离子(Na+)和石灰石成分里的碳酸根离子(CO32-)结合成了碳酸钠,可是食盐的另一成分氯离子(Cl-)和石灰石的另一成分钙离子(Ca2+)却结合成了没有多大用途的氯化钙(CaCl2),因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
二、联合制碱法(又称侯氏制碱法)它是我国化学工程专家侯德榜(1890~1974)于1943年创立的。
是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳——合成氨厂用水煤气制取氢气时的废气。

1.3 纯碱的生产一、纯碱的性质纯碱化学名为碳酸钠,分子式Na2CO3,相对分子质量106,系白色单斜体结晶,比重为2.533;熔点为840~852 ℃。
纯碱易溶与水。
在35.4℃是溶解度最大,100克水可以溶解49.7克碳酸钠。
纯碱易吸潮,在空气中吸收水蒸气和二氧化碳而结块,生成重碱:Na2CO3+CO2+H2O = 2NaHCO3纯碱加热至400℃时开始分解,生成氧化钠和二氧化碳:Na2CO3 Na2O+CO2↑纯碱与酸类反应生成盐,并放出二氧化碳: Na2CO3+H2SO4 =Na2SO4+ CO2↑+H2O纯碱与石灰水作用生成氢氧化钠------苛化烧碱的反应:Na2CO3+Ca(OH)2 =2NaOH+CaCO3↓纯碱与盐类起复分解反应-----氯化钠精制反应之一:Na2CO3 + CaSO4 = CaCO3↓+ Na2SO4二、制碱工业的发展远在几千年前,劳动人民就有使用碱的知识,在没有工业方法生产碱以前人们所需要的碱都取自天然碱和草木灰。
至于应用化学方法制取纯碱,还只是近两百年的事情。
1、路步兰法1791年,法国人路步兰成功地研究出以食盐为原料的制碱法,即路步兰法,该发首先用硫酸和食盐制取硫酸钠、石灰石和炭,按100:100:35.5的重量比混合,在反射炉或回转炉内煅烧(950~1000°C),生成熔块(黑灰),再经浸取、蒸发、短少等过程而得到纯碱。
产品中含碳酸钠约为95%左右。
该法的主要化学反应为: H2SO4+2NaCl =Na2SO4+2HClNa2SO4+ CaCO3+2C 高温 Na2CO3+CaS+2CO2制取硫酸钠时产生的氯化氢气体,经水吸收制成或用氧化法制成氯气。
浸取“黑灰”后的废渣,经与二氧化碳作用可得到硫化氢;从硫化氢中可回收硫磺。
路步兰法盛行一时。
但其放的主要生产过程系在固相中进行,并且需要高温,生产不能、连续,原料利用不充分,设备腐蚀严重。
因此,人们除了改进路步兰法之外,又在探索新的制碱方法。

氢氧化钠主要制作方法一、实验室法钠盐与氧化钙反应:可以用一些碳酸氢钠(小苏打)和一些氧化钙(生石灰)(一般的食品包装袋中用来做吸水剂的小袋子中有,例如海苔包装中)。
把生石灰放于水中,反应后变为石灰浆(氢氧化钙溶液、熟石灰),把碳酸氢钠(或碳酸钠)的固体颗粒(浓溶液也行)加入石灰浆中,为保证产物氢氧化钠的纯度,需使石灰浆过量,原因:参考氢氧化钙和碳酸钠的溶解度。
搅拌加快其反应,待其反应一会儿后,静置片刻,随着碳酸钙的沉淀,上层清液就是氢氧化钠溶液,小心倒出即可。
CaO + H₂O ==== Ca(OH)₂Ca(OH)₂+Na₂CO₃ ====CaCO₃↓+2NaOHNaHCO₃+ Ca(OH)₂==== CaCO₃↓+ NaOH + H₂O(推荐)钠与水反应取一块金属钠,擦去表面煤油,刮去表面氧化层,放入盛有水的烧杯中。
反应化学方程式:2Na+2H₂O====2NaOH+H₂↑现象:(浮、熔、游、响)浮:钠浮在水面上;熔:钠熔化成小球;游:钠在水面上游动;响:钠咝咝作响;二、工业法工业上生产烧碱的方法有苛化法和电解法两种。
苛化法按原料不同分为纯碱苛化法和天然碱苛化法;电解法可分为隔膜电解法和离子交换膜法。
纯碱苛化法将纯碱、石灰分别经化碱制成纯碱溶液、化灰制成石灰乳,于99~101℃进行苛化反应,苛化液经澄清、蒸发浓缩至40%以上,制得液体烧碱。
将浓缩液进一步熬浓固化,制得固体烧碱成品。
苛化泥用水洗涤,洗水用于化碱。
Na₂CO₃+Ca(OH)₂→2NaOH+CaCO₃↓天然碱苛化法天然碱经粉碎、溶解(或者碱卤)、澄清后加入石灰乳在95~100℃进行苛化,苛化液经澄清、蒸发浓缩至NaOH浓度46%左右、清液冷却、析盐后进一步熬浓。
制得固体烧碱成品。
苛化泥用水洗涤,洗水用于溶解天然碱。
Na₂CO₃+Ca(OH)2→2NaOH+CaCO₃↓NaHCO₃+Ca(OH)2→NaOH+CaCO₃↓+H2O隔膜电解法将原盐化盐后加入纯碱、烧碱、氯化钡精制剂除去钙、镁、硫酸根离子等杂质,再于澄清槽中加入聚丙烯酸钠或苛化麸皮以加速沉淀,砂滤后加入盐酸中和,盐水经预热后送去电解,电解液经预热、蒸发、分盐、冷却,制得液体烧碱,进一步熬浓即得固体烧碱成品。
工业生产纯碱的化学方程式
纯碱,又称碳酸钠,是一种重要的化工原料,广泛应用于玻璃制造、纺织业、造纸业等各个领域。
工业生产纯碱的化学方程式主要涉及氢氧化钠和二氧化碳的化学反应。
工业生产纯碱的化学方程式如下:
NaOH + CO2 → Na2CO3 + H2O.
在工业生产中,首先通过氯碱法或氨碱法生产氢氧化钠(NaOH),然后将氢氧化钠与二氧化碳(CO2)进行反应,生成碳酸钠(Na2CO3)和水(H2O)。
这个化学方程式反映了碳酸钠的生产过程,是工业生产纯碱的重要步骤之一。
通过这个化学方程式,我们可以清晰地了解纯碱的生产原理,以及氢氧化钠和二氧化碳之间的化学反应过程。
工业生产纯碱的化学方程式的研究和应用,对于提高纯碱的生产效率、降低生产成本具有重要意义,也有助于推动纯碱在各个行
业的广泛应用。
通过不断深入研究和应用,工业生产纯碱的化学方程式将继续发挥重要作用,推动纯碱产业的发展和进步。
氢氧化钠主要制作方法一、实验室法钠盐与氧化钙反应:可以用一些碳酸氢钠(小苏打)和一些氧化钙(生石灰)(一般的食品包装袋中用来做吸水剂的小袋子中有,例如海苔包装中)。
把生石灰放于水中,反应后变为石灰浆(氢氧化钙溶液、熟石灰),把碳酸氢钠(或碳酸钠)的固体颗粒(浓溶液也行)加入石灰浆中,为保证产物氢氧化钠的纯度,需使石灰浆过量,原因:参考氢氧化钙和碳酸钠的溶解度。
搅拌加快其反应,待其反应一会儿后,静置片刻,随着碳酸钙的沉淀,上层清液就是氢氧化钠溶液,小心倒出即可。
CaO + H₂O ==== Ca(OH)₂Ca(OH)₂+Na₂CO₃ ====CaCO₃↓+2NaOHNaHCO₃+ Ca(OH)₂==== CaCO₃↓+ NaOH + H₂O(推荐)钠与水反应取一块金属钠,擦去表面煤油,刮去表面氧化层,放入盛有水的烧杯中。
反应化学方程式:2Na+2H₂O====2NaOH+H₂↑现象:(浮、熔、游、响)浮:钠浮在水面上;熔:钠熔化成小球;游:钠在水面上游动;响:钠咝咝作响;二、工业法工业上生产烧碱的方法有苛化法和电解法两种。
苛化法按原料不同分为纯碱苛化法和天然碱苛化法;电解法可分为隔膜电解法和离子交换膜法。
纯碱苛化法将纯碱、石灰分别经化碱制成纯碱溶液、化灰制成石灰乳,于99~101℃进行苛化反应,苛化液经澄清、蒸发浓缩至40%以上,制得液体烧碱。
将浓缩液进一步熬浓固化,制得固体烧碱成品。
苛化泥用水洗涤,洗水用于化碱。
Na₂CO₃+Ca(OH)₂→2NaOH+CaCO₃↓天然碱苛化法天然碱经粉碎、溶解(或者碱卤)、澄清后加入石灰乳在95~100℃进行苛化,苛化液经澄清、蒸发浓缩至NaOH浓度46%左右、清液冷却、析盐后进一步熬浓。
制得固体烧碱成品。
苛化泥用水洗涤,洗水用于溶解天然碱。
Na₂CO₃+Ca(OH)2→2NaOH+CaCO₃↓NaHCO₃+Ca(OH)2→NaOH+CaCO₃↓+H2O隔膜电解法将原盐化盐后加入纯碱、烧碱、氯化钡精制剂除去钙、镁、硫酸根离子等杂质,再于澄清槽中加入聚丙烯酸钠或苛化麸皮以加速沉淀,砂滤后加入盐酸中和,盐水经预热后送去电解,电解液经预热、蒸发、分盐、冷却,制得液体烧碱,进一步熬浓即得固体烧碱成品。
化学方程式1.镁在空气中燃烧:1.2Mg+O2点燃2MO2现象:发出耀眼的白光,放出热量,生成白色固体.2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O4现象:剧烈燃烧,火星四射,放出热量,生成黑色固体.3.铜在空气中加热:2Cu+O2△2CuO4.铝在空气中缓慢氧化:4Al+3O2====2Al2O35.氢气中空气中燃烧:.2H2+O2点燃2H2O现象:产生淡蓝色火焰,放出热量6.红磷在空气中燃烧:4P+5O2点燃2P2O5现象:放出热量,生成白色固体7.硫粉在空气中燃烧:S+O2点燃SO2现象:产生淡蓝色色火焰,放出热量,生成有刺激性气味的气体.8.碳在氧气中充分燃烧:.C+O2点燃CO29.碳在氧气中不充分燃烧:2C+O2点燃2CO10.汞和氧气反应:2Hg+O22HgO11.一氧化碳在氧气中燃烧:2CO+O2点燃2CO212.甲烷在空气中燃烧: CH4+2O2 点燃2 H2O+CO213.酒精在空气中燃烧.C2H5OH+3O2点燃3 H2O+2CO214.葡萄糖缓慢氧化C6H12O6+6O2酶6 H2O+6CO215.氧化汞受热分解:2HgO△2Hg+O2↑16.用过氧化氢和二氧化锰制氧气:2H2O2MnO22H2O+O2↑17.加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑现象:高锰酸钾为暗紫色,二氧化锰为黑色18.加热氯酸钾和二氧化锰的混合物:2KClO3MnO22KCl+3O 2↑现象:氯酸钾和氯化钾均为白色19.电解水:2H 2O 通电2H 2↑+O 2现象:电极上有气泡产生,与正极相连一端和与负极相连一端产生气体的体积比为1:21.生石灰与水反应:1.CaO+H 2O==Ca(OH)22.二氧化碳溶于水:CO 2+H 2O==H 2CO 33.电解水: 2H 2O 通电2H 2↑+O 2↑4.甲烷在空气中燃烧: CH 4+2O 2 点燃2 H 2O+CO 25.酒精在空气中燃烧:C 2H 5OH+3O 2点燃3 H 2O+2CO 2 6.葡萄糖缓慢氧化:C 6H 12O 6+6O 2酶6 H 2O+6CO 27.氢气中空气中燃烧:2H 2+O 2点燃H 2O 8.氢气还原氧化铜:.H 2+CuO △Cu+H 2O1.石灰水与二氧化碳反应:.Ca(OH)2+CO 2===CaCO 3↓+H 2O2.苛性钠暴露在空气中变质:2NaOH+CO 2==Na 2CO 3+H 2O3.碳与二氧化碳的反应:CO 2+C 高温2CO4.碳酸的分解: H 2CO 3===H 2O+CO 2↑5.实验室制二氧化碳的反应原理:CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑6.碳酸钠与稀盐酸反应:Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑7.碳酸氢钠与稀盐酸反应:NaHCO 3+HCl==NaCl+H 2O+CO 2↑8.高温煅烧石灰石:CaCO 3高温CaO+CO 2↑9.木炭还原氧化铜:9.C+2CuO 高温2Cu+CO 2↑现象: 黑色粉末变红,生成能使澄清石灰水变浑浊的气体.10.焦炭还原氧化铁:.3C+2Fe 2O 3高温4Fe+3CO 2↑现象: 红色粉末变黑,生成能使澄清石灰水变浑浊的气体. 11.一氧化碳还原氧化铜:CO+CuO △Cu+CO 2H 2O CO 2、 CO现象: 黑色粉末变红,生成能使澄清石灰水变浑浊的气体. 12.用赤铁矿炼铁:3CO+Fe 2O 3高温2Fe+3 CO 2↑ 现象: 红色粉末变黑,生成能使澄清石灰水变浑浊的气体.13.一氧化碳在氧气中燃烧:2CO+O 2点燃2CO 21.用盐酸除铁锈: 1. Fe 2O 3+6HCl==2FeCl 3+3H 2O 现象: 红色固体逐渐消失,溶液由无色变为黄色.2.用硫酸除铁锈: Fe 2O 3+3H 2SO 4==Fe 2(SO 4)3+3H 2O 现象: 红色固体逐渐消失,溶液由无色变为黄色 1. 铁在氧气中燃烧:1. 3Fe+2O 2点燃Fe 3O 42.铁和稀硫酸:Fe+H 2SO 4 ==FeSO 4+H 2↑3.铁和稀盐酸: Fe+2HCl==FeCl 2+H 2↑4.铁和硫酸铜溶液: Fe+CuSO 4==FeSO 4+Cu 1.锌和稀硫酸:1.Zn+H 2SO 4==ZnSO 4+H 2↑现象: 有气泡产生.2.铁和稀硫酸: Fe+H 2SO 4 ==FeSO 4+H 2↑ 现象: 有少量气泡产生,溶液由无色变为浅绿色3.镁和稀硫酸: Mg+H 2SO 4==MgSO 4+H 2↑ 现象: 固体逐渐消失,有大量气泡产生,放出热量.4.铝和稀硫酸: 2Al+3H 2SO 4 ==Al 2(SO 4)3+3H 2↑5.锌和稀盐酸: Zn+2HCl==ZnCl 2+H 2↑现象: 有气泡产生.6.铁和稀盐酸: Fe+2HCl==FeCl 2+H 2↑现象: 有少量气泡产生,溶液由无色变为浅绿色. 7.镁和稀盐酸: Mg+2HCl==MgCl 2+H 2↑ Fe 2O 3 Fe 酸现象:固体逐渐消失,有大量气泡产生,放出热量.8.铝和稀盐酸: 2Al+6HCl==2AlCl3+3H2↑9.氧化铁和稀盐酸反应: Fe2O3+6HCl==2FeCl3+3H2O现象:红色固体逐渐消失,溶液由无色变为黄色.10.氧化铁和稀硫酸反应: Fe2O3+3H2SO4==Fe2(SO4)3+3H2O现象:红色固体逐渐消失,溶液由无色变为黄色.11.氧化铜和稀盐酸反应: CuO+2HCl==CuCl2+H2O现象: 黑色固体逐渐消失,溶液由无色变为蓝色.12.氧化铜和稀硫酸反应: CuO+H2SO4==CuSO4+H2O13.盐酸和烧碱反应: NaOH+HCl==NaCl+H2O现象:无现象14.硫酸和烧碱反应: 2NaOH+H2SO4==Na2SO4+2H2O现象:无现象15.氢氧化铝药物治疗胃酸过多: Al(OH)3+3HCl==AlCl3+3H2O16.盐酸和氢氧化钙反应: Ca(OH)2+2HCl==CaCl2+H2O17.硫酸和氢氧化钙反应:Ca(OH)2+H2SO4==CaSO4+2H2O18.大理石和稀盐酸反应: CaCO3+2HCl==CaCl2+H2O+CO2↑现象:有气泡产生19.碳酸钠与稀盐酸反应: Na2CO3+2HCl==2NaCl+H2O+CO2↑现象:有气泡产生20.碳酸钾与稀盐酸反应: .K2CO3+2HCl==2KCl+H2O+CO2↑现象:有气泡产生21.碳酸氢钠与稀盐酸反应: 21.NaHCO3+HCl==NaCl+H2O+CO2↑现象:有气泡产生22.硫酸和氯化钡反应: .H2SO4+BaCl2==2HCl+BaSO4↓现象: 生成白色沉淀23.盐酸和硝酸银反应: AgNO 3+HCl ==AgCl ↓+HNO 3现象: 生成白色沉淀 1.氢氧化钠变质: 1.2NaOH+CO 2==Na 2CO 3+H 2O 2.苛性钠吸收二氧化硫气体: 2NaOH+SO 2==Na 2SO 3+H 2O3.苛性钠与三氧化硫反应: 2NaOH+SO 3==Na 2SO 4+H 2O4.盐酸和烧碱反应: NaOH+HCl==NaCl+H 2O5.硫酸和烧碱反应: 2NaOH+H 2SO 4==Na 2SO 4+2H 2O6.氢氧化铝药物治疗胃酸过多: Al(OH)3+3HCl==AlCl 3+3H 2O7.盐酸和氢氧化钙反应: Ca(OH)2+2HCl==CaCl 2+H 2O8.氢氧化铜和硫酸反应:8.Cu(OH)2+H 2SO 4==CuSO 4+2H 2O 现象: 蓝色固体逐渐消失,溶液由无色变为蓝色.9.氢氧化钙与碳酸钠反应: Ca(OH)2+Na 2CO 3==CaCO 3↓+2NaOH 现象: 生成白色沉淀10.硫酸铜溶液和氢氧化钠溶液反应: CuSO 4+2NaOH==Cu(OH)2↓+Na 2SO 4 现象: 生成蓝色沉淀11.氯化铁溶液和氢氧化钠溶液: FeCl 3+3NaOH==Fe(OH)3↓+3NaCl 现象: 生成红褐色沉淀1.锌和硫酸铜溶液: 1.CuSO 4+Zn==ZnSO 4+Cu 现象: 生成红色固体,溶液由蓝色变为无色.2.铜和硝酸银溶液: Hg(NO 3)2+Cu==Cu(NO 3)2+Hg 现象: 生成 银白色固体,溶液由无色变为蓝色3.铝和硫酸铜溶液: 2Al+3CuSO 4 ==Al 2(SO 4)3+3Cu 现象: 生成红色固体,溶液由蓝色变为无色.4.碳酸钠与稀盐酸反应: Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑ 碱盐现象:有气泡生成5.用纯碱制烧碱: Ca(OH)2+Na2CO3==CaCO3↓+2NaOH现象:生成白色沉淀6.氯化钙溶液和碳酸钠溶液: Na2CO3+CaCl2==2NaCl+CaCO3↓现象:生成白色沉淀.。
化学方程式最重要化学方程式一.物质制取:1.高锰酸钾制氧气2KMnO4△K2MnO4+MnO2+O2↑2.过氧化氢制氧气 .2H2O2MnO22H2O+O2↑3.CO2实验室制法:CaCO3+2HCl==CaCl2+H2O+CO2↑4. 氢气实验室制法:Zn+H2SO4=ZnSO4+H2↑5.炼铁:3CO+Fe2O3高温2Fe+3CO26.纯碱制烧碱:Na2CO3+ Ca(OH)2 ==CaCO3↓+2NaOH二.物质性质(一)酸7.稀盐酸除铁锈:Fe2O3+6HCl==2FeCl3+3H2O8.盐酸中和氢氧化钙:2HCl+Ca(OH)2===CaCl2+2H2O9.盐酸检验碳酸盐:Na2CO3+2HCl===2NaCl+H2O+CO2↑(二)碱10.烧碱在空气中变质:2NaOH+CO2==Na2CO3+H2O11.氢氧化钙与硫酸铜(波尔多液):Ca(OH)2+CuSO4==Cu(OH)2↓+CaSO4(三)盐12.铁和硫酸铜溶液反应:Fe+CuSO4===FeSO4+Cu 三.石灰三角(Ca三角):13.高温煅烧石灰石:CaCO3高温CaO+CO2↑14.生石灰和水:CaO+H2O==Ca(OH)2 15.熟石灰和二氧化碳:Ca(OH)2+CO2==CaCO3↓+H2O重要化学方程式一.化合反应:1.镁燃烧:2Mg+O2点燃2MgO2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O43.铜在空气中受热:2Cu+O2△2CuO4.铝氧化:4Al+3O2==2Al2O35.氢气燃烧:2H2+O2点燃2H2O6.红磷燃烧:4P+5O2点燃2P2O57.硫粉燃烧:S+O2点燃SO28.碳充分燃烧:C+O2点燃CO29.碳不充分燃烧:2C+O2不完全燃烧2CO 10.一氧化碳燃烧:2CO+O2点燃2CO2 11.二氧化碳和水:CO2+H2O==H2CO3 12.生石灰和水:CaO+H2O==Ca(OH)2二.分解反应:13.加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑14.过氧化氢催化 .2H2O2MnO22H2O+O2↑15.电解水2H2O通电2H2↑+O2↑16.碳酸不稳定分解:H2CO3△H2O+CO2↑17.煅烧石灰石:CaCO3高温CaO+CO2↑三.置换反应18.锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑19.铁和稀硫酸Fe+H2SO4=FeSO4+H2↑20.铁和稀盐酸Fe+2HCl===FeCl2+H2↑21.铁和硫酸铜溶液反应:Fe+CuSO4===FeSO4+CuCaOCa(OH)2CaCO322.铜和硝酸银溶液反应:Cu+2AgNO3==2Ag +Cu(NO3)2四.复分解反应反应23.氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O24.氧化铁和稀硫酸反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O25.氧化铜和稀硫酸反应:CuO+H2SO4====CuSO4+H2O26.盐酸和氢氧化钠起反应:HCl+NaOH==NaCl+H2O27.盐酸和氢氧化钙反应:2HCl+Ca(OH)2===CaCl2+2H2O28.大理石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑29.碳酸钠与稀盐酸反应:Na2CO3+2HCl===2NaCl+H2O+CO2↑30.盐酸和硝酸银溶液反应:HCl+AgNO3===AgCl↓+HNO331.硫酸和氯化钡溶液反应:H2SO4+BaCl2===BaSO4↓+2HCl32.氢氧化钠(烧碱、火碱、苛性钠)与硫酸铜2NaOH+CuSO4==Cu(OH)2↓+Na2SO433.氢氧化钙与硫酸铜(波尔多液):Ca(OH)2+CuSO4==Cu(OH)2↓+CaSO434.氢氧化钙与碳酸钠(纯碱制烧碱):Na2CO3+ Ca(OH)2 ==CaCO3↓+2NaOH五.金属冶炼:35.氢气和氧化铜:H2+CuO△Cu+H2O36.木炭还原氧化铜:C+2CuO高温2Cu+CO2↑37.氧化铁炼铁:3CO+Fe2O3高温2Fe+3CO2五.其它反应:38.甲烷燃烧:CH4+2O2点燃CO2+2H2O39.烧碱在空气中变质:2NaOH+CO2==Na2CO3+H2O40.熟石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓+H2O初中化学方程式总汇一.化合反应:(1)单质与氧气的反应:1.镁在空气中燃烧:2Mg+O2点燃2MgO2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O43.铜在空气中受热:2Cu+O2△2CuO4.铝氧化:4Al+3O2==2Al2O35.氢气中空气中燃烧:2H2+O2点燃2H2O6.红磷在空气中燃烧:4P+5O2点燃2P2O57.硫粉在空气中燃烧:S+O2点燃SO28.碳在氧气中充分燃烧:C+O2点燃CO29.碳在氧气中不充分燃烧:2C+O2不完全燃烧2CO (2)化合物与氧气的反应:10.一氧化碳燃烧:2CO+O2点燃2CO211.二氧化硫和氧气:2SO2+O2催化剂2SO3(3)化合物和水反应:12.二氧化碳溶解于水:CO2+H2O==H2CO3 13.生石灰溶于水:CaO+H2O==Ca(OH)2 14.氧化钠溶于水:Na2O+H2O==2NaOH 15.二氧化硫溶于水生成亚硫酸:SO2+H2O==H2SO316.三氧化硫溶于水:SO3+H2O==H2SO4二.分解反应:17.加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑18.过氧化氢分解 .2H2O2MnO22H2O+O2↑19.电解水2H2O通电2H2↑+O2↑20.加热氯酸钾和二氧化锰:2KClO3△ MnO2 2KCl+3O2↑21.加热碱式碳酸铜:Cu2(OH)2CO3△2CuO+H2O+CO2↑22.碳酸氢铵分解NH4HCO3△NH3↑+H2O+CO2↑23.碳酸不稳定而分解:H2CO3△H2O+CO2↑24.高温煅烧石灰石:CaCO3高温CaO+CO2↑三.置换反应条件:取决于活动性顺序(1)金属单质+酸----盐+氢气25.锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑26.铁和稀硫酸Fe+H2SO4=FeSO4+H2↑27.镁和稀硫酸Mg+H2SO4=MgSO4+H2↑28.锌和稀盐酸Zn+2HCl===ZnCl2+H2↑29.铁和稀盐酸Fe+2HCl===FeCl2+H2↑30.镁和稀盐酸Mg+2HCl==MgCl2+H2↑31.铝和稀盐酸2Al+6HCl=2AlCl3+3H2↑(2)金属单质+盐(溶液)---另一种金属+另一种盐32.铁和硫酸铜溶液反应:Fe+CuSO4===FeSO4+Cu33.锌和硫酸铜溶液反应:Zn+CuSO4===ZnSO4+Cu34.铜和硝酸银溶液反应:Cu+2AgNO3==2Ag +Cu(NO3)2四.复分解反应反应反应条件:必须生成气体或水或沉淀(1)金属氧化物+酸-----盐+水35.氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O36.氧化铁和稀硫酸反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O37.氧化铁和硝酸反应:Fe2O3+6HNO3=2Fe (NO3)3+3H2O38.氧化铜和稀盐酸反应:CuO+2HCl====CuCl2+H2O39.氧化铜和稀硫酸反应:CuO+H2SO4====CuSO4+H2O(2)酸+碱------盐+水(中和反应)40.盐酸和氢氧化钠起反应:HCl+NaOH==NaCl+H2O41.盐酸和氢氧化钾起反应:HCl+KOH===KCl+H2O42.盐酸和氢氧化铜反应:2HCl+Cu(OH)2===CuCl2+2H2O43.盐酸和氢氧化钙反应:2HCl+Ca(OH)2===CaCl2+2H2O44.盐酸和氢氧化铁反应:3HCl+Fe(OH)3====FeCl3+3H2O45.氢氧化铝药物治疗胃酸(盐酸)过多:3HCl+Al(OH)3====AlCl3+3H2O46.硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O47.硫酸和氢氧化铜反应:H2SO4+Cu(OH)2=CuSO4+2H2O48.硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3====Fe2(SO4)3+6H2O(3)酸+盐----另一种酸+另一种盐49.大理石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑50.碳酸钠与稀盐酸反应:Na2CO3+2HCl===2NaCl+H2O+CO2↑51.盐酸和硝酸银溶液反应:HCl+AgNO3===AgCl↓+HNO352.硫酸和碳酸钠反应:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑53.硫酸和氯化钡溶液反应:H2SO4+BaCl2===BaSO4↓+2HCl(4)碱+盐---另一种碱+另一种盐54.氢氧化钠(俗称烧碱、火碱、苛性钠)与硫酸铜反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO455.氢氧化钠与氯化铁:3NaOH+FeCl3===Fe(OH)3↓+3NaCl56.氢氧化钙与硫酸铜(波尔多液):Ca(OH)2+CuSO4==Cu(OH)2↓+CaSO457.氢氧化钙与碳酸钠(纯碱制烧碱):Na2CO3+ Ca(OH)2 ==CaCO3↓+2NaOH58.硫酸铵和氢氧化钠反应:(NH4)2SO4+2NaOH===Na2SO4+2H2O+2NH3↑59.硝酸铵和氢氧化钠反应:NH4NO3+NaOH===NaNO4+H2O+NH3↑(5)盐+盐-----两种新盐60.氯化钠溶液和硝酸银溶液:NaCl+AgNO3====AgCl↓+NaNO361.硫酸钠和氯化钡:Na2SO4+BaCl2====BaSO4↓+2NaCl五.金属冶炼62.氢气还原氧化铜:H2+CuO△Cu+H2O63.炭还原氧化铜:C+2CuO高温2Cu+CO2↑64.焦炭还原氧化铁:C+2Fe2O3高温4Fe+3CO2↑65.焦炭还原四氧化三铁:2C+Fe3O4高温3Fe+2CO2↑66.一氧化碳还原氧化铜:CO+CuO△Cu+CO267.一氧化碳还原氧化铁:3CO+Fe2O3高温2Fe+3CO268.一氧化碳还原四氧化三铁:4CO+Fe3O4高温3Fe+4CO2五.其它反应:(1)有机物的反应69.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O70.酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O71.呼吸作用:C6H12O6+6O26CO2+6H2O72.光合作用:6CO2+6H2O叶绿素光照C6H12O6+6O2(2)非金属氧化物+碱----盐+水(参考1—3化合物和水的反应)73.烧碱暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O74.苛性钠吸收三氧化硫气体:2NaOH+SO3====Na2SO4+H2O75.熟石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓+H2O76.消石灰吸收二氧化硫:Ca(OH)2+SO2===CaSO3+H2O77.苛性钠吸收二氧化硫气体:2NaOH+SO2===Na2SO3+H2O。
纯碱制烧碱的化学方程式
纯碱制烧碱的化学方程式
烧碱是一种重要的化工原料,广泛应用于玻璃、纺织、皮革、橡胶、电子、化肥等众多工业领域。
而烧碱的生产则有多种方法,其中纯碱制烧碱是最为常
见的一种。
下面,我们就来详细介绍一下纯碱制烧碱的化学方程式。
纯碱制烧碱的原理
纯碱制烧碱是通过氢氧化钠在高温下分解发生碳化反应,生成氧化钠和一
氧化碳,再通过氧气氧化生成氧化钙,最终与水反应生成烧碱。
纯碱制烧碱的化学方程式
纯碱制烧碱的化学反应方程式如下:
2NaOH → Na2CO3 + H2
2Na2CO3 + O2 → 2Na2O + 2CO2
Na2O + H2O → 2NaOH
这个方程式可以分成三个步骤:
第一个步骤:氢氧化钠分解
在300℃~400℃的温度下,氢氧化钠会发生碳化反应,生成氧化钠和一氧化碳。
2NaOH → Na2CO3 + H2
第二个步骤:氧化钠还原
产生的氧化钠和氧气在高温下反应,生成二氧化碳和氧化钙。
2Na2CO3 + O2 → 2Na2O + 2CO2
第三个步骤:氧化钙水解
氧化钙会与水反应生成氢氧化钠,最终得到烧碱。
Na2O + H2O → 2NaOH
这三个步骤就是纯碱制烧碱的化学反应过程。
在实际生产中,还需要考虑
到反应温度、反应时间、反应压力等因素的控制,才能保证生产出高质量的烧碱。
总结
纯碱制烧碱是一种重要的生产技术,其化学反应方程式为2NaOH →
Na2CO3 + H2,2Na2CO3 + O2 → 2Na2O + 2CO2,Na2O + H2O → 2NaOH。
这个方程式可以分为三个步骤,分别是氢氧化钠分解、氧化钠还原和氧化钙水解。
在实际生产中,需要控制多个因素,才能得到高质量的烧碱。