erbB-2_酪氨酸激酶(TK)受体__Apexbio
- 格式:pdf
- 大小:448.45 KB
- 文档页数:2

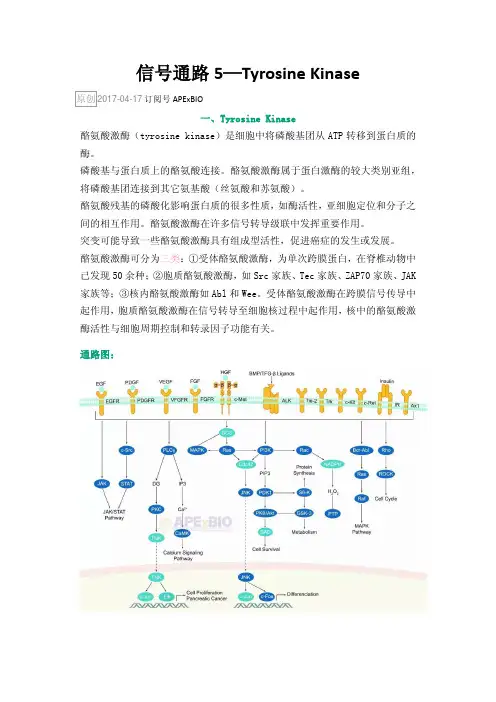
信号通路5—Tyrosine KinaseAPExBIO一、Tyrosine Kinase酪氨酸激酶(tyrosine kinase)是细胞中将磷酸基团从ATP转移到蛋白质的酶。
磷酸基与蛋白质上的酪氨酸连接。
酪氨酸激酶属于蛋白激酶的较大类别亚组,将磷酸基团连接到其它氨基酸(丝氨酸和苏氨酸)。
酪氨酸残基的磷酸化影响蛋白质的很多性质,如酶活性,亚细胞定位和分子之间的相互作用。
酪氨酸激酶在许多信号转导级联中发挥重要作用。
突变可能导致一些酪氨酸激酶具有组成型活性,促进癌症的发生或发展。
酪氨酸激酶可分为三类:①受体酪氨酸激酶,为单次跨膜蛋白,在脊椎动物中已发现50余种;②胞质酪氨酸激酶,如Src家族、Tec家族、ZAP70家族、JAK 家族等;③核内酪氨酸激酶如Abl和Wee。
受体酪氨酸激酶在跨膜信号传导中起作用,胞质酪氨酸激酶在信号转导至细胞核过程中起作用,核中的酪氨酸激酶活性与细胞周期控制和转录因子功能有关。
通路图:二、相关蛋白或基因1. Bcl-AblBcl-Abl是组成型激活的嵌合酪氨酸激酶。
Bcr-Abl酪氨酸激酶失活导致慢性粒细胞白血病(CML)。
Bcr-Abl酪氨酸激酶抑制剂用于大多数CML患者的一线治疗。
2. GSK-3Glycogen synthase kinase 3,糖原合成酶激酶3。
GSK-3是一种丝氨酸/苏氨酸激酶,主要作用是使糖原合成酶发生磷酸化而失活。
GSK-3基因家族包括GSK-3α和 GSK-3β。
胰岛素引起的Akt激活,上皮生长因子、血小板衍化生长因子等引起的Ras/Raf/ERK/p90Rsk1激活以及p90Rsk、P70S6K均能引起GSK-3α和 GSK-3β磷酸化使其失去活性,参与调节多种疾病的生理过程,包括II型糖尿病,阿尔茨海默病,炎症,癌症和双相情感障碍。
3. SykSpleen tyrosine kinase,脾脏酪氨酸激酶。
Syk是非受体细胞质酪氨酸激酶家族,在各种细胞表面受体(包括CD74,Fc受体和整合素)信号传导中起作用。

肿瘤治疗中的靶向药物类别介绍引言:在肿瘤治疗领域,传统的治疗方法如化疗和放疗,虽然在某些情况下可以取得一定的疗效,但是却常常伴随着严重的副作用和不良反应。
近年来,随着对肿瘤发展及分子机制的研究逐渐深入,靶向药物作为一种新的治疗策略被广泛应用。
本文将介绍肿瘤治疗中的靶向药物的几类重要代表。
一、酪氨酸激酶抑制剂酪氨酸激酶抑制剂是一类通过靶向酪氨酸激酶(TK)来干扰癌细胞信号传导途径的药物。
这些药物通过抑制TK酶的活性,阻断了细胞内的异常信号传递,从而抑制癌细胞的生长和分裂。
其中最知名的代表是HER2激酶抑制剂,可用于HER2阳性乳腺癌治疗,如曲妥珠单抗(trastuzumab)和拉普替尼(lapatinib)。
二、激酶抑制剂激酶抑制剂是一类抑制肿瘤细胞内的某些激酶活性的药物。
这些激酶在细胞内起到调控细胞生长和分裂的作用,因此通过抑制它们的活性可以抑制肿瘤细胞的生长和扩散。
激酶抑制剂常用于治疗慢性骨髓性白血病、结直肠癌等多种肿瘤。
常见的激酶抑制剂有伊马替尼(imatinib)、替尼泊坦(dasatinib)、格列卫(gefitinib)等。
三、抗血管生成剂抗血管生成剂是一类通过阻断肿瘤血管新生来抑制肿瘤生长和转移的药物。
这些药物作用于肿瘤细胞周围的血管内皮细胞,抑制血管生成因子的信号传导,从而减少肿瘤细胞的血液供应。
通过降低肿瘤血液供应,抗血管生成剂可以阻断肿瘤的营养供应,进而导致肿瘤细胞的死亡。
代表性的抗血管生成剂有贝伐珠单抗(bevacizumab)和索拉非尼(sorafenib)。
四、免疫检查点抑制剂免疫检查点抑制剂是一类可以增强免疫系统对肿瘤的识别和攻击能力的药物。
肿瘤细胞常常通过与免疫细胞表面的检查点分子结合,从而逃避免疫系统的攻击。
免疫检查点抑制剂能够阻断这种结合,恢复免疫细胞对肿瘤的识别和攻击能力,从而加强抗肿瘤免疫反应。
免疫检查点抑制剂在治疗多种恶性肿瘤中取得了显著的疗效,如PD-1抑制剂(如乌班替尼umbn)、CTLA-4抑制剂(如伊皮利慢)等。

胃癌组织中EGFR、C—erbB-2、TopoIIα及P—gP的表达及意义胃癌是由于胃黏膜上皮细胞发生癌变而引起的恶性肿瘤,其发病率在全球范围内仍居高位。
EGFR(表皮生长因子受体)和C—erbB-2(人类表皮生长因子受体2)是胃癌中常见的两种受体酪氨酸激酶,与肿瘤细胞的增殖、分化、转移等过程密切相关。
TopoIIα(DNA拓扑异构酶IIα)是DNA合成过程中一个重要的酶,在胃癌的预后及化疗中具有重要作用。
P—gP(耐药蛋白)是胃癌细胞中的一种多药耐受性蛋白,在胃癌化学治疗中也具有重要的作用。
EGFR和C—erbB-2的表达过量与胃癌的发生和转移密切相关。
胃肠道黏膜上皮细胞发生癌变后,EGFR和C—erbB-2的表达水平均明显升高。
这种表达过量可以通过各种机制促进胃癌的增殖、分化、抗凋亡和转移。
因此,EGFR和C—erbB-2不仅是胃癌发生的重要标志物,还是胃癌治疗及预后评估的重要指标。
TopoIIα是DNA合成的一个必需酶,它能够通过拓扑结构来维护DNA链的稳定性。
近年来的研究表明,胃癌中TopoIIα的表达与化疗的无效性和耐药性密切相关。
当TopoIIα表达增加时,化疗药物在胃癌细胞中的DNA结构改变效果也会增强。
因此,TopoIIα可作为化疗效果的预警指标,以及制定胃癌化疗方案的重要依据。
P—gP是一种多药耐受性蛋白,在胃癌化学治疗中具有极其重要的作用。
P—gP的表达会导致化疗药物在肿瘤细胞内逐渐被排斥。
同时,P—gP表达水平的高低也与胃癌的化疗敏感性密切相关。
因此,通过检测P—gP的表达水平,可以更好地预测胃癌在化疗中的反应,并为化疗提供更有效的治疗方案。
在胃癌的诊治中,EGFR、C—erbB-2、TopoIIα和P—gP的表达水平均对治疗效果及预后起着至关重要的作用。
了解这些因子在胃癌发生、发展及治疗过程中的作用,可以帮助医生更好地评估病情、制订更合理的治疗方案,从而更好地提高胃癌治疗的成功率。

蛋白酪氨酸激酶综述目前至少已有近六十种分属20个家族的受体酪氨酸激酶被子识别。
所有受体酷氨酸激酶都属于I型膜蛋白,其分子具有相似的拓朴结构:糖基化的胞外配体结合区,疏水的单次跨膜区,以及胞内的酪氨酸激酶催化结构域及调控序列。
不同受体酪氨酸激酶结合,将导致受体发生三聚化,并进一步使受体胞内区特异的受体酪氨酸残基发生自身磷酸化或交叉磷酸化,从而激活下游的信号转导通路。
许多肿瘤的发生、发展都与酪氨酸激酶的异常表达有着极其密切的联系,下面将对几类与肿瘤的发生发展最为密切的受体酪氨酸激酶的研究迸展做一简介。
一、表皮生长因子受体(Epidermal grovth factor receptor, EGFR)家族EGFRPE包括EGFR、ErbB2、ErbB4等4个成员,其家族受体酪氨酸激酶(RTK)以单体形式存在,在结构上由胞外区、跨膜区、胞内区3个部分组成,胞外区具有2个半氨酸丰富区,胞内区有典型的ATP结合位点和酪氨酸激酶区,其酪氨酸激酶活性在调节细胞增殖及分化中起着至关重要的作用。
人的egfr基因定位于第7号染色体的短臂(7p12.3-p12.1),它编码的产物EGFR由1210个氨基酸组成,蛋白分子量约为170kDa,其中,712-979位属于酪氨酸激酶区。
EGFR的专一配体有EGF、TGF、amphiregulin,与其他EGFR家庭成员共有的配体有(cellulin(BTC)、heparin-bindingEGF(HB-EGF)、Epiregulin(EPR) )等。
EGFR在许多上皮业源的肿瘤细胞中表达,如非小细胞性肺癌,乳腺癌、头颈癌,膀胱癌,胃癌,前列腺癌,卵巢癌、胶质细胞瘤等。
另外,在一些肿瘤如恶性胶质瘤、非小细胞性肺癌、乳腺癌、儿童胶质瘤、成神经管细胞瘤及卵巢癌等中还可检测到EGFR缺失。
最为常见的EGFR缺失突变型是EGFRⅧ,EGFR Ⅷ失去了配体结合区,但是可自身活化酪氨酸激酶,刺激下游信号通路的激活,而不依赖于与其配全结合。

受体酪氨酸激酶分类引言:受体酪氨酸激酶是一类重要的酶,广泛存在于细胞膜上,参与多种细胞信号转导过程。
根据其结构和功能的差异,受体酪氨酸激酶可以分为多个亚型,每个亚型都具有特定的生物学功能。
一、RTK(Receptor Tyrosine Kinase)RTK又称受体酪氨酸激酶,是一类跨膜蛋白,具有双重功能,既是受体分子,又是酪氨酸激酶。
RTK的活性状态能够受到配体结合的调控,进而激活下游信号通路。
RTK在生物体内广泛分布,参与了细胞增殖、分化、存活等多种生理过程。
二、Cytokine Receptor(细胞因子受体)细胞因子受体也是一类受体酪氨酸激酶,其结构与RTK类似,都具有酪氨酸激酶活性。
不同之处在于,细胞因子受体的配体是细胞因子家族中的成员,如肿瘤坏死因子(TNF)家族、白细胞介素(IL)家族等。
细胞因子受体通过配体的结合激活酪氨酸激酶活性,进而传递细胞信号。
三、Non-Receptor Tyrosine Kinase(非受体酪氨酸激酶)与RTK和细胞因子受体不同,非受体酪氨酸激酶没有受体分子的结构,但具有酪氨酸激酶活性。
非受体酪氨酸激酶广泛存在于细胞内质网、线粒体、细胞骨架等细胞结构中,参与细胞信号传导、细胞凋亡、细胞增殖等生物学过程。
四、Receptor-like Tyrosine Phosphatase(受体样酪氨酸磷酸酶)受体样酪氨酸磷酸酶是一类具有酪氨酸磷酸酶活性的受体酪氨酸激酶。
与前面几类受体酪氨酸激酶不同的是,受体样酪氨酸磷酸酶主要通过去磷酸化的方式调节细胞信号转导。
受体样酪氨酸磷酸酶在细胞凋亡、细胞黏附、细胞增殖等过程中发挥重要作用。
五、Dual-specificity Kinase(双特异性激酶)双特异性激酶是一类既能磷酸化酪氨酸,又能磷酸化丝氨酸或苏氨酸的酶。
与其他受体酪氨酸激酶不同,双特异性激酶的底物不仅仅限于酪氨酸,还可以磷酸化其他氨基酸,从而调控多种细胞信号通路。
六、Atypical Tyrosine Kinase(非典型酪氨酸激酶)非典型酪氨酸激酶是一类与传统酪氨酸激酶结构和功能差异较大的酶。

【肺癌进展报告2021】靶向耐药并非穷途末路!EGFR-TKI耐药应对策略大盘点靶向治疗的出现,给肺癌治疗领域带来重大突破。
表皮生长因子受体(EGFR)突变是非小细胞肺癌(NSCLC)患者最常见的突变,靶向EGFR的小分子酪氨酸激酶抑制剂(TKIs)是这部分患者的首选治疗。
令人遗憾的是,无论是一代和二代EGFR-TKIs,还是三代EGFR-TKI,用的时间久了,多数病人不可避免地会发生耐药。
不过,靶向耐药并非穷途末路!EGFR-TKI耐药的机制是什么?一旦发生耐药,该如何应对?下文将一一为大家盘点。
一、EGFR突变以及次第涌现的三代EGFR-TKI▲▲▲EGFR属于酪氨酸激酶型受体,在哺乳动物的正常组织广泛中表达。
在正常细胞中,EGFR受体和配体结合,信号通路激活,促使细胞生长、增殖,但完成使命后就会收到指令立即关闭。
当EGFR发生突变时,受体不再需要服从其它信号的控制,自己不停地发出信息,让细胞不受控制地拼命生长,正常细胞就变成了癌细胞。
EGFR突变是NSCLC患者最常见的驱动基因改变,高达50%的东亚NSCLC患者可观察到EGFR突变,女性、从未吸烟者或曾经少量吸烟者发生率较高。
EGFR突变主要是指EGFR第18~21外显子上酪氨酸激酶区域的突变,其中第19号外显子的非移码缺失突变和21号外显子的L858R 错意突变为常见突变,约占到EGFR突变的85%~90%,其余的10%~15%的突变则称之为罕见突变,包括G719X、L861Q、S768I 及20外显子插入突变。
EGFR-酪氨酸激酶抑制剂(EGFR-TKI)主要通过与EGFR酪氨酸激酶区域的三磷酸腺苷(ATP)竞争性结合,从而阻断EGFR信号通路的传递。
根据药物结合特点和作用位点不同,分为第一代、第二代和第三代EGFR-TKI。
第一代EGFR-TKI可逆性地抑制EGFR的酪氨酸激酶活性,代表性药物为吉非替尼、厄洛替尼和埃克替尼。
第二代EGFR-TKI不可逆地抑制EGFR的酪氨酸激酶活性,同时对ERBB家族的其它成员产生抑制作用,代表性药物为达克替尼和阿法替尼。


酪氨酸激酶抑制剂(TKI)酪氨酸激酶抑制剂(Tyrosine Kinase Inhibitors,简称TKI)是一类抑制酪氨酸激酶活性的药物。
酪氨酸激酶是一类在细胞内发挥关键调节作用的酶,其中包括多个重要信号通路的调控酶。
TKI被广泛应用于癌症治疗中,因其能够阻断癌症细胞中异常活跃的酪氨酸激酶活性,抑制肿瘤生长和扩散。
工作原理TKI通过与酪氨酸激酶结合,阻断其活性,从而抑制细胞内重要信号通路的异常激活。
酪氨酸激酶的异常活跃在多种癌症中普遍存在,促进了肿瘤生长和转移。
TKI属于靶向治疗药物,通过选择性阻断癌症细胞特异的靶点酪氨酸激酶,可以降低对健康细胞的毒性。
应用领域慢性髓性白血病(CML)慢性髓性白血病是一种造血干细胞恶性克隆性疾病,常伴有BCR-ABL融合基因的异常表达。
Imatinib是一种经典的TKI,通过特异性抑制BCR-ABL激酶活性,成功治疗了大部分CML患者。
除了Imatinib,还有多种新一代TKI药物如Nilotinib和Dasatinib等,对于CML耐药或无效的患者,这些药物可以是有效的替代品。
肺癌肺癌是最常见的恶性肿瘤之一。
EGFR(表皮生长因子受体)是肺癌中普遍过表达的靶点,EGFR-TKI(EGFR酪氨酸激酶抑制剂)因此成为治疗非小细胞肺癌的重要药物。
目前已经有多种EGFR-TKI药物如Gefitinib、Erlotinib和Osimertinib被批准上市,并取得了良好的临床效果。
结肠癌结肠癌是消化道最常见的恶性肿瘤之一。
RAS/RAF/MEK/ERK信号通路在结肠癌中扮演重要角色,其中RAS突变较为普遍。
Sorafenib和Regorafenib是靶向该信号通路的多激酶抑制剂,通过抑制细胞增殖和血管生成等途径,发挥抗肿瘤作用。
这些药物在治疗转移性结肠癌患者中展现了一定的疗效。
副作用和注意事项虽然TKI药物在肿瘤治疗中有很好的疗效,但也存在一定的副作用和注意事项。
常见的副作用包括恶心、呕吐、腹泻、皮疹、疲劳等。

酪氨酸激酶信号通路在肿瘤细胞中的作用肿瘤是现代人类面临的严重疾病之一,其基本特征是恶性细胞的非受控生长。
肿瘤生长的复杂过程涉及许多基因、通路和信号网络的调控。
酪氨酸激酶信号通路是一种重要的信号转导通路,参与了肿瘤的形成和发展。
本文将详细讨论酪氨酸激酶信号通路在肿瘤细胞中的作用。
一、酪氨酸激酶信号通路的基本概念酪氨酸激酶(Tyrosine Kinase,TK)是一种能够磷酸化靶蛋白上的酪氨酸残基的酶。
酪氨酸激酶可分为受体型酪氨酸激酶(RTK)和非受体型酪氨酸激酶(非RTK)。
其中,RTK主要是一种跨膜受体,能够接受外界的信号并传递给细胞内。
酪氨酸激酶信号通路是由受体激活后形成的信号途径,主要包含激酶自激、受体激酶磷酸化、激酶磷酸化底物等环节。
二、1.促进肿瘤细胞增殖和转移酪氨酸激酶信号通路在肿瘤细胞中的作用主要是通过促进增殖和转移来参与肿瘤的发展。
例如,在胃癌细胞中,HGF激活c-Met受体酪氨酸激酶,进而活化肿瘤相关信号转导通路,促进了癌细胞的生长、迁移和侵袭。
另外,许多癌细胞表达高水平的EGFR、HER2和IGF-1R等受体酪氨酸激酶,该通路也会在肿瘤包括乳腺癌、肝癌和胶质母细胞瘤等不同类型癌细胞中发挥作用。
2.参与癌细胞治疗抗性现代肿瘤治疗模式中,常常采用放疗和化疗等综合措施,以达到肿瘤细胞死亡或生长停滞的效果。
然而,一些肿瘤细胞会经过适应性演化,从而获得了对治疗的抗性。
酪氨酸激酶信号通路在癌细胞的抗肿瘤治疗过程中也发挥了重要作用。
例如,在结直肠癌中,KRAS 处于活跃状态的细胞通常会表现出抗放疗和化疗的特性。
该通路还能够介导HER2阳性乳腺癌的暴露性治疗抗性。
三、酪氨酸激酶信号通路的抑制剂在肿瘤治疗中的应用由于酪氨酸激酶信号通路在肿瘤细胞中的作用日益凸显,因此阻断该通路的抑制剂被广泛应用于癌细胞的治疗。
与传统的化疗治疗不同,抑制剂是具有针对性的分子药物,不仅具有治疗效果,而且能够降低治疗的毒副作用。

ErbB家族受体激活途径异常与癌细胞增殖相关因素挖掘癌症是一种严重威胁人类健康的疾病,其特征之一是恶性细胞的不受控制的增殖。
许多研究表明,ErbB家族受体激活途径的异常与癌细胞增殖密切相关。
因此,挖掘与这一激活途径相关的因素对于深入理解癌细胞增殖机制,以及寻找新的抗癌药物靶点具有重要意义。
ErbB家族受体包括ErbB1(也称为EGFR)、ErbB2、ErbB3和ErbB4,它们是一类具有酪氨酸激酶活性的受体酪氨酸激酶。
这些受体在正常的细胞生长和分化过程中发挥重要作用,但在某些情况下,它们的激活途径异常导致了癌细胞的不受控制增殖,促进了肿瘤的形成和进展。
一种可能导致ErbB家族受体激活途径异常的因素是突变。
许多研究发现,ErbB家族受体在癌症中常常存在突变,这些突变可以增加其活性,使其持续受到激活,从而推动癌细胞的增殖。
例如,EGFR的突变可以引发肺癌的发生和进展,HER2(一种ErbB2家族成员)的过表达与乳腺癌的恶性程度密切相关。
此外,表观遗传学修饰也是ErbB家族受体激活途径异常的常见原因之一。
表观遗传学修饰是指染色质DNA结构和功能的可逆调控,通过DNA甲基化、组蛋白乙酰化、组蛋白甲基化等修饰方式来调控基因的表达水平。
研究发现,一些表观遗传学修饰酶的过度表达或突变与ErbB家族受体异常的激活途径以及癌细胞的增殖有关。
例如,DNA甲基转移酶DNMT1的过度表达可以导致EGFR基因启动子区域的甲基化增加,从而导致EGFR的异常激活,促进乳腺癌细胞的增殖。
细胞外生长因子和细胞外基质(ECM)成分也可以影响ErbB家族受体激活途径的正常调控。
细胞外生长因子如EGF、FGF等能够结合ErbB家族受体并激活其酪氨酸激酶活性。
ECM成分如透明质酸、纤维连接蛋白等能够与ErbB家族受体及其配体发生相互作用,影响其激活途径。
研究表明,癌细胞依赖于ECM成分的异常沉积和生长因子的过度刺激来维持其异常的ErbB家族受体激活状态,从而促进癌细胞的增殖。
受体酪氨酸激酶的7个亚族受体酪氨酸激酶是一类重要的膜受体激酶,参与多种生理和病理过程,包括细胞增殖、分化、细胞迁移、代谢调控等。
根据其结构和功能的差异,受体酪氨酸激酶可以分为7个亚族,分别是:EGFR/ErbB、Eph、FGFR、IGF1R/INSR、PDGFR、VEGFR和c-Met。
下面将对这7个亚族的特点和重要作用进行介绍。
第一亚族:EGFR/ErbBEGFR(表皮生长因子受体)或ErB-1是表皮生长因子家族的成员,它是一种单链膜蛋白,只有普通外显子产生的异二聚体是其活性形式。
EGFR通过细胞外的配体结合和跨膜结构域的酪氨酸激酶活性而被激活。
EGFR在多种人类癌症中高度表达,对于肿瘤细胞生长和扩散起到重要作用。
第二亚族:EphEph亚族是一个广泛存在于多种哺乳动物组织中的家族,包括EphA和EphB两个亚家族。
Eph受体与其配体ephrin结合后,可以传递各种生长因子、细胞黏附和细胞迁移的信号,参与神经系统发育、血管生成和癌症发生等。
第三亚族:FGFRFGFR(成纤维细胞生长因子受体)是一类高度保守的酪氨酸激酶受体,包括FGFR1-4四个家族成员。
FGFR是多肽生长因子家族的成员,可以与多种成纤维细胞生长因子结合,调控细胞增殖、分化和迁移。
FGFR异常激活与多种疾病的发生和发展密切相关,包括肿瘤和一些遗传性疾病。
第四亚族:IGF1R/INSRIGF1R(胰岛素样生长因子1受体)和INSR(胰岛素受体)是酪氨酸激酶家族的成员,这两个受体都参与调节细胞的代谢和生长。
IGF1R是胰岛素样生长因子1的受体,可以与其结合,促进细胞生长和分化,而INSR则是胰岛素的受体。
第五亚族:PDGFRPDGFR(血小板源性生长因子受体)是一类双链膜受体激酶,包括PDGFR-α和PDGFR-β两个亚型。
PDGFR与PDGF结合后,能够调节细胞生长和发育,参与多种疾病的发生和发展,包括肿瘤、免疫系统疾病和细胞增殖异常等。
蛋白酪氨酸激酶综述目前至少已有近六十种分属20个家族的受体酪氨酸激酶被子识别。
所有受体酷氨酸激酶都属于I型膜蛋白,其分子具有相似的拓朴结构:糖基化的胞外配体结合区,疏水的单次跨膜区,以及胞内的酪氨酸激酶催化结构域及调控序列。
不同受体酪氨酸激酶结合,将导致受体发生三聚化,并进一步使受体胞内区特异的受体酪氨酸残基发生自身磷酸化或交叉磷酸化,从而激活下游的信号转导通路。
许多肿瘤的发生、发展都与酪氨酸激酶的异常表达有着极其密切的联系,下面将对几类与肿瘤的发生发展最为密切的受体酪氨酸激酶的研究迸展做一简介。
一、表皮生长因子受体(Epidermal grovth factor receptor, EGFR)家族EGFRPE包括EGFR、ErbB2、ErbB4等4个成员,其家族受体酪氨酸激酶(RTK)以单体形式存在,在结构上由胞外区、跨膜区、胞内区3个部分组成,胞外区具有2个半氨酸丰富区,胞内区有典型的ATP结合位点和酪氨酸激酶区,其酪氨酸激酶活性在调节细胞增殖及分化中起着至关重要的作用。
人的egfr基因定位于第7号染色体的短臂(7p12.3-p12.1),它编码的产物EGFR由1210个氨基酸组成,蛋白分子量约为170kDa,其中,712-979位属于酪氨酸激酶区。
EGFR的专一配体有EGF、TGF、amphiregulin,与其他EGFR家庭成员共有的配体有(cellulin(BTC)、heparin-bindingEGF(HB-EGF)、Epiregulin(EPR) )等。
EGFR在许多上皮业源的肿瘤细胞中表达,如非小细胞性肺癌,乳腺癌、头颈癌,膀胱癌,胃癌,前列腺癌,卵巢癌、胶质细胞瘤等。
另外,在一些肿瘤如恶性胶质瘤、非小细胞性肺癌、乳腺癌、儿童胶质瘤、成神经管细胞瘤及卵巢癌等中还可检测到EGFR缺失。
最为常见的EGFR缺失突变型是EGFRⅧ,EGFR Ⅷ失去了配体结合区,但是可自身活化酪氨酸激酶,刺激下游信号通路的激活,而不依赖于与其配全结合。
细胞因子受体的分类及其主要特征细胞因子受体是一类分布在细胞膜上的蛋白质,它们在细胞间的信号传递中起着关键作用。
根据其结构和功能的不同,细胞因子受体可以分为几个主要类别。
1. 细胞外酪氨酸激酶受体(Receptor Tyrosine Kinase, RTK)细胞外酪氨酸激酶受体是一类具有酪氨酸激酶活性的受体。
它们包括EGFR、PDGFR和FGFR等。
这类受体的主要特征是具有一个细胞外结构域、一个跨膜结构域和一个细胞内酪氨酸激酶结构域。
当配体结合到细胞外结构域时,受体二聚化并激活其酪氨酸激酶活性,进而激活下游信号通路,参与细胞生长、分化和存活等过程。
2. 细胞外酪氨酸激酶相关蛋白受体(Receptor Tyrosine Kinase-Associated Proteins, RACKs)细胞外酪氨酸激酶相关蛋白受体是一类通过与酪氨酸激酶受体相互作用而发挥功能的蛋白质。
它们包括SH2结构域和PTB结构域蛋白等。
这类受体的主要特征是通过与酪氨酸激酶受体的磷酸化位点相结合,调节其激酶活性和下游信号通路的激活。
RACKs蛋白的功能多样,可以调节细胞增殖、迁移和凋亡等过程。
3. 细胞内酪氨酸激酶受体(Non-Receptor Tyrosine Kinase)细胞内酪氨酸激酶受体是一类在细胞内起信号传导作用的酪氨酸激酶。
它们包括Src家族蛋白、JAK蛋白和Syk蛋白等。
这类受体的主要特征是不具有细胞外结构域,而是通过其酪氨酸激酶结构域直接参与信号传导。
这类受体在细胞增殖、分化和免疫应答等过程中发挥重要的调节作用。
4. 细胞外受体(G-protein Coupled Receptor, GPCR)细胞外受体是一类通过结合G蛋白参与信号传导的受体。
它们包括Rhodopsin家族、Glutamate家族和Adhesion家族等。
这类受体的主要特征是具有7个跨膜结构域,通过结合G蛋白的活化和抑制来调节下游信号通路的激活。
ErbB2入核机制研究初探的开题报告
题目:ErbB2入核机制研究初探
研究背景和意义:
ErbB2(也称HER2/neu)是一种膜受体酪氨酸激酶,它在肿瘤发生和发展过程中扮演着重要角色。
ErbB2通常被认为是一种细胞膜受体,并与EGFR、ErbB3和ErbB4等相关联。
这些受体通过激活信号通路调节细胞增殖、生存、分化和移动等过程。
然而,近年来的研究表明,ErbB2可能具有入核能力,也就是说,它能够进入细胞核并影响基因转录。
ErbB2的入核机制尚未完全阐明,这限制了我们对它在肿瘤中的作用和其它生物学过程中的作用的理解。
因此,本研究旨在探究ErbB2入核机制,并阐述它在细胞中的生物学意义。
研究内容和方法:
本研究拟通过以下三个方面的研究内容和方法来探究ErbB2入核机制:
1.分析ErbB2蛋白的结构域,并预测它的入核能力:使用生物信息学工具预测ErbB2蛋白的结构域,并结合已有文献研究对其入核能力进行预测;
2.观察ErbB2的核内定位:采用免疫荧光染色法或电子显微镜技术,观察ErbB2是否可以进入细胞核并定位在特定区域中;
3.探究ErbB2入核对基因转录的影响:使用实时荧光定量PCR技术来检测ErbB2入核对基因转录的影响,并测定这种影响的程度和时间依赖性。
研究预期结果和意义:
本研究预期通过以上研究内容和方法,明确ErbB2的入核机制并阐述它在细胞中的生物学意义。
这将有助于我们深入理解ErbB2在肿瘤发生和发展中的作用,并为其在癌症诊断和治疗中的应用提供新的思路和方向。
同时,该研究还有助于我们对其它细胞膜受体的作用机制有更深入的认识和了解。
ErbB2受体酪氨酸激酶激酶区的表达与纯化江希;周祥山;张元兴【期刊名称】《微生物学通报》【年(卷),期】2008(35)9【摘要】以GFP融合表达的形式在毕赤酵母中表达具有生物活性的受体酪氨酸激酶ErbB2的激酶区.构建受体酪氨酸激酶激酶区与GFP的融合表达载体pPIC3.5K,转化毕赤酵母GS115,通过组氨酸营养缺陷型筛选,G418高拷贝菌株筛选,以及摇瓶诱导表达筛选,选取较高水平表达菌株进行5升罐培养,以镍亲和层析手段纯化得到蛋白表达产物,进行SDS-PAGE分析和酶联免疫反应检测酶活.结果表明在毕赤酵母中成功诱导表达了约100kD的激酶融合蛋白并具有激酶活性.该研究为筛选ErbB2的抑制剂奠定了基础.【总页数】5页(P1393-1397)【作者】江希;周祥山;张元兴【作者单位】华东理工大学生物反应器工程国家重点实验室,上海,200237;华东理工大学生物反应器工程国家重点实验室,上海,200237;华东理工大学生物反应器工程国家重点实验室,上海,200237【正文语种】中文【中图分类】Q93【相关文献】1.Mer受体酪氨酸激酶蛋白在胃癌组织中的表达及意义 [J], 董娟娟;胡显桥2.癫痫伴抑郁大鼠杏仁核脑源性神经营养因子及其受体酪氨酸激酶受体B的表达观察 [J], 杨钧哲;许新炜;朱含笑;程莉晶;李云3.血清微小RNA-150表达水平与晚期非小细胞肺癌患者行表皮生长因子受体酪氨酸激酶抑制剂治疗效果及预后的关系 [J], 关英;郭丽云;王千千;阿选德4.Tec激酶区作用蛋白RAI16的原核表达和纯化 [J], 许文;王阁;邓婧;杨进;郑继军;王红中;胡庆;王东;李增鹏;杨志祥5.四种常见受体酪氨酸激酶在胃癌中的表达及对预后的影响 [J], 黄国强;黄一波;张海强;许国富因版权原因,仅展示原文概要,查看原文内容请购买。
受体型酪氨酸激酶ErbB受体亚族研究进展
李照民;梅岩艾
【期刊名称】《细胞生物学杂志》
【年(卷),期】2003(25)4
【摘要】ErbB受体亚族属于受体型酪氨酸激酶(RTK)超家族中的I亚族,对于胚胎发育是必需的,并与腺体肿瘤的癌变有关。
ErbB受体亚族有4个成员,它们在上皮和神经等组织内表达。
本文综述了ErbB受体亚族的研究概况,以及ErbB受体介导的信号转导机制及其在癌变中的作用机理等研究进展。
【总页数】5页(P202-206)
【关键词】受体型酪氨酸激酶;ErbB受体亚族;信号转导机制;癌变
【作者】李照民;梅岩艾
【作者单位】复旦大学生命科学学院生理学和生物物理学系立人实验室
【正文语种】中文
【中图分类】Q257
【相关文献】
1.受体型酪氨酸激酶RON及其在恶性肿瘤发生发展中的作用研究进展 [J], 马琪;虞碧霞;陈俊丰;程跃
2.受体型酪氨酸激酶RON在乳腺癌侵袭及转移中的作用研究进展 [J], 莫光泉;张宏颖;李连宏
3.蛋白酪氨酸激酶亚族TAM受体 [J], 张利文
4.受体酪氨酸激酶ErbB2靶向治疗策略和内吞降解调控的研究进展 [J], 张迎秋;刘书言;刘晗
因版权原因,仅展示原文概要,查看原文内容请购买。