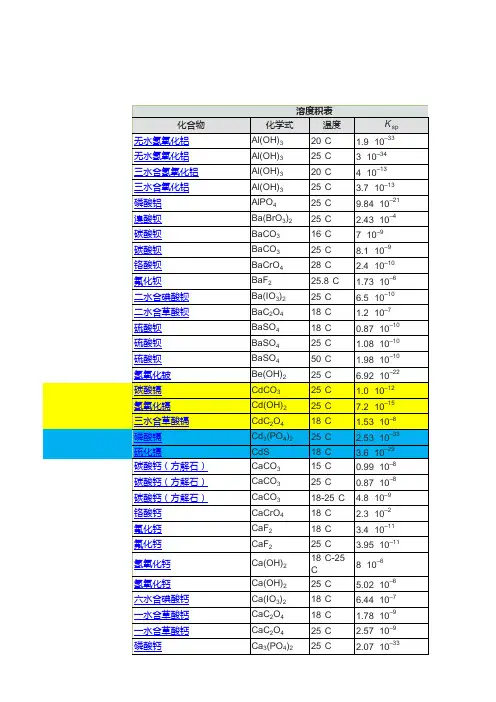
常见难溶电解质的溶度积常数(刘震收集整理)
- 格式:xls
- 大小:31.50 KB
- 文档页数:1

难溶电解质的溶度积溶度积严格地说,在水中绝对不溶的物质是不存在的。
通常将溶解度小于0.01 g/L的物质称为难溶电解质。
例如,在一定温度下,将过量AgCl固体投入水中,Ag+和Cl-离子在水分子的作用下会不断离开固体表面而进入溶液,形成水合离子,这是AgCl的溶解过程。
同时,已溶解的Ag+和 Cl-离子又会因固体表面的异号电荷离子的吸引而回到固体表面,这就是AgCl的沉淀过程。
当沉淀与溶解两过程达到平衡时,此时的状态称为沉淀溶解平衡。
溶解AgCl(s) ==== Ag+ + Cl-(未溶解固体) 沉淀 (已溶解的水合离子)根据平衡原理,其平衡常数可表示为但因c(AgCl)为常数,a(Ag+) = c(Ag+), a(Cl-) = c(Cl-)故上式可写成∴ a(Ag+) ´ a(Cl-) = c(Ag+) ´ c(Cl-) = K Ө = Ksp Ө即为多相离子平衡的平衡常数,称为溶度积常数(可简称溶度积)。
对于一般的难溶电解质AmBn的沉淀溶解平衡AmBn(s) ==== mAn+ + nBm-Ksp=c^m(An+)×c^n(Bm-)上式的意义是:在一定温度下,难溶电解质饱和溶液中各离子浓度幂的乘积为一常数。
严格地说,应该用溶解平衡时各离子活度幂的乘积来表示。
但由于难溶电解质的溶解度很小,溶液的浓度很稀。
一般计算中,可用浓度代替活度。
Ksp的大小反映了难溶电解质溶解能力的大小。
Ksp越小,则该难溶电解质的溶解度越小。
Ksp的物理意义;(1)Ksp的大小只与此时温度有关,而与难溶电解质的质量无关;(2)表达式中的浓度是沉淀溶解达平衡时离子的浓度,此时的溶液是饱和或准饱和溶液;(3)由Ksp的大小可以比较同种类型难溶电解质的溶解度的大小;不同类型的难溶电解质不能用Ksp比较溶解度的大小。
编辑本段溶解度和溶度积的相互换算Ksp与S均可判断溶解度大小,二者有无关系?根据溶度积常数关系式,可以进行溶度积和溶解度之间的计算。
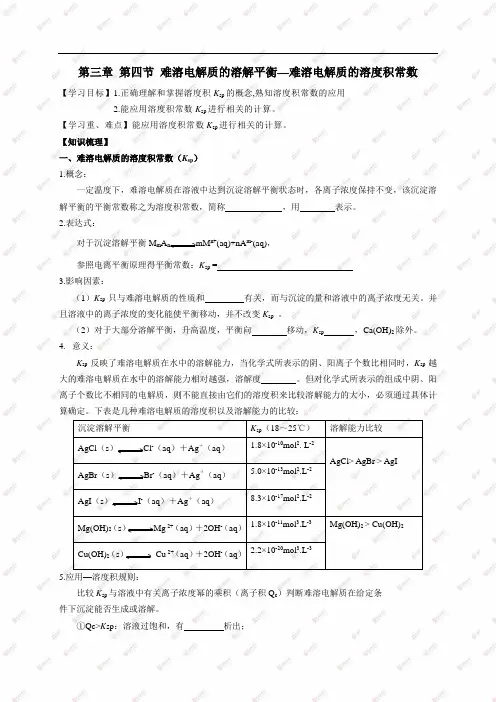
第三章第四节难溶电解质的溶解平衡—难溶电解质的溶度积常数【学习目标】1.正确理解和掌握溶度积K sp的概念,熟知溶度积常数的应用2.能应用溶度积常数K sp进行相关的计算。
【学习重、难点】能应用溶度积常数K sp进行相关的计算。
【知识梳理】一、难溶电解质的溶度积常数(K sp)1.概念:一定温度下,难溶电解质在溶液中达到沉淀溶解平衡状态时,各离子浓度保持不变,该沉淀溶解平衡的平衡常数称之为溶度积常数,简称,用表示。
2.表达式:对于沉淀溶解平衡M m A n mM n+(aq)+nA m-(aq),参照电离平衡原理得平衡常数:K sp =3.影响因素:(1)K sp只与难溶电解质的性质和有关,而与沉淀的量和溶液中的离子浓度无关。
并且溶液中的离子浓度的变化能使平衡移动,并不改变K sp。
(2)对于大部分溶解平衡,升高温度,平衡向移动,K sp,Ca(OH)2除外。
4.意义:K sp反映了难溶电解质在水中的溶解能力,当化学式所表示的阴、阳离子个数比相同时,K sp越大的难溶电解质在水中的溶解能力相对越强,溶解度。
但对化学式所表示的组成中阴、阳离子个数比不相同的电解质,则不能直接由它们的溶度积来比较溶解能力的大小,必须通过具体计算确定。
下表是几种难溶电解质的溶度积以及溶解能力的比较:沉淀溶解平衡K sp(18~25℃)溶解能力比较AgCl(s)Cl-(aq)+Ag+(aq) 1.8×10-10mol2. L-2AgCl> AgBr > AgI AgBr(s)Br-(aq)+Ag+(aq) 5.0×10-13mol2.L-2AgI(s)I-(aq)+Ag+(aq)8.3×10-17mol2.L-2Mg(OH)2(s)Mg 2+(aq)+2OH-(aq)1.8×10-11mol3.L-3Mg(OH)2> Cu(OH)2Cu(OH)2(s)Cu 2+(aq)+2OH-(aq)2.2×10-20mol3.L-35.应用—溶度积规则:比较K sp与溶液中有关离子浓度幂的乘积(离子积Q c)判断难溶电解质在给定条件下沉淀能否生成或溶解。
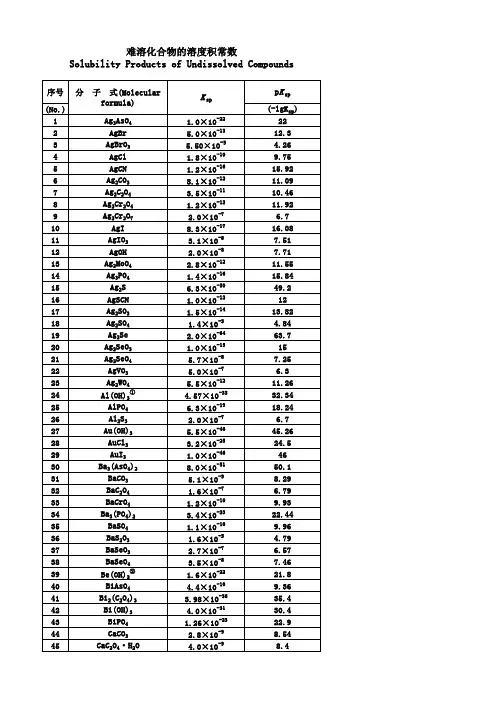

电解质溶液中“四大平衡常数”的比较和联系电离平衡常数(K a 、K b )水的离子积常数(K w )盐类的水解常数(K h ) 难溶电解质的溶度积常数(K sp )表达式 (1)一元弱酸HA: HA H ++A -K a =c (H +)·c (A -)c (HA );(2)一元弱碱BOH:BOHB ++OH -K b =c (B +)·c (OH -)c (BOH )K w =c (H +)·c (OH -) (1)强碱弱酸盐,如CH 3COONa溶液:CH 3COO -+H 2O CH 3COOH+OH -K h =c (CH 3COOH )·c (OH -)c (CH 3COO -)=K wK a; (2)强酸弱碱盐,如NH 4Cl 溶液:N H 4++H 2ONH 3·H 2O+H +K h =c (NH 3·H 2O )·c (H +)c (NH 4+)=K wK bM m A n (s)m M n +(aq)+n A m -(aq)K sp (M m A n )=c m(M n +)·c n(A m -)影响 因素 只与温度有关,升高温度,K a 、K b 增大 只与温度有关,升高温度,K w 增大 只与温度有关,K h 随温度的升高而增大 只与难溶电解质的性质和温度有关突破点1 电离常数与水解常数、水的离子积的关系 (1)定量关系a.对于一元弱酸HA,K a 与K h 的关系 HAH ++A -,K a (HA)=c (H +)·c (A -)c (HA );A -+H 2OHA+OH -,K h (A -)=c (OH -)·c (HA )c (A -)。
则K a ·K h =c (H +)·c (OH -)=K w ,故K h =K wK a。
常温时,K a ·K h =K w =1.0× 10-14,K h =1.0×10-14K a。

第三章第四节难溶电解质的溶解平衡—难溶电解质的溶度积常数【学习目标】1.正确理解和掌握溶度积K sp的概念,熟知溶度积常数的应用2.能应用溶度积常数K sp进行相关的计算。
【学习重、难点】能应用溶度积常数K sp进行相关的计算。
【知识梳理】一、难溶电解质的溶度积常数(K sp)1.概念:一定温度下,难溶电解质在溶液中达到沉淀溶解平衡状态时,各离子浓度保持不变,该沉淀溶解平衡的平衡常数称之为溶度积常数,简称,用表示。
2.表达式:对于沉淀溶解平衡M m A n mM n+(aq)+nA m-(aq),参照电离平衡原理得平衡常数:K sp =3.影响因素:(1)K sp只与难溶电解质的性质和有关,而与沉淀的量和溶液中的离子浓度无关。
并且溶液中的离子浓度的变化能使平衡移动,并不改变K sp。
(2)对于大部分溶解平衡,升高温度,平衡向移动,K sp,Ca(OH)2除外。
4.意义:K sp反映了难溶电解质在水中的溶解能力,当化学式所表示的阴、阳离子个数比相同时,K sp越大的难溶电解质在水中的溶解能力相对越强,溶解度。
但对化学式所表示的组成中阴、阳离子个数比不相同的电解质,则不能直接由它们的溶度积来比较溶解能力的大小,必须通过具体计算确定。
下表是几种难溶电解质的溶度积以及溶解能力的比较:沉淀溶解平衡K sp(18~25℃)溶解能力比较AgCl(s)Cl-(aq)+Ag+(aq) 1.8×10-10mol2. L-2AgCl> AgBr > AgI AgBr(s)Br-(aq)+Ag+(aq) 5.0×10-13mol2.L-2AgI(s)I-(aq)+Ag+(aq)8.3×10-17mol2.L-2Mg(OH)2(s)Mg 2+(aq)+2OH-(aq)1.8×10-11mol3.L-3Mg(OH)2> Cu(OH)2Cu(OH)2(s)Cu 2+(aq)+2OH-(aq)2.2×10-20mol3.L-35.应用—溶度积规则:比较K sp与溶液中有关离子浓度幂的乘积(离子积Q c)判断难溶电解质在给定条件下沉淀能否生成或溶解。




岩土工程师基础知识考点:难溶电解质2016岩土工程师基础知识考点:难溶电解质难溶电解质的沉淀溶解平衡:AnBm(s) == nA m+(aq)+mBn-(aq)(1)溶度积(常数):Ksp(AnBm)={ ceq(Am+)}n{ceq(Bn-)}m溶度积Ksp在一定温度下为一常数.如, AgCl(s) ===== Ag+(aq)+Cl-(aq)25oC,KSP(AgCl)={ceq(Ag+)}.{ceq(Cl-)}=1.77×10-7KSP(CaF2)= ceq(Ca2+ ).{ ceq(F-)}2=3.4×10-11KSP{ Mg(OH)2}=ceq(Mg2+ ).{ ceq(OH-)}2=1.8×10-11(2)溶解度s(mol.dm-3)与溶度积Ksp的关系:1)溶解度s:每dm3水溶液中含溶质的摩尔数, mol.dm-3。
2) 溶解度s与溶度积Ksp的关系:对于AB型沉淀:如 AgCl、AgBr、AgI、CaCO3、CaSO4等。
CaCO3(s) = Ca2+(aq) + CO32-(aq)平衡浓度/mol·dm-3 s sKsp (CaCO3) = s2 ,s= 对于A2B或AB2型沉淀:如Ag2CrO4,Mg(OH)2等。
Ag2CrO4 (s) = 2Ag+(aq) + CrO42-(aq)平衡浓度/mol·dm-3 2s sKsp (Ag2CrO4) = (2s)2s = 4s3 ,s= 对同一种类型的沉淀, 溶度积Ksp越大, 溶解度S越大;对不同类型的沉淀,通过计算S比较溶解度的大小。
例1.250C时,铬酸银(Ag2CrO4)的`溶解度为1.31×10-4 mol.dm-3,求其溶度积.解: Ag2CrO4 (s) = 2Ag+(aq) + CrO42-(aq)平衡浓度/mol·dm-3 2s sKsp (Ag2CrO4) = (2s)2s = 4s3=4×(1.31×10-4)3=9.0×10-12 例2. 250C时, AgCl、Ag2CrO4的溶度积分别为1.56×10-10、9.0×10-12,问其溶解度何者为大?解:AgCl溶解度为:s= = Ag2CrO4的溶解度为:s= 可见溶解度大小为: Ag2CrO4> AgCl(3)溶度积规则:判断沉淀的生成和溶解。
