高考化学大一轮复习 第2节 考点1 脂肪烃的结构和性质教师用书 新人教版选修5
- 格式:doc
- 大小:457.14 KB
- 文档页数:8


高中化学第二章第一节脂肪烃教案新人教版选修第一节脂肪烃 (2)技能掌握烯烃、炔烃的结构特点和主要化学性质乙炔的实验室制法过程方法要注意充分发挥学生的主体性培养学生的观察能力、实验能力和探究能力情感态度价值观在实践活动中,体会有机化合物在日常生活中的重要应用,同时关注有机物的合理使用重点炔烃的结构特点和化学性质难点乙炔的实验室制法知识结构与板书设计二、烯烃的顺反异构1、顺反异构2、形成条件:(1)具有碳碳双键 (2)组成双键的每个碳原子必须连接两个不同的原子或原子团、三、炔烃:分子里含有碳碳三键的一类脂肪烃称为炔烃。
1、乙炔的结构:分子式:C2H2,实验式:CH,电子式:结构式:H-C C-H,分子构型:直线型,键角:1802、乙炔的实验室制取3、乙炔的性质:乙炔是无色、无味的气体,微溶于水。
(1)氧化反应:可燃性(明亮带黑烟)2C2H2 +5O24CO2 +2H2O 易被 KMnO4酸性溶液氧化(叁键断裂)(2)加成反应:乙炔与溴发生加成反应四、脂肪烃的来源及其应用教学过程备注练习写出戊烯的同分异构体:思考以下两种结构是否相同?二、烯烃的顺反异构讲在烯烃中,由于双键的存在,除因双键位置不同而产生的同分异构体外,在烯烃中还有一种称为顺反异构(也称几何异构)的现象。
当 C C 双键上的两个碳原子所连接的原子或原子团不相同时,就会有两种不同的排列方式。
1、由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。
2、形成条件:(1)具有碳碳双键 (2)组成双键的每个碳原子必须连接两个不同的原子或原子团、讲两个相同的原子或原子团居于同一边的为顺式( cis-),分居两边的为反式( trans-)。
例如,在2-丁烯中,两个甲基可能同时位于分子的一侧,也可能分别位于分子的两侧。
投影顺丁烯反丁烯的结构图三、炔烃分子里含有碳碳三键的一类脂肪烃称为炔烃。
自学讨论在学生自学教材的基础上,教师与学生一起讨论乙炔的分子结构特征,并推测乙炔可能的化学性质小结乙炔的组成和结构1、乙炔 (ethyne)的结构分子式:C2H2,实验式:CH,电子式:结构式:H-C C-H,分子构型:直线型,键角:180 投影乙炔的两钟模型2、乙炔的实验室制取 (1)反应原理:CaC22H2O CH CH Ca( OH)2 (2)装置:固 -液不加热制气装置。
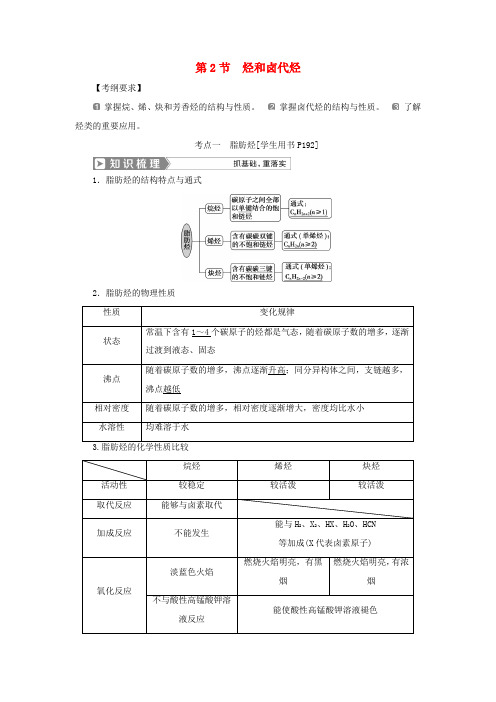
第2节烃和卤代烃【考纲要求】掌握烷、烯、炔和芳香烃的结构与性质。
掌握卤代烃的结构与性质。
了解烃类的重要应用。
考点一脂肪烃[学生用书P192]1.脂肪烃的结构特点与通式2.脂肪烃的物理性质性质变化规律状态常温下含有1~4个碳原子的烃都是气态,随着碳原子数的增多,逐渐过渡到液态、固态沸点随着碳原子数的增多,沸点逐渐升高;同分异构体之间,支链越多,沸点越低相对密度随着碳原子数的增多,相对密度逐渐增大,密度均比水小水溶性均难溶于水烷烃烯烃炔烃活动性较稳定较活泼较活泼取代反应能够与卤素取代加成反应不能发生能与H2、X2、HX、H2O、HCN等加成(X代表卤素原子)氧化反应淡蓝色火焰燃烧火焰明亮,有黑烟燃烧火焰明亮,有浓烟不与酸性高锰酸钾溶液反应能使酸性高锰酸钾溶液褪色加聚反应 不能发生 能发生鉴别不能使溴水、酸性高锰酸钾溶液褪色能使溴水、酸性高锰酸钾溶液褪色烷烃与卤素单质的取代反应是分子中的氢原子逐步被取代,并且是各步反应同时进行,产物是烃的多种卤代物的混合物和卤化氢。
按要求书写方程式:(1)乙烷和Cl 2生成一氯乙烷:。
(2)烷烃的燃烧通式:。
(3)单烯链烃的燃烧通式:。
(4)丙烯使溴的CCl 4溶液褪色:。
(5)丙烯与H 2O 的加成反应:。
(6)丙烯的加聚反应:。
(7)乙炔和H 2生成乙烷:。
(8)乙炔和HCl 生成氯乙烯:。
(9)氯乙烯的加聚反应:。
(10)等物质的量的CH 2CHCHCH 2与Br 2加成可能的反应: ① ; ② 。
答案:(1)CH 3CH 3+Cl 2――→光CH 3CH 2Cl +HCl(2)C n H 2n +2+3n +12O 2――→点燃n CO 2+(n +1)H 2O(3)C n H 2n +32n O 2――→点燃n CO 2+n H 2O题组一 考查烃分子中原子的共线、共面问题1.下列化合物的分子中,所有原子都处于同一平面的有( ) ①乙烷 ②甲苯 ③氟苯 ④四氯乙烯 A .①② B .②③ C .③④D .①④解析:选C 。



最新人教版高中化学《脂肪烃》知识梳理第一节脂肪烃答案:(1)分子中的碳原子之间都是以单键结合成链状,碳原子剩余的价键全部跟氢原子结合,使每个碳原子的化合价都达到“饱和”(2)C n H 2n +2(4)C n H 2n +2+3n +12O 2――→点燃n CO 2+(n +1)H 2O(5)分子中的官能团是碳碳双键,其键角为120°,与双键相连的四个原子及形成双键的两个碳原子共平面(6)C n H 2n (n ≥2)(7)C n H 2n +3n 2O 2――→点燃n CO 2+n H 2O(8)褪色(9)CH 2===CH 2+Br 2―→CH 2Br —CH 2Br(11)由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象(12)基本相同 (13)有一定差异(14)分子中含有碳碳三键(C≡C)的不饱和链烃 (15)C n H 2n -2(n ≥2)(16)C n H 2n -2+3n -12O 2――→点燃n CO 2+(n -1)H 2O(17)褪色(18)CH≡CH+HCl ――→催化剂加热CH 2===CHCl (19)n CH≡CH――→催化剂CH===CH (20)CaC 2+2H —OH ―→C 2H 2↑+Ca(OH)21.烷烃(1)烷烃的结构①烷烃的结构特点:烷烃分子中的碳原子与碳原子都是以单键结合成链状,碳原子剩余的价键全部跟氢原子结合,使每个碳原子的化合价都达到“饱和”,所以烷烃也称为饱和链烃。
如CH 4、CH 3—CH 3等。
②烷烃通式:C n H 2n +2。
(2)烷烃的物理性质的变化规律烷烃的物理性质随着分子中碳原子数的递增发生递变:①熔点、沸点逐渐升高,而对于组成相同的烷烃同分异构体随着支链的增多,而使熔沸点降低,如熔沸点:正戊烷>异戊烷>新戊烷。
②相对密度逐渐增大,但是都小于水的密度;③常温下状态由气态(n ≤4)逐渐过渡到液态、固态;④烷烃都不易溶于水而易溶于有机溶剂。
课题:第二章第一节脂肪烃(1)教学目的知识技能1、了解烷烃、烯烃和炔烃的物理性质的规律性变化2、了解烷烃、烯烃、炔烃的结构特点过程与方法1、注意不同类型脂肪烃的结构和性质的对比2、善于运用形象生动的实物、模型、计算机课件等手段帮助学生理解概念、掌握概念、学会方法、形成能力情感态度价值观根据有机物的结果和性质,培养学习有机物的基本方法“结构决定性质、性质反映结构”的思想重点烯烃的结构特点和化学性质难点烯烃的顺反异构知识结构与板书设计第二章烃和卤代烃第一节脂肪烃一、烷烃(alkane)和烯烃(alkene)1、结构特点和通式:(1) 烷烃: (2) 烯烃:2、物理性质3、基本反应类型(1) 取代反应: (2) 加成反应:(3) 聚合反应:4、烷烃化学性质(与甲烷相似)烷烃不能使酸性高锰酸钾溶液和溴水褪色(1)取代反应:(2)氧化反应:5、烯烃的化学性质(与乙烯相似)(1)加成反应(2)氧化反应○1燃烧:○2使酸性KMnO4溶液褪色:○3催化氧化:2R—CH=CH2 + O22R1COR2CH3(3) 加聚反应6、二烯烃的化学性质(1)二烯烃的加成反应:(1,4一加成反应是主要的)(2) 加聚反应: n CH2=CHCH=CH2催化剂(顺丁橡胶)教学过程备注[引入]同学们,从这节课开始我们来学习第二章的内容——烃和卤代烃。
甲烷、乙烯、苯这三种有机物都仅含碳和氢两种元素,它们都是碳氢化合物,又称烃。
根据结构的不同,烃可分为烷烃、烯烃、炔烃和芳香烃等。
而卤代烃则是从结构上可以看成是烃分子中的氢原子被卤原子取代的产物,是烃的衍生物的一种。
我们先来学习第一节——脂肪烃。
第二章 烃和卤代烃第一节 脂肪烃一、烷烃(alkane)和烯烃(al kene) 1、结构特点和通式:(1) 烷烃:仅含C —C 键和C —H 键的饱和链烃,又叫烷烃。
(若C —C 连成环状,称为环烷烃。
)通式:C n H 2n+2 (n≥1)(2) 烯烃:分子里含有一个碳碳双键的不饱和链烃叫做烯烃。
第2节 烃和卤代烃
明考纲
析考情
考点1 脂肪烃的结构和性质
1.烷烃、烯烃、炔烃的组成及结构特点
2.脂肪烃的物理性质
3.脂肪烃的化学性质 (1)氧化反应
(2)烷烃的卤代反应 ①反应条件:光照。
②无机试剂:卤素单质,水溶液不反应。
③产物特点:多种卤代烃混合物+HX(X 为卤素原子)。
④量的关系:取代1 mol 氢原子,消耗1_mol 卤素单质,如乙烷和氯气生成一氯乙烷:
CH 3CH 3+Cl 2――→光照
CH 3CH 2Cl +HCl 。
(3)烯烃、炔烃的加成反应(写出有关反应方程式)
(4)烯烃、炔烃的加聚反应 ①丙烯的加聚反应方程式:。
②乙炔的加聚反应方程式:
n CH≡CH ――→催化剂
==。
4.脂肪烃的来源和用途
易错警示(1)烷烃与卤素单质的取代反应是分子中的氢原子逐步被取代,并且是各步反应同时进行,产物是烃的多种卤代物的混合物和卤化氢。
(2)实验室制备C2H4时:酒精与浓硫酸的体积比为1∶3;温度计的水银球插入反应混合液的液面下;反应温度迅速升至170 ℃;浓硫酸作催化剂和脱水剂。
(3)实验室制备C2H2时:不能使用启普发生器;为了得到比较平缓的乙炔气流,可用饱和食盐水代替水。
判断正误,正确的画“√”,错误的画“×”。
(1)溴水和酸性KMnO4溶液既可除去乙烷中的乙烯,也可以鉴别乙烷与乙烯。
(×)
(2)将石蜡油在碎瓷片上受热分解产生的气体能使溴的CCl4溶液褪色。
(√)
500~600 ℃
(3)反应CH2===CH—CH3+Cl2――→
CH2===CH—CH2Cl+HCl为取代反应。
(√)
(4)聚丙烯、聚氯乙烯分子中含碳碳双键。
(×)
(5)烷烃同分异构体之间,支链越多,沸点越高。
(×)
(6) 是两种不同的物质,它们互为同分异构
体。
(×)
题组一脂肪烃的结构与性质
1.[2017·金版原创]在通常条件下,有关下列物质的说法不正确的是( )
A.沸点:戊烷>异戊烷>新戊烷>丁烷>2甲基丙烷
B.同分异构体种数:戊烷>戊烯>戊醇
C.点燃时火焰明亮程度:丙炔>丙烯>丙烷
D.密度:己烷<水<溴乙烷
答案 B
解析烷烃的沸点随碳原子数的增多而升高,碳原子数相同时,直链高于支链,A项正确;戊烷有3种同分异构体,戊烯有5种同分异构体,戊醇有8种同分异构体,B项错误;点燃时火焰明亮程度取决于烃的含碳量,含碳量越大,火焰越明亮,C项正确;烷烃的密度小于水,卤代烃的密度大于水,D项正确。
2.某烃结构式用键线式表示为,该烃与Br2加成时(物质的量之比为1∶1),所得的产物有( )
A.3种 B.4种
C.5种 D.6种
答案 C
解析
总结提升
结构决定性质
不同的碳碳键对有机物的性质有着不同的影响:
(1)碳碳单键有稳定的化学性质,典型反应是取代反应;
(2)碳碳双键中有一个化学键易断裂,典型反应是氧化反应、加成反应和加聚反应;
(3)碳碳三键中有两个化学键易断裂,典型反应是氧化反应、加成反应和加聚反应;
(4)苯的同系物侧链易被酸性高锰酸钾溶液氧化,是因为苯环对取代基的影响,而苯不能被酸性高锰酸钾溶液氧化。
题组二脂肪烃常见反应类型
3.下列说法正确的是( )
A.乙烯使溴的四氯化碳溶液褪色与乙烯使酸性KMnO4溶液褪色均发生了加成反应
B.丙烯和氯气在一定条件下生成CH2===CH—CH2Cl与乙烷和氯气光照下均发生了取代反应
C.己烷与溴水混合时溴水褪色与乙醇使酸性KMnO4溶液褪色均发生了氧化反应
D.乙烯生成聚乙烯与氨基酸生成蛋白质均发生了加聚反应
答案 B
解析乙烯使酸性KMnO4溶液褪色发生了氧化反应,A项错误;己烷与溴水混合时溴水褪色发生了萃取,是物理变化,C项错误;氨基酸生成蛋白质发生了缩聚反应,D项错误。
4.某气态烃0.5 mol能与1 mol HCl加成,加成后产物分子上的氢原子又可与3 mol Cl2完全取代,则该烃可能为( )
A.乙烯B.1,3丁二烯
C.乙炔D.丙炔
答案 D
解析气态烃0.5 mol能与1 mol HCl加成,说明该烃中含有一个碳碳三键或两个碳碳双键,则A错误。
0.5 mol加成产物上的氢原子可与3 mol Cl2完全取代,说明加成产物中含有6个氢原子,其中有两个氢原子来源于HCl,因此气态烃中含有4个氢原子,只有D正确。
总结提升
不饱和烃常见反应类型总结
(1)加成反应:分子中的碳碳双键或碳碳三键断裂,双键或三键两端的碳原子可与其他原子或原子团结合。
(2)加聚反应:实质上是加成反应,与普通加成反应有所不同的是生成的产物一般为高分子化合物。
(3)氧化反应:可以燃烧,也可以被酸性高锰酸钾溶液氧化,一般乙炔被氧化成CO2;烯烃在酸性KMnO4溶液的作用下,分子中的碳碳双键断开,双键碳原子上连有两个氢原子的被氧化成CO2,双键碳原子上连有一个氢原子的最终被氧化成羧酸,双键碳原子上无氢原子的被氧化成酮。
具体的反应:
题组三乙烯与乙炔的制备方法
5.[2016·东城模拟]如图是制备和研究乙炔性质的实验装置图,下列说法不正确的是( )
A.制备乙炔的反应原理是CaC2+2H2O―→Ca(OH)2+CH≡CH↑
B.c的作用是除去影响后续实验的杂质
C.d中的有机产物与AgNO3溶液混合能产生沉淀
D.e中的现象说明乙炔能被酸性高锰酸钾溶液氧化
答案 C
解析实验室通过电石与水的反应制取乙炔,化学反应方程式为CaC2+2H2O―→Ca(OH)2+CH≡CH↑,故A正确;硫酸铜溶液可以除去乙炔中混有的H2S和PH3等杂质,故B正确;d 中的有机产物为1,1,2,2-四溴乙烷,属于非电解质,不能电离出溴离子,故与AgNO3溶液不反应,故C错误;乙炔容易被酸性高锰酸钾溶液氧化,使酸性高锰酸钾溶液褪色,故D 正确。
6.[2016·武汉模拟]实验室里用乙醇和浓硫酸反应生成乙烯,乙烯再与溴反应制1,2-二溴乙烷。
在制备过程中部分乙醇被浓硫酸氧化产生CO2、SO2,进而与Br2反应生成HBr等酸性气体。
浓硫酸
CH2===CH2↑+H2O。
已知:CH3CH2OH――→
170 ℃
(1)用下列仪器,以上述三种物质为原料制备1,2-二溴乙烷。
如果气体流向为从左到右,正确的连接顺序是(短接口或橡皮管均已略去):B经A①插入A中,D接A②;A③接________接________接________接________。
(2)装置C的作用是
________________________________________________________________________。
(3)装置F中盛有10% NaOH溶液的作用是
________________________________________________________________________。
(4)在反应管E中进行的主要反应的化学方程式为
_______________________________________________________________________________ _________________________________________________________________。
(5)处理上述实验后三颈烧瓶中废液的正确方法是________。
A.废液经冷却后倒入下水道中
B.废液经冷却后倒入空废液缸中
C.将水加入烧瓶中稀释后倒入空废液缸中
答案(1)C F E G
(2)作安全瓶
(3)除CO2、SO2等酸性气体
(4)CH2===CH2+Br2―→C H2Br—CH2Br
(5)B
解析(1)乙醇与浓硫酸共热170 ℃制取乙烯,由于浓硫酸有氧化性,而乙醇有还原性,二者容易发生氧化还原反应产生SO2、CO2酸性气体,可以用碱性物质,如NaOH来吸收除去,产生的乙烯与溴水发生加成反应就产生了1,2-二溴乙烷。
所以B经A①插入A中,D接A②;A③接C接F接E接G。
(2)装置C的作用是作安全瓶,防止倒吸现象的发生。
(3)装置F中盛有10% NaOH溶液的作用是除CO2、SO2等酸性气体。
(4)在反应管E中进行的主要反应的化学方程式为
CH2===CH2+Br2―→CH2Br—CH2Br。
(5)处理上述实验后三颈烧瓶中废液的正确方法是废液经冷却后倒入空废液缸中。