化学方程式集(按字母排序)
- 格式:doc
- 大小:272.00 KB
- 文档页数:12
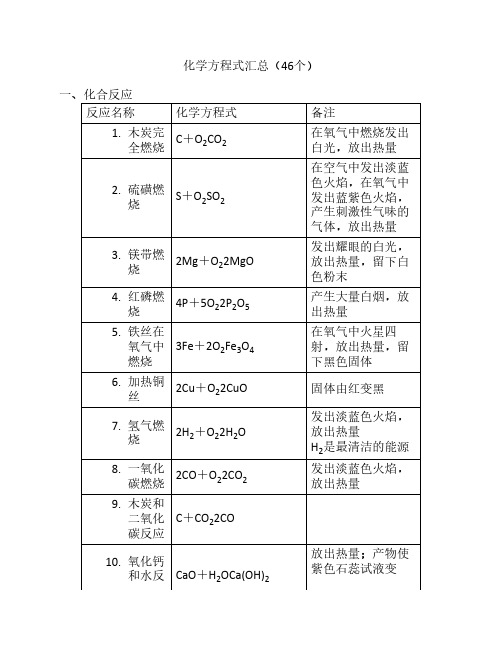
化学方程式汇总(46个)一、化合反应反应名称化学方程式备注1. 木炭完全燃烧C+O2CO2在氧气中燃烧发出白光,放出热量2. 硫磺燃烧S+O2SO2在空气中发出淡蓝色火焰,在氧气中发出蓝紫色火焰,产生刺激性气味的气体,放出热量3. 镁带燃烧2Mg+O22MgO发出耀眼的白光,放出热量,留下白色粉末4. 红磷燃烧4P+5O22P2O5产生大量白烟,放出热量5. 铁丝在氧气中燃烧3Fe+2O2Fe3O4在氧气中火星四射,放出热量,留下黑色固体6. 加热铜丝2Cu+O22CuO固体由红变黑7. 氢气燃烧2H2+O22H2O发出淡蓝色火焰,放出热量H2是最清洁的能源8. 一氧化碳燃烧2CO+O22CO2发出淡蓝色火焰,放出热量9. 木炭和二氧化碳反应C+CO22CO10. 氧化钙和水反CaO+H2OCa(OH)2放出热量;产物使紫色石蕊试液变应蓝,使无色酚酞试液变红11. 二氧化碳和水反应CO2+H2OH2CO3产物使紫色石蕊试液变红12. 硫酸铜粉末和水反应CuSO4+5H2OCuSO4·5H2O白色粉末变成蓝色晶体,放出热量CuSO4粉末用于检验物质是否含有水二、分解反应反应名称化学方程式备注13. 碳酸受热分解H2CO3H2O+CO2↑H2CO3不稳定14. 电解水2H2O2H2↑+O2↑正负极都产生气泡,负极产生的气体体积是正极产生气体的2倍负氢正氧,氢二氧一;工业上生产H215. 高温煅烧大理石或石灰石CaCO3CaO+CO2↑工业上生产CaO16. 过氧化氢在二氧化锰的催化作用下分解2H2O22H2O+O2↑产生大量气泡,放出热量实验室制取O217. 加热氯酸钾和二氧化锰的混合物2KClO32KCl+3O2↑实验室制取O218. 加热硫酸铜晶体CuSO4·5H2OCuSO4+5H2O蓝色晶体变成白色粉末,试管口产生无色液体三、置换反应反应名称化学方程式备注19. 木炭还原氧化铜C+2CuO2Cu+CO2↑产生红色固体20. 氢气还原氧化铜H2+CuOCu+H2O产生红色固体,试管口产生无色液体H2有还原性,用于冶炼金属21. 镁带在二氧化碳中燃烧2Mg+CO22MgO+C产生黑色和白色固体22. 锌粒和稀盐酸反应Zn+2HClZnCl2+H2↑实验室制取H223. 锌粒和稀硫酸反应Zn+H2SO4ZnSO4+H2↑实验室制取H224. 铁钉和稀盐酸反应Fe+2HClFeCl2+H2↑Fe元素从0价变成+2价25. 铁钉和稀硫酸Fe+H2SO4FeSO4+H2↑26. 铁丝和硫酸铜溶液反应Fe+CuSO4FeSO4+Cu铁丝表面产生红色固体27. 铜丝和硝酸银溶液反应Cu+2AgNO3Cu(NO3)2+2Ag铜丝表面产生银白色固体四、复分解反应反应名称化学方程式备注28. 氢氧化镁治疗胃“泛酸”Mg(OH)2+2HClMgCl2+2H2O29. 大理石或石灰石和稀盐酸反应CaCO3+2HClCaCl2+H2O+CO2↑实验室制取CO230. 硝酸银溶液和稀盐酸反应AgNO3+HClAgCl↓+HNO3产生白色沉淀31. 氯化钡溶液和稀硫酸反应BaCl2+H2SO4BaSO4↓+2HCl产生白色沉淀32. 硫酸铜溶液和氢氧化钠溶液反应CuSO4+2NaOHCu(OH)2↓+Na2SO4产生蓝色沉淀33. 氯化铁溶液和氢氧化钠溶液FeCl3+3NaOHFe(OH)3↓+3NaCl产生红褐色沉淀34. 碳酸钠溶液和石灰水反应Na2CO3+Ca(OH)2CaCO3↓+2NaOH35. 硫酸铜溶液和熟石灰制取农药波尔多液CuSO4+Ca(OH)2Cu(OH)2↓+CaSO436. 碳酸钠溶液和足量盐酸反应Na2CO3+2HCl2NaCl+H2O+CO2↑37. 氯化钠溶液和硝酸银溶液反应NaCl+AgNO3AgCl↓+NaNO3AgCl不溶于HNO338. 硫酸钠溶液和氯化钡溶液反应Na2SO4+BaCl2BaSO4↓+2NaClBaSO4不溶于HNO3五、其他反应反应名称化学方程式备注39. 甲烷燃烧CH4+2O2CO2+2H2O产生淡蓝色火焰40. 少量二氧化碳通入石灰水CO2+Ca(OH)2CaCO3↓+H2O产生白色沉淀;石灰水在空气中变质;石灰水用于检验CO241. 少量二氧NaOH在空气中变化碳和氢氧化钠溶液反应CO2+2NaOHNa2CO3+H2O质;NaOH溶液用于吸收CO242. 氢氧化钠溶液吸收二氧化硫SO2+2NaOHNa2SO3+H2ONa2SO3名称是亚硫酸钠43. 一氧化碳还原氧化铜CO+CuOCu+CO2产生红色固体尾气需要燃烧处理,防止CO污染空气44. 一氧化碳还原氧化铁3CO+Fe2O32Fe+3CO2工业炼铁的主要反应45. 盐酸除铁锈Fe2O3+6HCl2FeCl3+3H2O溶液变成棕黄色46. 硫酸溶解氧化铜固体CuO+H2SO4CuSO4+H2O溶液变成蓝色*固体小颗粒分散到气体中形成烟;小液滴分散到气体中形成雾。

化学一到八单元化学方程式1.镁在空气中燃烧:2Mg + O2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧:C + O2 点燃CO29. 碳在氧气中不充分燃烧:2C + O2 点燃2CO10. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O13. 水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑16. 加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18. 高温煅烧石灰石:CaCO3 高温CaO + CO2↑19. 氢气还原氧化铜:H2 + CuO 加热Cu + H2O20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温3Fe + 4CO226. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl=== ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2o38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl ↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓+ Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓+ 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓+ 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓+ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓+ 2NaCl72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO41、化合反应.1、镁在空气中燃烧2、铁在空气中燃烧3、铜在空气中加热4、铝在空气中燃烧5、氢气在空气中燃烧6、红磷在空气中燃烧7、硫粉在空气中燃烧8、碳在氧气中充分燃烧9、碳在氧气中不充分燃烧10、一氧化碳在氧气中燃烧11、二氧化碳溶解于水12、二氧化碳通过炽热的碳层2、分解反应.1、水在直流电的作用下分解2、氧化汞受热分解3、加热高锰酸钾4、双氧水在二氧化锰的作用下分解5、碳酸不稳定而分解6、高温煅烧石灰3、置换反应.1、氢气还原氧化铜2、木炭还原氧化铜3、焦炭还原氧化铁4、锌和稀硫酸反应5、铁和稀硫酸反应6、镁和稀硫酸反应7、铝和稀硫酸反应8、锌和稀盐酸反应9、铁和稀盐酸反应10、镁和稀盐酸反应11、铝和稀盐酸反应12、铁和硫酸铜溶液反应13、铝和硫酸铜溶液反应14、铜和硝酸银溶液反应15、镁和氧化铜反应4、复分解反应.1、氢氧化钠与硫酸铜反应2、大理石与稀盐酸反应3、碳酸钠与稀盐酸反应5、其它反应.1、一氧化碳还原氧化铜2、用赤铁矿炼铁3、甲烷在空气中燃烧4、酒精在空气中燃烧。

初三60个必背化学式化学是一门研究物质性质、组成以及变化的科学,它在现代社会中扮演着重要的角色。
为了更好地理解化学原理和应用,初三的学生应该掌握一些基本的化学式。
下面是60个初三必背的化学式,分为无机化学和有机化学两个部分。
一、无机化学1.水(H2O)2.氧气(O2)3.二氧化碳(CO2)4.氯化钠(NaCl)5.硫酸(H2SO4)6.硝酸(HNO3)7.苯酚(C6H5OH)8.硝化甘油(C3H5(NO3)3)10.氨(NH3)11.碳酸氢钠(NaHCO3)12.硝酸钾(KNO3)13.硫酸铜(CuSO4)14.亚硝酸钠(NaNO2)15.硫酸铁(Fe2(SO4)3)16.亚硫酸钠(Na2SO3)17.硝酸钠(NaNO3)18.氯化钾(KCl)19.碘化钾(KI)20.硫酸钠(Na2SO4)21.重铬酸钾(K2Cr2O7)22.氢氧化钠(NaOH)24.一氧化二氮(N2O)25.氟化钙(CaF2)26.氧化钙(CaO)27.氧化铜(CuO)28.五氧化二磷(P2O5)29.硝酸银(AgNO3)30.氮气(N2)31.二氧化硫(SO2)32.二氯甲烷(CH2Cl2)33.氯气(Cl2)34.氮氧化物(NOx)35.硝酸盐(NO3-)36.硫化氢(H2S)38.三氯甲烷(CHCl3)39.碳酸钙(CaCO3)40.二氯乙烯(C2H2Cl2)41.二硫化碳(CS2)42.碳酸亚铁(FeCO3)43.高锰酸钾(KMnO4)44.磷酸二氢钠(NaH2PO4)45.醋酸(CH3COOH)二、有机化学46.乙烯(C2H4)47.丙烷(C3H8)48.乙醇(C2H5OH)49.乙酸(CH3COOH)50.乙酸乙酯(C4H8O2)51.甲醇(CH3OH)52.甲酸(HCOOH)53.甲酸甲酯(HCOOCH3)54.甲酸乙酯(HCOOC2H5)55.乙酸丙酯(C5H10O2)56.丙酮(C3H6O)57.氯仿(CHCl3)58.苯(C6H6)59.甲苯(C7H8)60.醋酐(C4H6O3)这些化学式涵盖了初三学生需要了解的基本无机和有机化学化合物。

有机化学基础反应方程式汇总1. 甲烷(烷烃通式:C n H 2n +2)甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 2 点燃CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+Cl 光照3Cl(一氯甲烷)+HClCH 3Cl+Cl 光照2Cl 2(二氯甲烷)+HClCH 2Cl 2+Cl 光照3(三氯甲烷)+HCl (CHCl 3又叫氯仿)CHCl 3+Cl 光照4(四氯化碳)+HCl(3)分解反应甲烷分解:CH 高温22. 乙烯(烯烃通式:C n H 2n )乙烯的制取:CH 3CH 2浓硫酸170℃2=CH 2↑+H 2O(消去反应)(1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 点燃2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2Br —CH 2Br与氢气加成:CH 2=CH 2+H 2催化剂CH 3CH 3 与氯化氢加成:CH 2=CH 2+HCl 催化剂CH 3CH 2Cl 与水加成:CH 2=CH 2+H 2O催化剂CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n CH 2=CH 2催化剂 [CH 2—CH 2 ] n 适当拓展:CH 3CH =CH 2+Cl 3׀ Cl CH -׀ ClCH 2 CH 3CH =CH 2+H 2催化剂CH 3CH 2CH 3 CH 3CH =CH 2+HCl 催化剂CH 3CH 2CH 2Cl 或CH 3׀ ClCHCH 3 CH 3CH =CH 2+H 2O 催化剂CH 3CH 2CH 2OH 或CH 3׀ OHCHCH 3 n CH 2=CH -CH 3催化剂 [CH 2—׀ CH 3CH ] n (聚丙烯) 3. 乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。

化学方程式大全一、概述化学方程式是化学反应过程中的数学描述,它以化学物质的化学式为基础,用符号和数字表示化学反应的开始物质、产物和反应条件。
在化学实验或工业生产中,化学方程式是非常重要的,可以帮助我们了解反应的原理和过程,指导实验操作和工艺优化。
二、化学方程式大全1. 氧气和氢气的反应2H2 (g) + O2 (g) → 2H2O (l)实验现象:氢气燃烧时发出“噼噼啪啪”的声音,并产生水蒸气。
2. 碳酸氢铵分解反应NH4HCO3 (s) → NH3 (g) + H2O (g) + CO2 (g)实验现象:固体碳酸氢铵加热后产生氨气、水蒸气和二氧化碳气体,同时产生白色沉淀。
3. 硫酸与钠碱的中和反应H2SO4 (aq) + 2NaOH (aq) → Na2SO4 (aq) + 2H2O (l)实验现象:硫酸和钠碱混合后产生大量热量,溶液升温,现象有起泡、溶液变热等。
4. 铜与硝酸的反应Cu (s) + 4HNO3 (aq) → Cu(NO3)2 (aq) + 2NO2 (g) + 2H2O (l)实验现象:固体铜在硝酸中反应产生褐色气体,并有溶液颜色变化。
5. 铁与氯化氢的反应Fe (s) + 2HCl (aq) → FeCl2 (aq) + H2 (g)实验现象:固体铁与盐酸反应生成氢气,并有溶液颜色变化。
6. 合成甲烷反应2H2 (g) + CO2 (g) → CH4 (g) + 2H2O (g)实验现象:氢气和二氧化碳反应生成甲烷气体,同时有水蒸气产生。
7. 氢氧化钠与盐酸的中和反应NaOH (aq) + HCl (aq) → NaCl (aq) + H2O (l)实验现象:氢氧化钠与盐酸混合后产生大量热量,同时溶液变热,有溶液颜色变化。
8. 碳与氧气的反应C (s) + O2 (g) → CO2 (g)实验现象:碳和氧气反应产生二氧化碳气体,并伴随着明亮的火焰。
9. 氢气与氯气的反应H2 (g) + Cl2 (g) → 2HCl (g)实验现象:氢气和氯气混合后发生爆炸性反应,产生盐酸气体。

九年级化学全册化学式和化学方程式汇总单质化合物酸盐有机物其他:氨气NH3常见物质的俗名常见的化学方程式说明:用楷体标示的内容不是重点。
化合反应•••••••••••••••红磷在空气中燃烧,产生白烟:4P+5O2—白磷自燃:4P+5O2=2P.O<木炭充分燃烧:C+O2—CO2木炭不充分燃烧:2C+O2堂暨2CO硫在空气(氧气)中燃烧:S+O o-SO2铁丝在氧气中燃烧:3Fe+2O o—Fe3O4铝在氧气中燃烧:4A1+3O2—2A12O3铝不易生锈的原因:4Al+3O.=2Al2O3镁在空气中燃烧:2Mg+O o—2MgO铜在空气中加热:2Cu+O2-2CuO氢气在氧气中燃烧:2H2+O詈2H2O将CO2变成CO:C+CO2-2CO氧化碳溶于水形成碳酸:CO2+H2O=H2CO32P2O5用生石灰制取熟石灰:CaO+H2O=Ca(OH)2一氧化碳燃烧:2CO+O2-2CO2向澄清的石灰水中通入过量的二氧化碳,变浑浊的石灰水又变澄清:CaCO3+CO2+H2O=Ca(HCO3)2氢气在氯气中燃烧:亘整占燃钠在氯气中燃烧:—镁在氮气中燃烧:工暨(注意氮元素的化合价)上面三个化学方程式给我们的启示是:燃烧不一定有氧气参与。
分解反应汞在空气中加热:2Hg+O.=^=2HgO氧化汞加强热:2HgO-2Hg+OJ分解过氧化氢制取氧气(实验室制取氧气的反应原理之一):2H2O2胆必2H2O+OJ加热高锰酸钾制取氧气(实验室制取氧气的反应原理之一):2KMnO^JLK2MnO4+MnO2+OJ加热氯酸钾制取氧气(实验室制取氧气的反应原理之一):2KClO3喽2KC1+302T••••••••分解过氧化氢制取氧气符合绿色化学的观念,是三种方案中最安全、最节约资源的一种。
电解水生成氢气和氧气:2H20—2HJ+OJ工业制取生石灰和C02的反应原理:CaC03—CaO+CO.T干粉灭火器的反应原理(碳酸氢钠受热分解):2NaHC03—Na2cO3+H2O+CO2T碱式碳酸铜受热分解:Cu2(0H)2C03—2CuO+H2O+COJ过氧化氢溶液不稳定,发生分解:2H2O2=2H2O+O2T碳酸不稳定,分解成水和二氧化碳:H2co3=H2O+CO2T碳铵(碳酸氢铵)“消失”并发出刺激性气味:NH4HCO3=NH3T+C02t+H20石笋、钟乳石的形成过程:CaCO3+CO2+H2O=Ca(HCO3)2Ca(HCO3)2=CaCOJ+CO2T+H2O置换反应氢气还原氧化铜:H2+CuO=^=Cu+H20木炭还原氧化铜:C+2CuO-2Cu+C02木炭还原氧化铁:3C+2Fe o O3-4Fe+3COJ水煤气的形成:C+H 2O —H 2+CO (注意没有气体生成符号实验室制取氢气的反应原理:Zn+H 2so 4=ZnSO 4+HJ 金属与稀盐酸的反应 ■ 2X +2HCl=2X Cl+H 2T(X 是+1价的金属,包括K 、Na )■ X +2HCl=X C12+H 2T (X 是+2价的金属,包括Ca 、Mg 、Zn 、Fe ) ■ 2Al+6HCl=2AlCl 3+3HJ •金属与稀硫酸的反应■ 2X +H 2SO 4=X 2sO 4+H 2t(X 是+1价的金属,包括K 、Na )■ X +H 2so 4=X SO 4+H 2T (X 是+2价的金属,包括Ca 、Mg 、Zn 、Fe ) ■ 2Al+3H 2so 4=Al 2(SO 4)3+3HJ •金属与盐溶液的反应■镁♦3Mg+2AlCl 3=3MgCl 2+2Al 3Mg+Al 2(so 4)3=3Mgso 4+2Al 3Mg+2Al(No 3)3=3Mg(No 3)2+2Al♦ Mg+X Cl2=MgCl 2+X (X 是+2价的金属,包括Zn 、Fe 、Cu ) ♦ Mg+X SO 4=MgSO 4+X (X 是+2价的金属,包括Zn 、Fe 、Cu )♦ Mg+X (NO 3)2=Mg(NO 3)2+X (X 是+2价的金属,包括Zn 、Fe 、Cu ) ♦ Mg+2AgNo 3=Mg(No 3)2+2Ag■铝 ♦ 2Al+3X Cl 2=2AlCl 3+3X (X 是+2价的金属,包括Zn 、Fe 、Cu ) ♦ 2Al+3X SO 4=Al 2(SO 4)3+3X (X 是+2价的金属,包括Zn 、Fe 、Cu ) ♦ 2Al+3X (NO 3)2=2Al(NO 3)3+3X (X 是+2价的金属,包括Zn 、Fe 、Cu ) ♦ Al+3AgNo 3=Al(No 3)3+3Ag■锌 ♦ Zn+X Cl2=ZnCl 2+X (X 是+2价的金属,包括Fe 、Cu ) ♦ Zn+X SO 4=ZnSO 4+X (X 是+2价的金属,包括Fe 、Cu )♦ Zn+X (NO 3)2=Zn(NO 3)2+X (X 是+2价的金属,包括Fe 、Cu ) ♦ Zn+2AgNo 3=Zn(No 3)2+2Ag■铁♦ Fe+CuCl 2=FeCl 2+Cu ♦ Fe+Cuso 4=Feso 4+Cu♦ Fe+Cu(No 3)3=Fe(No 3)3+Cu ♦ Fe+2AgNo 3=Fe(No 3)2+2Ag ■铜:Cu+2AgNO 3=Cu(NO 3)2+2Ag■K 、不遵循这样的置换反应,它们与盐溶液反应时,会先和水反应生成对应的碱,然后再和盐溶液反应。
初中化学方程式总结表1、碳铵受热分解:NH4HCO3 = NH3↑+ H2O + CO2↑2、铜绿受热分解:Cu2(OH)2CO3 = 2CuO + H2O +CO2↑3、铜绿和稀盐酸反应:Cu2(OH)2CO3 + 4HCl = 2CuCl2 + 3H2O +CO2↑4、红磷或白磷燃烧:4 P + 5 O2 点燃 2 P2O5 (黄色火焰,放热,生成白色固体)5、硫燃烧:S + O2 点燃SO2(空气中淡蓝色火焰,氧气中蓝紫色火焰)6、镁燃烧:2 Mg + O2 点燃2MgO (放出耀眼的白光,放热,生成白色固体)7、铁丝燃烧:3 Fe + 2 O2 点燃Fe3O4 (剧烈燃烧,火星四射,放热,生成黑色固体)8、铜丝加热:2Cu + O2(紫红色固体变黑)9、氧气充足时碳燃烧: C + O2 点燃CO210、氧气不足时碳燃烧: 2 C + O2 点燃 2 CO11、实验室用高锰酸钾制氧气:2KMnO4 △K2MnO4 + MnO2 + O2↑12、实验室用氯酸钾制氧气:2KClO △2KCl + 3O2↑(MnO2作催化剂)13、实验室用过氧化氢溶液制氧气:2H2O2== 2H2O + O2↑(MnO2作催化剂) (反应放热)14、电解水:2 H2O 通电O2↑+ 2H2↑(正氧负氢,体积比1:2,质量比8:1)15、氢气燃烧(氢气爆炸):2 H2 + O2 点燃 2 H2O16、实验室制CO2:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑(药品:大理石/石灰石和稀盐酸)17、工业制二氧化碳:CaCO3 高温CaO + CO2 ↑18、二氧化碳的检验:CO2 + C a(O H)2= CaCO3↓+ H2O19、二氧化碳与水反应:CO2 + H2O = H2CO320、碳酸分解:H2CO3 = CO2↑+ H2O21、CO燃烧:2 CO + O2点燃 2 CO222、碳还原二氧化碳:C+CO2 高温 2 CO23、碳还原氧化铜:C+2 CuO 高温 2 Cu + CO2↑24、氢气还原氧化铜:H2 + CuO === Cu + H2O25、CO还原CuO:CO + CuO △Cu + CO226、CO还原Fe2O3:3CO + Fe2O3高温2Fe + 3CO2MnO227、CO还原Fe3O4:4CO + Fe3O4高温3Fe + 4CO228、甲烷燃烧:CH4 + 2O2 点燃CO2 + 2H2O29、乙醇(酒精)燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O30、氢气在氯气中燃烧:H2 + Cl2点燃2HCl31、浓盐酸和浓氨水相遇生成白烟:HCl + NH3 == NH4Cl酸+ 活泼金属→盐+ 氢气(反应放热)32、实验室制取氢气:Zn + 2HCl = ZnCl2 + H2↑Zn + H2S O4= ZnS O4+ H2↑33、镁和稀酸反应:Mg+ 2HCl =MgCl2 + H2↑Mg + H2SO4 = MgSO4 + H2↑34、铁和稀酸反应:Fe + 2HCl = FeCl2 + H2↑Fe + H2SO4 = FeSO4 + H2↑35、铝和稀酸反应:2Al+6HCl = 2AlCl3+3H2↑2Al+3H2SO4 =Al2(SO4)3 + 3 H2↑酸 + 金属氧化物→盐+ 水36、用酸去除铁锈:Fe2O3+6HCl==2FeCl3+3H2O Fe2O3+3H2SO4==Fe2(SO4)3+3H2O(红棕色固体消失,溶液由无色变成黄色)37、硫酸和氧化铜反应:CuO+H2SO4==CuSO4+H2O (黑色固体消失,溶液由无色变成蓝色)38、硝酸和氧化锌反应:ZnO+2HNO3==Zn(NO3)3+H2O39、硫酸和氧化铝反应:Al2O3 + 3H2SO4 == Al2(SO4)3 + 3H2O40、盐酸和氧化镁反应:MgO + 2HCl == MgCl2 + H2O酸 + 碱→盐+ 水(反应放热)41、烧碱和酸反应:NaOH+HCl==NaCl+H2O 2NaOH+H2SO4==Na2SO4+2H2O42、蓝色沉淀和酸的反应:Cu(OH)2+2HCl==CuCl2+2H2O Cu(OH)2+H2SO4==CuSO4+2H2O43、氢氧化钡和硫酸的反应:Ba(OH)2+H2SO4==BaSO4↓+2H2O44、石灰乳和稀盐酸的反应:Ca(OH)2+2HCl==CaCl2+2H2O45、氢氧化镁治疗胃酸过多:Mg(OH)2+2HCl==MgCl2+2H2O46、氨水和稀硫酸的反应:2NH3·H2O + H2SO4 == (NH4)2SO4 + 2H2O酸 + 盐→新酸+ 新盐(酸 + 碳酸盐→盐+ 水+ 二氧化碳)47、稀盐酸和硝酸银反应:HCl+AgNO3== AgCl↓+HNO348、稀硫酸和氯化钡反应:H2SO4+BaCl2==BaSO4↓+2HCl49、稀硫酸和硝酸钡反应:H2SO4 + Ba(NO3)2 ==BaSO4↓+2HNO350、纯碱和稀盐酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑51、小苏打和稀盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑碱 + 非金属氧化物→盐+ 水(非基本反应类型)52、火碱溶液吸收CO2:2NaOH + CO2 = Na2CO3 + H2O53、火碱溶液吸收SO2:2NaOH + SO2 = Na2SO3 + H2O54、石灰水吸收SO2:Ca(OH)2 + SO2 = CaSO3↓+ H2O碱 + 盐→新碱+ 新盐(碱 + 铵盐→新盐+ 水+ 氨气)55、配制波尔多液:CuSO4+Ca(OH)2==Cu(OH)2↓+CaSO456、纯碱制烧碱:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH Ba(OH)2+Na2CO3==BaCO3↓+2NaOH57、氯化铁和烧碱混合:FeCl3+3NaOH==Fe(OH)3↓+3NaCl58、氯化镁和石灰水混合:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl259、苛性钠和氯化铵混合加热:NaOH+NH4Cl==NaCl+NH3↑+H2O60、熟石灰和硫酸铵反应:Ca(OH)2+(NH4)2SO4==CaSO4+2NH3↑+2H2O61、硫酸镁和氢氧化钡反应:MgSO4 + Ba(OH)2 == BaSO4↓+ Mg(OH)2↓62、硫酸铵和氢氧化钡反应:(NH4)2SO4 + Ba(OH)2 == BaSO4↓ + 2NH3↑ + 2H2O金属 + 盐溶液→新金属+ 新盐63、湿法炼铜:Fe + CuSO4 = Cu + FeSO464、锌和硫酸亚铁反应:Zn + FeSO4 = Fe + ZnSO465、铜与硝酸银反应:2AgNO3 + Cu = 2Ag+ Cu(NO3)266、铝与硫酸铜反应: 2Al + 3CuSO4 = 3Cu + Al2(SO4)3盐1 + 盐2 →新盐1 + 新盐267、氯化钠和硝酸银反应:NaCl+AgNO3==AgCl↓+NaNO368、硫酸钠和氯化钡反应:Na2SO4+BaCl2==BaSO4↓+2NaCl69、纯碱和氯化钡反应:Na2CO3 + BaCl2 == BaCO3↓+2NaCl70、纯碱和氯化钙反应:Na2CO3 + CaCl2 ==CaCO3↓+2NaCl钙循环高温71、制取生石灰:CaCO3 == CaO + CO2↑72、生石灰制取熟石灰(反应放热):CaO + H2O = Ca(OH)273、熟石灰生成碳酸钙:CO 2 + C a (O H )2 = CaCO 3↓ + H 2O 常见的盐74、电解食盐水: 2NaCl + 2H 2O == 2NaOH + H 2↑ + Cl 2↑ 侯德榜制碱法75、NaCl + NH 3 +CO 2 + H 2O === NaHCO 3↓ + NH 4Cl(先通氨气,溶液呈碱性,有利于吸收CO2,提高产率) 76、2NaHCO 3 == Na 2CO 3 + H 2O +CO 2↑77、纯碱溶液中持续通入二氧化碳:Na 2CO 3 + H 2O +CO 2 == 2NaHCO 378、胆矾的生成:CuSO 4 + 5H 2O == CuSO 4·5H 2O (白色固体变蓝色)79、可燃冰完全燃烧:CH 4·nH 2O + 2O 2 == CO 2 + (2+n)H 2O80、光合作用: 6CO 2 + 6H 2O == C 6H 12O 6 + 6O 2 81、呼吸作用: C 6H 12O 6 + 6O 2 == 6CO 2 + 6H 2O82、硫酸型酸雨的形成:① 2SO 2 + O 2 == 2SO 3 SO 3 + H 2O == H 2SO 4② SO 2+H 2O == H 2SO 3 2H 2SO 3 + O 2 == 2H 2SO 4 通电点燃 光照 叶绿素 酶尘埃。
中学化学方程式大全一、非金属单质(F2、Cl2、O2、S、N2、P、C、Si)(1)、氧化性F2 + H2=2HF (冷暗处爆炸)2F2 +2H2O=4HF+O2Cl2 +H2=2HCl (光照或点燃)3Cl2 +2P点燃2PCl3Cl2 +PCl3△PCl5Cl2 +2Na点燃2NaCl3Cl2 +2Fe点燃2FeCl3Cl2 +2FeCl2=2FeCl3Cl2+Cu点燃CuCl2Cl2+2NaBr=2NaCl+Br2Cl2 +2NaI =2NaCl+I2Cl2 +Na2S=2NaCl+S↓Cl2 +H2S=2HCl+S↓Cl2+SO2 +2H2O=H2SO4 +2HCl Cl2 +H2O2=2HCl+O22O2 +3Fe点燃Fe3O4O2+K △2S+H2△H2S2S+C △2S+Fe △FeSS+2Cu △Cu2S3S+2Al △Al2S3S+Zn △ZnSN2+3H2催化剂高温高压2NH3N2+3Mg △Mg3N2N2+6Na=2Na3NP4+6H2△4PH3(2)、还原性S+O2点燃SO2N2+O2=2NO(放电)4P+5O2点燃P4O10(常写成P2O5)2P+3X2=2PX3 (X表示F2、Cl2、Br2) PX3+X2=PX5C+2F2=CF4C+2Cl2=CCl42C+O2(少量)点燃2COC+O2(足量)点燃CO2C+CO2△2COC+H2O高温CO+H2(生成水煤气) 2C+SiO2高温Si+2CO↑(制得粗硅) Si(粗)+2Cl2高温SiCl4(SiCl4+2H2高温Si(纯)+4HCl)Si(粉)+O2△2Si+C △SiC(金刚砂)Si+2NaOH+H2O=Na2SiO3+2H2↑(3)、歧化Cl2+H2O=HCl+HClO(加酸抑制歧化、加碱或光照促进歧化)Cl2+2NaOH=NaCl+NaClO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热、浓)=5KCl+KClO3+3H2O3S+6NaOH △2Na2S+Na2SO3+3H2O3C+CaO 电炉CaC2+CO↑3C+SiO2电炉SiC+2CO↑二、金属单质(Na、Mg、Al、Fe)(1)、还原性2Na+H2=2NaH4Na+O2=2Na2O2Na2O+O2△2Na2O22Na+O2△Na2O22Na+S=Na2S(爆炸)2Na+2H2O=2NaOH+H2↑2Na+2NH3=2NaNH2+H24Na+TiCl4(熔融)=4NaCl+TiMg+Cl2=MgCl2Mg+Br2=MgBr22Mg+O2点燃2MgOMg+S=MgSMg+2H2O=Mg(OH)2+H2↑2Mg+CO2点燃2MgO+C 2Mg+SiO2点燃2MgO+Si Mg+H2S=MgS+H2Mg+H2SO4=MgSO4+H2↑2Al+3Cl2△2AlCl34Al+3O2点燃2Al2O3(钝化)4Al+3MnO2高温2Al2O3+3Mn 2Al+Cr2O3高温Al2O3+2Cr2Al+Fe2O3高温Al2O3+2Fe2Al+3FeO △Al2O3+3Fe2Al+6HCl=2AlCl3+3H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑2Al+6H2SO4(浓)△Al2(SO4)3+3SO2↑+6H2O(Al、Fe、C在冷、浓的H2SO4、HNO3中钝化) Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O2Al+2NaOH+2H2O=2NaAlO2+3H2↑2Fe+3Br2=2FeBr3Fe+I2△2Fe+S △FeS3Fe+4H2O(g)高温Fe3O4+4H2 Fe+2HCl=FeCl2+H2↑Fe+CuCl2=FeCl2+Cu三、非金属氢化物(HF、HCl、H2O、H2S、NH3) (1)、还原性4HCl(浓)+MnO2△MnCl2+Cl2↑+2H2O16HCl+2KMnO4=2KCl+2MnCl2↑+5Cl2+8H2O 2H2O+2F2=4HF+O22H2S+3O2(足量)=2SO2+2H2O2H2S+O2(少量)=2S↓+2H2O2H2S+SO2=3S+2H2O2NH3+3Cl2=N2+6HCl8NH3+3Cl2=N2+6NH4Cl4NH3+5O2催化剂△4NO+6H2O4NH3+6NO催化剂△5N2+6HO(用氨清除NO)NaH+H2O=NaOH+H2↑(2)、酸性4HF+SiO2=SiF4↑+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量) H2S+CuCl2=CuS↓+2HCl(3)、碱性NH3+HCl=NH4Cl(白烟)NH3+HNO3=NH4NO3(白烟)2NH3+H2SO4=(NH4)2SO4NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl(侯氏制碱法)(此反应用于工业制备小苏打、苏打)(4)、不稳定性2HI △H2+I22H2O电解2H2↑+O2↑2H2O2=2H2O+O2↑H2S △H2+S四、非金属氧化物(1)、低价态的还原性2SO2+O2催化剂△2SO32SO2+O2+2H2O=2H2SO4(这是SO2在大气中缓慢发生的环境化学反应) SO2+Cl2+2H2O=H2SO4+2HClSO2+Br2+2H2O=H2SO4+2HBrSO2+I2+2H2O=H2SO4+2HI2NO+O2=2NO2NO+NO2+2NaOH=2NaNO2+H2O(用于制硝酸工业中吸收尾气中的NO和NO2) 2CO+O2点燃2CO2CO+CuO △23CO+Fe2O3△2CO+H2O催化剂△CO2+H2(2)、氧化性SO2+2H2S=3S↓+2H2O(CO2不能用于扑灭由Mg、Ca、Ba、Na、K等燃烧的火灾) (3)、与水的作用SO2+H2O=H2SO3SO3+H2O=H2SO43NO2+H2O=2HNO3+NON2O5+H2O=2HNO3P2O5+H2O(冷)=2HPO3P2O5+3H2O(热)=2H3PO4(P2O5极易吸水、可作气体干燥剂CO2+H2O=H2CO3(4)、与碱性物质的作用SO2+2NH3+H2O=(NH4)2SO3SO2+ (NH4)2SO3+H2O=2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2、再用H2SO4处理2NH4HSO3+H2SO4=(NH4)2SO4+2H2O+2SO2↑生成的硫酸铵作化肥、SO2循环作原料气)SO2+Ca(OH)2=CaSO3↓+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)CO2+2NaOH(过量)=Na2CO3+H2OCO2(过量)+NaOH=NaHCO3CO2+Ca(OH)2(过量)=CaCO3↓+H2O2CO2(过量)+Ca(OH)2=Ca(HCO3)2CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3CO2+C6H5ONa+H2O=C6H5OH+NaHCO3SiO2+CaO高温CaSiO3SiO2+2NaOH=Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3高温Na2SiO3+CO2↑SiO2+CaCO3高温CaSiO3+CO2↑五、金属氧化物(1)、低价态的还原性FeO+4HNO3=Fe(NO3)3+NO2↑+2H2O(2)、氧化性Fe2O3+3H2=2Fe+3H2O (制还原铁粉)Fe3O4+4H2△2O(3)、与水的作用Na2O+H2O=2NaOH2Na2O2+2H2O=4NaOH+O2↑(4)、与酸性物质的作用Na2O+SO3=Na2SO4Na2O+CO2=Na2CO3Na2O+2HCl=2NaCl+H2O2Na2O2+2CO2=2Na2CO3+O2Na2O2+H2SO4(冷、稀)=Na2SO4+H2O2 MgO+SO3=MgSO4MgO+H2SO4=MgSO4+H2OAl2O3+3H2SO4=Al2(SO4)3+3H2O (Al2O3是两性氧化物Al2O3+2NaOH=2NaAlO2+H2O)FeO+2HCl=FeCl2+H2OFe2O3+6HCl=2FeCl3+3H2OFe3O4+8HCl(浓)△FeCl2+2FeCl3+4H2O六、含氧酸(1)、氧化性HClO+H2SO3=H2SO4+HCl(氧化性HClO>HClO2>HClO3>HClO4、但浓、热的HClO4氧化性很强)2H2SO4(浓)+C △CO2↑ +2SO2↑+2H2O2H2SO4(浓)+S △2↑+2H2OH2SO4(浓)、HNO3(浓)+Fe(Al) 室温或冷的条件下钝化6H2SO4(浓)+2Fe △Fe2(SO4)3+3SO2↑+6H2O2H2SO4(浓)+Cu △CuSO4+SO2↑+2H2OH2SO4(稀)+Fe=FeSO4+H2↑2H2SO3+2H2S=3S↓+2H2O4HNO3(浓)+C △CO2↑+4NO2↑+2H2O(2)、还原性H2SO3+X2+H2O=H2SO4+2HX (X表示Cl2、Br2、I2) 2H2SO3+O2=2H2SO4H2SO3+H2O2=H2SO4+H2O5H2SO3+2KMnO4=2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O=H2SO4+2FeCl2+2HCl(3)、酸性H2SO4(浓) +CaF2=CaSO4+2HF↑H2SO4(浓)+NaCl △NaHSO4+HCl↑H2SO4(浓) +2NaCl Na2SO4+2HCl↑(用HNO3和浓H2SO4不能制备H2S、HI、HBr、(SO2) 等还原性气体)H3PO4(浓)+NaBr=NaH2PO4+HBrH3PO4(浓)+NaI=NaH2PO4+HI(4)、不稳定性2HClO=2HCl+O2↑(见光或受热分解)4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)H4SiO4=H2SiO3+H2O七、碱(1)、低价态的还原性4Fe(OH)2+O2+2H2O=4Fe(OH)3(2)、与酸性物质的作用2NaOH+SO2(少量)=Na2SO3+H2ONaOH+SO2(足量)=NaHSO32NaOH+SiO2=Na2SiO3+H2O2NaOH+Al2O3=2NaAlO2+H2O2NaOH+Cl2=NaCl+NaClO+H2ONaOH+HCl=NaCl+H2ONaOH+H2S(足量)=NaHS+H2O2NaOH+H2S(少量)=Na2S+2H2O3NaOH+AlCl3=A l(O H)3↓+3NaClNaOH+Al(OH)3=NaAlO2+2H2ONaOH+NH4Cl △NaCl+NH3↑+H2O(3)、不稳定性Mg(OH)2△2O2Al(OH)3△2O3+3H2O2Fe(OH)3△2O3+3H2OCu(OH)2△CuO+H2O八、盐(1)、氧化性2FeCl3+Fe=3FeCl2强热2FeCl 3+Cu =2FeCl 2+CuCl 2(用于雕刻铜线路版)2FeCl 3+Zn =2FeCl 2+ZnCl 22FeCl 3+H 2S =2FeCl 2+2HCl+S ↓2FeCl 3+2KI =2FeCl 2+2KCl+I 2(2)、还原性2FeCl 2+Cl 2=2FeCl 33Na 2S+8HNO 3(稀)=6NaNO 3+2NO ↑+3S ↓+4H 2O3Na 2SO 3+2HNO 3(稀)=3Na 2SO 4+2NO ↑+H 2O2Na 2SO 3+O 2=2Na 2SO 4(3)、与碱性物质的作用MgCl 2+2NH 3·H 2O =Mg(OH)2↓+NH 4ClAlCl 3+3NH 3·H 2O =Al(OH)3↓+3NH 4ClFeCl 3+3NH 3·H 2O =Fe(OH)3↓+3NH 4Cl(4)、与酸性物质的作用Na 3PO 4+HCl =Na 2HPO 4+NaClNa 2HPO 4+HCl =NaH 2PO 4+NaClNaH 2PO 4+HCl =H 3PO 4+NaClNa 2CO 3+HCl =NaHCO 3+NaClNaHCO 3+HCl =NaCl+H 2O+CO 2↑3Na 2CO 3+2AlCl 3+3H 2O =2Al(OH)3↓+3CO 2↑+6NaCl 3NaHCO 3+AlCl 3=Al(OH)3↓+3CO 2↑+3NaCl(5)、不稳定性Na 2S 2O 3+H 2SO 4=Na 2SO 4+S ↓+SO 2↑+H 2ONH 4Cl △NH 3↑+HCl ↑ NH 4HCO 3△ NH 3↑+H 2O+CO 2↑ 2KNO 3 △2+O 2↑ 2Cu(NO 3)2△ 2CuO+4NO 2↑+O 2↑ 2KMnO 4△ K 2MnO 4+MnO 2+O 2↑ 2KClO 3 △2KCl+3O 2↑(MnO 2作催化剂) 2NaHCO 3 △ Na 2CO 3+H 2O+CO 2↑Ca(HCO 3)2 △CaCO 3+H 2O+CO 2↑CaCO 3 高温 CaO+CO 2↑ MgCO 3 高温MgO+CO 2↑ 有机化学反应方程式:甲烷 1、↑+−−→−+∆432CaO3CH CO Na NaOH COONa CH2、O H 2CO O 2CH 2224+−−→−+点燃3、HCl Cl CH Cl CH 324+−→−+光4、HCl Cl CH Cl Cl CH 2223+−→−+光5、HCl CHCl Cl Cl CH 3222+−→−+光6、HCl CCl Cl CHCl 423+−→−+光7、24H 2C CH +−−→−高温 乙烯8、O H CH CH OH CH CH 222C 17023+↑=−−→−--。
一.物质与氧气的反应:1单质与氧气的反应:1.镁在空气中燃烧:2Mg+O2点燃2MgO2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O43.铜在空气中受热:2Cu+O2加热2CuO4.铝在空气中燃烧:4Al+3O2点燃2Al2O35.氢气中空气中燃烧:2H2+O2点燃2H2O6.红磷在空气中燃烧:4P+5O2点燃2P2O57.硫粉在空气中燃烧:S+O2点燃SO28.碳在氧气中充分燃烧:C+O2点燃CO29.碳在氧气中不充分燃烧:2C+O2点燃2CO2化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO+O2点燃2CO211.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O12.酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O二.几个分解反应:13.水在直流电的作用下分解:2H2O通电2H2↑+O2↑14.加热碱式碳酸铜:Cu2OH2CO3加热2CuO+H2O+CO2↑15.加热氯酸钾有少量的二氧化锰:2KClO3====2KCl+3O2↑16.加热高锰酸钾:2KMnO4加热K2MnO4+MnO2+O2↑17.碳酸不稳定而分解:H2CO3===H2O+CO2↑18.高温煅烧石灰石:CaCO3高温CaO+CO2↑三.几个氧化还原反应:19.氢气还原氧化铜:H2+CuO加热Cu+H2O20.木炭还原氧化铜:C+2CuO高温2Cu+CO2↑21.焦炭还原氧化铁:3C+2Fe2O3高温4Fe+3CO2↑22.焦炭还原四氧化三铁:2C+Fe3O4高温3Fe+2CO2↑23.一氧化碳还原氧化铜:CO+CuO加热Cu+CO224.一氧化碳还原氧化铁:3CO+Fe2O3高温2Fe+3CO225.一氧化碳还原四氧化三铁:4CO+Fe3O4高温3Fe+4CO2四.单质、氧化物、酸、碱、盐的相互关系1金属单质+酸--------盐+氢气置换反应26.锌和稀硫酸反应:Zn+H2SO4===ZnSO4+H2↑27.铁和稀硫酸反应:Fe+H2SO4===FeSO4+H2↑28.镁和稀硫酸反应:Mg+H2SO4===MgSO4+H2↑29.铝和稀硫酸反应:2Al+3H2SO4===Al2SO43+3H2↑30.锌和稀盐酸反应:Zn+2HCl===ZnCl2+H2↑31.铁和稀盐酸反应:Fe+2HCl===FeCl2+H2↑32.镁和稀盐酸反应:Mg+2HCl===MgCl2+H2↑33.铝和稀盐酸反应:2Al+6HCl===2AlCl3+3H2↑2金属单质+盐溶液-------另一种金属+另一种盐34.铁和硫酸铜溶液反应:Fe+CuSO4===FeSO4+Cu35.锌和硫酸铜溶液反应:Zn+CuSO4===ZnSO4+Cu36.铜和硝酸汞溶液反应:Cu+HgNO32===CuNO32+Hg3碱性氧化物+酸--------盐+水37.氧化铁和稀盐酸反应:Fe2O3+6HCl===2FeCl3+3H2O38.氧化铁和稀硫酸反应:Fe2O3+3H2SO4===Fe2SO43+3H2O39.氧化铜和稀盐酸反应:CuO+2HCl====CuCl2+H2O40.氧化铜和稀硫酸反应:CuO+H2SO4====CuSO4+H2O41.氧化镁和稀硫酸反应:MgO+H2SO4====MgSO4+H2O42.氧化钙和稀盐酸反应:CaO+2HCl====CaCl2+H2O4酸性氧化物+碱--------盐+水43.苛性钠暴露在空气中变质:2NaOH+CO2====Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH+SO2====Na2SO3+H2O 45.苛性钠吸收三氧化硫气体:2NaOH+SO3====Na2SO4+H2O 46.消石灰放在空气中变质:CaOH2+CO2====CaCO3↓+H2O 47.消石灰吸收二氧化硫:CaOH2+SO2====CaSO3↓+H2O5酸+碱--------盐+水48.盐酸和烧碱起反应:HCl+NaOH====NaCl+H2O49.盐酸和氢氧化钾反应:HCl+KOH====KCl+H2O50.盐酸和氢氧化铜反应:2HCl+CuOH2====CuCl2+2H2O51.盐酸和氢氧化钙反应:2HCl+CaOH2====CaCl2+2H2O52.盐酸和氢氧化铁反应:3HCl+FeOH3====FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl+AlOH3====AlCl3+3H2O54.硫酸和烧碱反应:H2SO4+2NaOH====Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4+2KOH====K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4+CuOH2====CuSO4+2H2O57.硫酸和氢氧化铁反应:3H2SO4+2FeOH3====Fe2SO43+6H2O58.硝酸和烧碱反应:HNO3+NaOH====NaNO3+H2O6酸+盐--------另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3+2HCl===CaCl2+H2O+CO2↑60.碳酸钠与稀盐酸反应:Na2CO3+2HCl===2NaCl+H2O+CO2↑61.碳酸镁与稀盐酸反应:MgCO3+2HCl===MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+AgNO3===AgCl↓+HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑64.硫酸和氯化钡溶液反应:H2SO4+BaCl2====BaSO4↓+2HCl7碱+盐--------另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH+CuSO4====CuOH2↓+Na2SO4 66.氢氧化钠与氯化铁:3NaOH+FeCl3====FeOH3↓+3NaCl 67.氢氧化钠与氯化镁:2NaOH+MgCl2====MgOH2↓+2NaCl68.氢氧化钠与氯化铜:2NaOH+CuCl2====CuOH2↓+2NaCl69.氢氧化钙与碳酸钠:CaOH2+Na2CO3===CaCO3↓+2NaOH8盐+盐-----两种新盐70.氯化钠溶液和硝酸银溶液:NaCl+AgNO3====AgCl↓+NaNO3 71.硫酸钠和氯化钡:Na2SO4+BaCl2====BaSO4↓+2NaCl 五.其它反应:72.生石灰溶于水:CaO+H2O===CaOH274.氧化钠溶于水:Na2O+H2O====2NaOH76.硫酸铜晶体受热分解:CuSO4·5H2O加热CuSO4+5H2O77.无水硫酸铜作干燥剂:CuSO4+5H2O====CuSO4·5H2O锌和盐酸的反应:Zn+2HCl=ZnCl2+H2↑21、铁和盐酸:Fe+2HCl=FeCl2+H2↑22、铁和稀硫酸:Fe+H2SO4=FeSO4+H2↑23、氢气还原氧化铜:H2+CuO=△=Cu+H2O24、木炭还原氧化铜:C+2CuO=高温=2Cu+CO2↑25、碳还原氧化铁:3C+2Fe2O3=高温=4Fe+3CO2↑26、铁和硫酸铜溶液:Fe+CuSO4=Cu+FeSO427、铜和硝酸汞溶液:Cu+HgNO32=Hg+CuNO3228、氢气还原氧化铁:3H2+Fe2O3=△=2Fe+2H2O29、铝和稀硫酸:2Al+3H2SO4=Al2SO43+3H2↑30、钠和水反应:2Na+2H2O=2NaOH+H2↑四复分解反应31、大理石和稀盐酸实验室制CO2:CaCO3+2HCl=CaCl2+H2O+CO2↑32、氢氧化钠和硫酸铜:2NaOH+CuSO4=CuOH2↓+Na2SO433、碳酸钠和盐酸灭火器原理:Na2CO3+2HCl=2NaCl+H2O+CO2↑34、碳酸钾草木灰和盐酸:K2CO3+2HCl=2KCl+H2O+CO2↑35、盐酸和氢氧化钠中和反应:HCl+NaOH=NaCl+H2O36、硫酸和氢氧化钠溶液:H2SO4+2NaOH=Na2SO4+2H2O37、硫酸与氯化钡溶液:H2SO4+BaCl2=BaSO4↓+2HCl38、盐酸与硝酸银溶液:HCl+AgNO3=AgCl↓白+HNO339、氢氧化钠和氯化铁溶液:3NaOH+FeCl3=FeOH3↓红褐色+3NaCl40、碳酸钡和稀硝酸:BaCO3+2HNO3=BaNO32+CO2↑+H2O41、硫酸钠和氯化钡:Na2SO4+BaCl2=BaSO4↓+2Na Cl42、氯化钠和硝酸银:NaCl+AgNO3=AgCl↓+NaNO343、碳酸钠和石灰水:Na2CO3+CaOH2=CaCO3↓+2NaOH44、氢氧化铝和盐酸:AlOH3+3HCl=AlCl3+3H2O45、硝酸铵和氢氧化钠:NH4NO3+NaOH=△=NaNO3+H2O+NH3↑46、氢氧化铁和硫酸:2FeOH3+3H2SO4=Fe2SO4347、盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O48、氧化铜和硫酸:CuO+H2SO4=CuSO4+H2O五其他:49、二氧化碳使澄清石灰水变浑浊:CO2+CaOH2=CaCO3↓+H2O50、二氧化碳通入氢氧化钠溶液:CO2+2NaOH=Na2CO3+H2O51、用氢氧化钠溶液吸收二氧化硫:SO2+2NaOH=Na2SO3+H2O52、一氧化碳还原氧化铜:CO+CuO=△=Cu+CO253、一氧化碳还原氧化铁炼铁:3CO+Fe2O3=高温=2Fe+3CO254、甲烷在空气中燃烧:CH4+2O2=点燃=CO2+2H2O55、乙醇在空气中燃烧:C2H5OH+3O2=点燃=2CO2+3H2O56、甲醇在空气中燃烧:2CH3OH+3O2=点燃=2CO2+4H2OⅡ、金属活动性顺序表:KCaNaMgAlZnFeSnPbHCuHgAgPtAu———————————————————————→金属活动性由强逐渐减弱小结:1、只有排在H前面的金属才能置换出酸里的氢2、只有排在前面的金属才能将排在后面的金属从它的盐溶液中置换出来二、溶液的酸碱度——pH石蕊试液红紫蓝—————————————————————————————酚酞试液无无红01234567891011121314│└—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┘←————————————中性——————————————→六、金属1金属与氧气反应:40.镁在空气中燃烧:2Mg+O2点燃2MgO41.铁在氧气中燃烧:3Fe+2O2点燃Fe3O442.铜在空气中受热:2Cu+O2加热2CuO43.铝在空气中形成氧化膜:4Al+3O2=2Al2O32金属单质+酸--------盐+氢气置换反应44.锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑45.铁和稀硫酸Fe+H2SO4=FeSO4+H2↑46.镁和稀硫酸Mg+H2SO4=MgSO4+H2↑47.铝和稀硫酸2Al+3H2SO4=Al2SO43+3H2↑48.锌和稀盐酸Zn+2HCl==ZnCl2+H2↑49.铁和稀盐酸Fe+2HCl==FeCl2+H2↑50.镁和稀盐酸Mg+2HCl==MgCl2+H2↑51.铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑3金属单质+盐溶液-------新金属+新盐52.铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu53.锌和硫酸铜溶液反应:Zn+CuSO4==ZnSO4+Cu54.铜和硝酸汞溶液反应:Cu+HgNO32==CuNO32+Hg3金属铁的治炼原理:55.3CO+2Fe2O3高温4Fe+3CO2↑七、酸、碱、盐1、酸的化学性质1酸+金属--------盐+氢气见上2酸+金属氧化物--------盐+水56.氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O57.氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2SO43+3H2O58.氧化铜和稀盐酸反应:CuO+2HCl==CuCl2+H2O59.氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O3酸+碱--------盐+水中和反应60.盐酸和烧碱起反应:HCl+NaOH==NaCl+H2O61.盐酸和氢氧化钙反应:2HCl+CaOH2==CaCl2+2H2O62.氢氧化铝药物治疗胃酸过多:3HCl+AlOH3==AlCl3+3H2O63.硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O4酸+盐--------另一种酸+另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑65.碳酸钠与稀盐酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑67.硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl 2、碱的化学性质1碱+非金属氧化物--------盐+水68.苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O 69.苛性钠吸收二氧化硫气体:2NaOH+SO2==Na2SO3+H2O 70.苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O 71.消石灰放在空气中变质:CaOH2+CO2==CaCO3↓+H2O 72.消石灰吸收二氧化硫:CaOH2+SO2==CaSO3↓+H2O2碱+酸--------盐+水中和反应,方程式见上3碱+盐--------另一种碱+另一种盐73.氢氧化钙与碳酸钠:CaOH2+Na2CO3==CaCO3↓+2NaOH1盐溶液+金属单质-------另一种金属+另一种盐74.铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu2盐+酸--------另一种酸+另一种盐75.碳酸钠与稀盐酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑碳酸氢钠与稀盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑。
元素周期律及元素周期表中常考知识点一、化学方程式(一)置换反应1、金属置换金属2Al+Fe2O3Al2O3+2Fe 2Al+3FeO Al2O3+3FeFe+CuCl2===FeCl2+Cu Fe+Cu2+=Fe2++Cu2、非金属置换非金属--Cl2+2NaBr===2NaCl+Br2Cl2+2Br=2Cl+Br2Cl2+2HBr=2HCl+Br2 (Cl2气与HBr、HI、H2S、NH3气体不能共存)--Cl2+2KI===2KCl+I2Cl2+2I=2Cl+I2Cl2+Na2S===2NaCl+S↓Cl2+S2–=2Cl–+S↓Cl2+H2S===2HCl+S↓(水溶液中:Cl2+H2S=2H++2Cl–+S↓2H2S+O2(少量)2S↓+2H2O 2H2S+3O2(足量)2SO2+2H2O C+H2O CO+H2(生成水煤气)2C+SiO2Si+2CO(制得粗硅)2F2+2H2O===4HF+O22NH3+3Cl2===N2+6HCl 8NH3+3Cl2===N2+6NH4Cl3、金属置换非金属2Na+2H2O==2NaOH+H2↑2Na+2H2O=2Na++2OH―+H2↑Mg+2H2O Mg(OH)2+H2↑2Mg+CO22MgO+C2Al+6HCl===2AlCl3+3H2↑2Al+6H+=2Al3++3H2↑2Al+3H2SO4===Al2(SO4)3+3H2↑2Al+6H+=2Al3++3H2↑(Al,Fe在冷,浓的H2SO4,HNO3中钝化)3Fe+4H2O(g)Fe3O4+4H2↑Fe+2HCl===FeCl2+H2↑Fe+2H+=Fe2++H2↑4NO+6H2O4NH3+3O2(纯氧)2N2+6H2O 4NH3+5O2催化剂△4、与水作用产生气体:2F2+2H2O===4HF+O2C+H2O CO+H2(生成水煤气)2Na+2H2O==2NaOH+H2↑2Na+2H2O=2Na++2OH―+H2↑Mg+2H2O Mg(OH)2+H2↑3Fe+4H2O(g)Fe3O4+4H2↑3NO2+H2O===2HNO3+NO (NO2不是硝酸的酸酐)2Na2O2+2H2O===4NaOH+O2↑2Na2O2+2H2O=4Na++4OH–+O2↑(此反应分两步:Na2O2+2H2O===2NaOH+H2O2;2H2O2===2H2O+O2H2O2的制备可利用类似的反应:BaO2+H2SO4(稀)===BaSO4+H2O2)1. CaC2△2. 氯化铵固体和氢氧化钙固体实验室制取氨2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑3. 氯气的实验室制法MnO2 + 4HCl(浓) MnCl2 +Cl2↑+ 2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O16 H++10Cl-+2MnO4–=2Mn2++5Cl2↑+8H2O4.5. 亚硫酸钠与浓硫酸反应制备二氧化硫Na2SO3 +H2SO4(浓)===Na2SO4+H2O+SO2 ↑6. 乙烯实验室制法(浓硫酸作催化剂,脱水剂)CH3CH2H2O +CH2=CH2 ↑2H2SO4(浓)+C CO2↑+2SO2↑+2H2O4HNO3(浓)+C CO2↑+4NO2↑+2H2ONH4Cl NH3↑+HCl↑2HI H2+I2NH4HCO3NH3↑+H2O+CO2↑2KMnO4K2MnO4+MnO2+O2↑2KClO32KCl+3O2↑7. 2NaHCO3Na2CO3+H2O+CO2↑8.9. 苯与液溴反应(需铁作催化剂)+ Br2 +HBr10.11. 过氧化钠可用在呼吸面具和潜水艇中作为氧气来源 2Na 2O 2 + 2CO 2 = 2Na 2CO 3+ O 2 12.13. 电解熔融氧化铝制铝 2Al 2O 3Al + 3O 2↑ 电解熔融的氯化镁制镁MgCl 2电解Mg+Cl 2↑14. 氧化铝溶于盐酸Al 2O 3 + 6HCl2AlCl 3 +3H 2O15. 氧化铝溶于氢氧化钠溶液 Al 2O 3 + 2NaOH2NaAlO 2 +H 2O16. 氢氧化铝溶液中加盐酸Al(OH)3 + 3HCl = AlCl 3 + 3H 2O17. A l(OH)3与NaOH 溶液反应: Al(OH)3 + NaOH NaAlO 2 +2 H 2O 18. 铝离子与水反应生成氢氧化铝胶体 Al 3++3H 2OAl(OH)3(胶体)+3H +19. 铝片与稀盐酸反应2Al + 6HCl = 2AlCl 3 + 3H 2↑20. 铝与氢氧化钠溶液反应2Al + 2NaOH + 2H 2O = 2NaAlO 2 + 3H 2↑21. 铝与三氧化二铁高温下反应(铝热反应) 2Al + Fe 2O 3 高温2Fe + Al 2O 3NH 3+NaCl+H 2O+CO 2===NaHCO 3+NH 4Cl (侯德榜制碱:用于工业制备小苏打,苏打)(1)H 2:先后通过灼热的CuO 和CuSO 4,黑色的CuO 变红,白色CuSO 4粉末变蓝色。
中学化学方程式按字母排序A (2)Ba (3)C (3)F (6)H (7)I (10)K (10)L (11)Mg (11)N (11)O (12)P (12)A2Ag+H2S=Ag2S+H2↑银器遇硫化氢气体变黑2Ag+2Zn(OH)2Ag2O+Zn+H2O 银锌电池2Ag++Sn2+=2Ag+Sn4+工业化学镀选修2-662Ag2O4Ag+O2↑必修2-80Ag2O+H2O+Zn2Ag+Zn(OH)2锌银电池选修4-752AgBr+Na2S=Ag2S↓+2NaBr溴化银沉淀转化为硫化银黑色沉淀选修4-64AgCl+NaBr=AgBr↓+NaCl氯化银白色沉淀转化为溴化银沉淀选修4-642AgNO3+Na2CO3=2AgCl↓+ 2NaNO3必修1-080AgNO3+NaCl=AgCl↓+ NaNO3必修1-0802AgNO3+Cu=2Ag+Cu(NO3)24AgNO3+2H2O4Ag+O2↑+HNO3放氧生酸型AgNO3+NH3·H2O=AgOH↓+ NH4NO3配制银氨溶液AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+H2O 配制银氨溶液2Al+2NaOH+2H2O=2NaAlO2+3H2↑短周期中唯一能与碱溶液放出氢气的金属必修1-0472Al+6HCl=2AlCl3+3H2↑制氢气必修1-0504Al+3O22Al2O3铝可能成为新能源必修1-0502Al+Fe2O3Al2O3+2Fe 铝热反应焊接无缝钢轨必修2-812Al+3Cl22AlCl32Al+Cr2O3Al2O3+ 2Cr 工业制铬-铝热反应2Al+3H2SO4=Al2(SO4)3+3H2↑制氢气2Al+6H2SO4(浓、热)=Al2(SO4)3+3SO2↑+6H2O Al、Fe在冷、浓的H2SO4、HNO3中钝化Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O 浓HNO3的强氧化性4Al+3MnO22Al2O3+3Mn 工业制锰-铝热反应2Al(OH)3Al2O3+3H2O 必修1-055Al(OH)3+3HCl=AlCl3+3H2O 两性氢氧化物必修1-055Al(OH)3+NaOH=NaAlO2+2H2O 两性氢氧化物必修1-055Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4必修1-054Al2O3+6HCl=2AlCl3+3H2O 两性氧化物必修1-0542Al2O34Al+3O2↑ 工业电解制铝必修2-80Al2O3+2NaOH=2NaAlO2+H2O Al2O3是两性氧化物,工业提纯氧化铝选修2-61Al2O3+3H2SO4=Al2(SO4)3+3H2OAl4C3+12H2O=Al(OH)3+3CH4↑AlCl3+3NaOH=Al(OH)3↓+3NaCl 必修1-059AlCl3+6H2O+3NaAlO2=4Al(OH)3↓+3 NaCl 唯一的双水解产物相同2AlCl3+3H2O Al2O3+3HCl↑由溶液制备AlCl3晶体时,必须在氯化氢气氛中蒸干溶液2AlCl3+3H2O+3Na2CO3=2Al(OH)3↓+3CO2↑+6NaCl2AlCl3+6H2O+3Na2S=2Al(OH)3↓+3H2S↑+6HCl白色沉淀、臭鸡蛋气味气体AlCl3+3NaHCO3=Al(OH)3↓+3CO2↑+3NaClAlCl3+4NaOH=NaAlO2+3NaCl+2H2O 正滴反滴,现象不一AlCl3+3NH3·H2O=Al(OH)3↓+3NH4ClAlCl3·6H2O+SOCl2AlCl3+5H2O+2HCl↑+SO2↑无水氯化铝的制备选修4-60Al2S3+6H2O=2Al(OH)3+3H2S↑BaBa(NO3)2+H2SO4=BaSO4↓+2HNO3初下-722NH4Cl+Ba(OH)2·8H2O=BaCl2+2NH3↑+10H2O 常温下能自发进行的吸热反应必修2-30BaCl2+Na2SO4=BaSO4↓+2NaCl白色沉淀必修1-007BaCl2+CuSO4=BaSO4↓+CuCl2白色沉淀必修1-029BaCl2+H2SO4=BaSO4↓+2HCl初下-73BaCO3+H2SO4=BaSO4↓+H2O+CO2↑必修1-0323Ba(OH)2+2KAl(SO4)2=2Al(OH)3↓+3BaSO4↓+K2SO4明矾溶液中加氢氧化钡至Al3+刚好沉淀完全选修4-592Ba(OH)2+KAl(SO4)2=KAlO2+2BaSO4↓+2H2O明矾溶液中加氢氧化钡至SO42-刚好沉淀完全选修4-59Br2+H22HBrBr2+Na2S=S↓+2NaBrBr2+H22HCl 必修2-082NaI+Br2=2NaBr+I2无色淀粉溶液变蓝紫色必修2-09Br2+2H2O+SO2=H2SO4+2HBr 海水提溴必修2-83BrCl+H2O=HCl+HBrO CC+H2O CO↑+H2↑工业生产水煤气必修1-0332C+SiO2Si+2CO↑工业制粗硅必修1-075C+2H2SO4(浓)2SO2↑+CO2↑+2H2O浓H2SO4的强氧化性必修1-096C+MgO Mg(g)+CO↑必修2-802C+O2(少量)2CO 木炭不完全燃烧初上-107C+2CuO2Cu+CO2↑木炭还原氧化铜初上-108C+O2(足量)CO2木炭不完全燃烧初上-34C+CO22CO 工业炼铁-焦炭制CO,归中反应初下-172C+Na2SO42CO2↑+Na2S 工业路布兰法制纯碱选修2-153C+SiO22CO+SiC 选修2-52 C+FeO CO+Fe 工业炼钢脱碳选修2-593C+CaO CaC2+ CO↑工业生产电石C+4HNO3(浓)=CO2↑+4NO2↑+2H2O HNO3的强氧化性C 2H8N2+2N2O4=2CO2↑+3N2↑+4H2O 火箭高能燃料燃烧必修1-086C 6H5ONa+CO2+H2O=C6H5OH↓+NaHCO3C 6H6+CH3(CH2)9CH=CH2CH3(CH2)9CH2CH2-C6H5工业合成洗涤剂选修2-95CaC2+2H2O=Ca(OH)2+C2H2↑Ca(ClO)2+CO2+H2O=2HClO+CaCO3↓漂白粉的漂白原理必修1-081Ca(ClO)2+4HCl(浓)=2Cl2↑+CaCl2+H2O 实验室制氯气Ca(HCO3)2CaCO3↓+CO2↑+H2O 钟乳石、石笋的形成,暂时硬水的软化选修2-262Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O 工业制取漂白粉必修1-079Ca(OH)2+SO3=CaSO4+H2O 必修1-085Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2海水提镁必修2-06Ca(OH)2+CO2=CaCO3↓+H2O 石灰水检验CO2初上-115Ca(OH)2+2CO2(过量)=Ca(HCO3)2Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O 实验室制氨气初下-79Ca(OH)2+SO2=CaSO3↓+H2O不能用澄清石灰水鉴别SO2和CO2,可用品红鉴别,硫酸工业尾气处理选修2-07Ca(OH)2+Na2CO3=2NaOH+CaCO3↓工业纯碱制烧碱Ca2++2NaR=2Na++CaR2离子交换法软化硬水选修2-27Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2工业生产磷肥——重钙Ca3(PO4)2+H2SO4(浓)=Ca(H2PO4)2+ CaSO4工业生产磷肥——普钙Ca5(PO4)3OH+F-=Ca5(PO4)3F+OH-含氟牙膏防龋齿选修4-66Ca5(PO4)4OH+4H+=5Ca2++3HPO42- +H2O 龋齿的形成选修4-66CaF2+H2SO4(浓)=CaSO4+2HF↑CaCl2+Na2SO4=CaSO4↓+2NaCl必修2-44CaCl2+Na2CO3=CaCO3↓+2NaCl初下-82CaCl2+8NH3=CaCl2·(NH3)8CaCl2不能干燥NH3CaCO3CaO+CO2↑工业烧石灰初上-100CaCO3+2HCl=CaCl2+H2O+CO2↑实验室制二氧化碳初上-109CaCO3+SiO2CaSiO3+CO2↑工业制玻璃选修1-542CaCO3+O2+2SO2=2CaSO4+CO2煤加石灰石减少二氧化硫排放选修1-77CaCO3+Na2S CaS+Na2CO3工业路布兰法制纯碱选修2-15CaCO3+2CH3COOH=H2O+CO2↑+(CH3COO)2Ca 醋酸除水垢选修4-67CaCO3+H2O+CO2=Ca(HCO3)2石灰水通CO2变浊后又变清CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑CaO+SiO2CaSiO3工业炼铁造渣必修1-070CaO+SO3=CaSO4必修1-085CaO+H2O=Ca(OH)2工业生石灰变熟石灰初上-120CaO+FeS CaS+FeO 工业炼钢脱硫选修2-59CO2+CaO=CaCO3生石灰变质2Na++CaR2=Ca2++2NaR 离子交换树脂的再生选修2-27CaSO3+H2SO4=CaSO4+H2O+SO2↑硫酸工业尾气处理选修2-07CaSO4+Na2CO3=CaCO3↓+Na2SO4石膏降低盐碱地的碱性选修4-59Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2镉镍电池选修4-78CH3(CH2)9CH2CH2-C6H4-SO3H+NaOH→CH3(CH2)9CH2CH2-C6H4-SO3Na+H2O工业合成洗涤剂选修2-95CH3(CH2)9CH2CH2C6H5+H2SO4→CH3(CH2)9CH2CH2-C6H4-SO3H 工业合成洗涤剂选修2-95CH3COONa+H2O CH3COOH+NaOH 醋酸钠水解呈碱性选修4-56CH4+2H2O=4H2+CO2工业生产氢气选修2-12CH4+H2O=3H2+CO 工业生产氢气,天然气的重整选修2-12、43Cl2+2Na2NaCl 白烟必修1-034Cl2+2FeCl2=2FeCl3浅绿色溶液变棕黄色必修1-0592Cl2+Si SiCl4必修1-075Cl2+Cu CuCl2棕色烟必修1-0773Cl2+2Fe2FeCl3棕黄色烟必修1-077Cl2+H2O=HCl+HClO 必修1-078Cl2+2NaOH=NaCl+NaClO+H2O 工业制取漂粉精必修1-079Cl2+H22HCl 苍白色雾必修2-08Cl2+2NaBr=2NaCl+Br2无色溶液变橙黄色必修2-09Cl2+2NaI=2NaCl+I2无色淀粉溶液变蓝紫色必修2-09Cl2+2HBr=2HCl+Br2海水提溴必修2-835Cl2+2CN-+8OH-=2CO2+N2+10Cl-+4H2O 氯氧化法处理含氰废水选修1-89Cl2+PCl32PCl5选修4-32Cl2+2H2O+SO2=H2SO4+2HClCl2+H2S=2S↓+2HClCl2+Na2S=S↓+2NaCl2P+3Cl22PCl3白雾3Cl2+8NH3(足量)N2+6NH4Cl3Cl2+2NH3N2+6HClClCH2CH2PO3H→HCl+CH2=CH2↑+HPO3植物生长调节剂选修2-893CO+Fe2O33CO2+2Fe 工业冶铁原理必修2-452CO+O22CO2淡蓝色火焰、气体燃料初上-117CO+H2O CO2+ H2工业制氢气选修2-13CO+3H2CH4+H2O 工业煤的气化选修2-412CO+2NO N2+2CO2汽车尾气转化选修4-24CO+CuO CO2+CuCO+SiO2Si+CO22CO2+2Na2O2=2Na2CO3+O2Na2O2作供氧剂必修1-052H 2O+CO2+K2CO3=2KHCO3工业生产水煤气除CO2,合三为一选修2-13CO2+NH3+H2O=NH4HCO3氨碱法制纯碱选修2-16CO2+H2O+NH3+NaCl=NaHCO3↓+NH4Cl 联合制碱法-侯氏制碱法选修2-17CO2+2H2O+NaAlO2=Al(OH)3↓+NaHCO3选修2-61CO2+2NH3H2NCOONH4工业生产尿素选修2-86CO2+2Mg2MgO+C CO2不能用于扑灭由Mg,Ca,Ba,Na,K等的火灾CO2+Na2O=Na2CO3CO2+2NaOH(过量)=Na2CO3+H2O 正滴反滴,现象不一CO2(过量)+NaOH=NaHCO3正滴反滴,现象不一CoCl2+6H2O=CoCl2·6H2O(粉红色)变色水泥选修1-60CoCl2+2H2O=CoCl2·2H2O(紫红色)变色水泥选修1-60Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 还原法处理含铬废水选修1-89Cu+2FeCl3=2FeCl2+CuCl2用于雕刻铜线路版必修1-059Cu+2H2SO4(浓)SO2↑+CuSO4+2H2O 浓H2SO4的强氧化性必修1-096Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O HNO3的强氧化性,制二氧化氮必修1-0963Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O HNO3的强氧化性,制一氧化氮必修1-0962Cu+S Cu2S2Cu(NO3)2CuO+4NO2↑+O2↑Cu(OH)2CuO+H2OCu2S+O22Cu+SO2火法炼铜必修2-81CuCl2+Zn=ZnCl2+Cu 必修1-050CuCl2Cu+Cl2↑电解电解质型选修4-80CuCl2+Fe=FeCl2+CuCuCl2+H2S=CuS↓+2HCl黑色沉淀CuO+2HCl=CuCl2+H2O 必修1-036H 2+CuO H2O+Cu 初上-943CuO+2NH33Cu+3H2OCuSO4+Fe=FeSO4+Cu 湿法炼铜原理初上-91CuSO4+Zn=ZnSO4+Cu 原电池原理选修4-712CuSO4+2H2O2Cu+O2↑+2H2SO4放氧生酸型电解CuSO4+H2S=CuS↓+H2SO4用于除去H2S杂质CuSO4+Na2S =CuS↓+Na2SO4黑色沉淀FF 2+H2=2HF 暗处就能爆炸必修2-082F2+2H2O=4HF+O23Fe+4H2O(气)Fe3O4+4H2↑必修1-0504Fe+3O22Fe2O3必修2-812Fe+2H2O+O2=2Fe(OH)2钢铁吸氧腐蚀原理选修4-85Fe+2FeCl3=3FeCl2Fe+H2SO4(稀)=FeSO4+H2↑制氢气2Fe+6H2SO4(浓)3SO2↑+Fe2(SO4)3+6H2O 浓H2SO4的强氧化性Fe+2HCl=FeCl2+H2↑制氢气Fe+6HNO3(浓)Fe(NO3)3+3NO2↑+3H2O HNO3的强氧化性Fe+I2FeI2碘的弱氧化性3Fe+2O2Fe3O4火星四射,黑色熔融物Fe+S FeS4HNO3(稀)+Fe(不足)=Fe(NO3)3+NO↑+2H2O HNO3的强氧化性2Fe+O22FeO 工业炼钢选修2-598HNO3(稀)+3Fe(过量)=3Fe(NO3)2+2NO↑+4H2O HNO3的强氧化性4Fe(OH)2+O2+2H2O=4Fe(OH)3白色-灰绿色-红褐色必修1-057Fe(OH)2FeO+H2O2Fe(OH)3Fe2O3+3H2O 必修1-057Fe(OH)3+3HCl=FeCl3+3H2O 必修1-0652Fe2++2H++H2O2=2Fe3++2H2O 硫酸铜中亚铁盐的氧化选修4-663Fe2++2[Fe(CN)3]3-=Fe3[Fe(CN)3]2亚铁盐的检验【黄血盐变滕氏蓝】选修4-87Fe2O3+6HCl=2FeCl3+3H2O 初下-53Fe2O3+3H22Fe+3H2O2Fe3++3CuO+3H2O=2Fe(OH)3↓+3Cu2+硫酸铜中铁盐的除去选修4-66Fe3O4+4H23Fe+4H2O 制还原铁粉Fe3O4+8HCl=FeCl2+2FeCl3+4H2OFeCl2+Mg=Fe+MgCl2必修1-059Fe3++3SCN-Fe(SCN)3平衡移动选修4-27FeCl3+MgCO3+3H2O=Fe(OH)3↓+3CO2↑+3MgCl2除去氯化镁中的氯化铁杂质选修4-582FeCl3+3Mg(0H)2=3MgCl2+2Fe(OH)3↓氢氧化镁沉淀转化为氢氧化铁选修4-64FeCl3+3H2O Fe(OH)3(胶体)+3HCl FeCl3饱和溶液滴入沸水制Fe(OH)3胶体2FeCl3+3H2O Fe2O3+3HCl↑由溶液制备FeCl3晶体时,必须在氯化氢气氛中蒸干溶液2FeCl3+3H2O+3Na2CO3=2Fe(OH)3↓+3CO2↑+6NaCl2FeCl3+H2S=2FeCl2+2HCl+S↓2FeCl3+2HI=I2+2FeCl2+2HCl2FeCl3+2KI=2FeCl2+2KCl+I2↓FeCl3+3KSCN=Fe(SCN)3+3KCl 溶液变血红色,用于检验Fe3+2FeCl3+Na2S=S↓+2FeCl2+2NaCl 淡黄色沉淀2FeCl3+3Na2S=S↓+2FeS↓+6NaCl先生成淡黄色沉淀,硫化钠过量后出现黑色沉淀FeCl3+3NaHCO3=Fe(OH)3↓+3CO2↑+3NaClFeCl3+3NaOH=Fe(OH)3↓+3NaCl红褐色沉淀,用于检验Fe3+FeCl3+3NH3·H2O=Fe(OH)3↓+3NH4ClFeO+2HCl=FeCl2+3H2O 必修1-056FeO+4HNO3=Fe(NO3)3+NO↑+2H2OFeS+2HCl=H2S↑+FeCl2硫化亚铁溶于酸选修4-674FeS2+11O28SO2+2Fe2O3工业制硫酸-黄铁矿的煅烧选修2-04FeSO4+2NaOH=Fe(OH)2↓+Na2SO4必修1-057H3H2+WO33H2O+W 必修1-037SiCl4+2H2Si(纯) +4HCl 工业制纯硅必修1-0753H2+N22NH3工业合成氨必修1-091H 2+I22HI 必修2-082H2+O22H2O 初上-66H 2+SiHCl33HCl+Si 工业制纯硅选修2-53H 2+S H2S6H2+3SiCl4+2N2Si3N4+12HCl 工业上化学气相法(CVD)制纯氮化硅选修2-525H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O浓度对反应速率的影响选修4-20H 2C2O4·2H2O CO2↑+CO↑+3H2OH 2CO3=H2O+CO2↑初上-109H 2NCOONH4H2NCONH2+H2O 工业生产尿素选修2-86H 2O+3NO2=2HNO3+NO 工业制硝酸-二氧化氮的吸收必修1-086H 2O(冷)+P2O5=2HPO3HPO3有剧毒3H2O(热)+P2O5=2H3PO4P2O5极易吸水作气体干燥剂2H2O+2Na=2NaOH+H2↑必修1-0462H2O+2Na2O2=4NaOH+O2↑Na2O2作供氧剂必修1-051H 2O+SO3=H2SO4工业生产硫酸-SO3的吸收原理必修1-085H 2O+SO2H2SO3必修1-085H 2O+NH3NH3·H2O 必修1-092H 2O+K2Cr2O7H2CrO4+K2CrO4平衡移动选修4-26NH4Cl+H2O NH3·H2O+HCl 选修4-56H 2O+Na2CO3NaHCO3+NaOH 盐碱地产生碱性的原因选修4-58H 2O+(x+2)TiCl4TiO2·xH2O↓+4HCl工业制TiO2,唯一含X的方程式!选修4-58H 2O+SOCl2=2HCl↑+SO2↑选修4-593H2O+2SbCl3=Sb2O3+6HCl 实验室Sb2O3选修4-602H2O+2MnO2+Zn=2MnOOH+Zn(OH)2碱性锌锰电池原理选修4-752H2O+2NaCl2NaOH+H2↑+Cl2↑氯碱工业,放氢生碱型选修4-81H2O+ICl=HCl+HIOH 2O+2KI+NO2=NO+I2↓+2KOH不能用淀粉KI溶液鉴别溴蒸气和NO22H2O+Mg=Mg(OH)2+H2↑6H2O+Mg3N2=3Mg(OH)2+2NH3↑H 2O+N2O5=2HNO3HNO3酸酐为N2O5,不是NO2H 2O+Na2O=2NaOH2H2O+2K=2KOH+H2↑必修2-06H 2O+NaHCO3H2CO3+NaOHH 2O+2NaOH+Si=Na2SiO3+2H2↑短周期中唯一能与碱溶液放出氢气的非金属2H2O+O2+2SO2=2H2SO4酸雨久放后,酸性增强3H2O+PCl3=H3PO3+3HClH 2O+H2SO3+X2=H2SO4X=Cl,Br,I2H2O+4NO2+O2=4HNO3工业生产硝酸选修2-862H2O2H2↑+O2↑电解水H 2O2+2KI+H2SO4=2H2O+I2+K2SO4海水提碘必修2-832H2O22H2O+O2↑实验室制氧气初上-37H 2O2+H2SO3=H2SO4+H2O2H2O2+N2H4=N2+4H2O 火箭高能燃料燃烧H 2O2+SO2=H2SO4H 2S+NH3·H2O=NH4HS+H2O 合成氨工业生产-原料气的净化选修2-12H 2S+2NaOH(足量)=Na2S+2H2OH 2S(足量)+NaOH=NaHS+H2O2H2S+O2(少量)2S↓+H2O 黄色粉末生成2H2S+3O2(足量)2SO2↑+2H2O2H2S+SO2=3S↓+2H2O 黄色粉末生成H2S H2+S2H2SO3+O2=2H2SO4酸雨久放后,酸性增强选修1-73H 2SO3+2FeCl3+H2O=H2SO4+2FeCl2+2HClH 2SO4(冷,稀)+Na2O2=Na2SO4+H2O2H 2SO4(浓)+NaCl NaHSO4+HCl↑高沸点酸制取低沸点酸选修2-15H 2SO4(浓)+2NaCl2HCl↑+Na2SO4选修2-15H 2S+H2SO4(浓)=S↓+ SO2↑+2H2O 浓H2SO4不能制取和干燥H2S等还原性气体H 2SO4(浓)+2HBr=SO2↑+Br2↑+2H2O 浓H2SO4不能制取和干燥HBr等还原性气体H 2SO4(浓)+2HI=I2+SO2↑+H2O 浓H2SO4不能干燥HIH 2SO4(浓)+2HI=SO2↑+I2↑+2H2O 浓H2SO4不能制取和干燥HI等还原性气体H 2SO4(浓)+NaNO3=NaHSO4+HNO3↑高沸点酸制取低沸点酸5H2SO4(浓)+2P2H3PO4+5SO2↑+2H2O2H2SO4(浓)+S3SO2↑+2H2O 浓H2SO4的强氧化性2H2SO4(浓)+S3SO2↑+2H2O 浓H2SO4的强氧化性2H2SO4(浓)+Zn SO2↑+ZnSO4+2H2OH 2SO4(稀)+Zn=ZnSO4+H2↑实验室制氢气初上-102H 2SO4+2KOH=K2SO4+2H2O 初下-11H 2SO4+Mg=MgSO4+H2↑制氢气初下-53H 2SO4+2NaOH=Na2SO4+2H2O 初下-592H2SO4+4KI+O2=2K2SO4+2I2+2H2O 温度对反应速率的影响选修4-21H 2SO4+Na2S2O3=Na2SO4+S↓+SO2↑+H2O 浓度对反应速率的影响选修4-212H2SO4+PbO2+Pb2PbSO4+2H2O 铅蓄电池选修4-76H 2SO4+MgO=MgSO4+H2OH 2SO4+NH3=NH4HSO4H 2SO4+2NH3=(NH4)2SO4H 2SO4+2NH4HSO3=(NH4)2SO4+2H2O+2SO2↑硫酸厂回收SO2H 2SO4(稀)+Na2SO3=SO2↑+Na2SO4+H2O 实验室制二氧化硫H 3PO4(浓)+NaCl HCl↑+NaH2PO4HCl+NH3=NH4Cl 唯一两气体变固体必修1-0923HCl+Si SiHCl3+H2工业制纯硅选修2-534HCl(浓)+MnO2MnCl2+Cl2↑+2H2O 实验室制氯气必修1-0366HCl(浓)+KClO33Cl2↑+KCl+H2O 实验室制氯气HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O 实验室制氯气2HCl+Na2SiO3=H2SiO3+2NaCl 必修1-0712HCl+Mg(OH)2=MgCl2+2H2O 海水提镁必修2-852HCl+Zn=ZnCl2+H2↑实验室制氢气初上-1022HCl+Mg=MgCl2+ H2↑制氢气初上-136HCl+NaOH=NaCl+H2O 初下-59HCl+KOH=KCl+H2O 初下-82HCl+Na2CO3=NaHCO3+NaCl 正滴反滴,现象不一HCl+NaHCO3=NaCl+H2O+CO2↑正滴反滴,现象不一2HCl+(NH4)2CO3=2NH4Cl+CO2↑+H2O2HCl+ZnO=ZnCl2+H2O2HClO2HCl+O2↑HClO的不稳定性必修1-078HClO+H2O2=HCl+H2O+O2↑HClO+H2SO3=H2SO4+HClHClO+Na2SO3=Na2SO4+HCl4HF+SiO2=SiF4↑+2H2OHF需保存在塑料瓶、唯一既能与酸又能与碱发生非氧化还原反应的非金属氧化物必修1-0704HF+Si=2H2↑+SiF4↑Hg2++S2-=HgS↓工业沉淀法废水除汞选修1-89 2HgO2Hg+O2↑实验室制氧气必修2-802HI H2+I2Fe2O3+6HI=2FeI2+3H2O+I22HNO2+O22HNO3水体富营养化选修1-855HNO3(浓)+P=H3PO4+5NO2↑+H2O 浓HNO3的强氧化性6HNO3(浓)+S H2SO4+6NO2↑+2H2O HNO3的强氧化性4HNO3(浓)2H2O+4NO2↑+O2↑浓HNO3的不稳定性HNO3+NH3=NH4NO3唯一的同一元素的氢化物与最高价含氧酸反应成盐必修1-1008HNO3(稀)+3Na2S=6NaNO3+2NO↑+3S↓+4H2O2HNO3(稀)+3Na2SO3=3Na2SO4+2NO↑+H2O4HNO3(稀)+3S3SO2+4NO↑+2H2O HNO3的强氧化性必修2-15II 2+2KClO3=Cl2+2KIO3I 2+Na2S=S↓+2NaII 2+Zn ZnI2滴水生紫烟KKCl+Na K↑+NaCl工业制钾2KClO32KCl+3O2↑实验室制氧气初上-382KMnO4K2MnO4+ MnO2+O2↑ 实验室制氧气L4Li+O22Li2O 必修2-062Li+2MnO2Li2Mn2O4锂电池原理选修4-75Mg2Mg+O22MgO 强白光、照明弹初上-923Mg+N2Mg3N2Mg(0H)2+2NH4Cl MgCl2+2NH3·H2O 氢氧化镁溶解于铵盐选修4-63Mg(HCO3)2MgCO3↓+CO2↑+H2O 暂时硬水的软化选修2-26Mg(OH)2MgO+H2OMg2++2NaR=2Na++MgR2离子交换法软化硬水选修2-27MgCl2+2NaOH=Mg(OH)2↓+2NaCl必修1-059MgCl2Mg+Cl2↑海水提镁必修2-80MgCl2+2NH3·H2O=Mg(OH)2↓+2NH4ClMgCl2·6H2O Mg(0H)2+2HCl↑+5H2O 选修4-60MgCO3+H2O Mg(OH)2↓+CO2↑暂时硬水的软化选修2-26MgCO3MgO+CO2↑MgO+SO3=MgSO4MgSO4+2NaOH=Mg(OH)2↓+N a2SO4工业提镁必修2-85MgSO4·7H2O MgSO4+7H2O↑制取无水硫酸镁选修4-602MnO2+2NH4Cl+Zn=ZnCl2+2NH3·H2O +Mn2O3锌锰干电池NN 2+O22NO 必修1-0862N2+3Si Si3N4新型陶瓷氮化硅的制取选修2-52N 2H4+O2=N2+2H2O 火箭高能燃料燃烧选修4-062N2H4+2NO2=3N2+4H2O 火箭高能燃料燃烧2N2O5(g)=4NO2(g)+O2(g) △H=+56.7kJ/mol选修4-344Na+O2=2Na2O 钠在空气中缓慢氧化必修1-0432Na+O2Na2O2钠在空气中燃烧生成生成浅黄色粉末必修1-0442Na+S=Na2S 爆炸2Na+2H2O=2NaOH+H2↑必修2-06Na2CO3+SiO2Na2SiO3+CO2↑工业制玻璃选修1-542Na2O+O2Na2O22Na2SO3+O2=2Na2SO42NaCl2NaOH+Cl2↑电解熔融氯化钠制钠必修2-802NaHCO3Na2CO3+CO2↑+H2O 氨碱法制纯碱必修1-052NaHCO3+NaOH=Na2CO3+H2ONaHSO4(浓)+NaCl Na2SO4+HCl高沸点酸制取低沸点酸选修2-152NaOH+SiO2=Na2SiO3+H2O磨口玻璃塞试剂瓶不能长期存放强碱液,唯一能与酸、碱发生非氧化还原反应的非金属氧化物必修1-0702NaOH+SO2(少量)=Na2SO3+H2O 实验室SO2尾气的处理必修1-090NH4NO3+NaOH NaNO3+NH3↑+H2O 必修1-0924NaOH(熔融)4Na+2H2O+O2↑电解熔融氢氧化钠制钠和氧气必修2-812NaOH+NO2+NO=2NaNO2+H2ONaOH+SO2(足量)=NaHSO32NaOH+Zn=Na2ZnO2+H2↑2NaOH+ZnO=Na2ZnO2+H2O4NH3+5O24NO+6H2O 工业上氨催化氧化制硝酸必修1-0932NH3+3O22HNO2+2H2O 水体富营养化选修1-854NH3+6NO=5N2+6H2O 用氨清除NO8NH3+6NO2=7N2+12H3O 用氨清除NO24NH3+3O2(纯氧)2N2+6H2ONH3·H2O NH3↑+H2O 必修1-092NH4Cl NH3↑+HCl↑必修1-092NH4HCO3NH3↑+H2O+CO2↑必修1-092NH4HCO3+NaCl=NaHCO3↓+NH4Cl 氨碱法制纯碱选修2-16(NH4)2CO3(s)NH4HCO3(s)+NH3(g)△H=+74.9kJ/mol 选修4-34(NH4)2CO3+2NaOH Na2CO3+2NH3↑+2H2O(NH4)2SO3+H2O+SO2=2NH4HSO3硫酸厂回收SO2、合三为一的反应3(NH4)2SO4N2↑+4NH3↑+3SO2↑+6H2ONH4NO3+Zn=N2↑+ZnO+2H2O2NO+O2=2NO2工业制硝酸,NO的检验—无色气体遇空气变红棕色必修1-0872NO2(g)N2O4(g) △H=-56.9kJ/mol 平衡移动选修4-28OO 2+S SO2必修1-084O 2+2SO22SO3硫酸工业生产-SO2的催化氧化必修1-085O 2 +Si(粉)SiO2必修1-0995O2+4P2P2O5初上-27P2P+3X22PX3X2表示F2,Cl2,Br2TiO2·xH2O TiO2+xH2O 工业制TiO2选修4-58。