第三章第三讲 铁及其化合物
- 格式:ppt
- 大小:1.12 MB
- 文档页数:83

必修一-第三章-第三节-铁及其化合物【要点梳理】要点一、铁1.铁的存在铁元素在地壳中的含量仅次于O、Si、Al,主要以+2价和+3价化合物的形式存在。
2.物理性质常温下,纯铁是银白色具有金属光泽的金属(纯铁的抗蚀力很强),易导电、导热,有延展性;铁粉为黑色。
铁的熔沸点都很高:熔点1535℃,沸点2750℃。
铁能被磁体吸引,在磁场的作用下,自身也能产生磁性3.化学性质当跟弱氧化剂反应时:Fe - 2e-= Fe2+当跟强氧化剂反应时:Fe - 3e-= Fe3+(1)与非金属的反应:3Fe + 2O2Fe3O4 2Fe + 3Cl22FeCl3 2Fe + 3Br2= 2FeBr3Fe + I2= FeI2 Fe + S FeS(2)与某些盐(如CuSO4)溶液的反应:Fe+Cu2+= Fe2++Cu(3)与酸的反应:与非氧化性酸:Fe+2H+= Fe2++H2↑(4)与水蒸汽的反应:3Fe + 4H2O(g)Fe3O4 + 4H2注意:①现象:用火柴点燃肥皂泡,听到爆鸣声②湿棉花的作用:提供反应所需水蒸气③肥皂液的作用:“收集”H2要点二、铁的化合物1.铁的氧化物(1)FeO不稳定,在空气里受热,就迅速被氧化成Fe3O4(2)Fe2O3常用作红色油漆和涂料,赤铁矿(主要成分是Fe2O3)是炼铁的原料(3)Fe3O4可以看成由FeO和Fe2O3按物质的量之比1∶1组合而成的复杂氧化物,通常也可写成FeO·Fe2O3的形式。
FeO、Fe2O3属于碱性氧化物,Fe3O4不属于碱性氧化物(4)铁的氧化物比较铁的氧化物氧化亚铁氧化铁四氧化三铁化学式FeO Fe2O3Fe3O4铁元素化合价+2 +3 +2、+3颜色、状态黑色粉末红色粉末黑色晶体俗称铁红溶解性均不溶于水与HCl反应离子方程式FeO + 2H+ = Fe2+ + H2O Fe2O3+ 6H+ = 2Fe3+ + 3H2O Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O(1)铁的氢氧化物的制备铁的氢氧化物Fe(OH)3Fe(OH)2操作方法实验现象生成红褐色沉淀首先生成白色絮状沉淀,然后迅速变成灰绿色,最后变成红褐色离子(或化学)方程式Fe3+ + 3OH-= Fe(OH)3↓Fe2+ + 2OH- = Fe(OH)2↓4Fe(OH)2 + O2 + 2H2O= 4Fe(OH)3Fe(OH)2的制备要点:①硫酸亚铁要现配(配制时,蒸馏水要煮沸,以减少蒸馏水中溶解的氧,防止亚铁离子被氧化)②制取Fe(OH)2时,要将吸有NaOH溶液的胶头滴管插到液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止空气与Fe(OH)2接触发生反应(2)铁的氢氧化物的性质名称氢氧化亚铁氢氧化铁化学式Fe(OH)2Fe(OH)3分类碱碱性质色态白色固体红褐色固体水溶性不溶于水与酸反应Fe(OH)2 + 2H+= Fe2++ 2H2O Fe(OH)3 + 3H+= Fe3+ + 3H2O 稳定性不稳定,在空气中易被氧化不稳定,受热易分解:2Fe(OH)3Fe2O3 +3H2O 转化4Fe(OH)2 + O2+ 2H2O = 4Fe(OH)3常见的亚铁盐主要有FeSO4·7H2O(绿矾),铁盐有FeCl3、Fe2(SO4)3等Fe2+、Fe3+的性质及检验方法:离子Fe3+Fe2+颜色黄色淡绿色与碱反应Fe3++3OH—= Fe(OH)3↓Fe2++2OH—= Fe(OH)2↓氧化性、还原性氧化性:2Fe3++Fe = 3Fe2+氧化性:Fe2+ + Zn = Zn2+ + Fe还原性:2Fe2 ++ Cl2= 2Fe3+ + 2Cl—检验方法加碱(NaOH)法①现象:红褐色沉淀②反应:Fe3+ + 3OH-= Fe(OH)3↓①现象:白色沉淀−−−→迅速灰绿色−−−→最终红褐色沉淀②反应:Fe2++2OH-= Fe(OH)2↓4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3加盐(SCN-)法(显色反应)①现象:加入KSCN溶液,溶液变为红色②反应:Fe3+ + 3SCN-= Fe(SCN)3(红色)①现象:加入KSCN溶液无明显现象,再滴入氯水变成红色溶液②反应:2Fe2+ + Cl2= 2Fe3+ + 2Cl-Fe3+ + 3SCN-= Fe(SCN)3(红色)利用氧化性及还原性加入淀粉KI溶液,变为蓝色加入酸性KMnO4溶液,紫色褪去要点三、Fe2+、Fe3+、Fe的相互转变——“铁三角”1.Fe只具有还原性,可以被氧化剂氧化成Fe2+、Fe3+(1)Fe能被S、Fe3+、Cu2+、H+等较弱氧化剂氧化为Fe2+如Fe + S △FeS,Fe + 2Fe3+= 3Fe2+(2)Fe能被Cl2、Br2、HNO3、浓H2SO4等强氧化剂氧化为Fe3+如2Fe + 3Cl2点燃2FeCl32.Fe2+既具有还原性又具有氧化性,可以被氧化为Fe3+,也可以被还原为Fe (1)当Fe2+遇到强氧化剂O2、Cl2、HNO3、KMnO4等时,被氧化为Fe3+,如2Fe2+ + Cl2= 2Fe3+ + 2Cl-(2)当Fe2+遇到C、Al、Zn、CO等还原剂时,可以被还原为Fe如Fe2+ + Zn = Zn2+ + Fe,FeO + CO △Fe + CO23.Fe3+具有较强氧化性,可被还原为Fe2+或Fe(1)Fe3+被C、CO、活泼的金属(钾、钠、钙除外)还原为Fe 如Fe2O3 + 3CO2Fe + 3CO2,Fe2O3 + 2Al2Fe + Al2O3。


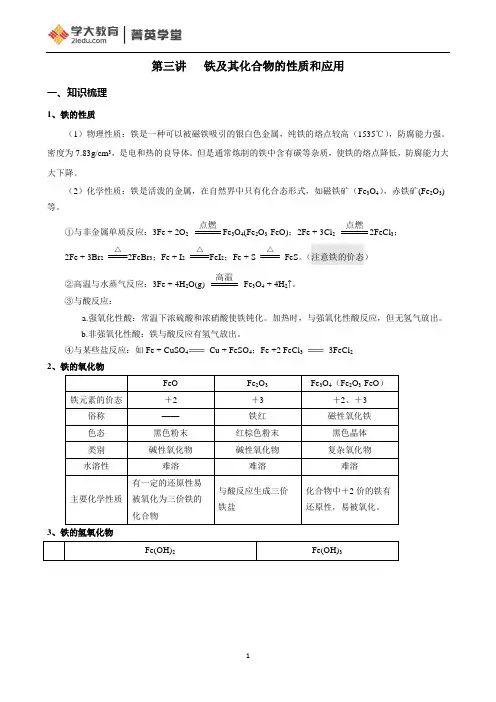
第三讲铁及其化合物的性质和应用一、知识梳理1、铁的性质(1)物理性质:铁是一种可以被磁铁吸引的银白色金属,纯铁的熔点较高(1535℃),防腐能力强。
密度为7.83g/cm3,是电和热的良导体。
但是通常炼制的铁中含有碳等杂质,使铁的熔点降低,防腐能力大大下降。
(2)化学性质:铁是活泼的金属,在自然界中只有化合态形式,如磁铁矿(Fe3O4),赤铁矿(Fe2O3)等。
①与非金属单质反应:3Fe + 2O2点燃Fe3O4(Fe2O3·FeO);2Fe + 3Cl2点燃2FeCl3;2Fe + 3Br2△2FeBr3;Fe + I2△FeI2;Fe + S△FeS。
(注意铁的价态)②高温与水蒸气反应:3Fe + 4H2O(g) 高温Fe3O4 + 4H2↑。
③与酸反应:a.强氧化性酸:常温下浓硫酸和浓硝酸使铁钝化。
加热时,与强氧化性酸反应,但无氢气放出。
b.非强氧化性酸:铁与酸反应有氢气放出。
④与某些盐反应:如Fe + CuSO4Cu + FeSO4;Fe +2 FeCl33FeCl22、铁的氧化物3、铁的氢氧化物4Fe(OH)4、Fe2+、Fe3+的检验5、铁三角图中:①Fe—Fe2+:Fe与弱氧化剂反应,如H+、Cu2+、I2、S等;②Fe2+—Fe:用还原剂如H2、CO等还原FeO或用Mg、Zn、Al等还原Fe2+盐溶液。
③Fe—Fe3+:铁与强氧化剂反应如KMnO4 、Cl2、Br2、浓H2SO4浓HNO3等。
④Fe3+—Fe:用还原剂如H2、CO等还原Fe2O3或用足量Mg、Zn、Al等还原Fe3+的盐溶液。
⑤Fe2+—Fe3+:Fe2+遇强氧化剂的反应如KMnO4 、Cl2、Br2、O2、浓H2SO4、浓HNO3、H2O2、Na2O2、HClO等。
⑥Fe3+—Fe2+:Fe3+遇某些还原剂的反应如Fe、Cu、SO2、I-、H2S等以及少量的Zn、Mg、Al等。
6、铁的冶炼原料:铁矿石(提供铁元素)、焦炭(提供热量和还原剂)、空气(提供氧气)、石灰石(除去铁矿石中的二氧化硅杂质)。


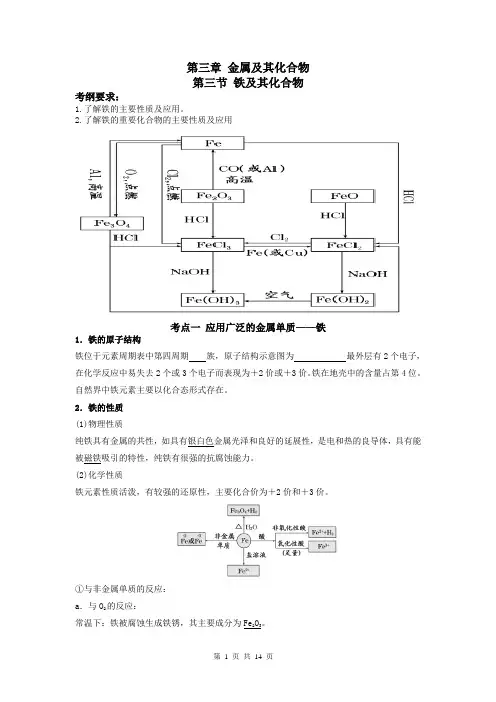
第三章金属及其化合物第三节铁及其化合物考纲要求:1.了解铁的主要性质及应用。
2.了解铁的重要化合物的主要性质及应用考点一应用广泛的金属单质——铁1.铁的原子结构铁位于元素周期表中第四周期族,原子结构示意图为最外层有2个电子,在化学反应中易失去2个或3个电子而表现为+2价或+3价。
铁在地壳中的含量占第4位。
自然界中铁元素主要以化合态形式存在。
2.铁的性质(1)物理性质纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。
(2)化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
①与非金属单质的反应:a.与O2的反应:常温下:铁被腐蚀生成铁锈,其主要成分为Fe2O3。
点燃时:3Fe +2O 2=====点燃Fe 3O 4。
b .与Cl 2的反应:2Fe +3Cl 2=====点燃2FeCl 3。
c .与S 的反应:Fe +S=====△FeS 。
②与水的反应:常温下铁与水不反应,在高温条件下与水蒸气反应: 3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
③与酸的反应:a .与非氧化性酸反应的离子方程式为Fe +2H +===Fe 2++H 2↑。
b .与氧化性酸:遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应无H 2产生。
④与某些盐溶液的反应:a .与CuSO 4溶液反应的离子方程式为Fe +Cu 2+===Fe 2++Cu 。
b .与FeCl 3溶液反应的离子方程式为2Fe 3++Fe===3Fe 2+。
3.铁的应用(1)用途:用途最广泛的是铁合金——钢,用于制造不锈钢、特种钢、钢板、钢管等。
(2)制备:工业上冶炼铁的反应方程式为:3CO +Fe 2O 3=====高温2Fe +3CO 2。
命题点 铁反应后元素价态的判断(1)铁与弱氧化剂(如S 、I 2、H +、Fe 3+、Cu 2+)等反应所得产物为Fe 2+,铁元素的价态为+2价,如:Fe +I 2=====△FeI 2。



第三节铁及其化合物考纲定位要点网络1.掌握铁的主要性质及应用.2.掌握铁的重要化合物的主要性质及应用.3。
了解铁及其重要化合物的制备方法。
4.了解Fe2+、Fe3+的检验方法。
铁的单质、氧化物及氢氧化物知识梳理1.铁的位置、存在和物理性质2.铁单质的化学性质铁单质性质活泼,有较强的还原性。
(1)与非金属单质的反应Fe与S反应:Fe+S错误!FeS。
(2)与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe+4H2O(g)错误!Fe3O4+4H2。
(3)与酸的反应①与非氧化性酸反应的离子方程式:Fe+2H+===Fe2++H2↑。
②与氧化性酸反应:遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应无H2产生.(4)与某些盐溶液的反应①与CuSO4溶液反应的离子方程式:Fe+Cu2+===Cu+Fe2+。
②与FeCl3溶液反应的离子方程式:Fe+2Fe3+===3Fe2+.[辨易错](1)铁在潮湿的空气中生成的铁锈的主要成分是Fe2O3,而铁在纯氧中燃烧的产物是Fe3O4。
()(2)Fe与少量Cl2反应生成FeCl2,与足量Cl2反应生成FeCl3.()(3)浓硫酸可以用铁制容器贮存,是因为常温下Fe与浓硫酸不反应. () (4)1 mol Fe与足量水蒸气高温充分反应,转移电子数为3N A.()[答案](1)√(2)×(3)×(4)×3.铁的氧化物和氢氧化物(1)铁的三种典型氧化物①物理性质②化学性质a.FeO、Fe2O3、Fe3O4分别与盐酸反应的离子方程式为FeO+2H+===Fe2++H2O,Fe2O3+6H+===2Fe3++3H2O,Fe3O4+8H+===2Fe3++Fe2++4H2O。
b.FeO不稳定,在空气中受热生成Fe3O4,其化学方程式为6FeO+O2=====,△2Fe3O4.注意:Fe3O4的组成可用氧化物的形式表示为FeO·Fe2O3,即有错误!的铁显+2价,错误!的铁显+3价。