9.7乳状液,泡沫和气溶胶
- 格式:ppt
- 大小:353.00 KB
- 文档页数:10



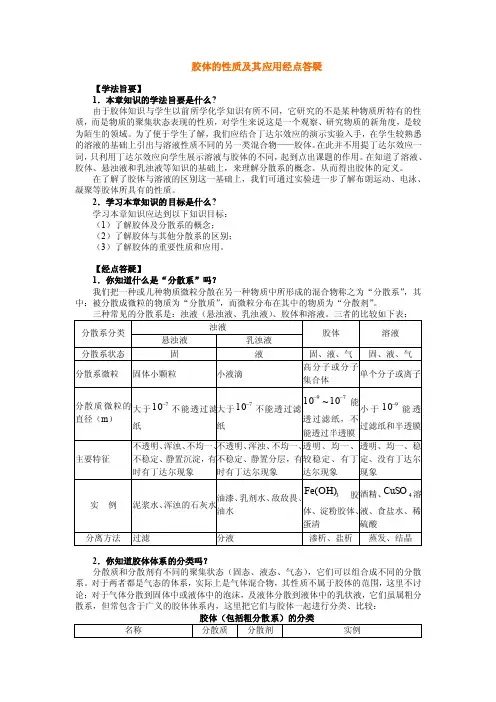
胶体的性质及其应用经点答疑【学法旨要】1.本章知识的学法旨要是什么?由于胶体知识与学生以前所学化学知识有所不同,它研究的不是某种物质所特有的性质,而是物质的聚集状态表现的性质,对学生来说这是一个观察、研究物质的新角度,是较为陌生的领域。
为了便于学生了解,我们应结合丁达尔效应的演示实验入手,在学生较熟悉的溶液的基础上引出与溶液性质不同的另一类混合物——胶体。
在此并不用提丁达尔效应一词,只利用丁达尔效应向学生展示溶液与胶体的不同,起到点出课题的作用。
在知道了溶液、胶体、悬浊液和乳浊液等知识的基础上,来理解分散系的概念。
从而得出胶体的定义。
在了解了胶体与溶液的区别这一基础上,我们可通过实验进一步了解布朗运动、电泳、凝聚等胶体所具有的性质。
2.学习本章知识的目标是什么?学习本章知识应达到以下知识目标:(1)了解胶体及分散系的概念;(2)了解胶体与其他分散系的区别;(3)了解胶体的重要性质和应用。
【经点答疑】1.你知道什么是“分散系”吗?我们把一种或几种物质微粒分散在另一种物质中所形成的混合物称之为“分散系”,其中:被分散成微粒的物质为“分散质”,而微粒分布在其中的物质为“分散剂”。
2.你知道胶体体系的分类吗?分散质和分散剂有不同的聚集状态(固态、液态、气态),它们可以组合成不同的分散系。
对于两者都是气态的体系,实际上是气体混合物,其性质不属于胶体的范围,这里不讨论;对于气体分散到固体中或液体中的泡沫,及液体分散到液体中的乳状液,它们虽属粗分散系,但常包含于广义的胶体体系内,这里把它们与胶体一起进行分类、比较:液胶体和亲液胶体,胶体粒子为多个分子聚集体的是憎液胶体。
因其胶粒与分散剂(液体)不亲合(不溶)而得名。
从体系的热力学特点考虑,憎液胶体是热力学不稳定体系,是一相(分散质质点,)分布在另一相(分散剂介质)中的多相分散体系,体系中的界面(质点与介质之间的相界面)总是要减少,胶体质点趋向于聚集在一起,有发生聚沉而使分散体系破坏的倾向(粗分散体系更易如此)。




胶体与表面化学第一章绪论(2学时)1.1胶体的概念什么是胶体,胶体的分类1.2胶体化学发展简史1.3胶体化学的研究对象表面现象,疏液胶体,缔合胶体,高分子溶液。
重点:胶体、分散系统、分散相、分散介质的概念。
难点:胶体与表面化学在矿物加工工程中的作用及意义。
教学方法建议:启发式教学,引导学生对胶体及表面化学的兴趣。
第二章胶体与纳米材料制备(4学时)2.1胶体的制备胶体制备的条件和方法,凝聚法原理。
2.2胶体的净化渗析、渗透和反渗透。
2.3单分散溶胶单分散溶胶的定义及制备方法。
2.4胶体晶体胶体晶体的定义及制备方法2.5纳米粒子的制备什么是纳米材料,纳米粒子的特性及制备方法重点:胶体的制备、溶胶的净化、胶体晶体的制备。
难点:胶体制备机理。
教学方法建议:用多媒体教学,注重理论联系实际。
第三章胶体系统的基本性质(8学时)3.1溶胶的运动性质扩散、布朗运动、沉降、渗透压和Donnan平衡。
3.2溶胶的光学性质丁道尔效应和溶胶的颜色。
3.3溶胶的电学性质电动现象、双电层结构模型和电动电势(。
电势)3.4溶胶系统的流变性质剪切速度越切应力,牛顿公式,层流与湍流,稀胶体溶液的黏度。
3.5胶体的稳定性溶胶的稳定性、DLVO理论、溶胶的聚沉、高聚物稳定胶体体系理论。
3.6显微镜及其对胶体粒子大小和形状的测定显微镜的类型及基本作用重点:沉降、渗透压、电泳、电渗、。
电势的计算、双电层结构模型、DLVO理论、溶胶的聚沉。
难点:双电层结构模型。
教学方法建议:多媒体教学和板书教学相结合。
第四章表面张力、毛细作用与润湿作用(6学时)4.1表面张力和表面能净吸力和表面张力的概念、影响表面张力的因素、液体表面张力和固体表面张力的测定方法。
4.2液-液界面张力Anntonff规则、Good-Girifalco公式、Fowkes理论和液-液界面张力的测定。
4.3毛细作用与Laplace公式和Kelvin公式毛细作用,Laplace公式和Kelvin公式的应用,曲界面两侧的压力差及与曲率半径的关系,毛细管上升或下降现象,弯曲液面上的饱和蒸气压。



《物理化学》课程教学大纲(供高职药学、中药类专业使用)一、前言物理化学是药学、中药类的专业基础课。
本课程是在学生已经学过高等数学、物理学、无机化学、分析化学和有机化学的基础上,进一步系统地阐明化学变化的基本规律。
要求学生系统地掌握物理化学的基本原理、基本方法与基本技能,通过各个教学环节培养学生独立思考、独立分析和创新的能力,使之具有一定的分析和解决药学方面实际问题的能力,从而为进一步学好专业课程及今后从事药学、药物制剂工作和科学研究,奠定良好的化学理论基础。
物理化学内容非常丰富。
根据药学、药物制剂等专业的要求,本课程的任务是学习化学热力学、化学动力学、电化学、表面现象和胶体等基本内容。
本课程理论讲授共36学时,2学分。
物理化学实验在实验化学课程中进行。
理论教学主要通过课堂讲授,多媒体影视课件、习题课(或课堂讨论)、演算习题、自学及实验等教学形式,达到学习本课程的目的。
二、教学内容与要求绪论(一)教学目的与要求1、熟悉物理化学课程的研究对象、任务、内容及发展趋势。
2、了解物理化学在化学与药学中的地位和作用。
3、掌握物理化学的研究方法与学习方法。
(二)教学内容1、概述物理化学的研究对象和任务、内容和特点及发展趋势。
2、物理化学在化学与药学中的地位和作用(重点)。
3、物理化学的研究方法与学习方法(重点)。
(三)教学形式与方法采用课堂讲授、多媒体影视课件、讨论、自学等教学形式。
第一章热力学第一定律(一)教学目的与要求1、熟悉热力学的一些基本概念和可逆过程的意义及特点。
2、掌握热力学第一定律、内能和焓的概念。
掌握状态函数的定义和特性。
3、掌握热力学第一定律的常用计算Q、W、U∆和H∆的方法。
4、了解节流膨胀的概念和意义。
5、掌握应用生成焓及燃烧焓计算反应热的方法。
6.熟悉反应热与温度的关系。
(二)教学内容1、热力学概论,热力学研究的对象、内容,方法和特点。
2、热力学基本概念,体系与环境,体系的性质,状态与状态函数,过程与途径。
气溶胶的产生及其在细胞培养中的注意事项1.气溶胶定义及其产生气溶胶是液态或固态微粒在空气中的悬浮体系。
它们能作为水滴和冰晶的凝结核(见大气凝结核、大气冰核)、太阳辐射的吸收体和散射体,并参与各种化学循环,是大气的重要组成部分。
雾、烟、霾、轻雾(霭)、微尘和烟雾等,都是天然的或人为的原因造成的大气气溶胶。
一般说来,半径小于1微米的粒子,大都是由气体到微粒的成核、凝结、凝聚等过程所生成;而较大的粒子,则是由固体和液体的破裂等机械过程所形成。
它们在结构上可以是均相的,也可以是多相的。
已生成的气溶胶在大气中仍然有可能再参加大气的化学反应或物理过程。
液体气溶胶微粒一般呈球形,固体微粒则形状不规则,其半径一般为10-3~102微米。
粒径在10-1~101微米的气溶胶在大气光学、大气辐射、大气化学、大气污染和云物理学等方面具有重要作用。
小粒径气溶胶的浓度受凝聚作用所限制,而大粒子的浓度则受沉降作用所限制。
微粒在大气中沉降的过程中,受的阻力和重力的作用达到平衡时,各种粒子的沉降速度不同。
2.生物安全柜生物安全柜(Biological safety cabinets,BSCs)是利用空气净化技术,实现第一道物理隔离的技术产品,是为操作原代培养物、菌毒株以及诊断性标本等具有感染性的实验材料时,用来保护操作者本人、实验室环境以及实验材料,使其避免暴露于上述操作过程中可能产生的感染性气溶胶和溅出物而设计的。
当操作液体或半流体,例如摇动、倾注、搅拌,或将液体滴加到固体表面上或另一种液体中时,均有可能产生气溶胶。
在对琼脂板划线接种、用吸管接种细胞培养瓶、采用多道加样器将感染性试剂的混悬液转移到微量培养板中、对感染性物质进行匀浆及涡旋振荡、对感染性液体进行离心以及进行动物操作时,这些实验室操作都可能产生感染性气溶胶。
由于肉眼无法看到直径小于5μm 的气溶胶以及直径为5~100μm 的微小液滴,因此实验室工作人员通常意识不到有这样大小的颗粒在生成,并可能吸入或交叉污染工作台面的其他材料。
注册化工工程师执业资格基础考试大纲公共基础考试科目和主要内容1.数学(考题比例20% )1.1 空间解析几何向量代数、直线、平面、柱面、旋转曲面、二次曲面和空间曲线等方面知识。
1.2 微分学极限、连续、导数、微分、偏导数、全微分、导数与微分的应用等方面知识,掌握基本公式,熟悉基本计算方法。
1.3 积分学不定积分、定积分、广义积分、二重积分、三重积分、平面曲线积分、积分应用等方面知识,掌握基本公式和计算方法。
1.4 无穷级数数项级数、幂级数、泰勒级数和傅立叶级数等方面的知识。
1.5 微分方程可分离变量方程、一阶线性方程、可降阶方程及常系数线性方程等方面的知识。
1.6 概率与数理统计概率论部分,随机事件与概率、古典概率、一维随机变量的分布和数字特征等方面的知识。
数理统计部分,参数估计、假设检验、方差分析及一元回归分析等方面的基本知识。
2.热力学(考题比例9% )2.1 气体状态参量、平衡态、理想气体状态方程、理想气体的压力和温度的统计解释。
2.2 功、热量和内能。
2.3 能量按自由度均分原理、理想气体内能、平均碰撞次数和平均自由程、麦克斯韦速率分布律。
2.4 热力学第一定律及其对理想气体等值过程和绝热过程的应用、气体的摩尔热容、焓。
2.5 热力学过程、循环过程。
2.6 热机效率。
2.7 热力学第二定律及其统计意义、可逆过程和不可逆过程、熵。
3.普通化学(考题比例14% )3.1 物质结构与物质状态原子核外电子分布、原子与离子的电子结构式、原子轨道和电子云概念、离子键特征、共价键特征及类型。
分子结构式、杂化轨道及分子空间构型、极性分子与非极性分子、分子间力与氢键。
分压定律及计算。
液体蒸气压、沸点、汽化热。
晶体类型与物质性质的关系。
3.2溶液溶液的浓度及计算。
非电解质稀溶液通性及计算、渗透压概念。
电解质溶液的电离平衡、电离常数及计算、同离子效应和缓冲溶液、水的离子积及pH、盐类水解平衡及溶液的酸碱性。