分析化学第六讲配位滴定二
- 格式:ppt
- 大小:1.20 MB
- 文档页数:39
![分析化学第六章--配位滴定法[精编文档]](https://uimg.taocdn.com/34d081a4ba0d4a7302763a96.webp)








第五章:配位滴定法§5-1概述一、配位滴定法:以配位反应为基础的滴定分析方法。
例:AgNO3标液滴定CN-:Ag++ 2CN-⇌[Ag(CN)2]- , K=1.0⨯1021滴定达到化学计量点时,多加一滴AgNO3溶液,Ag+就与[Ag(CN)2]-反应生成白色的Ag[Ag(CN)2]-沉淀,以指示终点的到达。
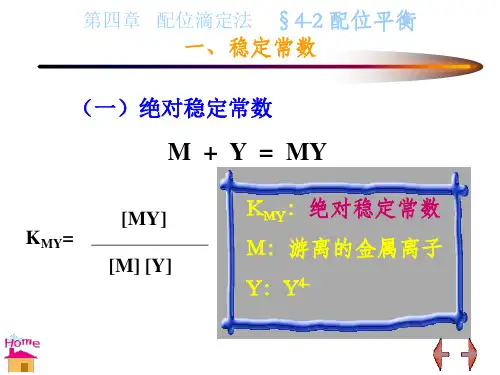
终点反应为:[Ag(CN)2]-+ Ag+⇌Ag[Ag(CN)2]-配合物的稳定性以配合物稳定常数K稳表示。
配位反应在分析化学中应用非常广泛,许多显色剂、萃取剂、沉淀剂、掩蔽剂等都是配合物。
二. 配合物的分类(一)无机配位剂(一般无机配位剂很少用于滴定分析)原因:⑴与金属离子形成的配位化合物不够稳定;⑵存在逐级配位现象,化学计量关系不稳定。
M + n L == ML n (L只有一个配位原子)与多元酸相似,无机配合物通常是逐级形成的(分步),一般稳定性不高。
例:配合离子Cu(NH3)42+的形成过程Cu + NH3== Cu(NH3)2+k1 = 1.4⨯104Cu(NH3)2++ NH3== Cu(NH3)22+k2 = 3.1⨯103Cu(NH3)22++ NH3== Cu(NH3)32+k3 = 7.8⨯102Cu(NH3)32++ NH3== Cu(NH3)42+k4 = 1.4⨯102(1)分步稳定常数:k,1/k = k离,n ——分步离解常数(2)累计稳定常数:β第一级累积稳定常数β1 = k1第二级累积稳定常数β2= k1k2┇┇第n级累积稳定常数β4 = k1 k2…k n(3)总稳定常数K:K= βn(二)有机配位剂(用于配位滴定的通常是有机配位剂,而有机配位剂中最常用的又是氨羧配位剂)氨羧配位剂指:含有—N(CH2COOH)2基团的有机化合物。
几乎能与所有金属离子配合。
目前已研究的有几十种,重要的有:乙二胺四乙酸(EDTA)、氨三乙酸(NTA)、乙二胺四丙酸(EDTP)等。