酪氨酸酶抑制率测定方法
- 格式:doc
- 大小:26.00 KB
- 文档页数:2


六种中药不同提取方法对酪氨酸酶的抑制率和抗氧化功效研究王昌涛;潘妍;宋岳昊;董银卯
【期刊名称】《天然产物研究与开发》
【年(卷),期】2009(021)B05
【摘要】本文研究六种中药提取液的酪氨酸酶抑制率和DPPH自由基的清除率。
结果表明:六种中药酪氨酸酶抑制率和DPPH自由基的清除率研究中,醇提法〉酶提法〉水提法。
抑制酪氨酸酶活性实验中,甘草和白术效果最好,所有提取方法提取的中药提取液抑制率都高于50%。
DPPH自由基清除率实验中,白僵蚕和白蔹的效果最好,抑制率均高于20%。
【总页数】4页(P175-178)
【作者】王昌涛;潘妍;宋岳昊;董银卯
【作者单位】北京工商大学植物资源研究开发北京市重点实验室,北京100048【正文语种】中文
【中图分类】R284.2
【相关文献】
1.不同烹饪方法对六种食物抗氧化能力影响的研究 [J], 尹再强;梁英武;于楠;张春玉
2.水田芥不同浓度乙醇提取物抗氧化性及抑制酪氨酸酶活性的研究 [J], 岳文明;都晓伟;王昌涛
3.社区不同年龄段人群选择不同功效中药养生及治疗疾病情况的调查研究 [J], 许喆
4.六种中药复方乙醇提取物对酪氨酸酶激活作用及动物致色素作用的研究 [J], 刘之力;李雅莉;刘俐;史月君;涂彩霞
5.三七不同部位提取物体外抗氧化功效研究 [J], 查雨锋;詹易;李婷;颜宏;黄加文;吴德松
因版权原因,仅展示原文概要,查看原文内容请购买。

1. 4念珠藻甲醇提取物对酪氨酸酶活性的抑制1. 4. 1念珠藻甲醇提取物对酪氨酸酶活力的影响提取物对酪氨酸酶的抑制参照Masuda和Kubo的方法[ 6, 7] , 并略作修改。
待测样品用DMSO 进行浓度梯度稀释, 浓度分别为1、05、025、0125 mg / mL; 换算成反应体系中的终浓度分别为333、1665、8325、4 3 g /mL。
反应在96孔细胞板上进行, 每组8孔, 分别是: A. 不含样品, 但含酪氨酸酶的阴性对照, 3孔重复; B. 不含样品及酪氨酸酶的空白对照, 1孔; C. 包含样品及酪氨酸酶, 3孔重复,D. 含样品但不含酪氨酸酶的空白对照, 1 孔。
A 孔中加入190 L pH 68、0 1 mo l/L 磷酸缓冲液,10 L 1380 U /mL酪氨酸酶; B 孔中加入200 L 相同的磷酸缓冲液; C 孔中加入180 L磷酸缓冲液,10 L 1380 U /mL酪氨酸酶, 10 L样品; D 孔中加入190 L磷酸缓冲液, 10 L样品。
然后将细胞板在30条件下放置5 m in, 再在每孔中加入100 L2 5 mmo l/L L-酪氨酸( 见表1 )。
在30反应10m in后, 立即置于Tecan Sunrise 酶标仪中测量在475 nm下的吸光值。
提取物对酪氨酸酶活性的抑制按公式计算:抑制率=( A - B ) - ( C- D)*100%A – B参照文献方法〔3〕在数支干燥的试管中各加入1.oml0.03%左旋多巴溶液,再加上维生素E一日环糊精溶液,(加入量按表所列体积) 最后的磷酸钠缓冲液加至5.Oml,25℃恒温10 min后,加入0.4ml酶提取液,立即计时并迅速置于恒温槽内,待反应1min,用BaCRmanDV一70型分光原度计在475nm处测定吸收度,以缓冲液为参比,然后根据多巴色素的消光系数“=3700求出Vi,把无维生素E一日环糊精溶液存在时速度定为100%,求出不同浓度维生素E一日环糊精存在时酶的相对活性以及对酶的抑制率抑制率二V。

几种复配美白剂的美白功效研究文/罗婷婷 孙祥灵 赵昆 段国梅 李土桂 何秋星本文通过对7种不同美白剂原料进行复配研究,采用单因素试验、正交试验以及综合评价,优选最佳美白复配组合,通过B16细胞试验评价美白复配组合的美白功效,以此探讨美白复配原料对皮肤色素沉着的改善作用,旨在为今后美白复配化妆品的开发提供依据。
关键词美白剂;复配;黑色素瘤细胞中国素有“一白遮三丑”的审美观念,追求“肤如雪,凝如脂”历来是中国女性关注的热点话题。
目前,大多数美白剂的美白作用机制主要通过抑制酪氨酸酶活性、阻断黑色素合成过程、加速黑色素角质细胞脱落、抑制黑色素向角质细胞迁移、清除自由基等方面来改善皮肤黑色素沉着、肤色暗沉等问题[1-2]。
因此,美白型护肤品在化妆品领域的研究中具有较为广阔的市场和发展潜力。
实验部分01试剂与仪器烟酰胺、熊果苷、维生素C、凝血酸、光甘草啶、谷胱甘肽、白藜芦醇,广州品赫生物技术有限公司;FeSO4、水杨酸,天津市福晨化学试剂厂;三羟甲基氨基甲烷,上海润捷化学试剂有限公司;DPPH、邻苯三酚、酪氨酸酶,上海宝曼生物科技有限公司;B16小鼠黑色素瘤细胞株,北京北纳创联生物技术研究院;DMEM培养基、0.25%胰蛋白酶、胎牛血清,美国Gbico公司;DMSO、MTT、TritonX-100,美国MP Biomedicals公司。
UV-2600,CH紫外分光光度计,岛津公司;SC-3610低速离心机,安徽中科中佳科学仪器有限公司;二氧化碳细胞培养箱,上海圣科仪器设备有限公司;Infinite M200 PRO酶标仪,帝肯贸易有限公司。
02实验方法2.1 单因素试验将维生素C(0.10、0.12、0.14、0.16、0.18mg/mL)、白藜芦醇(0.04、0.08、0.12、0.15、0.20mg/mL)、谷胱甘肽(0.03、0.05、0.08、0.10、0.12mg/mL)、光甘草叮(0.05、0.08、0.10、0.12、0.15mg/mL)、凝血酸(0.02、0.05、0.08、0.12、0.14mg/ mL)、熊果苷(0.25、0.30、0.35、0.40、0.45mg/mL)和烟酰胺(0.14、0.16、0.18、0.20、0.25mg/mL)分别以DPPH 自由基清除率为指标,考察7种美白原料的浓度对DPPH 自由基的抗氧化作用,根据其结果筛选出对DPPH自由基清除效果最好的3种美白原料,其为组合1。
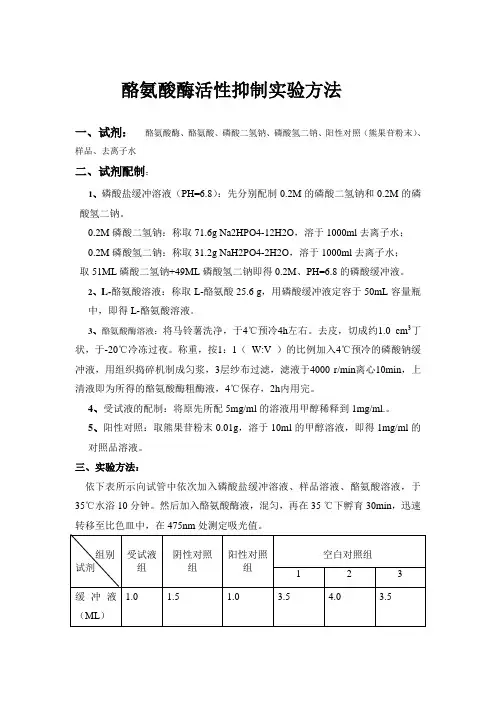
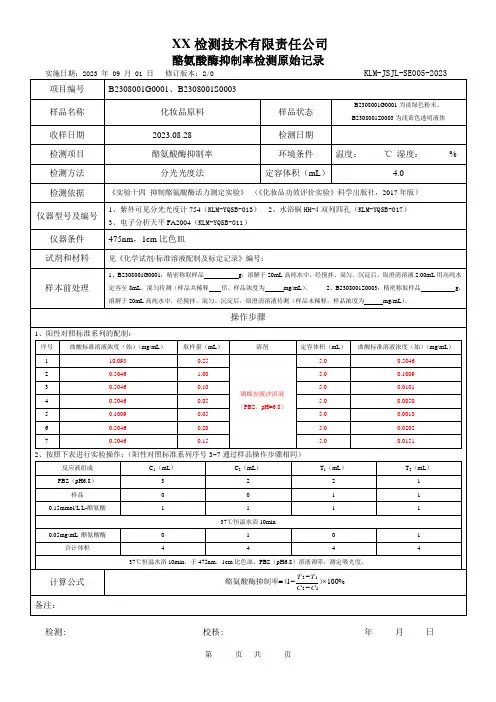
酪氨酸酶活性抑制实验方法一、试剂:酪氨酸酶、酪氨酸、磷酸二氢钠、磷酸氢二钠、阳性对照(熊果苷粉末)、样品、去离子水二、试剂配制:1、磷酸盐缓冲溶液(PH=6.8):先分别配制0.2M的磷酸二氢钠和0.2M的磷酸氢二钠。
0.2M磷酸二氢钠:称取 71.6g Na2HPO4-12H2O,溶于 1000ml 去离子水;0.2M磷酸氢二钠:称取 31.2g NaH2PO4-2H2O,溶于1000ml 去离子水;取51ML磷酸二氢钠+49ML磷酸氢二钠即得0.2M、PH=6.8的磷酸缓冲液。
2、L-酪氨酸溶液:称取L-酪氨酸25.6 g,用磷酸缓冲液定容于50mL容量瓶中,即得L-酪氨酸溶液。
3、酪氨酸酶溶液:将马铃薯洗净,于4℃预冷4h左右。
去皮,切成约1.0 cm3丁状,于-20℃冷冻过夜。
称重,按1:1(W:V )的比例加入4℃预冷的磷酸钠缓冲液,用组织捣碎机制成匀浆,3层纱布过滤,滤液于4000 r/min离心10min,上清液即为所得的酪氨酸酶粗酶液,4℃保存,2h内用完。
4、受试液的配制:将原先所配5mg/ml的溶液用甲醇稀释到1mg/ml.。
5、阳性对照:取熊果苷粉末0.01g,溶于10ml的甲醇溶液,即得1mg/ml的对照品溶液。
三、实验方法:依下表所示向试管中依次加入磷酸盐缓冲溶液、样品溶液、酪氨酸溶液,于35℃水浴10分钟。
然后加入酪氨酸酶液,混匀,再在35 ℃下孵育30min,迅速转移至比色皿中,在475nm处测定吸光值。
受试组用空白对照组1调零,阴性对照组用空白对照组2调零,阳性对照组用空白对照组3调零。
受试组吸光值为A1,阴性对照组吸光值为A2,阳性对照组吸光值为A3。
抑制率=1-[(A1-A2)/(A3-A2)]×100%=(A3-A1)/(A3-A2)×100% 注:受试液组共四种样品。

5种酸味中药抑制酪氨酸酶活性实验研究
陈彬;张理平;梁娟;周露
【期刊名称】《福建中医药大学学报》
【年(卷),期】2013(023)002
【摘要】目的研究5种酸味中药对酪氨酸酶活性的抑制作用. 方法采用碱提酸沉法提取5种酸味中药的酸性成分,多巴速率氧化法检测提取物对酪氨酸酶的抑制率. 结果 5种酸味中药的碱提酸沉溶液中,枳椇子、金樱子、木瓜、地榆、绿萼梅对酪氨酸酶的抑制率分别达到81.66%、68.53%、59.73%、54.28%和39.36%. 结论5种酸味中药对酪氨酸酶均有明显的抑制作用,其中以枳棋子作用最强,对治疗黑色素增多性疾病有潜在的应用价值.
【总页数】3页(P32-34)
【作者】陈彬;张理平;梁娟;周露
【作者单位】福建中医药大学药学院,福建福州350122;福建中医药大学药学院,福建福州350122;福建中医药大学药学院,福建福州350122;福建中医药大学药学院,福建福州350122
【正文语种】中文
【中图分类】R285.5
【相关文献】
1.白藜芦醇对酪氨酸酶活性抑制作用的实验研究 [J], 罗利琼
2.白芷美白液体外抑制酪氨酸酶活性的实验研究 [J], 欧喜燕;于秀华
3.5种酸味中药抑制酪氨酸酶活性实验研究 [J], 陈彬;张理平;梁娟;周露;
4.6种中药抑制酪氨酸酶活性的实验研究 [J], 李艳莉;钟理;梁丽红
5.中药对黑素生物合成影响研究Ⅰ.82味中药乙醇提取物对酪氨酸酶活性的抑制作用 [J], 雷铁池;朱文元;夏明玉;张美华;范卫新
因版权原因,仅展示原文概要,查看原文内容请购买。

19种中草药美白及抗氧化活性的比较王雪梅;沈雪梅;吴文琴;张娜;王荣庆【摘要】以无水乙醇和水作为萃取剂超声提取19种中草药,采用紫外-可见分光光度法测试各中草药提取液对酪氨酸酶和DPPH·、·OH、·O-23种自由基的抑制率及半数抑制浓度IC50.结果表明,茯苓、黄芩、红景天、赤芍、人参、白蔹均表现出较强的酪氨酸酶抑制活性,其中茯苓对酪氨酸酶的抑制能力最强.红景天、黄芩、白芍、赤芍的综合抗氧化活性强于其他中草药.%Absolute ethyl alcohol and water were used to extract 19 kinds of Chinese herbal medicine with ultrasonic extraction,the inhibition ratio and the half inhibition concentration on tyrosinase and three kinds of radical of DPPH·,·OH and ·O-2 were determined by UV-visible spectrophotometry.The results showed that extracts of poria cocos,scutellaria baicalensis,rhodiola rosea,radix paeoniae rubra,ginseng and ampelopsis japonica showed a strong inhibitory effecton the tyrosinase,in which poria cocos was the strongest,while the extracts of rhodiola rosea,scutellaria baicalensis,radix paeoniae alba and radix paeoniae rubra had stronger comprehensive antioxidant activity than the other herbs.【期刊名称】《安徽大学学报(自然科学版)》【年(卷),期】2017(041)001【总页数】9页(P86-94)【关键词】中草药;酪氨酸酶;自由基;抗氧化活性;抑制率【作者】王雪梅;沈雪梅;吴文琴;张娜;王荣庆【作者单位】安徽大学化学化工学院,安徽合肥 230601;安徽大学化学化工学院,安徽合肥 230601;安徽大学化学化工学院,安徽合肥 230601;安徽大学化学化工学院,安徽合肥 230601;安徽大学化学化工学院,安徽合肥 230601【正文语种】中文【中图分类】TQ658;R285皮肤中黑色素的数目、大小、类型及分布影响着人体皮肤颜色.黑色素是由黑素细胞内的酪氨酸在酪氨酸酶、多巴色素互变酶,5,6-二羟吲哚-2-羧酸氧化酶(TRP-1)的综合作用下形成的[1].由黑色素的合成途径可知,酪氨酸酶在黑色素产生过程中起着至关重要的作用[2],其活性过高或异常表达会引起黑色素生成过多,并引发皮肤色素性疾病[3-4];此外,机体在代谢过程中产生的具有高活性的自由基对黑色素的合成也有着重要的影响[5].体内的氧自由基产生过量不但会促进酪氨酸酶催化氧化,生成脂褐素,在细胞内大量堆积,形成皮肤斑点,同时也会使皮肤血管老化,营养成分不能及时输送到肌肤[6-7].所以,通过抑制酪氨酸酶和清除过量的自由基不但能有效阻止黑色素产生、抑制黑色素沉着,同时还能增强皮肤对自由基的防御能力,从而达到美白防衰的效果[8].笔者对19种中草药进行超声提取.以无水乙醇和水作为提取剂,通过比较各提取液对酪氨酸酶和 3种自由基的抑制率,筛选出具有较强的酪氨酸酶抑制作用和较好抗氧化能力的中草药.1.1 试剂与仪器L-酪氨酸、酪氨酸酶(25 kU),上海生工生物工程股份有限公司;1,1-二苯基-2-苦肼基自由基(DPPH·),上海梯希爱化成工业发展有限公司;三羟甲基氨基甲烷(Tris),Sigma-Aldrich公司;邻苯三酚、盐酸、水杨酸、硫酸亚铁、30%过氧化氢、无水乙醇、氢氧化钠、磷酸二氢钾、维生素C(Vc),均为分析纯;当归、红景天、赤芍、白蔹、人参、黄芩、桑葚、苦参、玉竹、葛根、六月雪、茯苓、川芎、白芨、苦丁茶、金银花、白芍、苍术,均购于百姓缘大药房;黄蜀葵花,购于阜阳;蒸馏水,实验室自制.UV-1750紫外-可见分光光度计,日本岛津;JK3200B超声波清洗器,合肥金尼克机械制造有限公司;AB104-N分析天平,精度0.000 1 g,梅特勒-托利多仪器(上海)有限公司;DZF-6020型真空干燥箱,上海一恒科技有限公司.1.2 实验操作1.2.1 制备中草药提取液称取19种干燥、粉碎后的中草药各1.0 g,选择无水乙醇和水分别为提取剂超声提取.先分别加入提取剂40 mL,超声30 min后过滤;再向滤渣中加入40 mL该提取剂,继续超声30 min,合并两次滤液,并将其定容到100 mL,制得各中草药提取液原液.原液浓度为10 mg·mL-1,作为抑制酪氨酸酶测试液;原液稀释为1 mg·mL-1作为清除自由基测试液;均以Vc做阳性对照.1.2.2 酪氨酸酶抑制率的测定分别配置pH=6.8的磷酸盐缓冲液(PBS),1 mg·mL-1的L-酪氨酸溶液,0.07 mg·mL-1的酪氨酸酶溶液.按以下设置组加样,1测试样:2.0 mL PBS+0.5 mL酪氨酸酶溶液+0.5 mL L-酪氨酸溶液;2测试样:2.5 mL PBS+0.5 mL酪氨酸酶溶液;3测试样:0.5 mL样品溶液+1.5 mL PBS+0.5 mL酪氨酸酶溶液+0.5 mLL-酪氨酸溶液;4测试样:0.5 mL样品溶液+2.0 mL PBS+0.5 mL酪氨酸酶溶液.将各测试样混匀,置37 ℃水浴中保温30 min后立即于475 nm处测吸光度(A)[9].按公式(1)计算酪氨酸酶抑制率(I)其中:A1~A4为测试样1~4在475 nm处的A值.1.2.3 抗氧化能力的测定1.2.3.1 DPPH·抑制率测定将3 mL中草药待测液和3 mL浓度为0.200 mmol·L-1的DPPH·乙醇溶液加入同一具塞试管中,摇匀,室温下置于暗处30 min,测定其在波长517 nm处的吸光度Ai1,同法测定提取剂与DPPH·溶液各3 mL混合后的吸光度A01以及该样品溶液与无水乙醇各3 mL混合后的吸光度Aj1,依据公式(2)计算中草药对DPPH·的抑制率(S1)[10-11]1.2.3.2 ·OH抑制率测定在同一具塞试管中分别加入浓度为9.0 mmol·L-1的水杨酸-乙醇溶液和9.0 mmol·L-1的FeSO4溶液,以及中草药待测液各2 mL,然后加入8.8 mmol·L-1 H2O2溶液2 mL,摇匀,置于37 ℃水浴中反应30 min,以蒸馏水为参比,在波长510 nm处测定吸光度Ai2;以蒸馏水2 mL替代水杨酸-乙醇溶液测定吸光度Aj2;用提取剂2 mL替代中草药待测液并测定吸光度A02.依据公式(3)计算中草药对·OH的抑制率(S2)[12]抑制率测定将5 mL pH为8.2的Tris-HCl缓冲溶液加入具塞试管中,先置于25 ℃水浴中预热20 min,然后加入2 mL待测液和0.5 mL浓度为5.00 mmol·L-1的邻苯三酚溶液(用10 mmol·L-1的HCl溶液配制),摇匀后放入25 ℃的水浴中反应4 min,以10 mmol·L-1的HCl溶液作参比,选择波长320 nm测定吸光度Ai3;以0.5 mL的HCl溶液替代邻苯三酚溶液,测定吸光度Aj3;用2 mL提取剂替代中草药待测液并测定吸光度A03.依据公式(4)计算中草药对·O2-的抑制率(S3)[13]1.2.4 IC50测定用上述同样方法测定提取物和Vc在不同浓度下对酪氨酸酶的抑制率及其抗氧化能力,并依据浓度-抑制率曲线估算出半数抑制浓度(IC50).以Vc作为酪氨酸酶抑制率测试和抗氧化能力测试的阳性对照组.1.2.5 数据处理每组实验重复3次,数据采用Excel统计,以x±s表示.2.1 19种中草药的选择依据我国的中医药美容有着两千多年的历史,具有美容功效的药物已达160余种.笔者从中医药美容古方中选取祛斑、增白皮肤使用频率较高[14],或文献报道[15-16]具有较好抑制酪氨酸酶活性的19种中草药作为研究对象.依据中医药美容祛斑原理,红景天、人参补气养血,当归、川芎、赤芍、白芍、白芨活血化瘀,茯苓、苍术、六月雪健脾利湿,白蔹、葛根、黄芩、黄蜀葵花、苦丁茶、苦参、金银花清热、解毒、散结、凉血、化瘀,玉竹养阴生津,桑葚补肝益肾,所选的19种中草药虽以不同机制作用于人体,都具有一定的靓白皮肤的功效.2.2 19种中草药对酪氨酸酶的抑制作用酪氨酸酶是一种多酚氧化酶,在黑色素形成过程中分别参与催化一元酚羟基化生成邻二羟基化合物和氧化邻苯二酚生成邻苯二醌这两类不同的反应,是黑色素生成的关键酶,其活性强弱决定了黑色素数量的多少[2].目前市场上销售的许多美白、祛斑产品都是以抑制酪氨酸酶达到美白作用[17].因此,对酪氨酸酶抑制作用的强弱是评价增白效果的主要指标.在黑色素的生成过程中,在酪氨酸酶的催化作用下,首先由酪氨酸转化为多巴,多巴再转化为多巴醌.多巴醌是一种在波长475 nm处有特征吸收的有色物质.当加入对酪氨酸酶有抑制作用的样液时,多巴醌的合成量下降,下降的程度与样液的浓度呈一定的量效关系,因此依据475 nm的吸光度变化比较样液对酪氨酸酶的抑制作用的强弱[18-19].19种中草药提取液对酪氨酸酶的抑制率测定结果见表1.由表1可知:19种中草药的无水乙醇提取液和水提取液对酪氨酸酶都有一定的抑制作用.其中茯苓、赤芍、红景天、白蔹、黄芩、人参、葛根的无水乙醇提取液对酪氨酸酶的抑制率都在80%以上;赤芍、红景天、人参、白蔹、黄芩、茯苓、桑葚的水提取液对酪氨酸酶的抑制率也在80%以上.对前6种中草药进行梯度稀释,分别测定其对酪氨酸酶抑制作用,并计算IC50.IC50 为抑制率达到50%时的样品浓度,IC50 的值越小,对酪氨酸酶抑制活性越高.对前6种中草药酪氨酸酶抑制强弱复筛的测定结果见表2.由表2可知:6种中草药无水乙醇提取液中只有茯苓无水乙醇提取液的IC50(0.101 mg·mL-1)小于Vc(0.314 mg·mL-1),说明茯苓醇提液比Vc具有更好的酪氨酸酶抑制作用.6种中草药水提取液的IC50都比Vc的大,说明该6种中草药水提取液的酪氨酸酶抑制作用均弱于Vc.2.3 19种中草药提取液对DPPH·的抑制作用DPPH·在有机溶剂中是一种稳定的自由基,其乙醇溶液呈紫色,在波长517 nm处具有最大吸收.当有抗氧化剂存在时,DPPH·的单电子被捕捉而使其颜色变浅,在最大吸收波长处的吸光度值会下降[20],根据吸光度与浓度呈一定的量效关系,可推知体系中的DPPH·含量变化,用于评价样液的抗氧化能力.19种中草药提取液对DPPH·的抑制率测定结果见表3.由表3可知,19种中草药的无水乙醇提取液和水提取液对DPPH·都有一定的清除能力.其中红景天、黄芩、白芍、赤芍、苦丁茶、黄蜀葵花的无水乙醇提取液对DPPH·的抑制率都在90%以上;这6种中草药的水提取液对DPPH·的抑制率也均在70%以上.对前6种中草药提取液进行浓度梯度稀释,分别测定它们在不同浓度下对DPPH·自由基的抑制率,并计算IC50,测定结果列于表4.由表4可知,6种中草药中仅黄芩(0.043 mg·mL-1)的无水乙醇提取液的IC50小于Vc(0.046 mg·mL-1),说明黄芩醇提物比Vc具有更好的清除DPPH·的能力.2.4 19种中草药提取液对·OH的抑制作用利用Fenton反应,H2O2和Fe2+混合产生·OH,在反应体系中加入水杨酸可以有效捕捉·OH并生成有色物质,在510 nm处有强吸收.当有抗氧化剂存在时,·OH的单电子被捕捉而使其颜色变浅,在最大吸收波长处的吸光度值会下降,根据吸光度与浓度呈一定的量效关系,可推知体系中·OH含量的变化,用于评价实验样品的抗氧化能力[21-22].19种中草药提取液对·OH的抑制率测定结果见表5.由表5可知,19种中草药提取液对·OH自由基的清除能力相对较弱,抑制率超过50%的仅有红景天、黄芩、茯苓的无水乙醇提取液和黄芩、红景天、白芍、赤芍、六月雪的水提取液.对红景天、黄芩、白芍、赤芍、六月雪、茯苓这6种中草药提取液进行浓度梯度稀释,测定各稀释液对·OH自由基的抑制率,计算IC50并将结果列于表6.由表6可知,无水乙醇提取液中仅红景天、黄芩、茯苓可测出IC50;除茯苓外,其余5种中草药的水提取液均可测出IC50;红景天无水乙醇提取液的IC50最小(0.193 mg·mL-1),但仍大于Vc的IC50 (0.049 mg·mL-1).2.5 19种中草药提取液对的抑制作用邻苯三酚在碱性条件下迅速自氧化,生成与半醌自由基,又加速半醌自由基氧化成有色的醌类物质,该物质在紫外波长320 nm处有灵敏吸收.由于醌类物质的积累依赖于的浓度,所以加入抗氧化物质后,被捕捉,导致320 nm处的最大吸光度降低.根据吸光度与浓度呈一定的量效关系,可推知体系中含量的变化,因而推算样液对的清除能力[23-24].醌类物质的积累在1 ~ 4 min内与时间呈良好的线性关系,之后减慢,所以选定反应时间4 min[25].表7列出了19种中草药提取液对自由基的抑制率.由表7可见,19 种中草药提取液对自由基的抑制率达到了80%以上的有黄芩、黄蜀葵花、白芍、红景天、苦丁茶、赤芍的无水乙醇提取液,以及赤芍、白芍、黄蜀葵花的水提取液.对前6种中草药进行浓度梯度稀释,根据测定各稀释液对自由基的抑制率,计算IC50并将结果列于表8.由表8可知,黄芩(0.091 mg·mL-1)、苦丁茶(0.258 mg·mL-1) 、红景天(0.432 mg·mL-1)的无水乙醇提取液,黄芩水提取液(0.278 mg·mL-1)的IC50,均小于Vc(0.457 mg·mL-1).说明黄芩提取液、苦丁茶和红景天的无水乙醇提取液比Vc具有更好的清除能力.笔者测定了19种中草药的无水乙醇和水提取液对酪氨酸酶和3种自由基的抑制率,通过初筛和复筛分析比较得出以下结论:19种中草药的无水乙醇提取液和水提取液对酪氨酸酶都具有一定的抑制作用.茯苓、黄芩、红景天、赤芍、人参、白蔹均表现出较强的酪氨酸酶抑制活性,其中茯苓对酪氨酸酶的抑制能力最强.19种中草药的无水乙醇提取液和水提取液对3种自由基的清除作用有较大差异.红景天、黄芩、白芍、赤芍的综合抗氧化活性强于其他中草药.在筛选的19种中草药中,红景天、黄芩、赤芍兼具较好的酪氨酸酶抑制作用和抗氧化活性.对酪氨酸酶抑制率的测试是评价美白功效的常用方法,对自由基抑制率的测试则是评价抗氧化功效的常用方法.笔者综合分析评价了19种中草药提取液的酪氨酸酶抑制作用及抗氧化性能,研究结果可为化妆品、保健品中添加中草药美白抗氧化活性成分提供一定的参考.必须指出,仅通过对酪氨酸酶活性的抑制程度来筛选中草药美白活性成分,不可避免带有一定的片面性和盲目性.但相对于人体实验测试周期较长或缺乏人体测试仪器的情况,该法也不失为一种快速筛选和评价美白活性成分的方法.后续实验中将增加对黑色素生成过程中同时发挥作用的多巴色素互变酶和DHICA氧化酶的抑制作用及美白活性成分的皮肤渗透性能的测试,以完善体外筛选方法,快速评价美白活性成分的功效.【相关文献】[1] 吴娅楠,黄曾辉,徐立. 桑树美白活性的研究进展[J]. 蚕学通讯, 2013, 33 (2): 7-13.[2] 王玉林,何锦风,王维民,等. 皮肤黑色素的产生及美白浅析[J]. 日用化学品科学, 2013,36 (2): 33-35.[3] PARK H Y, KOSMADAKI M, YAAR M, et al. Cellular mechanisms regulating human melanogenesis[J]. Cellular Molecular Life Sciences, 2009, 66 (9): 1493-1506.[4] 张海霞,梁乃龙. 黄褐斑与酪氨酸酶活性的相关性研究[J]. 辽宁中医药大学学报, 2010 (9):99-100.[5] 焦晶晶,张英. 植物类黄酮作为护肤因子在化妆品领域的研究进展[J]. 精细化工, 2004, 21: 98-102.[6] PARVEZ S, KANG M, CHUNG H S, et al. Survey and mechanism of skin depigmenting and lightening agents[J]. Phytotherapy Research, 2006, 20 (11): 921-934.[7] 桑琛,李明学. 衰老自由基学说和运动对抗自由基损伤的作用[J]. 吉林体育学院学报, 2007,23 (1): 80-81.[8] 涂国荣,张利兴,苏昆,等. 自由基与皮肤衰老的关系及天然抗衰老植物在化妆品中的应用[J]. 日用化学品科学, 1999 (S1): 82-85.[9] 刘宇红,董银卯,李才广. 皮肤化学美白剂抑制酪氨酸酶活性的研究[J]. 日用化学工业, 2001 (1): 21-23.[10] YEN G C, CHEN H Y. Antioxidant activity of various tea extracts in relation to their antimutagenicity[J]. Journal of Agricultural and Food Chemistry, 1995, 43 (1): 27-32. [11] BUTSAT S, SIRIAMORNPUN S. Antioxidant capacities and phenolic compounds of the husk, bran and endosperm of Thai rice[J]. Food Chemistry. 2010, 119 (2): 606-613.[12] 颜军,郭晓强,邬晓勇,等. 银耳多糖的提取及其清除自由基作用[J]. 成都大学学报 (自然科学版), 2006, 25 (1): 35-38.[13] 林明霞,李涂蓝,潘冬贵,等. 鸡骨草醇提物体外抗氧化自由基作用研究[J]. 中国现代应用药学, 2013, 30 (10): 1047-1050.[14] 武谦虎. 美容中医一本通[M]. 北京: 中国医药科技出版社, 2013.[15] 傅国强,马鹏程,吴勤学,等. 196味中药乙醇提取物对酪氨酸酶的抑制作用[J]. 中华皮肤科杂志, 2003, 36 (2): 103-106.[16] 桂卉,唐婷,严航,等. 葛根黄酮类物质美白作用的研究[J]. 日用化学工业, 2013, 43 (4): 290-293.[17] 杜孝元,刘玮,史飞,等. 酪氨酸酶活性抑制实验及其在祛斑美白化妆品功效评价中的应[J]. 中国美容医学, 2005, 14 (6): 740-742.[18] CHEN Q X, KUBO I. Kinetics of mushroom tyrosinase inhibition by quercetin[J]. Journal of Agricultural and Food Chemistry. 2002, 50 (14): 4108-4112.[19] 欧霖拱. 皮肤黑素成因分析与美白祛斑化妆品的研究[J]. 福建轻纺, 2011 (6): 22-26.[20] 郑大贵,叶青,叶红德,等. DPPH·法评价Vc、异Vc及其衍生物的抗氧化性能[J]. 食品工业科技, 2008, 29 (4): 113-116.[21] 张昊,任发政. 羟基和超氧自由基的检测研究进展[J]. 光谱学与光谱分析, 2009, 29 (4): 1093-1099.[22] 张春生,方玉酶,王毅红,等. 野生鱼腥草黄酮化合物对羟基自由基的清除作用[J]. 食品科技,2009, 34 (6): 188-190.[23] ALI S, CHOUDHARY M I, RAHMAN A U. Superoxide anion radical, an important target for the discovery of antioxidants[J]. Atherosclerosis Supplements, 2008, 9 (1): 268-270.[24] 玄红专,桑青,麻建军. 邻苯三酚自氧化法测定不同蜂产品抗氧化活性的研究[J]. 食品科技,2008 (4): 137-139.[25] 韩少华,朱靖博,王妍妍. 邻苯三酚自氧化法测定抗氧化活性的方法研究[J]. 中国酿造,2009 (6): 155-157.。

熟地黄提取液对酪氨酸酶的抑制作用研究一、仪器和药品:仪器:分光光度计、微量移液器(1ml)、电子天平、容量瓶(10ml、50ml、250ml)、回流装置一套、沸石、抽滤装置、旋转蒸发仪、水浴恒温箱、烧杯和量筒若干。
药品:熟地黄粉末(约50g)、体积分数50%的乙醇(200ml)、磷酸氢二钠、磷酸二氢钠、L-酪氨酸、酪氨酸酶、去离子水若干。
二、实验方案:A、熟地黄有效成分的提取:1、干燥熟地黄粉末10.0 g + 体积分数50%的乙醇100mL,室温浸泡24 h。
2、烧瓶+沸石+上述浸泡液,回流提取3 h,冷却后抽滤取滤液。
残渣再次加50%乙醇100mL 回流提取3 h,冷却抽滤取滤液,合并两次滤液。
(回流温度约80℃。
)3、将滤液置于旋转蒸发仪上60-65℃浓缩回收溶剂,得膏状提取物。
4、称取适量膏状提取物+去离子水配置成1 mg/mL 溶液备用。
B、磷酸缓冲溶液(PBS)的配制:1、称取磷酸氢二钠13.3984 g,加去离子水溶解,转移至250mL 容量瓶中定容得a液;另称取磷酸二氢钠6.9011 g,加去离子水溶解,转移至250mL容量瓶中定容得b液。
2、分别移取a、b两溶液各50mL至250mL容量瓶中,加去离子水定容,即得pH=6.8的磷酸缓冲溶液。
C、L-酪氨酸溶液和酪氨酸酶溶液的配制:1、称取L-酪氨酸25.6 g,用PBS缓冲液定容于50mL容量瓶中,即得L-酪氨酸溶液。
2、称取酪氨酸酶0.3502 g,用PBS缓冲液定容于10mL容量瓶中,即得酪氨酸酶溶液。
(冰水浴中操作、保存。
)D、酪氨酸酶活力的测定:(分光光度法测A475)用微量移液器分别按表一剂量准确移取a、b、c、d四组样液,置于37℃水浴中恒温10 min后,各加入0.40mL酪氨酸酶溶液,混匀,37℃温育反应10 min,迅速移入比色皿中,测得在475nm处的吸光度A a、A b、A c、A d ,然后按下面的公式计算熟地提取液对酪氨酸酶的抑制率:抑制率=[1-(A d-A c)/(A b-A a)]×100%其中:a:既无底物也无提取物的待测液;b:有底物但无提取物的待测液;c:无底物但有提取物的待测液;d:既有底物也有提取物的待测液。


柿子叶提取物对酪氨酸酶的抑制作用贾朝;王婷【摘要】[目的]测定柿子叶不同提取物对酪氨酸酶的抑制作用.[方法]以多巴为底物,利用酪氨酸酶与多巴反应生成红色多巴醌的原理,用酶标仪检测柿子叶不同提取物对酪氨酸酶的抑制作用.[结果]柿子叶的乙醚萃取物对酪氨酸酶有最大抑制,最大抑制率为43.5%,半数抑制浓度(IC50)为0.591 mg/ml.[结论]柿子叶的乙醚提取物对酪氨酸酶具有较强的抑制作用,具有一定的美白功效.【期刊名称】《安徽农业科学》【年(卷),期】2015(000)026【总页数】4页(P8-10,26)【关键词】酪氨酸酶抑制剂;柿叶;多酚类物质【作者】贾朝;王婷【作者单位】商洛学院,陕西商洛726000;商洛学院,陕西商洛726000【正文语种】中文【中图分类】S-03Inhibition of Persimmon Leaves Extract on TyrosinaseJIA Zhao, WANG Ting (Shangluo College, Shangluo, Shaanxi 726000) Key words Tyrosinase inhibitor; Persimmon leaves; Olyphenols酪氨酸酶[1](Tyrosinase,EC.1.14.18.1)又称多酚氧化酶(PPO),广泛存在于微生物、动植物及人体中,是结构复杂的含铜氧化还原酶。
酪氨酸酶在黑色素合成过程中起着关键作用。
造成皮肤黑色素生成的原因有多种,如遗传因素和环境因素。
目前研究结果基本上认为其成因在于皮肤细胞中的酪氨酸在酪氨酸酶的作用下逐渐氧化为多巴(Dopa)、多巴醌(Dopaquinone),生成的这些醌类物质易于多聚化,并与细胞内蛋白作用,生成黑色或棕色的色素沉淀,最后逐步转化为皮肤黑色素(Tyrsinemelanin)[2],其反应式见图1。
酪氨酸酶的双核铜中心结构[3]如图 2 所示。
每个铜离子由3个组氨酸残基的亚氨基共价结合固定在活性中心上,其中2个组氨酸在横向,结合较强,有一个在轴向,结合较弱。
第 49 卷第 12 期2021 年 6 月广州化工Guangzhou Chemical Industry Vol. 49 No. 12Jun. 2021白鲜皮抑制酪氨酸酶作用研究及其美白面膜制备**基金项目:2019年大学生创新创业项目(201910162047)。
第一作者:杨宇(1999-),女,本科学生,制药专业。
通讯作者:陈晓霞(1980-),女,博士,副教授,主要从事药物分析工作。
杨 宇,宋孟霜,陈 婕,王姝萱,刘 畅,李欣然,陈晓霞(辽宁中医药大学药学院,辽宁大连116600)摘 要:采用紫外-可见分光光度法对不同浓度白鲜皮水提物及醇提物抑制酪氨酸酶活性进行研究,结果显示白鲜皮醇提物与水提物相比,具有更强的抑制酪氨酸酶活性的作用,且存在剂量依赖性。
当含生药浓度达到16mg/mL 时,其抑制率可到到 76%o 以白鲜皮醇提物为主要美白成分,制备了外观显透明色,呈弱酸性,清凉无刺激感,粘稠度适中,易于贴敷的美白面膜, 期望进行更进一步的开发,实现规模化生产。
关键词:白鲜皮;酪氨酸酶;抑制;美白面膜中图分类号:TQ685. 2文献标志码:B 文章编号:1001-9677(2021)012-0088-03Study on Inhibitation of Cortex Dictam on Tyrosinase andWhitening Mask Preparing *YANG Yu , SONG Meng -shuang , CHEN Jie , WANG Shu -xuan , LIU Chang , LI Xin -ran , CHEN Xiao -xia (College of Pharmacy , Liaoning University of Traditional Chinese Medicine , Liaoning Dalian 116600 , China)Abstract : Inhibitation of different concentrations of water extract and alcohol extract from cortex dictam ontyrosinaseactivity was detected with UV-Vis spectrophotometry , results showed that alcohol extract from cortex dictam had stronger inhibitory effect on tyrosinase activity than water extract , and there was a dose-dependent. When the concentration of raw drug reached 16 mg/mL, its inhibition rate can reach 76%. The whitening maskwas prepared with alcohol extract form cortex dictam as the main whitening ingredient. It showed transparent color , weak acid , cool no irritation , moderate viscosity , easy to apply.Key words : cortex dictam ; tyrosinase ; inhibitation ; whitening mask随着人民生活水平的提高,越来越多的女性朋友关注皮肤 保养。
酶抑制率法检测流程
1、缓冲液配制(1555ML怡宝矿泉水为例,1:100比例配置)
A、取55ML矿泉水出来,此时矿泉水剩1500ML。
B、取15ML缓冲液,加入1500ML矿泉水中。
C、摇匀,常温保存。
(缓冲液保质期30天)
2、对照测试
A、在比色皿中依次加入3ML缓冲液(已配置好的)、100μL酶试剂和100μL显色剂,混匀。
B、加入100μL底物,迅速摇匀。
C、立即上机对照测试。
(对照必须大于
0.1合格,低于0.1需要重新做对照)
3、样品前处理
A、选样品,擦去表面泥土,剪成1cm方碎片。
B、称取2g剪碎样品,放去50ML离心管。
C、加入10ML缓冲液。
D、轻轻震摇1分钟,静置1分钟。
4、样品测试
A、在比色皿中依次加入3ML待测液、100μL酶试剂和100μL显色剂,混匀。
B、静置10分钟。
C、加入100μL底物,迅速摇匀。
D、立即上机样品测试。
5、结果判断
A、农药残留超标:≥50%(阳性样品做2次以上重复检测)。
B、农药残留合格:抑制率<50%。
不同中药乙醇提取物对酪氨酸酶抑制活性的对比分析宝应县中医医院江苏省扬州市225800【摘要】目的:研究分析不同中药乙醇提取物对酪氨酸酶抑制活性的对比。
方法:选取中药诃子、艾叶、紫草、白芷等药材应用70%乙醇提取方法,将维生素C、熊果苷作为阳性参照,运用体外酪氨酸酶抑制方法,对比不同药物的活性。
结果:中药诃子酪氨酸酶抑制率达到50.34%,艾叶酪氨酸酶抑制率为21.67%,而紫草酪氨酸酶抑制率达到-10.36%。
结论:中药诃子、艾叶醇提取物对于酪氨酸酶有抑制活性,能够为美白中药的研究提供新方向。
【关键词】乙醇提取物;美白;酪氨酸酶抑制活性美容中药与化妆品在我国有着悠久的发展历史,最早在《五十二病方》中记录有关美容的方剂共8首[1]。
由于中药的毒副作用相对比较低,应用后有着明显的效果,所以深受爱美女士的追捧。
中医药美白、祛斑等产品在国外发展迅猛,市面上有许多美白产品都是利用抑制酪氨酸酶活性,降低黑色素形成,具有美白的作用,药物美白作用效果可利用监测手段,将酪氨酸酶抑制率作为重要的评估标准。
本次研究基于体外实验,借助酪氨酸酶活性抑制实验,对诃子、艾叶、紫草、白芷等药材美白与抗菌消炎中药的美白活性进行观察,为研发中药美白制剂提供可靠的研究依据。
1.材料与方法1.1材料选取熊果苷由台湾第一化工原料股份有限公司提供;酪氨酸酶与酪氨酸源自于美国Sigma企业;KH2PO4与K2HPO4由台湾联工化学制药厂提供。
1.2中药供试液制取中药饮片诃子、艾叶、紫草、白芷中药源于北京同仁堂药方,称量10克原药材,放在三角瓶中,加入用药乙醇150毫升浸泡12小时,在三角瓶口处,覆盖玻璃皿,文火加热45分钟,把中药提取液进行抽滤处理,旋转蒸发仪器浓缩,旋转真空干燥仪器,使其在温度为50℃的环境下干燥处理,制备供试中药提取物粉末,利用天平精准称量17毫克中药提取液干燥粉末,将其转移到容量瓶之中,通过纯净水超声溶解定容处理后,制取成浓度为每升1.7毫克的供试药液。
油溶性美白剂对酪氨酸酶抑制性能的测试方法
周忠;王建国;周蕾;王建新
【期刊名称】《日用化学工业》
【年(卷),期】2003(033)005
【摘要】化学分析方法测定油溶性美白剂对酪氨酸酶活性的抑制率可在有机溶剂-水体系中进行.通过测定若干单一有机溶剂和复配有机溶剂对酪氨酸酶活性的抑制率及相关的溶解参数,发现复配有机溶剂V(丙二醇):V(乙酸乙酯)为9:1的用量为0.5 mL时,对酪氨酸酶活性的抑制率为29.4%.该复配有机溶剂与水构成的测试体系可用于油溶性美白剂,如异甘草素和甘草素对酪氨酸酶活性的抑制率的测定.
【总页数】3页(P326-328)
【作者】周忠;王建国;周蕾;王建新
【作者单位】江南大学,化学与材料工程学院,江苏,无锡,214036;江南大学,化学与材料工程学院,江苏,无锡,214036;江南大学,化学与材料工程学院,江苏,无锡,214036;江南大学,化学与材料工程学院,江苏,无锡,214036
【正文语种】中文
【中图分类】TQ658.5
【相关文献】
1.4种美白剂对B-16细胞内酪氨酸酶活性抑制的研究 [J], 李玲;宋伟民;周华
2.马铃薯酪氨酸酶体外筛选美白剂测定体系的建立 [J], 徐鹏;付绍平;王伟;赵长新;章克昌
3.皮肤化学美白剂抑制酪氨酸酶活性的研究 [J], 刘宇红;董银卯;李才广
4.几种美白剂抑制酪氨酸酶活性的研究 [J], 刘琦;刘洋;吴金昊;陶丽莉;王楠;赵华
5.三种美白剂对酪氨酸酶活性的抑制 [J], 陆晔;周名权;翁康生;刘国星
因版权原因,仅展示原文概要,查看原文内容请购买。
酶抑制率法
酶抑制率法是一种常用的生物化学实验方法,用于测定酶活性及其抑制剂的效能。
该方法通过测定酶催化反应中底物的消耗量或产物的生成量,来间接衡量酶的活性水平。
同时,该方法还可以用于评估抑制剂对酶的抑制效果,为药物研发提供重要的参考依据。
酶抑制率法的原理是利用抑制剂抑制酶活性的特性,通过比较酶抑制前后反应速率的差异来计算抑制率。
具体操作流程如下:
1. 酶活性测定:首先需要确定酶的活性水平,即酶在一定条件下催化反应的速率。
这一步通常采用比色法或荧光法等方法,通过测定底物的消耗量或产物的生成量来计算酶的活性。
2. 抑制剂添加:将抑制剂加入反应体系中,等待一定时间使其与酶反应,达到抑制酶活性的效果。
3. 再次测定酶活性:在抑制剂作用一定时间后,再次测定酶的活性水平,计算抑制前后反应速率的差异,即可得到抑制率。
酶抑制率法的优点在于操作简便、灵敏度高、结果可靠。
同时,该方法还可以用于评估抑制剂的类型、浓度、作用机制等,为药物研发提供有力的数据支持。
但是,该方法也存在一些局限性,如只适用于酶活性稳定的反应体系、对于多种抑制剂的评价可能存在误差等。
总之,酶抑制率法是一种重要的生物化学实验方法,广泛应用于生物医学、药物研发、食品科学等领域。
随着技术的不断发展,该方法也将不断完善和优化,为科学研究和工业应用提供更加精准、可靠的数据支持。
1. 4念珠藻甲醇提取物对酪氨酸酶活性的抑制
1. 4. 1念珠藻甲醇提取物对酪氨酸酶活力的影响
提取物对酪氨酸酶的抑制参照Masuda和Kubo的方
法[ 6, 7] , 并略作修改。
待测样品用DMSO 进行浓度
梯度稀释, 浓度分别为1、05、025、0125 mg / mL; 换算成反应体系中的终浓度分别为333、1665、8325、4 3 g /mL。
反应在96孔细胞板上
进行, 每组8孔, 分别是: A. 不含样品, 但含酪氨酸
酶的阴性对照, 3孔重复; B. 不含样品及酪氨酸酶的
空白对照, 1孔; C. 包含样品及酪氨酸酶, 3孔重复,
D. 含样品但不含酪氨酸酶的空白对照, 1 孔。
A 孔
中加入190 L pH 68、0 1 mo l/L 磷酸缓冲液,
10 L 1380 U /mL酪氨酸酶; B 孔中加入200 L 相
同的磷酸缓冲液; C 孔中加入180 L磷酸缓冲液,
10 L 1380 U /mL酪氨酸酶, 10 L样品; D 孔中加
入190 L磷酸缓冲液, 10 L样品。
然后将细胞板
在30条件下放置5 m in, 再在每孔中加入100 L
2 5 mmo l/L L-酪氨酸( 见表1 )。
在30反应
10m in后, 立即置于Tecan Sunrise 酶标仪中测量在475 nm下的吸光值。
提取物对酪氨酸酶活性的抑
制按公式计算:
抑制率=( A - B ) - ( C- D)*100%
A – B
参照文献方法〔3〕在数支干燥的试管中
各加入1.oml0.03%左旋多巴溶液,再加上维
生素E一日环糊精溶液,(加入量按表所列体积) 最后的磷酸钠缓冲液加至5.Oml,25℃恒温10 min后,加入0.4ml酶提取液,立即计时并迅速置于恒温槽内,待反应1min,用BaCRman
DV一70型分光原度计在475nm处测定吸收度,以缓冲液为参比,然后根据多巴色素的消光系数“=3700求出Vi,把无维生素E一日环糊精溶液存在时速度定为100%,求出不同浓度维生
素E一日环糊精存在时酶的相对活性以及对酶的抑制率
抑制率二V。
空白一V抑制V。
空白x100%。