朗伯比尔定律
- 格式:doc
- 大小:91.50 KB
- 文档页数:5

朗伯比尔定律概念
朗伯比尔定律(Lambert's cosine law),也称为朗伯定律或兰伯特定律,是光学中的一个基本定律,描述了光的反射特性。
朗伯比尔定律表明,当光线垂直射到一个完全漫反射表面上时,单位面积上的辐射光强(光线能量)与入射光线与法线之间的夹角的余弦成正比。
换句话说,光的反射强度取决于光线入射角的余弦值。
数学表达式为:
I = I0 * cos(θ)
其中,
•I 是入射点(或观察点)的光强(光线能量),
•I0 是垂直入射到表面的光源的光强,
•θ 是入射光线与法线之间的夹角。
根据朗伯比尔定律,当光线以垂直角度入射时,即θ = 0,光的反射光强最大,全部入射光被反射。
当光线以水平角度入射时,即θ = 90°,光的反射光强最小,没有光线被反射。
朗伯比尔定律对于解释光的漫反射现象、表面亮度以及光线与物体之间的相互作用很重要,广泛应用于光学、计算机图形学、遥感等领域。


朗伯-比尔定律
朗伯比尔定律(Lambert-Beer law)是分光光度法的基本定律,是描述物质对某一波长光吸收的强弱与吸光物质的浓度及其液层厚度间的关系。
朗伯比尔
定律概念又称比尔定律、比耳定律、朗伯-比尔定律(Beer-Lambert Law)、布格-朗伯-比尔定律,是光吸收的基本定律,适用于所有的电磁辐射和所有的吸光物质,包括气体、固体、液体、分子、原子和离子。
比尔-朗伯定律是比色分析及分光光度法的理论基础。
光被吸收的量正比于光程中产生光吸收的分子数目。
朗伯比尔定律公式意义比尔—朗伯定律数学表达式A=lg(1/T)=Kbc A为吸光度,T为透射比(透光度),是出射光强度(I)比入射光强度(I0). K
为摩尔吸光系数.它与吸收物质的性质及入射光的波长λ有关. c为吸光物质的浓度,单位为mol/L,b为吸收层厚度,单位为.【b也常用L替换,含义一致】物理意义物理意义是当一束平行单色光垂直通过某一均匀非散射的吸光物质时,其吸光度A与吸光物质的浓度c及吸收层厚度b成正比,而与透光度T 成反相关。

朗伯比尔定律计算公式浓度的单位朗伯比尔定律可是化学学科中的一个重要知识点哟!咱们先来了解一下它的计算公式。
朗伯比尔定律的表达式为:A = εbc,其中 A 表示吸光度,ε 是摩尔吸光系数,b 是光程,而 c 就是咱们要说的浓度啦。
说到浓度的单位,这可有点讲究。
在化学里,浓度的常用单位有摩尔每升(mol/L),还有质量浓度单位,比如克每升(g/L)。
给大家讲个我之前遇到的事儿。
有一次我在实验室里带着学生做实验,就是利用朗伯比尔定律来测定某种溶液中物质的浓度。
当时有个学生就被这浓度单位给弄迷糊了。
我们做的是测定硫酸铜溶液中铜离子的浓度。
按照实验步骤,先配置了一系列不同浓度的标准溶液,然后测量它们的吸光度。
这个迷糊的学生在计算的时候,一会儿把浓度单位弄成了克每毫升,一会儿又弄成了摩尔每毫升,结果算出来的结果那叫一个乱七八糟。
我就跟他说:“你得先把单位搞清楚,就像咱们走路得先认准方向,不然走得再快也是瞎折腾。
”我耐心地给他重新讲解了浓度单位的换算,让他明白了摩尔每升和其他单位之间的关系。
这孩子后来恍然大悟,重新认真计算,终于得出了正确的结果。
从这个小事情就能看出来,搞清楚浓度的单位那是相当重要的。
要是单位错了,后面的计算和分析就全错啦。
在实际应用中,比如在环境监测中,测定水中某种污染物的浓度,就得准确选择和使用合适的浓度单位,才能为环境保护提供可靠的数据支持。
在医学领域,检测血液中某些成分的浓度,同样也得注意单位的问题。
否则,医生就没法准确判断病情,给出合适的治疗方案。
总之,朗伯比尔定律中浓度的单位虽然看起来只是个小小的细节,但却能对整个实验和分析结果产生巨大的影响。
大家在学习和应用的时候,可千万要小心谨慎,别在这个小沟里翻了船哟!。
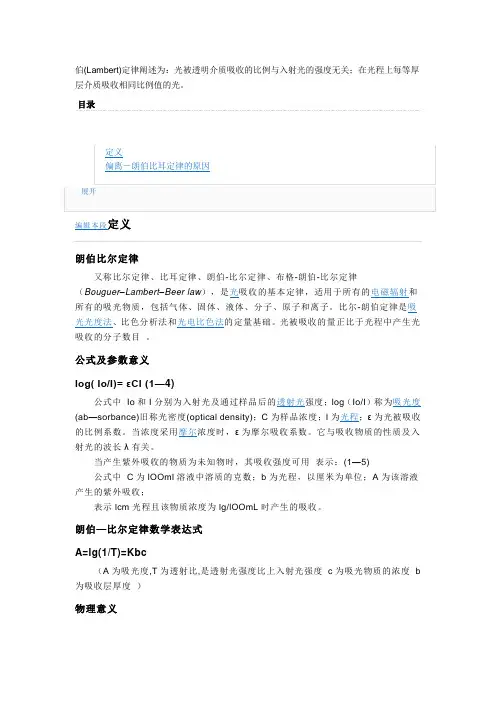
伯(Lambert)定律阐述为:光被透明介质吸收的比例与入射光的强度无关;在光程上每等厚层介质吸收相同比例值的光。
目录编辑本段定义朗伯比尔定律又称比尔定律、比耳定律、朗伯-比尔定律、布格-朗伯-比尔定律(Bouguer–Lambert–Beer law),是光吸收的基本定律,适用于所有的电磁辐射和所有的吸光物质,包括气体、固体、液体、分子、原子和离子。
比尔-朗伯定律是吸光光度法、比色分析法和光电比色法的定量基础。
光被吸收的量正比于光程中产生光吸收的分子数目。
公式及参数意义log( Io/I)= εCl (1—4)公式中Io和I分别为入射光及通过样品后的透射光强度;log(Io/I)称为吸光度(ab—sorbance)旧称光密度(optical density);C为样品浓度;l为光程;ε为光被吸收的比例系数。
当浓度采用摩尔浓度时,ε为摩尔吸收系数。
它与吸收物质的性质及入射光的波长λ有关。
当产生紫外吸收的物质为未知物时,其吸收强度可用表示:(1—5)公式中C为lOOml溶液中溶质的克数;b为光程,以厘米为单位;A为该溶液产生的紫外吸收;表示lcm光程且该物质浓度为lg/lOOmL时产生的吸收。
朗伯—比尔定律数学表达式A=lg(1/T)=Kbc(A为吸光度,T为透射比,是透射光强度比上入射光强度c为吸光物质的浓度b 为吸收层厚度)物理意义当一束平行单色光垂直通过某一均匀非散射的吸光物质时,与其吸光度A与吸光物质的浓度c及吸收层厚度b成正比.朗伯-比耳定律成立的前提(1) 入射光为平行单色光且垂直照射.(2) 吸光物质为均匀非散射体系.(3) 吸光质点之间无相互作用.(4) 辐射与物质之间的作用仅限于光吸收,无荧光和光化学现象发生.比尔-朗伯定律维基百科,自由的百科全书(重定向自比尔-朗伯定律)比尔-朗伯定律(Beer–Lambert law),又称比尔定律、比耳定律、朗伯-比尔定律、布格-朗伯-比尔定律(Bouguer–Lambert–Beer law),是光吸收的基本定律,适用于所有的电磁辐射和所有的吸光物质,包括气体、固体、液体、分子、原子和离子。

朗伯比尔与光的吸收定律朗伯比尔与光的吸收定律,也称为朗伯定律,是物理学中描述物体表面对光的吸收和反射行为的一种定律。
该定律由德国物理学家约翰·海因里希·朗伯于19世纪中叶提出,成为光学领域中的重要基础理论之一。
朗伯定律的核心思想是,物体表面对光的吸收与反射取决于光入射角度、表面材质和光的波长。
朗伯定律适用于光线直线传播且入射光与表面垂直的情况下。
根据该定律,单位面积上吸收的光功率密度(也称为辐射强度)与入射光照射的角度成正比,且与表面材质的光学特性有关。
具体而言,朗伯定律可以用下面的数学表达表示:I = I₀* cosθ其中,I是被物体表面吸收的光功率密度,I₀是光线垂直入射到表面时的光功率密度,θ是入射光线与表面法线之间的夹角(入射角度)。
根据朗伯定律,当入射角θ为0度(即光线垂直入射到表面时),cosθ的值为1,因此吸收的光功率密度最大,物体表面几乎完全吸收入射光。
而当入射角θ为90度(即光线平行于表面时),cosθ的值为0,吸收的光功率密度为0,表明物体表面完全反射入射光。
朗伯定律还告诉我们,与入射光垂直的表面吸收光的能力往往大于与入射光平行的表面。
这是因为与入射光平行的表面往往更容易发生反射,而与入射光垂直的表面则更容易吸收光能。
此外,朗伯定律还与物体表面的光学特性密切相关。
光学特性包括表面反射率、材料吸收系数和折射率等。
不同材料的光学特性不同,因此其对于不同波长的光的吸收和反射行为也会有所差异。
总而言之,朗伯比尔与光的吸收定律是描述物体表面对光的吸收和反射行为的一种定律。
它指出吸收的光功率密度与入射角度、表面材质和光的波长有关。
朗伯定律在物理学和光学领域具有广泛的应用,为解释光的传播和物体表面的光学特性提供了重要的理论基础。

朗伯比尔定律的应用原理1. 什么是朗伯比尔定律朗伯比尔定律(Lambert’s Law),也叫比尔-朗伯定律(Beer-Lambert Law),是描述溶液中光强衰减规律的一个重要定律。
它提供了溶液浓度与光强之间的关系,为分析化学和光学领域提供了重要的工具。
2. 朗伯比尔定律的表达式朗伯比尔定律可以用如下的表达式表示:A = εlc其中,A表示溶液的吸光度,ε称为摩尔吸光系数,l表示光程长度,c表示溶液的浓度。
3. 朗伯比尔定律的应用原理朗伯比尔定律的应用原理基于溶液中物质对特定波长光的吸收。
当光穿过溶液时,被溶液中的物质吸收的光强会减弱,而吸光度A即表示吸收的强度。
根据朗伯比尔定律的表达式可知,吸光度A与摩尔吸光系数ε、光程长度l以及溶液浓度c有关。
通过改变这些参数的值,可以实现溶液中物质的定量分析。
4. 朗伯比尔定律的应用领域朗伯比尔定律在分析化学和光学领域有着广泛的应用。
以下列举了一些常见的应用领域。
•紫外-可见吸收光谱:通过测量溶液在紫外-可见波段的吸收光谱,可以确定物质的摩尔吸光系数、浓度和光程长度等参数,并用于分析定量分析、质量分析等领域。
•荧光光谱:荧光光谱是利用物质在吸收光的作用下产生的快速放出的荧光来研究物质性质的一种分析方法,朗伯比尔定律也适用于荧光分析。
•红外光谱:通过测量溶液在红外波段的吸收光谱,可以确定物质的摩尔吸光系数,从而实现物质的定量分析和结构分析。
•色谱技术:色谱技术包括气相色谱(GC)、液相色谱(LC)等,朗伯比尔定律可以用于根据溶液在色谱柱中的吸收特性确定溶液中目标物质的浓度。
•生物分析:朗伯比尔定律常用于生物分析领域,如酶活性测定、蛋白质测定等。
5. 朗伯比尔定律的局限性朗伯比尔定律在一定条件下可以提供比较准确的分析结果,但也存在一些局限性。
以下是一些常见的局限性:•波长选择:朗伯比尔定律适用于特定波长的吸收分析,需要选择适合的光源和检测器。
•非线性吸收:在溶液浓度较高时,物质的吸收光谱可能变得非线性,这时朗伯比尔定律的应用就需要考虑修正因素。

朗伯比尔定律的三个公式
朗伯比尔定律是光学中非常重要的定律之一,它是描述光线在透
过物体时会发生什么变化的定律。
朗伯比尔定律的基本思想是,对于
一个给定的波长的光线,透过同一物体时经过的路径长度相同,因此
光线的强度是相等的。
具体来讲,朗伯比尔定律有三个公式。
第一个公式是指物体的反射率与其颜色和表面结构有关。
这个公
式可以写为R = Kρ,其中R是物体的反射率,K是一个常数,ρ是物体表面的材料属性。
第二个公式是指物体的透过率与其材料属性和物体厚度有关。
这
个公式可以写为T = kt/d,其中T是物体的透过率,k是一个与物体
材料相关的常数,d是物体的厚度。
第三个公式是指物体的吸收率与其透过率和反射率有关。
这个公
式可以写为A = 1 - R - T,其中A是物体的吸收率,R是物体的反射率,T是物体的透过率。
从这三个公式可以看出,物体的反射率、透过率和吸收率是彼此
相关的,它们之间存在一个不断平衡的过程。
如果物体的透过率变大,那么其反射率和吸收率就会随之减小。
相反,如果物体的反射率或者
吸收率变大,那么其透过率就会减小。
朗伯比尔定律不仅在光学中有重要意义,而且在工业生产和科学
研究中也有广泛的应用。
例如,在制备光学元件和显示器件时需要考
虑到反射率、透过率和吸收率的影响,而在材料的选择和测试实验中
也需要考虑这些因素。
因此,掌握朗伯比尔定律及其三个公式的应用,对于光学科学和实际应用都有着巨大的指导意义。



朗伯比尔定律的基本原理朗伯比尔定律(Lambert's cosine law),又称兰伯特余弦定律,是光学中的一个基本原理。
该定律描述了光的强度与光束入射角之间的关系。
根据朗伯比尔定律,光线在介质中传播时,其强度与入射角的余弦成正比。
朗伯比尔定律的基本原理是,当光线垂直入射于一个均匀的、完全散射的表面时,光线在各个方向上的强度相等。
换句话说,光线的亮度只取决于光线入射的方向,与其位置无关。
这意味着光线在入射角相同的情况下,无论是在接近光源的位置还是在远离光源的位置,其亮度都是相同的。
朗伯比尔定律的应用非常广泛。
在光学设计和照明工程中,人们经常使用这个定律来计算光线的亮度。
在计算机图形学中,朗伯比尔定律被用来模拟光照效果,使得渲染出的图像更加真实。
朗伯比尔定律的数学表达形式是I = I0 * cosθ,其中I表示光线的强度,I0表示入射光线的强度,θ表示光线与法线之间的夹角。
这个公式说明了光线的强度与入射角的余弦成正比。
当光线垂直入射时,夹角θ为0,余弦值为1,光线的强度最大。
而当光线与表面垂直平行时,夹角θ为90°,余弦值为0,光线的强度为0。
朗伯比尔定律的实际应用非常广泛。
在日常生活中,我们可以观察到许多与该定律相关的现象。
例如,当太阳光照射到地面时,由于地面的倾斜角度不同,太阳光的亮度也会有所不同。
当太阳直射时,阳光最为强烈,而当太阳倾斜时,阳光则变得柔和。
这是因为太阳光在穿过大气层后,会遵循朗伯比尔定律,其强度与太阳光的入射角有关。
在摄影学中,摄影师常常利用朗伯比尔定律来调整光线的亮度和角度,以获得更好的拍摄效果。
通过调整光线的角度和强度,摄影师可以创造出不同的光影效果,为照片增添艺术感。
朗伯比尔定律还被广泛应用于照明工程。
照明设计师可以根据朗伯比尔定律来计算光源的位置和角度,以确保照明效果均匀。
通过合理安排光源的位置和角度,可以使得照明效果更加舒适和自然。
朗伯比尔定律是光学中的一个基本原理,描述了光线强度与入射角之间的关系。
朗伯比尔定律《朗伯比尔定律》是经典物理学家著名创立的一组定律,其主要探讨物体运动以及其物理性质之间的原理和规律。
同时,该组定律也是科学史上伟大发现之一,它为进一步探索物理学科提供了重要的理论指导,也为实际应用创造了极大的便利。
朗伯比尔定律具体指的是两个不同物体在弹性撞击中能量的完全守恒。
这两个物体分别可以是同质或异质的,它们可以是有形的物体,也可以是液体,气体和自由长度的波状。
此定律可以表达为质量的乘积加上能量的和,即m1v1 + m2v2 = m1v1 + m2v2。
其中,m1和m2分别表示两个物体的质量,v1和v2表示物体的初速度,v1和v2表示发生弹性撞击后物体的末速度。
朗伯比尔定律只适用于弹性撞击,也就是物体撞击后,彼此质量均不变、形状无变化、动能不损失,只有速度发生了变化的情况下才能有效。
很明显,朗伯比尔定律揭示了物体发生弹性撞击时其动能(即物体质量乘以其速度的平方)是完全守恒的,即得出等式m1v12 +m2v22 = m1v12 + m2v22。
朗伯比尔定律最早是由经典物理学家朗伯比尔于1825年提出的,它是他在研究物体撞击冲击原理时,对完全守恒律这一基本物理现象的一次有史以来最深入的研究。
他通过实验发现,当两个物体发生弹性撞击时,它们的质量和能量总和是完全守恒的,即m1v1 + m2v2 = m1v1 + m2v2。
其实,早在1700年,英国物理学家安伯勒就提出了类似的概念,但他的定位并不确切。
朗伯比尔定律的重要性在于它使人们完全意识到了能量守恒律,同时也提出了通俗易懂的解释方法,如质量乘以速度的平方这个成分能完全守恒,以及影响物体撞击的其他因素,如时间、面积等。
在物理学的研究中,朗伯比尔定律给人们提供了一种力学观念,允许他们从宏观层面对物体发生的相互作用有更精确的分析。
它的原理也被运用到其他领域,如气体动力学、欧姆定律等,这些也是物理学史上重要的研究,朗伯比尔定律为以上研究和实验提供了重要的理论基础。
朗伯比尔定律公式与浓度单位在化学领域,浓度是指溶液中溶质的质量或摩尔数与溶剂的质量或体积的比值。
浓度的计量单位有多种,如质量浓度、摩尔浓度、体积浓度等。
而朗伯比尔定律公式则是用来计算溶液中溶质的浓度的重要公式之一。
一、朗伯比尔定律公式朗伯比尔定律公式是描述溶液中溶质浓度与其吸光度之间关系的公式。
该公式的表达式为:A = εlc其中,A表示吸光度,ε表示摩尔吸光系数,l表示光程长,c表示溶液中溶质的浓度。
摩尔吸光系数是一个物质的特性参数,它表示单位浓度下物质对某一波长的光的吸收能力。
摩尔吸光系数的计量单位为L mol^-1cm^-1。
光程长是指光线通过样品的长度,通常以厘米为单位。
通过朗伯比尔定律公式,可以通过测定溶液的吸光度来计算出溶液中溶质的浓度。
二、浓度单位1. 质量浓度质量浓度是指溶液中溶质的质量与溶剂的体积之比。
计量单位为克/升(g/L)或毫克/毫升(mg/mL)。
例如,一瓶500毫升的盐水中含有10克的盐,则盐水的质量浓度为20g/L。
2. 摩尔浓度摩尔浓度是指溶液中溶质的摩尔数与溶剂的体积之比。
计量单位为摩尔/升(mol/L)。
例如,一瓶500毫升的盐水中含有0.1摩尔的盐,则盐水的摩尔浓度为0.2mol/L。
3. 体积浓度体积浓度是指溶液中溶质的体积与溶剂的体积之比。
计量单位为升/升(L/L)或毫升/毫升(mL/mL)。
例如,一瓶500毫升的酒精中含有250毫升的纯酒精,则酒精的体积浓度为50%。
三、实际应用朗伯比尔定律公式在化学分析中有着广泛的应用。
例如,在药物分析中,可以通过测定药物溶液的吸光度来计算药物的浓度;在环境监测中,可以通过测定水中污染物的吸光度来检测水质的污染程度。
此外,朗伯比尔定律公式还可以用于分析化学实验中的定量分析,如酸碱滴定、络合滴定等。
总之,朗伯比尔定律公式与浓度单位是化学分析中不可或缺的重要概念和工具,对于化学实验和工业生产都具有重要的意义。
朗伯比尔定律公式单位朗伯比尔定律是光化学分析中非常重要的一个定律,在咱们的化学学习里那可是相当关键的哟!先来说说朗伯比尔定律的公式,它是这样的:A = εbc 。
这里的 A代表吸光度,ε是摩尔吸光系数,b 是光程,也就是盛放溶液的比色皿的宽度,而 c 则是溶液的浓度。
咱们来仔细瞅瞅这个公式里的单位。
吸光度 A 没有单位,就是个比值。
摩尔吸光系数ε 的单位通常是 L/(mol·cm) 。
光程 b 的单位一般是厘米(cm),溶液浓度 c 的单位通常是 mol/L 。
我还记得我当年教学生这个知识点的时候,有个特别有趣的事儿。
有个学生啊,总是把单位搞混,在做题的时候错得那叫一个离谱。
有一次考试,有道题让根据朗伯比尔定律计算某种溶液的浓度,这孩子倒是把公式记得挺熟,可就是单位全弄错了。
比如说,他把摩尔吸光系数的单位看成了 mol/cm ,光程的单位写成了 m ,这结果能对才怪呢!我把他叫到办公室给他讲这个问题,我问他:“你咋就把单位弄混啦?”他挠挠头,一脸不好意思地说:“老师,我一着急就给弄混了。
”我就耐心地跟他说:“这可不行啊,单位就像是每个数字的‘身份证’,弄错了‘身份’可就乱套啦。
”然后我就带着他,一道题一道题地重新梳理单位,让他真正明白每个单位的含义和使用规则。
经过那次之后,这孩子在单位的问题上可就谨慎多了,后来的作业和考试都很少再出错。
其实呀,朗伯比尔定律公式的单位问题,只要咱们多做几道题,多琢磨琢磨,就能搞得清清楚楚。
比如说,在实验中,当我们测量不同浓度溶液的吸光度时,就需要特别注意单位的统一,不然得出的结果可就没法用啦。
再比如说,在实际的科研工作中,科研人员们运用朗伯比尔定律来分析物质的浓度,那更是对单位的要求极其严格。
一旦单位出错,整个实验数据可能都得推翻重来,那可就麻烦大了!所以说,同学们在学习朗伯比尔定律的时候,可千万别忽略了单位这个重要的小细节,要把它像宝贝一样重视起来,这样才能在解题和实际应用中不出差错哟!总之,朗伯比尔定律公式的单位虽然看起来不起眼,但却是决定我们能否正确运用这个定律的关键。
朗伯比尔定律
弗朗侯瑞·伯比尔(Francois Bertier,1810年~1885年)定律是在1837年由法国物理学家弗朗侯瑞·伯比尔提出的一项物理定律,也被称为伯比尔定律、伯比尔流体力学定律以及恒定温度弹性流体定律。
它建立在惯性流体力学基础上,解释了当一种惯性流体经过一定区域时,其来流速度、压强以及密度成一定比例的定律。
伯比尔定律准确定义了气体动能和压强之间的关系,是描述气体力学的基础,在空气动力学、涡轮机械学等领域具有重要的工程应用价值。
它在一定区域内要求:若温度恒定,流体的动能变化与其压强之间有着对数关系;若压式恒定,流体的动能与其流量及密度之间有着幂律关系。
伯比尔定律可用来计算气体原始连续流体力学的基本性能及其关系,它的本质是一种数学变换,它记录了流体在特定区域内的力学参数,并将其转换成不受过程影响的恒定参数,比如压强等。
伯比尔定律表明,流体的来流速度、压强以及密度之间有着一定的关系,它强调了流体运动时,不同空间之间区域内的动能与压强之间有着一定的规律性,即压强/流体动能之比以及压强/流体容积之比都是恒定的。
在空气动力学等方面,伯比尔定律可以用来描述流体流动,例如对空气运动进行模拟,以及对流体运动进行理论分析,如计算流体在管道中的传输容积率等。
此外,伯比尔定律也可以用来计算涡轮机械的性能,因为蒸汽发动机的运行机制依赖于伯比尔定律,它在多种涡轮机械中都要求流体系统的压强、速度和压强的量值必须具有一定的关系,以及流体的来流温度和离去温度之间的温度变化必须达到一定的要求才能取得最大的蒸汽效率。
由于伯比尔定律明确描述了推力器(如涡轮机等)在不同区域内力学特性变化的定律,它也成为了许多涡轮机理论计算的重要参考依据。
朗伯比尔定律
姓名:李一航 学号:1322020112 专业:应用物理学
朗伯比尔定律阐述为:光被透明介质吸收的比例与入射光的强度无关;在光程上每等厚层介质吸收相同比例值的光。
kcd T 1lg I I lg A 0=⎪⎭⎫ ⎝⎛=⎪⎪⎭
⎫ ⎝⎛= 式中:0I 和I 分别是入射光和通过样品后的透射光的强度;
A ——吸光度(absorbance )旧称光密度(optical density ); C ——样品浓度;
d ——光程,即盛放溶液的液槽的透光厚度;
K ——光被吸收的比例系数;
T ——透射比,即透射光强度如入射光强度之比。
当浓度采用摩尔浓度时,k 为摩尔吸收系数。
它与吸收物质的性质及入射光的波长有关。
范围:
(1)入射光为单色平行光且垂直照射;
(2)吸光物质为均匀非散射体系;
(3)吸光质点之间无相互作用;
(4)辐射与物质之间的作用仅限于光吸收,无荧光和光化学现象发生。
偏离原因:
在分光光度分析中,朗伯比尔定律只是一个有限的定律,其成立条件是待测物为均一的稀溶液,气体等,无溶质、溶剂及悬浮物引起的散射;入射光为单色平行光。
导致偏离朗伯比尔定律的因素有很多,但基本上可以分为物理和化学两个方面。
物理方面主要是由于入射光的单色性不纯造成的;化学方面主要是由于溶液本身的化学变化造成的。
理想状态下吸光度对浓度作图可得一条直线其斜率为 b 但实际情况中常出现所作曲线不呈直线的情况。
引起偏离的原因有:光传播过程引起的偏离、仪器测量时误差引起的偏离、由溶液本身的化学反应引起的偏离,这些因素可能导致正偏差或负偏差。
1、光传播过程引起的偏离
在对朗伯比尔定律的偏离中P0 在通过吸收池时其减弱程度只
和介质的性质有关,我们定义含吸光物质的均匀溶液其总折射因子为 ˆ n 则有 ˆn n ik =− 其中 n 为组分的 折射因子 k 为介质的折射因子 均与 P0 的减弱有关,此时比例常数不再是ε而是()222n n +ε
● ,而对朗伯 比尔定 律的偏离正是由于忽略了折射因子的变化,折射因子随浓度 的增大而增大,即产生了()222+n n
的负偏差。
因
此,在吸光物质不发生反应的前提下,溶质浓度较高时,所得曲线有明显的负偏差 。
● 2、仪器因素
● 电压变化导致的光源的不稳定和检测器非线性响应均可 能导致偏差的产生 而采用双波长吸光系统可将上述因素的 影响降至最低 。
● 非单色光引起的偏离
● 严格讲,朗伯比尔定律只适用于单色光,但目前用各种方法所得到的入射光实质上都是复合光,因而导致对朗伯比尔定律的偏离。
●
●光栅缝宽对吸光度的影响
●使用紫外光照射时,由吸光光度法所得的光谱通带为1nm ,而
一般的分子吸收带平滑且带宽大于1nm,因此光谱通带对朗伯比尔定律的偏离可忽略,尤其是在最大吸收的情况下测吸光度时影响更小,但当吸收带很窄或在吸收曲线斜率很大处进行测量时对朗伯比尔定律的偏离就很明显了。
●
●由于杂光的波长范围一般在仪器测量极限附近,此时对朗伯比尔
定律产生负偏差,因为可见光源的光谱辐射和检测器对可见光的响应很明显,所以紫外可见光度法在可见光区常出现较严重的杂光问题.
●化学因素产生的影响
●溶液中的吸光物质常因解离、缔合、络合、形成复杂化合物,溶
剂分解而导致偏离朗伯比尔定律,缔合与络合的出现对紫外、可见吸光测量产生重要影响。
●(1)溶剂因素
●由于吸光物质的溶解,其光谱谱带发生偏移,尤其是当溶解
在介电常数很高的溶剂中,虽然这种溶剂效应在红外光谱下比在紫外光谱下更明显,但在紫外分析时仍可能产生很大的偏差。
●(2)温度因素
●改变温度会使溶液中电离平衡破坏使谱带产生偏移但在温
度范围变化不大5 的情况下温度因素可忽略。
●光电效应因素
●用一定波长的紫外光照射在荧光物质上,由于发射出荧光而
使透光度变大,溶液由于光电效应产生二向色性,即溶液由于各层浓度的不同而表现出不同颜色的现象,因此产生了对朗伯比尔定律的偏离,但该因素只有在光强度很大时才产生明显影响.。