武汉理工大学2012.12普通化学试卷A
- 格式:doc
- 大小:154.00 KB
- 文档页数:7
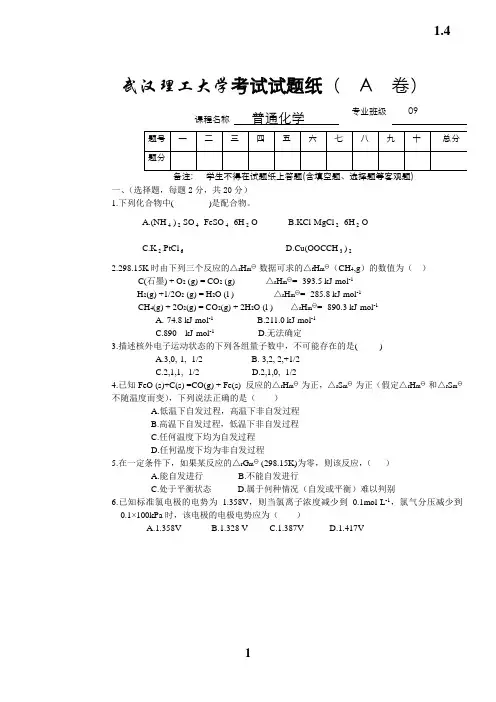
武汉理工大学考试试题纸( A 卷)课程名称普通化学专业班级09一、(选择题,每题2分,共20分)1.下列化合物中( )是配合物。
A.(NH4)2SO4·FeSO4·6H2O B.KCl·MgCl2·6H2OC.K2PtCl6D.Cu(OOCCH3)22.298.15K时由下列三个反应的△r H m 数据可求的△f H m (CH4,g)的数值为()C(石墨) + O2 (g) = CO2 (g) △r H m = -393.5 kJ·mol-1H2(g) +1/2O2 (g) = H2O (l ) △r H m = -285.8 kJ·mol-1CH4(g) + 2O2(g) = CO2(g) + 2H2O (l ) △r H m = -890.3 kJ·mol-1A.-74.8 kJ·mol-1B.211.0 kJ·mol-1C.890 kJ·mol-1D.无法确定3.描述核外电子运动状态的下列各组量子数中,不可能存在的是( )A.3,0,-1,- 1/2B. 3,2, 2,+1/2C.2,1,1,- 1/2D.2,1,0,- 1/24.已知FeO (s)+C(s) =CO(g) + Fe(s) 反应的△r H m 为正,△r S m 为正(假定△r H m 和△r S m 不随温度而变),下列说法正确的是()A.低温下自发过程,高温下非自发过程B.高温下自发过程,低温下非自发过程C.任何温度下均为自发过程D.任何温度下均为非自发过程5.在一定条件下,如果某反应的△r G m (298.15K)为零,则该反应,()A.能自发进行B.不能自发进行C.处于平衡状态D.属于何种情况(自发或平衡)难以判别6.已知标准氯电极的电势为 1.358V,则当氯离子浓度减少到0.1mol·L-1,氯气分压减少到0.1×100kPa时,该电极的电极电势应为()A.1.358VB.1.328 VC.1.387VD.1.417V1.47.对于下列两个反应式,说法完全正确的是()2Fe3+ +2Br — = 2Fe2+ + Br2Fe3+ + Br —= Fe2+ +1/2Br2A.E 、△G 、K 都相等B.E 、△G 相等,K 不等C.E 相等,△G 、K 不等D.△G 相等,E 、K 不相等8.将AgCl和AgI的饱和溶液的清液混合,在其中加入AgNO3固体,将会()A.只有AgCl沉淀B.只有AgI沉淀C.AgCl,AgI都沉淀,以AgCl为主D. AgCl,AgI都沉淀,以AgI为主9.对于一个化学反应来说,下列叙述正确的是()A.△G 越小,反应速率越快B.△H 越小,反应速率越快C.活化能越小,反应速率越快D.活化能越大,反应速率越快10.AgCl在下列物质中溶解度最大的是()A.纯水B.6 mol·L-1 NH3·H2OC.0.1mol·L-1 NaClD.0.1mol·L-1 BaCl2二、填空题(本题20分,每空1分)1.某温度下,N2(g) +3H2(g) =2NH3(g), △r H m <0。

…………装订线………………装订线内不要答题,不要填写信息………………装订线…………武汉理工大学考试试题答案(A卷)2014 ~2015 学年2 学期普通化学课程一、选择题(共20分,每小题2分)1. B;2. B;3. D;4. D;5. C;6. A(或D或者AD);7. B;8. C;9. C; 10. C二、填空题(共20分,每空1分)11. 1s22s22p63s23p63d104s1(注:写成[Ar]3d104s1也得分); 412.(注:未写出cθ也得分)13. sp;sp2;sp3;不等性sp314. Br2;I-15. -3211;正(或右)16. ; 1.09×101717. 7.45×10-7;7.8718. 增大;减小19. [Cu(NH3)4]SO420. HSO-4>HAc>H2S > HCO--2---2三、是非题(共10分,每小题2分)21. ×; 22. ×; 23. √; 24. ×; 25. ×四、问答题(共10分,每小题5分)26. 答:)OH(22kcv=( 3分) 一级反应( 2分)27.答:选用BaCl2为沉淀SO42-的试剂,生成溶度积很小的BaSO4,利于SO42-沉淀完全,达到除杂的要求。
( 2分) 过量的Ba2+,用Na2CO3(aq)作为沉淀试剂,生成BaCO3沉淀。
( 2分) 过量的CO32-,可采用加HCl生CO2除之;并控制溶液pH值接近6~7。
在上述除杂过程中所引进的Cl-,Na+,恰是食盐的基本组成。
( 1分) {}{}{}{}2θeq4θeqθ2eqθ2eqθClHClM nccccppccK)()()()(-++=五、计算题(共40分,每小题10分) 28. 解: (1)2SO 2(g) + O 2(g) === 2SO 3(g)初始分压/kPa 200 100改变分压/kPa -2x -x 2x 平衡分压/kPa 200 - 2x 100 - x 2x 根据题意,则:200 -2x + 100 -x + 2 x = 220 kPa解方程组得: x = 80 kPa ( 3 分) 因此:p eq (SO 2) = 200 -2x = 40 kPa p eq (O 2) = 100 -x = 20 kPa p eq (SO 3) = 2x = 160 kPa()()()()()()1002010040100160)(O )(SO )(SO 222eq 22eq 23eq ⨯=⨯=θθθθp pppppK = 80 ( 2 分) (2)2SO 2(g) + O 2(g) === 2SO 3(g)θm f H ∆ / kJ·mol -1 -296.83 0 -395.72 θm S / J·mol -1·K -1 248.22 205.14 256.76 θmr H ∆ = 2 × (-395.72) - 2 × (-296.83) = -197.78 kJ·mol -1θmr S ∆ = 2 × 256.76 - 2 × 248.22 - 205.14 = -188.06 J·mol -1·K -1( 2 分) 由θm r G ∆ = -RTln K θ = θm r H ∆ - T θm r S ∆,可知:T = θm r H ∆ / (θm r S ∆ - Rln K θ) = -197.78 kJ·mol -1 / (-188.06 J·mol -1·K -1 - 8.314 J·mol -1·K -1 ×ln80)= 881 K ( 3 分) 29. 解:(1)pH = p )HAc (θa K +lg[c (AC -) / c (HAc)] = - lg(1.8×10-5) + 0=4.74 ( 5分) (2)因为:pH = p )HAc (θa K +lg[c (AC -) / c (HAc)]5=4.74+ lg[c (AC -) / c (HAc)]所以[c (AC -) / c (HAc)] =1.8 (3分) 设V (HAc )= x ml ,V (NaAc )= (10-x ) mL 则 (10-x )×0.2÷10÷(x ×0.2÷10)=1.8解出 x = 3.57 mL ,10-x = 6.43 mL 3.57 mL 0.2mol·L −1 的HAc 和6.43 mL 0.2 mol·L −1 的NaAc 混合即得到10 mL 的HAc-NaAc 缓冲溶液。

2012年普通高等校招生统一考试(综)6.下列有关键的叙述,正确的是A.离子合物中一定含有离子键B.单质分子均不存在键.含有极性键的分子一定是极性分子D.含有共价键的合物一定是共价合物答案:A【解析】离子合物中一定含有离子键,A正确;只有单原子分子单质分子中不含键,B错误;O2分子含有极性键,但O2是非极性分子;NOH等离子合物含有共价键,但是离子合物,不是共价合物,D错误。
7.能正确表示下列反应的离子方程式是A.硫酸铝溶液中加入过量氨水 A3++3OH-= A(OH)3↓B.碳酸钠溶液中加入澄清石灰水 (OH)2+O32-= O3↓+2OH-.冷的氢氧钠溶液中通入氯气2+2OH-= O-+-+H2OD.稀硫酸中加入铁粉 2F+6H+= 2F3++3H2↑答案:【解析】A答案中氨水是弱电解质,应写成分子式,错误;B中澄清石灰水应写成离子形式,错误;D答案中铁粉与稀硫酸反应生成亚铁离子,错误。
8.合成氨所需的氢气可用煤和水作原料经过多步反应制得,其中的一步反应为:O(g)+H2O(g)催化剂O2(g)+H2(g) △H < 0反应到达平衡后,为提高O的转率,下列措施中正确的是A.增加压强B.降低温度.增大O的浓度D.更换催剂答案:B【解析】O(g)+H2O(g)催化剂O2(g)+H2(g)是一个气体总体积不发生改变的反应,增大压强平衡不移动,O的转率不变,A错误;反应式放热反应,降低温度平衡向放热方向移动,B正确;增大O 的浓度,平衡向正反应方向移动,O 的转率降低,错误;催剂对平衡没有影响,D错误。
9.反应A+B→(△H<0)分两步进行:①A+B→(△H>0),②→(△H<0)。
下列示意图中,能正确表示总反应过程中能量变的是A B D答案:D【解析】由反应 A+B →(△H <0)分两步进行① A+B→(△H >0)②→(△H <0)可以看出,A+B →(△H <0)是放热反应,A和B 的能量之和,由① A+B→(△H >0)可知这步反应是吸热反应,→(△H <0)是放热反应,故的能量大于A+B;A+B的能量大于, 的能量大于,答案:D。

武汉理⼯⼤学考试试题纸(A卷)武汉理⼯⼤学考试试题纸(A卷)课程名称⽆机化学(下)专业班级⼀.选择题(15分)1. 下列硝酸盐热分解为⾦属的是()(A)NaNO3(B)Pb(NO3) 2(C)AgNO3(D)Cu(NO3) 22. 下列各组硫化物,其中均难溶于稀酸, 但能溶于浓盐酸的是()(A)Bi2S3和CdS (B) ZnS和PbS (C) CuS 和Sb2S3 (D) As2S3和HgS3. 下列氢氧化物中,哪⼀种既能溶于过量的NaOH,⼜能溶于过量的氨⽔()(A)Ni(OH)2 (B)Fe(OH) 3(C)Zn(OH)2(D)Al(OH)34. 与浓盐酸反应不能⽣成黄绿⾊⽓体的物质是()(A)PbO2(B)Fe2O3(C) Co2O3(D) MnO25. 配制SnCl2溶液,常在溶液中放⼊少量固体Sn粒,其理由是()(A)防⽌Sn2+被氧化;(B)防⽌Sn2+⽔解;(C)防⽌SnCl2溶液产⽣沉淀;(D)防⽌SnCl2溶液挥发6. 下列物质中酸性最强的是()(A) H2S (B) H2SO3(C) H2SO4(D) H2S2O77. 在FeCl3和KNCS 的混合溶液中,加⼊⾜够的NaF,其现象是()(A)变成⽆⾊(B) 颜⾊加深(C) 产⽣沉淀(D) 颜⾊变浅8. 下列离⼦与过量KI溶液反应只能得到澄清的⽆⾊溶液的是()(A)Cu2+(B) Fe3+(C) Hg2+(D) Hg22+9.在NaH2PO4溶液中加⼊AgNO3溶液后主要产物是()(A) Ag2O (B) AgH2PO4 (C) Ag3PO4(D) Ag2HPO410. 下列叙述中正确的是()(A) H2O2 的分⼦构型为直线形;(B)H2O2既有氧化性⼜有还原性,主要⽤作氧化剂(C)H2O2是中强酸,分⼦间有氢键;(D)H2O2与K2Cr2O7 的酸性溶液反应⽣成稳定的蓝⾊CrO5,此反应可⽤来鉴定H2O2⼆、按性质递变规律排序(⽤>,<表⽰)(7分)1. 氧化性HClO4H5IO6HBrO42. 熔点SnCl2SnCl43. 熔点BeCl2MgCl2 SrCl24. 热稳定性碳酸碳酸氢盐碳酸盐5. 碱性Sn(OH)2 Sn(OH)46. 还原性Cl-Br-I-7. 酸性HClO HBrO HIO三、完成并配平下列⽅程式(20分)1.在消防队员的背包中,超氧化钾既是空⽓净化剂,⼜是供氧剂2. H3BO3+HOCH2CH2OH→3. Na2S2 + SnS →4. SbCl3(aq) 溶液稀释时变浑5. PCl5+H2O→6. Mn2++ NaBiO3 + H+→7. 常温下,液溴与碳酸钠溶液→8. Ag++Cr2O72-→9. Hg22++I-(过量)→10. HF腐蚀玻璃四、填空题( 28分)1. 氯⽓能使湿润的KI-淀粉试纸变蓝,有关的反应式为();但试纸长久与氯⽓接触后,蓝⾊会消失,这是因为(),反应式为()。

2012年高考真题——理综化学部分(全国卷)解析版下列关于化学键的叙述,正确的一项是A 离子化合物中一定含有离子键B 单质分子中均不存在化学键C 含有极性键的分子一定是极性分子D 含有共价键的化合物一定是共价化合物【答案解析】A离子化合物中一定含有离子键,A正确;只有单原子分子单质分子中不含化学键,B错误;CO2分子含有极性键,但CO2是非极性分子;NaOH等离子化合物含有共价键,但是离子化合物,不是共价化合物,D错误。
能正确表示下列反应的离子方程式是A 硫酸铝溶液中加入过量氨水+3OH-=Al(OH)3 ↓B 碳酸钠溶液中加入澄清石灰水Ca(OH) 2 +=CaCO3 ↓ + 2C 冷的氢氧化钠溶液中通入氯气Cl2 +2=Cl+ + H2OD 稀硫酸中加入铁粉2Fe + 6 = 2+ 3H2 ↑【答案解析】CA答案中氨水是弱电解质,应写成分子式,错误;B中澄清石灰水应写成离子形式,错误;D答案中铁粉与稀硫酸反应生成亚铁离子,错误。
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为CO(g)+ H2O(g) CO2(g)+ H2(g) △H <0反应达到平衡后,为提高CO的转化率,下列措施中正确的是A 增加压强B 降低温度C 增大CO 的浓度D 更换催化剂【答案解析】BCO(g)+ H2O(g)CO2(g)+ H2(g) 是一个气体总体积不发生改变的反应,增大压强平衡不移动,CO的转化率不变,A错误;反应式放热反应,降低温度平衡向放热方向移动,B正确;增大CO 的浓度,平衡向正反应方向移动,CO 的转化率降低,C错误;催化剂对化学平衡没有影响,D错误。
反应A+B →C(△H <0)分两步进行△ A+B→X (△H >0)△ X→C(△H <0)下列示意图中,能正确表示总反应过程中能量变化的是【答案解析】D由反应A+B →C(△H <0)分两步进行△ A+B→X (△H >0)△ X→C(△H <0)可以看出,A+B →C(△H <0)是放热反应,A和B 的能量之和C,由△ A+B→X (△H >0)可知这步反应是吸热反应,X→C(△H <0)是放热反应,故X的能量大于A+B;A+B的能量大于C,X 的能量大于C,答案:D。

6 、下列关于化学键的叙述,正确的一项是A 离子化合物中一定含有离子键B 单质分子中均不存在化学键C 含有极性键的分子一定是极性分子D 含有共价键的化合物一定是共价化合物【答案】A【解析】离子化合物中一定含有离子键,A正确;只有单原子分子单质分子中不含化学键,B错误;CO2分子含有极性键,但CO2是非极性分子;NaOH等离子化合物含有共价键,但是离子化合物,不是共价化合物,D错误。
【考点】1.离子键与离子化合物的关系:含有离子键的化合物一定是离子化合物,而离子化合物中却不一定只含有离子键.如NHNO、NaO是离子化合物,但在NHNO、NaO中除了含有24432223离子键外,还含有共价键。
2.共价键与共价化合物:共价化合物中一定含有共价键,但不一定有共价键的化合物就是共价化合物,即共价键既可以存在于共价化合物中,又可以存在于离子化合物中,如NHNO、NaO、2432NaOH 是离子化合物,但含有离子键的同时还含有共价键。
【点评】:本题把化学键和化合物的类型熔合成一体,考查学生对离子化合物、共价化合物、化学键、极性分子等知识的掌握和应用能力。
本题基础性较强,重点特出。
7 、能正确表示下列反应的离子方程式是3?Al+3OH-=Al(OH)↓硫酸铝溶液中加入过量氨水 A 32??COOH + 2=CaCO↓B 碳酸钠溶液中加入澄清石灰水Ca(OH) + 3 2 3???OHClO O =Cl+ + 2 + HClC 冷的氢氧化钠溶液中通入氯气22??3Fe H + 3H稀硫酸中加入铁粉2Fe + 6 = 2↑D 2C【答案】中澄清石灰水应写成离子形式,B【解析】A答案中氨水是弱电解质,应写成分子式,错误;错误;D答案中铁粉与稀硫酸反应生成亚铁离子,错误。
判断离子方程式的正误判时,关键抓住离子方程式是否符合客观事实、化【考点】学式的拆分是否准确、是否遵循电荷守恒和质量守恒、氧化还原反应中的得失电子是否守恒等;就能很好的解决问题。

2012年高考真题——理综化学部分(全国卷)解析版6 、下列关于化学键的叙述 , 正确的一项是A 离子化合物中一定含有离子键B 单质分子中均不存在化学键C 含有极性键的分子一定是极性分子D 含有共价键的化合物一定是共价化合物【答案】A【解析】离子化合物中一定含有离子键,A 正确;只有单原子分子单质分子中不含化学键,B 错误;CO2分子含有极性键,但CO2是非极性分子;NaOH 等离子化合物含有共价键,但是离子化合物,不是共价化合物,D 错误。
【考点】1.离子键与离子化合物的关系:含有离子键的化合物一定是离子化合物,而离子化合物中却不一定只含有离子键.如NH 4NO 3、Na 2O 2是离子化合物,但在NH 4NO 3、Na 2O 2中除了含有离子键外,还含有共价键。
2.共价键与共价化合物:共价化合物中一定含有共价键,但不一定有共价键的化合物就是共价化合物,即共价键既可以存在于共价化合物中,又可以存在于离子化合物中,如NH 4NO 3、Na 2O 2、NaOH 是离子化合物,但含有离子键的同时还含有共价键。
【点评】:本题把化学键和化合物的类型熔合成一体,考查学生对离子化合物、共价化合物、化学键、极性分子等知识的掌握和应用能力。
本题基础性较强,重点特出。
7 、能正确表示下列反应的离子方程式是A 硫酸铝溶液中加入过量氨水 3Al ++3OH-=Al(OH)3 ↓B 碳酸钠溶液中加入澄清石灰水 Ca(OH) 2 +23C O -=CaCO 3 ↓ + 2OH -C 冷的氢氧化钠溶液中通入氯气 Cl 2 + 2OH -=Cl O - + Cl -+ H 2OD 稀硫酸中加入铁粉 2Fe + 6 H += 23Fe + + 3H 2 ↑【答案】C【解析】A 答案中氨水是弱电解质,应写成分子式,错误;B 中澄清石灰水应写成离子形式,错误;D 答案中铁粉与稀硫酸反应生成亚铁离子,错误。
【考点】判断离子方程式的正误判时,关键抓住离子方程式是否符合客观事实、化学式的拆分是否准确、是否遵循电荷守恒和质量守恒、氧化还原反应中的得失电子是否守恒等;就能很好的解决问题。

武汉理工大学教务处试题标准答案及评分标准用纸课程名称普通化学(A 卷)一、选择题(每题2分,共30分)1 D;2 B;3 A;4 A;5 E;6 B;7 D;8 A;9 C; 10 A; 11 B; 12 B; 13 B; 14 C; 15 A二、填空题(每空1分,共25分)①逆向进行, Q=135.4> Kθ;②T>464.5 K, 1.6 ⨯10-6;③C6H12O6(葡萄糖)溶液,CaCl2溶液;④>0, >0;⑤(△S=89.93J·mol-1)向生成CO的方向进行, 向生成CO的方向进行;⑥MnO4-, Fe, MnO4- Br2, MnO4-;⑦-41.8, -41.8;⑧υ=kc2(NO)c(Cl2), 3, 则为原来的1/8;⑨ 1.285⨯10-3mol·dm-1, 8.49⨯10-7mol·dm-1, 增大; ⑩Fe, MnO4-, Fe Sn2+ I-;三、判断题(每题1分,共10分)1 ⨯ 2√ 3√ 4⨯ 5√ 6⨯ 7√ 8√ 9√ 10⨯四、计算题(第1小题15分,第2、3小题10分,共35分)1.⑴△r H mθ = -553.5 + (-393.5) - (-1216.3) = 269.3 (kJ·mol-1)△r S mθ = 70.42 + 213.6 - 112.1 = 171.92 (J·mol-1·K-1) (1分)△r G mθ(500K) = △r H mθ - T·△r S mθ = 269.3⨯103 - 500 ⨯ 171.92 = 183340 (J·mol-1) (2分)lnKθ(500K) = -△r G mθ(500K)/RT = -183340÷(8.314 ⨯ 500) = -44.10Kθ(500K) = 7.0 ⨯ 10-20(1分)⑵△r G m = △r G mθ + RTlnQ p = △r G mθ + RTln{p(CO2)/pθ} (1分)= 183340 + 8.314 ⨯ 500 ⨯ ln(90/100) = 182902 (J·mol-1)>0 (1分)所以反应向左进行;或:Q p = p(CO2)/pθ = 0.9 > Kθ,所以向左进行(1分)⑶△r G mθ(500K) = △r H mθ - T·△r S mθ,由△r G mθ≦0 得到反应正向进行的最低温度:T = △r H mθ /△r S mθ = 269.3 ⨯ 103÷ 171.92 (2分)= 1566.4(K) (1分)2.解:(1)HAc == H++ Ac-Ka = C(H+)·C(Ac-) /C(HAc);(4分)C(H+) = Ka·C(HAc) / C(Ac-) = 1.8 ⨯ 10-5⨯0.110÷0.150 = 1.32⨯ 10-5;(1分)pH = 4.88 (1分)(2)C(H+) = Ka·C(HAc) / C(Ac-) = 1.8 ⨯ 10-5⨯0.090÷0.170 = 9.53⨯ 10-6;pH = 5.02 (2分)(3)C(H+) = KaC(HAc) / C(Ac-) = 1.8 ⨯ 10-5⨯0.130÷0.130 = 1.8⨯ 10-5;pH = 4.74 (2分)3.(10分)一原电池由Ag+(aq)/Ag(s)(ϕθ = 0.78V)和Sn4+(aq)/ Sn2+(aq) (ϕθ = 0.21V)两半电池组成.解:(1)Eθ =ϕθ(Ag+/Ag) - ϕθ(Sn4+/ Sn2+) = 0.78V - 0.21V = 0.57V;(2分)(2)正极反应:Ag+(aq) + e = 2Ag(s) (1分)负极反应:Sn2+(aq) = Sn4+(aq) + 2e;(1分)(-)Pt⎪ Sn2+(aq),Sn4+(aq)⎪⎪ Ag+(aq)⎪Ag(+)(1分)(3)△r G mθ = - nFEθ = -2 ⨯ 96500 ⨯ 0.57 = -110010 (J·mol-1) (2分)(4)ϕ(Ag+/Ag) = ϕθ(Ag+/Ag) + 0.0592·lgC(Ag+) = 0.78 + 0.0592 ⨯ lg0.01 = 0.6616 (V) ϕ (Sn4+/ Sn2+) = ϕθ(Sn4+/ Sn2+) + 0.0592÷2⨯lg{C(Sn4+)/C(Sn2+)}= 0.21 + 0.0296 ⨯ lg(2.0/0.2) = 0.2396(V)E = ϕ(Ag+/Ag) - ϕ(Sn4+/ Sn2+) = 0.6616V - 0.2396V = 0.422V (3分)或:E = Eθ + 0.0592÷2⨯lg{ C2(Ag+)·C(Sn2+)/ C(Sn4+)} = 0.57 + 0.0592÷2 ⨯ lg(0.012⨯ 0.2/2) = 0.422 (V) (3分)。

6 、下列关于化学键的叙述 , 正确的一项是 A 离子化合物中一定含有离子键 B 单质分子中均不存在化学键 C 含有极性键的分子一定是极性分子 D 含有共价键的化合物一定是共价化合物 【答案】A 【解析】离子化合物中一定含有离子键,A正确;只有单原子分子单质分子中不含化学键,B错误;CO2分子含有极性键,但CO2是非极性分子;NaOH等离子化合物含有共价键,但是离子化合物,不是共价化合物,D错误。
【考点】1.离子键与离子化合物的关系:含有离子键的化合物一定是离子化合物,而离子化合物中却不一定只含有离子键.如NH4NO3、Na2O2是离子化合物,但在NH4NO3、Na2O2中除了含有离子键外,还含有共价键。
2.共价键与共价化合物:共价化合物中一定含有共价键,但不一定有共价键的化合物就是共价化合物,即共价键既可以存在于共价化合物中,又可以存在于离子化合物中,如NH4NO3、Na2O2、NaOH是离子化合物,但含有离子键的同时还含有共价键。
【点评】:本题把化学键和化合物的类型熔合成一体,考查学生对离子化合物、共价化合物、化学键、极性分子等知识的掌握和应用能力。
本题基础性较强,重点特出。
7 、能正确表示下列反应的离子方程式是 A 硫酸铝溶液中加入过量氨水 +3OH-=Al(OH)3 ↓ B 碳酸钠溶液中加入澄清石灰水 Ca(OH) 2 +=CaCO3 ↓ + 2 C 冷的氢氧化钠溶液中通入氯气 Cl2 + 2=Cl + + H2O D 稀硫酸中加入铁粉 2Fe + 6=2 + 3H2 ↑ 【答案】C 【解析】A答案中氨水是弱电解质,应写成分子式,错误;B中澄清石灰水应写成离子形式,错误;D答案中铁粉与稀硫酸反应生成亚铁离子,错误。
【考点】判断离子方程式的正误判时,关键抓住离子方程式是否符合客观事实、化学式的拆分是否准确、是否遵循电荷守恒和质量守恒、氧化还原反应中的得失电子是否守恒等;就能很好的解决问题。

2012年高考(新课标)理科综合能力测试化学部分一、选择题:7.下列叙述中正确的是A.液溴易挥发,在存放液溴的试剂瓶中应加水封B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+答案:A新东方解析:考查基础知识记忆。
A项,液溴的密度大于水,正确;B项,除了氯气外,其它的氧化剂如臭氧都可以将其氧化得到碘单质,则B错误;C项,应该是碘单质,则C错误;D项,不能排除硫酸根的干扰,错误。
8、下列说法中正确的是A.医用酒精的浓度通常为95%B.单质硅是将太阳能转化为电能的常用材料C.淀粉、纤维素和油脂都属于天然高分子化合物D.合成纤维和光导纤维都是新型无机非金属材料答案:B新东方解析:考查基础知识应用的记忆。
A项,医用酒精浓度应该为75%,则A 错误;C中油脂不是高分子化合物,高分子化合物分子量应达到10000以上,错误;D项,光导纤维为二氧化硅,合成纤维为有机材料,错误。
9.用N A表示阿伏加德罗常数的值。
下列叙述中不正确...的是A.分子总数为N A的NO2和CO2混合气体中含有的氧原子数为2N AB.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2N AC.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6N AD.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 N A答案:D新东方解析:考查阿伏伽德罗常数、物质的量有关的计算。
A项,每个NO2和CO2分子中均含有两个氧原子,则A正确;B项,乙烯C2H4和C4H8的最简式相同,则B正确;C项,NO2和N2O4中氮元素和氧元素的质量分数相同,则C正确;D项,条件是常温常压下,不是标准状况,由气体的体积无法计算出物质的量10.分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)A. 5种B.6种C.7种D.8种答案:D新东方解析:考查有机构结构和同分异构体的判断。
2012年普通高等学校招生全国统一考试(新课标卷)化学试题可能用到的相对原子质量:H l C l2 N 14 O 16 Mg 24 S 32 C1 35 5 Fe 56 Cu 64 Zn 65 Br 80一、选择题:本大题共13小题.每小题6分。
在每小题给出的四个选顼中,只有一项是符合题目要求的。
7.下列叙述中正确的是A.液溴易挥发,在存放液溴的试剂瓶中应加水封B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+8.下列说法中正确的是A.医用酒精的浓度通常为95%B.单质硅是将太阳能转变为电能的常用材料C.淀粉、纤维素和油脂都属于天然高分子化合物D.合成纤维和光导纤维都是新型无机非金属材料9.用N A表示阿伏加德罗常数的值。
下列叙述中不正确的是A.分子总数为N A的NO2和CO2混合气体中含有的氧原子数为2N AB.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2N AC.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6N AD.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2N A10.分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)A.5种B.6种C.7种D.8种11.已知温度T时水的离子积常数为K W。
该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是A.a=b B.混合溶液的pH=7C.混合溶液中,c(H+)=K mol/L D.混合溶液中,c(H+)+c(B-) =c(OH-)+c(A-)W12A716714281881813.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。
…………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线…………212(N 取得较高的转化率(g)…………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线……………………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线…………(1)计算混合后所得溶液的H+的浓度及pH53θb108.1)NH(-⨯=K)(aq)Mn…………装订线………………装订线内不要答题,不要填写信息………………装订线…………武汉理工大学考试试题答案(B卷)2012 ~2013 学年1 学期普通化学课程一.选择题(每题2分,共20分)1~5 CBAAB 6~10 BBBCD二.填空题(每空1分,共20分)11. -3211.0 kJ·mol-1,正向(或向右);12. 减少,有利于;13. v =k·c2(NO)·c(Cl2) , 3 ;14.-1.0152V ;15. 2.05 ×10-4, 4.7×10-11 ; 16. 11.6617. Zn2+, 4 , 四羟基合锌(Ⅱ)酸钠;18. [Ar]3d24s2或1s22s22p63s23p63d24s2,四,d;19. 刃型位错,螺型位错;20. 2 ,3d 。
三.是非题(对的在括号内填“√”号,错的填“×”号,每小题2分, 共10分)21~25 √ × × × ×26~30 √ ×√√ ×四、简答题(每题5分,共10分)31. H2O分子中O原子的价电子构型为2s22p4,成键时采用sp3杂化轨道,这四个轨道不完全对称分布在O原子的周围,其中两个轨道中含有两个孤对电子,而另外两个轨道中有未成对电子,可与H原子中自旋方向向反的未成对电子成键,由于孤对电子只受氧原子的吸引力,故与氧原子靠的较近,而它们对成键电子对有一定的排斥作用,使这两个成键电子对的键角减少,所以H2O分子的空间构型为“V”,由于分子呈不对称结构,而H-O具有极性,所以H2O分子也具有极性。