磷的同素异形体
- 格式:doc
- 大小:2.38 MB
- 文档页数:4

红磷和白磷结构红磷和白磷是两种常见的磷元素的同素异形体,它们在结构和性质上存在着显著的差异。
红磷是一种暗红色的固体,而白磷则是一种黄白色的固体。
下面将分别介绍红磷和白磷的结构、性质以及它们在日常生活中的应用。
一、红磷的结构红磷的结构是由P4分子构成的。
P4分子是由四个磷原子通过共用键连接而成的。
每个磷原子都与其他三个磷原子形成三个共用键,形成了一个四面体结构。
这种结构使得红磷的分子呈现出多面体的形状,同时也决定了红磷的性质。
二、红磷的性质红磷是一种稳定的物质,不易燃烧。
它在常温下呈现出暗红色,但在高温下会变为无色。
红磷的密度较低,熔点较高,且不溶于水。
此外,红磷是一种半导体材料,具有一定的导电性。
红磷具有一些特殊的性质,使得它在日常生活中得到广泛的应用。
首先,红磷是一种重要的阻燃剂。
由于其不易燃烧的性质,红磷常被用于制造防火涂料、防火塑料等产品,以提高材料的阻燃性能。
其次,红磷还可以用于制造医药和农药等化学产品。
此外,红磷还可以用作制造电子元器件、磷肥以及某些金属的脱氧剂等。
三、白磷的结构白磷的结构是由P4分子构成的。
与红磷不同的是,白磷的P4分子由四个磷原子通过单键连接而成。
这种结构使得白磷的分子呈现出链状结构,同时也决定了白磷的性质。
四、白磷的性质白磷是一种黄白色的固体,具有较高的反应活性。
它可在空气中自燃,因此需要存放在水中或低温下。
白磷的熔点较低,且具有较高的挥发性。
此外,白磷可溶于一些有机溶剂,但不溶于水。
白磷的反应活性使得它在军事工业和化学实验中得到广泛应用。
例如,白磷曾被用作制造炸弹和照明弹的成分。
此外,白磷还可以用于制造染料、杀虫剂、火药等化学产品。
红磷和白磷在结构和性质上存在着明显的差异,它们的应用领域也各不相同。
红磷主要用于阻燃、医药和农药制造等方面,而白磷则主要用于军事工业和化学实验。
了解红磷和白磷的结构和性质,有助于我们更好地理解它们的应用和作用机制。
通过合理利用红磷和白磷的特性,我们可以为人类的生活和科学研究提供更多的可能性。

磷元素的同素异形体
磷元素的同素异形体有四种:红磷、白磷、紫磷和黑磷。
红磷:红磷的化学式为P4,它是磷元素的稳定态,是一种恒定的立方体结构,每个磷原子的位置环绕着另外三个磷原子,所以红磷是一种高键强度的结构。
它是非常不稳定的,很容易受到热或士口的刺激而转变成其他同素异形体。
白磷:白磷化学式为P4O10,其中磷和氧的比例是1比4,白磷是一种高熔得体,当温度升高到44℃它就会变成液体,其结构组成为四个磷原子和十个氧原子构成了一种共价网络,四个磷原子在其内部形成一个立方体。
它相对于红磷来说更加不稳定,在环境会很容易被改变。
紫磷:紫磷的化学式为P4O6,其中磷和氧的比例是1比2,紫磷是一种共价网络,当其被暴露在空气中时会出现非常强的深紫色,它的结构有一个立方网络真空中由四个磷原子和六个氧原子组成,它是一种过渡态异形体。

红磷的熔点1. 红磷的概述红磷是一种常见的无机物,化学式为P4,是磷的一种同素异形体。
与白磷相比,红磷相对稳定,不易自燃。
红磷在自然界中广泛存在,主要以天然矿物形式存在于岩石和土壤中。
2. 红磷的物理性质红磷呈暗红色或紫红色晶体,具有脆性。
它是一种半导体材料,在常温下不导电。
与白磷相比,红磷不溶于水和大多数有机溶剂。
3. 红磷的化学性质红磷在空气中稳定,在高温下可以发生氧化反应。
当温度升高到约300°C时,红磷开始缓慢氧化生成白色的二氧化三聚磷(P4O10)。
这个过程称为“红-白转变”。
在更高温度下,如400°C以上,反应会加速进行。
4. 红-白转变红-白转变是指从稳定的红色晶体红磷转变为白色固体二氧化三聚磷(P4O10)的过程。
这个过程是可逆的,可以通过加热或冷却来控制。
红-白转变的温度称为红磷的熔点。
5. 红磷的熔点红磷的熔点约为590°C。
当温度升高到这个温度时,红磷开始发生红-白转变,逐渐转变为白色的二氧化三聚磷(P4O10)。
这个过程是自发进行的,不需要外界能量输入。
6. 影响红磷熔点的因素红磷的熔点受多种因素影响,包括压力、杂质和结构等。
在高压下,红磷的熔点会升高。
杂质也可能影响红-白转变和熔点。
此外,不同晶体结构的红磷可能具有不同的熔点。
7. 应用领域由于其稳定性和低毒性,红磷在多个领域得到了广泛应用。
以下是一些常见应用领域:7.1 化学工业红磷在化学工业中被用作生产有机磷化合物的原料,例如农药和阻燃剂。
红磷的氧化性质使其成为一种重要的试剂。
7.2 火柴生产传统火柴中的火柴头常使用红磷制成。
红磷可以与摩擦产生较高温度,点燃火柴。
7.3 光学材料由于其半导体特性,红磷在光学领域也有应用。
它可以用于制备光电器件和显示屏。
7.4 火箭推进剂在航天领域,红磷可以作为火箭推进剂的组成部分之一。
8. 安全注意事项红磷本身相对稳定,但在高温下可能发生自燃。
因此,在处理和储存时需要注意避免高温和火源。

初三化学中红磷实验知识点(大全)初三化学中红磷实验知识点1、什么是红磷红磷是磷的一种同素异形体,因呈红色而得名。
红磷和白磷都是由磷元素组成,但是构成它们分子的原子排列不同。
2、红磷的化学式是什么白磷的分子式为P4,而红磷的结构更为复杂,一般用P来作为红磷的化学式。
3、红磷的性质1.物理性质外观与性状:紫红色无定形粉末,无臭,具有金属光泽,在暗处不发磷光,无臭。
不溶于水也不溶于二硫化碳以及乙醇等有机溶剂。
熔点(℃): 590(4357kPa)相对密度(水=1):2.20相对蒸汽密度( 空气=1): 4.77饱和蒸汽压(kPa):4357(590℃)引燃温度(℃):240溶解性:微溶于水,略溶于乙醇、碱液,不溶于二硫化碳爆炸下限%(V/V):48~64mg/m³2.化学性质稳定性,易燃,无毒,遇氯酸钾、高锰酸钾、过氧化物和其他氧化剂时可引起爆炸。
4、红磷的作用1.用于制造火柴、农药,及用于有机合成。
2.磷有黄磷和赤磷之分。
农药生产上采用黄磷(亦称白磷),它是制备一切含磷农药中间体的起始原料,与硫反应得到五硫化二磷,与氯反应得到三氯化磷,进而可得一系列其他含磷中间体。
此外,黄磷主要用于生产磷酸,少量用于生产赤磷和五氧化二磷,军事上用于制造燃烧弹、信号弹等,也用于生产磷铁合金以及医药、有机原料等行业。
3.用于制备半导体化合物及用作半导体材料掺杂剂。
本品可用于阻燃聚烃类、聚苯乙烯、聚酯、尼龙、聚碳酸酯、聚甲醛、环氧树脂、不饱和树脂、橡胶、纺织品等。
而对聚对苯二甲酸乙二醇酯、聚碳酸酯以及酚醛树脂等含氧高聚物的阻燃尤为有效。
与其他磷系阻燃剂相比,相同质量的红磷能产生更多的磷酸,磷酸即可覆盖于被阻燃材料表面,又可在材料表面加速脱水碳化,形成液膜和碳层可将外部的氧,挥发性可燃物和热与内部的高聚物基质隔开而使燃烧中断。
由于红磷在达到同样的阻燃要求时用量较小,而且红磷的熔点高,溶解性差,因而以红磷阻燃的高聚物的某些物理性能比用一般阻燃剂制得的同类高聚物要好。

白磷替代红磷的原因白磷和红磷都是磷的同素异形体,它们的结构和性质稍有不同。
红磷是一种较为稳定的形态,不易燃烧,常用于制造火柴头等产品。
而白磷则具有非常高的反应性,容易燃烧,并且具有剧毒性。
由于白磷的危险性和环境污染问题,科学家们一直在探索替代红磷的方法,以减少白磷的使用。
下面是白磷替代红磷的几个原因。
1. 安全性:白磷具有高度的反应性和易燃性,一旦遇到空气中的氧气就会燃烧并释放出有毒气体。
这使得白磷的使用非常危险,容易引发火灾和环境污染。
而红磷相对稳定,不易燃烧,更加安全可靠。
2. 剧毒性:白磷在接触皮肤或吸入时都会对人体造成严重伤害甚至死亡。
它会引起化学性灼伤,损害肝脏、肾脏和骨髓等重要器官。
然而,红磷对人体的危害较小,与白磷相比,红磷更加安全。
3. 环境影响:白磷的燃烧会产生大量的有毒废气,包括二氧化磷、磷酸和磷酸酐等。
这些废气对环境和人类健康都造成严重影响,污染空气和水源。
相比之下,红磷的燃烧产生的废气较少,并且对环境的影响较小。
4. 可持续性发展:白磷是一种非可再生资源,采集和提取白磷会对周围的生态环境造成破坏。
而且,白磷资源相对有限,随着不断的使用,各国的白磷储量正在减少。
相反,红磷的原料更加充足,可持续性更好。
5. 替代技术发展:近年来,科学家们一直在探索替代白磷的方法和技术。
一种常见的替代方法是使用磷酸盐化合物取代白磷,例如亮磷或者无机磷酸盐。
这些替代物不具有白磷的高反应性和剧毒性,更加安全可靠。
6. 国际法规限制:出于对白磷的安全和环境影响的关注,一些国际法规对白磷的使用进行了限制。
例如,联合国的《臭氧层保护协议》和《全球水罐限制条约》等国际协议限制了白磷的使用。
这促使各国寻求替代方案,以符合国际法规要求。
综上所述,为了提高安全性、减少环境污染、保护人类健康和促进可持续发展,白磷被替代红磷已成为一个重要的研究方向。
通过替代技术的应用,我们能够减少白磷的使用,并实现更加安全、可靠和可持续的磷资源利用。

红磷和氧气的化学方程式红磷和氧气的化学方程式可以表示为P4 + 5O2 → 2P2O5。
红磷是一种固体物质,呈现出红棕色,是磷的一种同素异形体。
红磷的分子式为P4,其中有4个磷原子组成一个环状分子。
红磷相对于白磷来说比较稳定,在室温下不会自燃。
它主要用于制造磷酸盐肥料、农药、合成有机化合物等。
氧气是一种无色、无味、无臭的气体,化学式为O2。
它是地球大气中最常见的元素之一,占空气总体积的约20.95%。
氧气是生命活动所必需的,用于细胞呼吸和能量产生。
红磷和氧气在一定条件下可以发生化学反应,生成磷酸五氧化二磷(P2O5)。
这个反应是一个氧化反应,红磷被氧气氧化成了更高氧化态的磷。
红磷和氧气反应的化学方程式为P4 + 5O2 → 2P2O5。
在这个方程式中,P4表示红磷的分子,5O2表示5个氧气分子,2P2O5表示2个磷酸五氧化二磷分子。
这个方程式表明,在反应中,每4个红磷分子需要5个氧气分子参与反应,最终生成2个磷酸五氧化二磷分子。
从化学式可以看出,红磷和氧气的摩尔比为4:5,生成的磷酸五氧化二磷的摩尔比为2:1。
红磷和氧气的反应是一个放热反应,释放出大量的热能。
这是因为红磷和氧气之间的化学键较弱,而生成的磷酸五氧化二磷有更强的化学键,能够释放出能量。
红磷和氧气的反应速度较慢,在常温下需要外部能量的引入才能发生。
一旦反应开始,它会迅速放出热能,产生火焰,并且会继续自我加热,形成自燃的现象。
因此,红磷在储存和运输时需要注意防火防爆措施。
磷酸五氧化二磷是一种固体物质,呈白色结晶状。
它是一种强酸性氧化物,可以与水反应生成磷酸(H3PO4)。
磷酸五氧化二磷主要用于制造无机磷肥、磷酸盐、草木灰等。
此外,它还可以用作脱水剂、吸湿剂、催化剂等。
总结一下,红磷和氧气的化学方程式为P4 + 5O2 → 2P2O5。
这是一个氧化反应,红磷被氧气氧化成了磷酸五氧化二磷。
这个反应放出大量的热能,是一个放热反应。
磷酸五氧化二磷是一种固体物质,具有多种应用。

磷的同素异形磷元素的原子序数为15,其原子结构为1s2 2s2 2p6 3s2 3p3,其中有5个电子可以参与化学反应。
磷的同素异形是指具有相同原子序数,但具有不同的化学性质的同一元素的不同形态。
磷的同素异形有三种,分别是白磷、红磷和黑磷。
白磷是磷的最稳定的同素异形,其原子结构为1s2 2s2 2p6 3s23p3,其中有5个电子可以参与化学反应。
白磷是一种类固醇状的固体,具有极强的毒性,在空气中易被氧化,形成磷酸盐。
红磷是磷的第二稳定的同素异形,其原子结构为1s2 2s2 2p63s2 3p4,其中有6个电子可以参与化学反应。
红磷是一种液体,具有极强的毒性,在空气中易被氧化,形成磷酸盐。
黑磷是磷的第三稳定的同素异形,其原子结构为1s2 2s2 2p63s2 3p5,其中有7个电子可以参与化学反应。
黑磷是一种黑色固体,具有极强的毒性,在空气中易被氧化,形成磷酸盐。
磷的同素异形之间的化学性质有很大的差异,如白磷和红磷的沸点分别为280℃和317℃,白磷和黑磷的沸点分别为280℃和553℃,红磷和黑磷的沸点分别为317℃和553℃。
此外,白磷和红磷的比重分别为2.2和2.3,白磷和黑磷的比重分别为2.2和2.9,红磷和黑磷的比重分别为2.3和2.9。
磷的同素异形之间的化学反应也有很大的差异,如白磷和红磷可以与氧化剂发生氧化反应,形成磷酸盐;而黑磷则可以与还原剂发生还原反应,形成磷的氢化物。
此外,白磷和红磷可以与酸发生反应,形成磷酸盐;而黑磷则可以与碱发生反应,形成磷的氢化物。
综上所述,磷的同素异形有三种,分别是白磷、红磷和黑磷,它们之间的化学性质和化学反应有很大的差异,因此在实际应用中,应根据实际情况选择合适的磷的同素异形。

磷的同素异形体磷的同素异形体主要有三种:白磷、红磷、黑磷。
纯的白磷是无色透明的晶体,遇光即逐渐变为黄色,所以又叫黄磷。
黄磷在隔绝光和空气的情况下蒸馏,又可变白色。
经测定,无论在溶液中或在蒸气状态下,白磷都以P4的分子形式存在。
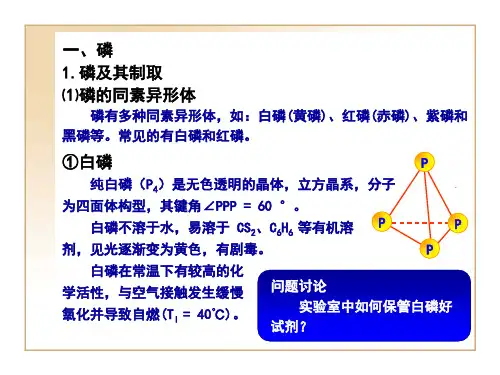
4个磷原子构成四面体,每一个磷原子用它的3个p轨道与另外3个磷原子的p轨道形成3个σ键,P4分子中磷原子之间的键角是60°。
P4分子是有张力的分子,这个张力使每一个P-P键的键能降低,这说明了为什么白磷在常温下有很高的化学活动性。
将白磷蒸气加热到800℃,P4开始分解为P2,这时的双原子分子结构跟氮分子相似(:P≡P:)。
白磷在密闭容器里加热到260℃,就会逐渐转化为暗红色粉末。
常温时,在光的作用下,白磷也会发生上述的转化,生成的暗红色的变体,其中主要成分是紫磷。
紫磷的化学活动性比白磷小,但仍能被硝酸氧化成磷酸。
紫磷跟氯酸钾一起摩擦可以猛烈燃烧。
白磷或紫磷跟三溴化磷煮沸,都会生成红磷。
红磷是紫磷的无定形体。
红磷的结构至今仍未弄清楚。
有人认为红磷是四面体结构的P4分子断裂开1个键之后,连接起来形成的长链状巨大分子。
将白磷在1.21×109Pa下加热,就得到黑磷。
黑磷呈铁灰色,具有金属光泽,能导电,密度为2.7g/cm3,着火点是490℃,外形像石墨。
黑磷的化学活动性比紫磷差,通常难于发生化学反应。
黑磷具有双层结构,每个磷原子有3个相邻的原子。
白磷、红磷和黑磷的分子结构如图6-7。
许多元素的单质像磷那样会形成同素异形体。
形成同素异形体有下列三种方式:(1)组成分子的原子数目不同,如氧气(O2)和臭氧(O3);(2)晶体里原子的排列方式不同,如金刚石和石墨;(3)晶体里分子的排列方式不同,如斜方硫和单斜硫。

磷和氯形成的化合物
五氧化二磷和氯形成的化合物是一种重要的化学物质,广泛应用于生物、工业和农业领域中。
五氧化二磷是一种磷的同素异形体,其中磷与氧的摩尔比例为5:2,是比普通磷多了一个氧原子的磷比其它磷形式更加稳定。
它具有低熔点、溶解性差等特点,在有机物中并不溶解,可以依靠与脂肪、胆固醇和碳酸钙结合在生物体内传递信息和修饰蛋白质。
如果五氧化二磷与其它物质发生反应,会产生各种磷化合物。
氯是一种具有毒性的重要元素,在自然界最常见的元素之一,可以杀灭抗生素抗药的细菌,在水处理、药剂生产和防疫领域中应用广泛。
五氧化二磷和氯之间的反应产物是磷酸氯(HClPO)2)。
磷酸氯具有相当的溶解性,但容易在碱性环境中水解,可以用来制备各种用于焊接、防腐、抗火剂等用途的物质。
此外,五氧化二磷和氯反应产生的另一种重要化合物是重磷酸钠(Na2H2P4O7)。
它具有极强的有机收缩性,能够与大量蛋白质发生结合,因此在医药、食品和化妆品等行业中广泛应用。
Marin Penta,一种由五氧化二磷和氯形成的化合物,也被广泛应用于扬柴机油配方中,以降低活性磷的水溶性,延迟机油变质的速度,提高机油的寿命。

磷的同素异形体
磷的同素异形体有多种,常见的有白磷、红磷。
(1)红磷
理化常数:国标编号:41001,CAS号:7723-14-0,别名:赤磷,分子式:P,外观与性状:紫红色无定形粉末,无臭,具有金属光泽,暗处不发光。
主要用途:用于制造火柴、农药,及用于有机合成。
(2)白磷
白磷是磷的一种同素异形体,分子是由四个磷原子构成的正四面体,键角60°,化学式为P₄。
为白色蜡状固体,遇光会逐渐变为淡黄色晶体(所以又称为黄磷),有大蒜的气味,有毒。
着火点很低,能自燃,在空气中可以发光。
白磷是一种易自燃的物质,其燃点为
40 ℃,但因摩擦或缓慢氧化而产生的热量有可能使局部温度达到40 ℃而燃烧。
因此,不能说气温在40 ℃以下白磷不会自燃。
白磷是一种有强毒的物质。
人的中毒剂量为15mg,致死量为50mg。
误服白磷后很快产生严重的胃肠道刺激腐蚀症状。
大量摄入可因全身出血、呕血、便血和循环系统衰竭而死。
若病人暂时得以存活,亦可由于肝、肾、心血管的功能不全而慢慢死去。
皮肤被磷灼伤面积达7%以上时,可引起严重的急性溶血性贫血,以至死于急性肾功能衰竭。
常期吸入磷蒸气,可导致气管炎、肺炎及严重的骨骼损害。
磷的同素异形体[编辑]维基百科,自由的百科全书(重定向自红磷)提示:本条目的主题不是磷的同位素。
磷的同素异形体这里列出磷的同素异形体,同素异形体是两种或以上由相同元素组成的单质相互之间的称谓(如石墨与金刚石互为同素异形体)。
白磷[编辑]白磷样品白磷分子白磷(黄磷),分子式P4,白色固体,质软,有剧毒,致死量为0.25g。
实验室臵于冷水中保存。
常用于化学武器。
34°C时可在空气中自燃,生成白色烟雾,主要成分为五氧化二磷(烟)以及五氧化二磷于空气中水结合生成的磷酸(雾),方程式为:P4 + 5O2→ 2P2O5白磷在常温下可以和空气中的氧气反应(这也是白磷在黑暗中可以发光的反应式):P4 + O2→ P4O + OO + O2→ O3两个方程式合起来为:P4 + 2O2→ P4O + O3[1]武器[编辑]白磷弹是手榴弹、炮弹、炸弹的一种,利用了白磷在空气中自燃的性质。
利用白磷本身毒性的化学武器也曾被研制。
起初白磷弹曾被当作燃烧弹使用,但后来由于其给交战国士兵造成的巨大身体及心理创伤而逐渐被各国弃用,转而作为目标指示弹及烟雾弹使用。
美军跟伊拉克武装分子在伊拉克费卢杰激战多个月,其间用过白磷弹。
2007年以色列进攻加沙城时曾使用过该武器。
2009年初以色列对加沙发动军事攻击,造成数千平民百姓死伤,而曾参与指挥作战的准将与上校2名高阶军官,因证实作战期间使用白磷弹遭受惩处,以色列国防军形象蒙上阴影。
安全[编辑]过去,不慎误服白磷后常用硫酸铜溶液洗胃。
但是,硫酸铜有毒,会损害肾脏和大脑。
目前,在美国等国家已经不再使用。
在下面这本美国海军编制的手册中推荐使用碳酸氢盐溶液来中和磷酸。
[2]红磷[编辑]红磷的外观红磷是磷的一种同素异形体,因呈红色而得名。
把白磷加热至 250°C 或暴露于阳光下一段时间即可获得红磷。
红磷的结构属多分子不规则排列。
用途[编辑]可当火柴摩擦面。
在俄罗斯和前苏联地区,红磷是一种监控物质,因为红磷可用作非法生产安非他明类的兴奋剂。
【人物与科研】西安交通大学张锦英副教授课题组:最稳定的磷的同素异形体——紫磷及紫磷烯紫磷或者HIttorf磷(1985年hittorf提出)是磷的另一种层状的同素异形体,但是至今都没有可靠的实验数据确定紫磷的合成及其晶体结构。
近日,西安交通大学张锦英课题组合成了紫磷单晶,通过单晶XRD等手段确定了紫磷的晶体结构(单个晶胞有84个原子),并通过声子谱证明了图尔恩和克雷布斯给出的结构的不合理性,同时在此基础上剥离出紫磷烯结构。
该工作发表于Angew. Chem. Int. Ed.(DOI: 10.1002/anie.201912761)。
张锦英副教授课题组致力于低维度新材料的开发合成及在新能源中的应用,主要包括碳和磷的新型同素异形体。
课题组已经合成了T-碳、环状磷、一维磷等新型结构。
西安交通大学电气学院特聘研究员,首批青年仲英学者。
本科毕业于华中科技大学材料系,硕士毕业于清华大学机械系,牛津大学获得量子信息处理专业博士学位,名古屋大学化学系师从Hisanori Shinohara教授从事碳纳米材料的博士后研究。
现从事新型低维度介稳态纳米结构的设计、性能、合成与可持续能源转换的基础研究,分别在Nat. Commun., Nano Lett., ACS Nano, Angew. Chem. Int. Ed 等权威杂志发表40多篇论文。
最稳定的磷的同素异形体——紫磷及紫磷烯石墨烯的发现引发了二维材料的研究热潮,并获得诺贝尔物理奖。
二维磷烯由于弥补了石墨烯没有带隙这一天然缺陷,且具有高的电荷迁移率,使磷二维材料重新成为研究热点。
类似于碳,磷也具有复杂的相图结构,存在多种同素异形体。
我们熟悉的在空气中会自燃产生磷光的白磷是磷的最活泼的一种同素异形体,而黑磷一直以来被认为是磷的最稳定的同素异形体。
紫磷或者HIttorf磷(1985年hittorf提出)是磷的另一种层状的同素异形体,Thurn和Krebs在1969年给出了紫磷的晶体结构。
⾼中同素异形体的概念举例
⽣活中最常见的,有碳的同素异形体:⾦刚⽯、⽯墨、富勒烯、碳纳⽶管、⽯墨烯和⽯墨炔;磷的同素异形体:⽩磷和红磷;氧的同素异形体:氧⽓、臭氧、四聚氧和红氧。
同素异形体,是相同元素组成,不同形态的单质.如碳元素就有⾦刚⽯、⽯墨、⽆定形碳等同素异形体.同素异形体由于结构不同,彼此间物理性质有差异;但由于是同种元素形成的单质,所以化学性质相似.
同素异形体是指由同样的单⼀化学元素组成,因排列⽅式不同,⽽具有不同性质的单质。
同素异形体之间的性质差异主要表现在物理性质上,化学性质上也有着活性的差异。
例如磷的两种同素异形体,红磷和⽩磷,它们的着⽕点分别是240和40摄⽒度,但是充分燃烧之后的产物都是五氧化⼆磷;⽩磷有剧毒,可溶于⼆硫化碳,红磷⽆毒,却不溶于⼆硫化碳。
同素异形体之间在⼀定条件下可以相互转化,这种转化是⼀种化学变化。
白磷燃烧表达式白磷燃烧表达式是指白磷与氧气反应时所产生的化学方程式。
白磷是一种磷的同素异形体,常温下为黄白色固体,具有高度的毒性和剧烈的化学活性。
它在空气中极易燃,燃烧时会产生明亮的白色光和大量的热能。
白磷燃烧的化学方程式可以表示为:P4 + 5O2 → 2P2O5在这个方程式中,P4代表四个磷原子形成的白磷分子,O2代表两个氧原子形成的氧气分子,P2O5代表两个磷原子和五个氧原子形成的磷酸酐分子。
这个方程式表达了白磷与氧气反应时,白磷分子中的磷原子与氧气分子中的氧原子结合形成磷酸酐分子的过程。
白磷燃烧是一种强烈的氧化反应。
当白磷与氧气接触时,白磷分子表面的氧原子与氧气分子中的氧原子发生反应,生成磷酸酐分子。
这个反应是放热反应,释放出大量的热能。
同时,燃烧过程中还会产生明亮的白色光,因此白磷燃烧时会呈现出明亮的火焰。
白磷燃烧的化学方程式中的系数表示了反应物和产物之间的摩尔比例关系。
根据方程式可以看出,每个白磷分子需要与5个氧气分子反应,才能生成2个磷酸酐分子。
这意味着在反应过程中,白磷和氧气的摩尔比为1:5。
这也说明了为什么白磷燃烧时需要足够的氧气供应,否则反应无法进行完全。
白磷燃烧是一种剧烈的反应,需要小心操作。
白磷在空气中燃烧时会释放出大量的有毒气体,如氧化磷蒸气和二氧化磷气体。
因此,在进行白磷燃烧实验时,应该在通风良好的实验室中进行,并采取适当的安全措施,如佩戴防护眼镜和手套。
同时,燃烧后产生的废气也需要经过处理,以防止对环境造成污染。
白磷燃烧是一种重要的化学反应,有着广泛的应用。
磷酸酐是一种重要的化学品,广泛用于农业、医药和化工等领域。
磷酸酐可以用作肥料,提供植物生长所需的磷元素;它还可以用于制备药物和化学试剂;此外,磷酸酐还是合成高分子材料的重要原料之一。
白磷燃烧表达式是指白磷与氧气反应时所产生的化学方程式。
这个方程式揭示了白磷与氧气反应生成磷酸酐的过程,同时也说明了白磷燃烧是一种剧烈的氧化反应。
白磷的晶体类型白磷是一种常见的磷元素同素异形体,其晶体结构有着特殊的类型。
在白磷结构中,磷原子通过共价键相互连接形成了一个独特的晶体结构。
白磷晶体的类型主要有两种,分别是单斜型和正交型。
下面将分别介绍这两种晶体类型的结构特点。
1. 单斜型晶体结构单斜型白磷的晶体结构是由P4四面体单元组成的。
每个P4四面体由四个磷原子组成,它们通过共价键连接在一起形成一个稳定的结构。
在单斜型晶体中,P4四面体呈现出呈菱形排列的特点。
每个磷原子都与其周围的三个磷原子相连接,形成了一个三维的网络结构。
这种结构使得单斜型白磷具有较高的稳定性和热稳定性。
2. 正交型晶体结构正交型白磷的晶体结构是由P4四面体单元和P2链组成的。
P4四面体单元是由四个磷原子组成的,它们通过共价键连接在一起形成一个稳定的结构。
而P2链是由两个磷原子通过共价键连接在一起形成的。
在正交型晶体中,P4四面体和P2链交替排列形成了一个三维的网络结构。
这种结构使得正交型白磷具有较高的稳定性和热稳定性。
白磷晶体的结构特点使得其具有一些特殊的性质和应用。
首先,白磷具有较高的化学活性,可以与氧气等物质反应产生磷酸。
其次,白磷具有较低的熔点和沸点,可以在较低的温度下燃烧。
此外,白磷还具有一定的光发射性质,可以在暗处发出微弱的绿光。
由于白磷具有较高的化学活性和热稳定性,因此在工业生产和科学研究中有着广泛的应用。
白磷被广泛用于制备农药、杀虫剂、阻燃剂等化学品,同时也可以用作制备磷肥的原料。
此外,白磷还可以用于制备光发射材料、涂料、火药等。
总结起来,白磷的晶体类型主要有单斜型和正交型两种。
单斜型白磷由P4四面体单元组成,具有较高的稳定性和热稳定性。
正交型白磷由P4四面体单元和P2链组成,同样具有较高的稳定性和热稳定性。
白磷晶体的结构特点赋予了其一些特殊的性质和应用,使其在化学工业和科学研究中有着重要的地位。
磷是一种非金属元素,位于元素周期表中的第15位,其化学符号为P。
磷有多种同素异形体,其中最常见的是白磷(P4),它是由四个磷原子通过共价键连接而成的正四面体结构。
白磷在常温下是白色的蜡状固体,具有强烈的刺激性气味。
在一定条件下,白磷可以燃烧,发出黄白色的火焰,并产生浓厚的白烟。
白磷不溶于水,但可溶于二硫化碳、松节油等有机溶剂。
除了白磷外,磷还有其他同素异形体,如红磷、黑磷等。
红磷是紫红色的粉末状固体,由许多长链的P4分子聚合而成;黑磷则是结构类似石墨的层状结构,其中每个磷原子都与其他的三个磷原子通过共价键连接。
因此,四个磷原子构成的单质是白磷。
磷的同素异形体[编辑]
维基百科,自由的百科全书
(重定向自红磷)
提示:本条目的主题不是磷的同位素。
磷的同素异形体
这里列出磷的同素异形体,同素异形体是两种或以上由相同元素组成的单质相互之间的称谓(如石墨与金刚石互为同素异形体)。
白磷[编辑]
白磷样品
白磷分子
白磷(黄磷),分子式P4,白色固体,质软,有剧毒,致死量为0.25g。
实验室臵于冷水中保存。
常用于化学武器。
34°C时可在空气中自燃,生成白色烟雾,主要成分为五氧化二磷(烟)以及五氧化二磷于空气中水结合生成的磷酸(雾),方程式为:
P4 + 5O2→ 2P2O5
白磷在常温下可以和空气中的氧气反应(这也是白磷在黑暗中可以发光的反应式):
P4 + O2→ P4O + O
O + O2→ O3
两个方程式合起来为:P4 + 2O2→ P4O + O3[1]
武器[编辑]
白磷弹是手榴弹、炮弹、炸弹的一种,利用了白磷在空气中自燃的性质。
利用白磷本身毒性的化学武器也曾被研制。
起初白磷弹曾被当作燃烧弹使用,但后来由于其给交战国士兵造成的巨大身体及心理创伤而逐渐被各国弃用,转而作为目标指示弹及烟雾弹使用。
美军跟伊拉克武装分子在伊拉克费卢杰激战多个月,其间用过白磷弹。
2007年以色列进攻加沙城时曾使用过该武器。
2009年初以色列对加沙发动军事攻击,造成数千平民百姓死伤,而曾参与指挥作战的准将与上校2名高阶军官,因证实作战期间使用白磷弹遭受惩处,以色列国防军形象蒙上阴影。
安全[编辑]
过去,不慎误服白磷后常用硫酸铜溶液洗胃。
但是,硫酸铜有毒,会损害肾脏和大脑。
目前,在美国等国家已经不再使用。
在下面这本美国海军编制的手册中推荐使用碳酸氢盐溶液来中和磷酸。
[2]
红磷[编辑]
红磷的外观
红磷是磷的一种同素异形体,因呈红色而得名。
把白磷加热至 250°C 或暴露于阳光下一段时间即可获得红磷。
红磷的结构属多分子不规则排列。
用途[编辑]
可当火柴摩擦面。
在俄罗斯和前苏联地区,红磷是一种监控物质,因为红磷可用作非法生产安非他明类的兴奋剂。
黑磷结构
黑磷[编辑]
黑磷是一种有金属光泽的晶体,它是用白磷在很高压强(12000大气压)和较高温度下转化而形成的,实用价值不大。
种类[编辑]
目前知道的黑磷有四种:斜方、菱形、立方和无定形。
无定形的黑磷在125°C时开始向红磷转变。
结构[编辑]
黑磷具有像石墨的片状结构和导电性,这类晶体有一些本质特征:如晶体内不仅有共价键,还有离子键和范德华力,是磷最不活跃的同素异形体。
紫磷[编辑]
紫磷加热至300°C才能在空气中被点燃,不溶于所有的溶剂,具有金属光泽,因此虽非金属却称作金属磷。
[来源请求]
紫磷可透过把白磷以500°C溶解在盛有熔融的铅的密封管中18小时制得。
此外,透过在一密封管中以530°C加热红磷,密封管的上半部维持在444°C,亦可制得紫磷结晶。
若紫磷在一充满惰性气体中(如氮气或二氧化碳)被加热则会升华,得出的气体会凝华为白磷。