高中化学 同素异形体有哪些
- 格式:docx
- 大小:21.87 KB
- 文档页数:1

专题5 微观结构与物质的多样性第一单元元素周期律和元素周期表.................................................................................... - 1 - 第1课时元素周期律.................................................................................................. - 1 - 第2课时元素周期表元素周期表的应用.............................................................. - 6 - 第二单元微粒之间的相互作用.......................................................................................... - 12 - 第1课时离子键........................................................................................................ - 12 - 第2课时共价键分子间作用力................................................................................ - 16 - 第三单元从微观结构看物质的多样性............................................................................ - 21 - 微专题6“位—构—性”在元素推断题中的应用 .............................................................. - 25 -第一单元元素周期律和元素周期表第1课时元素周期律一、原子序数及元素的原子核外电子排布、原子半径、元素化合价的变化规律1.原子序数化学家按照核电荷数由小到大的顺序给元素依次编号,这种编号叫作原子序数。


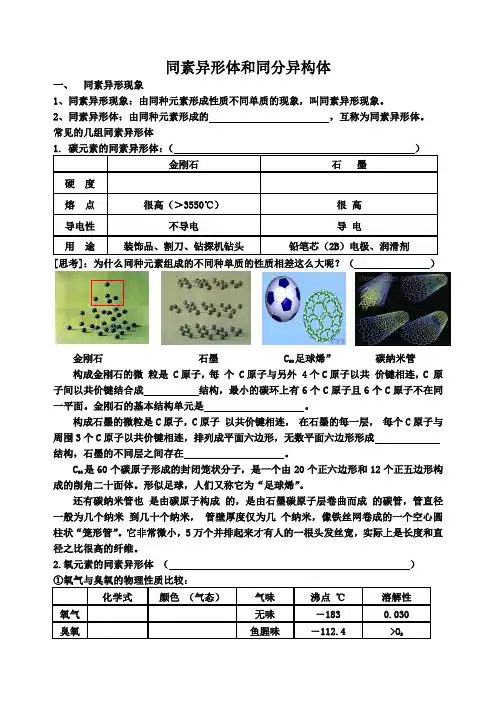
碳元素的同素异形体
碳元素是元素周期表中最重要的元素之一,它具有多种同素异形体。
它们之间的化学性质不同,但它们的原子结构和空间结构相同。
同素异形体的碳元素有四种:石墨烯、碳纳米管、碳纤维和碳点。
石墨烯是由一层厚度仅为一个原子的碳原子构成的,具有高强度、高热稳定性和高电导率等优异性能,广泛应用于航空航天、电子信息等领域。
碳纳米管由一层厚度仅为一个原子的碳原子组成的管状结构,具有高强度、高热稳定性和高电导率等优异性能,广泛应用于航空航天、电子信息等领域。
碳纤维是由多层碳管组成的纤维状结构,具有抗拉强度高、耐热性好、耐腐蚀性强等优异性能,广泛应用于航空航天、电子信息等领域。
碳点是由一层厚度仅为一个原子的碳原子组成的微米级结构,具有高强度、高热稳定性和高电导率等优异性能,广泛应用于航空航天、电子信息等领域。
综上所述,碳元素的同素异形体有石墨烯、碳纳米管、碳纤维和碳点,它们具有不同的化学性质,但它们的原子结构和空间结构相同,并且在航空航天、电子信息等领域有着广泛的应用。

1同位素是针对原子来说的,指质子数相同而中子数不同的原子,如D和H2同分异构体是指分子式相同而结构不同的化合物,如丁烷和异丁烷3同系物是指有机物中差一个CH2的物质,如烷4同素异形体是指单质,如O2,O3。
红磷白磷同位素是具有相同原子序数的同一化学元素的两种或多种原子之一,在元素周期表上占有同一位置,化学行为几乎相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
同位素的表示是在该元素符号的左上角注明质量数,例如碳14,一般用14C而不用C14。
自然界中许多元素都有同位素。
同位素有的是天然存在的,有的是人工制造的,有的有放射性,有的没有放射性。
同一元素的同位素虽然质量数不同,但他们的化学性质基本相同(如:化学反应和离子的形成),物理性质有差异[主要表现在质量上(如:熔点和沸点)]。
自然界中,各种同位素的原子个数百分比一定。
同位素是指具有相同核电荷但不同原子质量的原子(核素)称为同位素。
在19世纪末先发现了放射性同位素,随后又发现了天然存在的稳定同位素,并测定了同位素的丰度。
大多数天然元素都存在几种稳定的同位素。
同种元素的各种同位素质量不同,但化学性质几乎相同。
同素异形体,是相同元素组成,不同形态的单质。
如碳元素就有金钢石、石墨、无定形碳等同素异形体。
同素异形体由于结构不同,彼此间物理性质有差异;但由于是同种元素形成的单质,所以化学性质相似。
同分异构体:化学上,同分异构体是一种有相同化学式,有同样的化学键而有不同的原子排列的化合物。
简单地说,化合物具有相同分子式,但具有不同结构的现象,叫做同分异构现象;具有相同分子式而结构不同的化合物互为同分异构体。
很多同分异构体有相似的性质。
同系物定义同系物定义同系物定义同系物定义化学上,我们把结构相似,组成上相差1个或者若干个某种原子团的化合物互称为同系物。
多用于有机化合物。
旧定义(在比较旧的化学书上可能存在这个概念)化学上,我们把结构、化学性质、通式相似,组成上相差1个或者若干个CH2原子团(系差)具有相同官能团的化合物统称为同系物。

碳元素同素异形体
【实用版】
目录
1.碳元素的同素异形体概述
2.碳元素的同素异形体种类
3.各种同素异形体的性质和用途
4.碳元素同素异形体的化学性质
5.结论
正文
碳元素的同素异形体是指由碳元素组成的不同单质,它们的化学式相同,但原子排列方式不同,因此具有不同的物理和化学性质。
碳元素的同素异形体种类繁多,主要包括金刚石、石墨、碳 60(富勒烯)和无定型碳(如木炭、焦炭、活性炭等)。
金刚石是碳元素最坚硬的同素异形体,由碳原子以 sp3 杂化轨道形成共价单键,构成正四面体结构。
金刚石的硬度非常高,是自然界中天然存在的最坚硬的物质,广泛应用于工艺品、工业切割工具和贵重宝石等领域。
石墨是碳元素的另一种同素异形体,由碳原子以 sp2 杂化轨道形成共价单键,呈层状结构。
石墨具有良好的导电性和热稳定性,广泛应用于电极、电池、润滑剂和石墨烯制备等领域。
碳 60(富勒烯)是碳元素的一种球状同素异形体,由 60 个碳原子组成一个分子,呈足球状结构。
碳 60 具有许多特殊的物理和化学性质,如高强度、高硬度、高导电性和高热稳定性等,潜在应用于航空航天、汽车、电子和能源等领域。
无定型碳是指由碳原子组成的非晶态碳,包括炭黑、木炭、焦炭、骨
炭和活性炭等。
无定型碳具有较高的比表面积和吸附能力,广泛应用于催化剂、吸附剂、电极和炭黑制备等领域。
虽然碳元素的同素异形体具有不同的物理性质,但它们在化学性质上具有相似之处,例如在氧气中燃烧后产生的产物都是二氧化碳。

化学元素周期表中的同素异形体同素异形体是指在分子式相同的化合物中,其分子结构不同导致性质和化学行为也不同的化合物。
在化学元素周期表中,也存在许多同素异形体。
1. 氧的同素异形体氧的同素异形体有两种,分别为O2和O3。
其中,O2是二氧化物,是一种非常稳定的气体,而O3是臭氧,是一种有毒气体。
O3在光照作用下能够分解为O2和单质氧,因此具有消毒和氧化等功能,在空气净化中发挥着重要作用。
2. 碳的同素异形体碳的同素异形体包括钻石和石墨,它们都是由纯碳组成的,但它们的结构不同,钻石是由大量碳原子形成的立方晶系晶体,而石墨则是由平面碳原子层堆积而成的层状晶体。
因此,它们的物理和化学性质也截然不同。
钻石是一种非常坚硬的物质,可用于制作钻石首饰等高档商品;而石墨则是一种软的物质,可用于制作铅笔芯和涂料等。
3. 硫的同素异形体硫的同素异形体有三种,分别为单斜硫(S8)、三斜硫(Sα)和单轴硫(Sβ)。
但S8是最为稳定的一种,常见于日常生活中。
Sα和Sβ是两种相对不稳定的同素异形体,它们的分子形态不同,因此具有不同的化学行为。
例如,在酸性环境下,Sβ比Sα更容易发生反应,因为它的形态更接近于溶液中的硫酸离子。
4. 硅的同素异形体硅的同素异形体包括晶态硅和非晶态硅。
晶态硅是由大量硅原子形成的完整晶体,具有优异的电子性能,可作为集成电路中的材料使用;而非晶态硅则是无定形的硅物质,具有较高的弹性和耐蚀性能,在某些领域也有广泛应用。
5. 氮的同素异形体氮的同素异形体有两种,分别为N2和N3。
其中,N2是氮气,是一种非常稳定的气体,在空气中占据了80%以上的比例;而N3则是一种比较不稳定的同素异形体,只能在极低温下制备,具有一些独特的物理和化学性质。
例如,在高温高压的环境下,N3可分解为分子氮和单质氮。
总体来看,同素异形体是化学元素周期表中的重要组成部分,不仅体现了元素之间丰富多彩的性质和行为,也为科学家研究物质的特性和开发新材料提供了有益的参考。

同素异形体、同位素、同分异构体和同系物四个概念同素异形体,是指由同种元素组成的不同种单质,如:氧气和臭氧、红磷和白磷、金刚石和石墨及C60;同位素,是指质子数相同,中子数不同的一类原子,如氕、氘、氚;氧-16,氧-18;碳-12、碳-13、碳-14;同分异构体,是指分子式相同而结构式不同的一类物质之间的互称,如正丁烷和异丁烷、乙酸乙酯与丁酸。
同系物,是指结构相似,在分子组成上相差一个或若干个“CH2”原子团的物质的互称。
需要注意的同系物的适用范围为有机物。
1、同素异形体的对象是单质。
组成元素相同,结构不同,物理性质差异较大,化学性质相似。
如金刚石和石墨的导电性、硬度均不同,但都可以氧气反应生成二氧化碳;臭氧和氧气都具有氧化性,但是臭氧氧化性更强,不能供给呼吸。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如:O2和O3。
(2)晶格中原子排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列方式不同,例如:正交硫和单斜硫。
2、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱和物理性质有所差异。
3、同分异构体的对象是化合物(不局限于有机物),属于同分异构体的物质必须化学式相同,结构不同,因而性质不同。
具有“五同一异”,即同分子式、同最简式、同组成元素、同相对原子式量、同质量分数和不同结构。
属于同分异构体的物质可以是有机物,如正丁烷和异丁烷;可以是有机物和无机物,如氰酸铵和尿素;也可以是无机物,如[Pu(H2O)4]Cl3和[Pu(H2O)2Cl2]•2H2O•Cl。
在有机物中,很多物质都存在同分异构体,中学阶段有以下几类:(1)碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。
这是最常见的异构方式,如丁烷有两种同分异构体,即正丁烷和异戊烷。
(2)位置异构(官能团位置异构):指官能团或取代基在在碳链上的位置不同而造成的异构。

氧元素的同素异形体
摘要:
1.氧元素的同素异形体的定义
2.氧元素的同素异形体的种类
3.氧元素的同素异形体的性质
4.氧元素的同素异形体的应用
5.氧元素的同素异形体的环保意义
正文:
氧元素的同素异形体是指由氧元素组成的不同单质,它们的分子结构不同,因此具有不同的物理和化学性质。
氧元素的同素异形体主要有以下几种:
1.氧气(O2):氧气是我们生活中最常见的氧元素单质,它是无色、无味、无臭的气体,是支持燃烧和供给呼吸的必要物质。
2.臭氧(O3):臭氧是一种有特殊臭味的蓝色气体,它的分子结构比氧气更加复杂。
臭氧主要存在于距地球表面20~35 公里的同温层下部的臭氧层中,对保护生物免受紫外线的伤害有重要作用。
3.四聚氧(O4):四聚氧是一种由四个氧原子组成的分子,它的物理和化学性质与氧气和臭氧都有所不同。
四聚氧在自然界中很少存在,主要通过实验室合成。
4.红氧(O8):红氧是一种由八个氧原子组成的分子,它的分子结构非常稳定,因此在自然界中很少存在。
红氧主要通过实验室合成,具有较强的氧化性。
氧元素的同素异形体在环保方面有着重要的应用。
例如,臭氧层可以吸收太阳光中的紫外线,保护生物免受紫外线的伤害。
此外,氧气和臭氧在空气净化和水处理方面也有广泛的应用。

碳元素同素异形体
【原创版】
目录
1.碳元素的同素异形体概述
2.碳元素的同素异形体种类
3.碳元素同素异形体的性质差异
4.碳元素同素异形体的应用
5.结论
正文
碳元素的同素异形体是指由碳元素组成的不同单质,它们的化学式相同,但原子排列方式不同,因而具有不同的物理和化学性质。
碳元素的同素异形体主要包括金刚石、石墨、碳 60(富勒烯)和无定型碳(如木炭、焦炭、活性炭等)。
金刚石是碳元素最坚硬的同素异形体,其晶体结构由碳原子以 sp3 杂化轨道形成共价单键,构成正四面体。
金刚石在自然界中常见于钻石,具有很高的硬度和热导率,广泛应用于切割工具、工艺品和珠宝等领域。
石墨是碳元素的另一种同素异形体,其结构由碳原子以 sp2 杂化轨道形成共价单键,呈层状排列。
石墨具有良好的导电性和热稳定性,广泛应用于电极、润滑剂和石墨烯制备等领域。
碳 60(富勒烯)是碳元素的一种球状同素异形体,由 60 个碳原子组成一个分子。
碳 60 具有分子稳定性、高热导率和化学惰性等特点,在材料科学、生物医学和能源技术等领域具有广泛应用前景。
无定型碳是一类非晶态碳,包括木炭、焦炭、活性炭等。
它们具有较高的表面积和吸附能力,广泛应用于吸附剂、催化剂和储能材料等领域。
尽管碳元素的同素异形体具有不同的物理和化学性质,但它们在氧气
中燃烧后的产物都是二氧化碳。
此外,碳元素同素异形体之间也存在一定的转化关系,如在高温高压条件下,石墨可以转化为金刚石。
总之,碳元素的同素异形体具有丰富的物理和化学性质,以及广泛的应用前景。

同位素与同素异形体的定义在化学的世界里,有两个重要的概念:同位素和同素异形体。
这两个概念看似相似,实则有着明显的区别。
接下来,让我们一起深入了解一下它们。
首先,我们来谈谈同位素。
同位素指的是质子数相同而中子数不同的同一元素的不同原子。
这就好比是同一个家族的兄弟姐妹,虽然本质上都是这个家族的成员(具有相同的质子数,即元素种类相同),但在某些方面有所不同(中子数不同)。
比如说,氢元素就有三种同位素,分别是氕(H)、氘(D)和氚(T)。
它们都只有一个质子,但中子数不同,氕没有中子,氘有一个中子,氚有两个中子。
同位素的存在使得同一元素具有了不同的质量数。
同位素在我们的生活和科学研究中有着广泛的应用。
在医学领域,放射性同位素可以用于诊断和治疗疾病。
例如,碘 131 常用于治疗甲状腺疾病。
在考古学中,通过测量碳 14 的含量,可以推断出古生物或者文物的年代。
同素异形体则是指由同种元素组成的不同单质。
这就像是用同样的积木(元素),搭建出了不同的造型(单质)。
最常见的例子就是碳元素的同素异形体,如金刚石、石墨和 C60。
金刚石是自然界中最坚硬的物质之一,它的每个碳原子都与另外四个碳原子以共价键相连,形成了坚固的立体网状结构。
而石墨中的碳原子则是层状排列,层与层之间的结合力较弱,所以石墨质地较软,具有良好的导电性和润滑性。
C60 则是一种由 60 个碳原子组成的足球状分子,具有独特的物理和化学性质。
氧气和臭氧也是同素异形体的例子。
氧气(O₂)是我们呼吸所必需的,而臭氧(O₃)则在大气的臭氧层中起到吸收紫外线、保护地球生物的重要作用。
同素异形体之间的性质差异通常是由于它们的原子排列方式或者分子结构不同所导致的。
这种差异使得它们在物理性质和化学性质上都可能有很大的区别。
总的来说,同位素和同素异形体都是化学中非常重要的概念。
同位素的重点在于同一元素的不同原子,主要差异在中子数;而同素异形体的关键在于同种元素组成的不同单质,差异在于原子的排列方式或分子结构。
同素异形体有哪些
同一元素组成的不同种单质。
元素符号表示相同,分子式可不同,如石墨和金刚石、O2和O3;单质的组成或结构不同;物理性质不同,化学性质相似。
生活中最常见的,有碳的同素异形体:金刚石、石墨、富勒烯、碳纳米管、石墨烯和石墨炔;磷的同素异形体:白磷和红磷;氧的同素异形体:氧气、臭氧、四聚氧和红氧。
同素异形体,是相同元素组成,不同形态的单质.如碳元素就有金刚石、石墨、无定形碳等同素异形体.同素异形体由于结构不同,彼此间物理性质有差异;但由于是同种元素形成的单质,所以化学性质相似.
同素异形体是指由同样的单一化学元素组成,因排列方式不同,而具有不同性质的单质。
同素异形体之间的性质差异主要表现在物理性质上,化学性质上也有着活性的差异。
例如磷的两种同素异形体,红磷和白磷,它们的着火点分别是240和40摄氏度,但是充分燃烧之后的产物都是五氧化二磷;白磷有剧毒,可溶于二硫化碳,红磷无毒,却不溶于二硫化碳。
同素异形体之间在一定条件下可以相互转化,这种转化是一种化学变化。
第1页共1页。