碳有三种同素异形体
- 格式:docx
- 大小:12.53 KB
- 文档页数:1

第三章 元素及其化合物第一节 碳的多样性【学习目标】1.了解碳元素单质及其化合物的制备方法;2. 掌握碳单质及其重要化合物的主要性质及其应用;3.了解二氧化碳对环境的影响;【重点难点】碳单质及其重要化合物的主要性质及其应用【核心考点】考点一、碳的单质及其氧化物 1.多种多样的碳单质:(1)同素异形体:由___________组成的性质不同的几种_____,互称同素异形体。
(2)碳的三种常见同素异形体:(3)碳的化学性质:学习笔记2.碳的氧化物:(1)一氧化碳。
①物理性质:无色无味的气体,难溶于水,有毒。
②化学性质。
a.可燃性:_______________;b.还原性:与Fe2O3反应______________________。
(2)二氧化碳。
①物理性质:无色无味的气体,密度比空气大,可溶于水。
②化学性质③实验室制取原理:CaCO3+2HCl====CaCl2+CO2↑+H2O。
④用途:化工原料、灭火剂。
干冰用作制冷剂、人工降雨。
【思维诊断】1.判断正误(正确的打“√”,错误的打“×”)(1)金刚石和石墨互为同位素。
( )(2)用活性炭除去冰箱异味,发生了化学变化。
()(3)通过水可除去CO中的CO2。
( )(4)通过灼热CuO 除去H 2中的CO 。
( )(5)用CO 2鉴别Na[Al(OH)4]溶液和CH 3COONa 溶液。
( ) (6)实验室中可用石灰石和稀硫酸反应制备CO 2气体。
( )2.(2017·烟台模拟)下列有关碳和碳的化合物的说法中,错误的是 ( ) A. 金刚石和石墨物理性质不同,是因为它们的碳原子排列方式不同 B. 一氧化碳、二氧化碳、葡萄糖都属于有机物 C. 木炭、一氧化碳在一定条件下都能与氧化铜反应 D. 大气中二氧化碳的消耗途径主要是绿色植物的光合作用3.(2017·青岛模拟)海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚:Ca 2++2HCO 3-⇌ CaCO 3↓+H 2O+CO 2↑。

碳的同素异形体同素异形体,是相同元素组成,不同形态的单质。
如碳元素就有金钢石、石墨、无定形碳等同素异形体。
同素异形体由于结构不同,彼此间物理性质有差异;但由于是同种元素形成的单质,所以化学性质相似。
同素异形体的化学性质相似。
例如氧气是没有颜色、没有气味的气体,而臭氧是淡蓝色、有鱼腥味的气体;氧气的沸点-183℃,而臭氧的沸点-111.5℃;氧气比臭氧稳定,没有臭氧的氧化性强等。
一定要是单质.比如氧气和臭氧,一个是O2一个是O3同素异形体金刚石和石墨,都是碳同素异形体之间的转化不一定属于化学变化(例如:单斜硫和斜方硫)。
形成方式有三种:1.组成分子的原子数目不同,例如:氧气O2和臭氧O32.晶格中原子的排列方式不同,例如:金刚石和石墨和C603.晶格中分子排列的方式不同,例如:正交硫和单斜硫4. 还有红磷和白磷性质特点化学性质:相似或略有差异物理性质:差别很大示例碳的同素异形体(1)碳的同素异形体有金刚石、石墨和碳60等富勒烯,它们的不同性质是由微观结构的不同所决定的。
金刚石呈正四面体空间网状立体结构,碳原子之间形成共价键。
当切割或熔化时,需要克服碳原子之间的共价键,金刚石是自然界已经知道的物质中硬度最大的材料,它的熔点高。
上等无暇的金刚石晶莹剔透,折光性好,光彩夺目,是人们喜爱的饰品,也是尖端科技不可缺少的重要材料。
颗粒较小、质量略为低劣的金刚石常用在普通工业方面,如用于制作仪器仪表轴承等精密元件、机械加工、地质钻探等。
钻石在磨、锯、钻、抛光等加工工艺中,是切割石料、金属、陶瓷、玻璃等所不可缺少的;用金刚石钻头代替普通硬质合金钻头,可大大提高钻进速度,降低成本;镶嵌钻石的牙钻是牙科医生得心应手的工具;镶嵌钻石的眼科手术刀的刀口锋利光滑,即使用1000倍的显微镜也看不到一点缺陷,是摘除眼睛内白内障普遍使用的利器。
金刚石在机械、电子、光学、传热、军事、航天航空、医学和化学领域有着广泛的应用前景。
石墨是片层状结构,层内碳原子排列成平面六边形,每个碳原子以三个共价键与其它碳原子结合,同层中的离域电子可以在整层活动,层间碳原子以分子间作用力(范德华力)相结合。

炭素工艺学-炭素工艺学1、如何评价炭材料生产用石油焦的质量?2、什么是煤沥青,煤沥青具有哪些用途?3、什么叫锻烧?炭质原料锻烧的目的是什么?4、影响混捏质量的因素有哪些?5、什么是炭材料的成型?炭材料成型方法有哪几种,它们各适用于哪些制品的成型?6、挤压时影响压力大小的因素有哪些?7、影响挤压生坏质量的因素有哪些,如何提高压型成品率?8、什么是弹性后效〔生坯回胀〕?9、影响弹性后效〔生坯回胀〕的因素有哪些?10、挤压废品类型有哪些,其产生的缘由是什么?11、什么是等静压成型,等静压成型原理是怎样的?12、等静压成型有什么特点和规律?13、什么是焙烧?焙烧的目的是什么?14、什么是二次焙烧,它与一次焙烧有何差异?15、浸渍品经二次焙烧后再进展石墨化的优点是什么?16、焙烧工序废品产生的缘由是什么?17、什么是浸渍,哪些炭材料需要进展浸渍处理?18、为什么要对炭材料进展浸渍处理,浸渍的目的有哪些?19、影响浸渍效果的工艺因素有哪些?20、什么是石墨化和石墨化过程?石墨化的目的是什么?21、什么是石墨单晶、石墨多晶体和石墨微晶?22、什么是易石墨化炭和难石墨化炭?23、高纯石墨化原理是怎样的?24、什么是“内串”石墨化?25、石墨化供电有哪些特点?26、什么是石墨化炉的炉芯,装炉时围炉芯的目的是什么?27、什么是电阻料,其在石墨化过程中起什么作用?28、在石墨化过程中保温料起什么作用,对石墨化保温料有哪些要求?29、碳有三种同素异形体,分别是〔〕〔〕〔〕。
30、石墨按其外观外形分为两种,分别是〔〕〔〕。
31、生产各种炭素制品的主要原料有〔〕〔〕〔〕〔〕等。
32、体密度可以表示材料或制品的宏观组织构造的〔〕,制品的气孔率越大,则体密度〔〕,宏观组织构造越〔〕。
33、碳质材料及其碳和石墨制品样块中的气孔按其外形和位置可分为〔〕〔〕〔〕三种类型。
34、电解槽的残极可分为两大类分别是〔〕〔〕。
35、炭阳极属于少灰制品,其主要原料是〔〕〔〕。

第一节碳的多样性学案【学习目标】1、了解同素异形体的概念,知道碳有三种常见的同素异形体,它们的物理性质差异主要是由于碳原子的排列方式不同引起的。
2、知道含碳化合物种类繁多,一般为无机化合物和有机化合物。
3、认识Na2CO3和NaHCO3的主要性质,初步体会其性质差异。
4、了解碳及其化合物之间的转化和性质,并利用所学知识解释社会生活和自然现象。
体会化学在人类生产生活中的应用。
【学习内容】1.同素异形体的定义是:。
碳元素的同素异形体有:等。
在石墨中,碳原子呈排列,每一层上的碳原子以强的相互作用形成结构。
在金刚石中,碳原子之间以强的相互作用连接,形成结构。
C60分子形似足球,碳原子位于球的表面,呈排列。
不同,决定着碳的各种单质有着不同的性质。
2.含碳化合物可分为和。
含碳无机物中有两种重要的氧化物CO和CO2。
绿色植物通过作用吸收CO2,通过作用将CO2释放到大气中。
由于人类活动经由多途径增加大气中的CO2,使CO2的含量猛增,从而导致效应。
碳的另一氧化物CO在工业上常用做还原剂,高炉炼铁中CO还原Fe2O3的反应方程式:;含碳有机物也可以无机物为原料来合成,1828年,德国化学家用无机物NH4CNO合成出有机物(填化学式)。
3.Na2CO3俗称,是色体,广泛应用于玻璃、造纸等工业;NaHCO3俗称,也是色体,是发酵粉的主要成分之一。
Na2CO3分别与盐酸、澄清石灰水反应的离子方程式为、;NaHCO3分别与盐酸、NaOH溶液反应的离子方程式为、;鉴别Na2CO3和NaHCO3固体常用的方法是。
有关反应的化学方程式为。
4.Na2CO3和NaHCO3相互转化的化学方程式是:NaHCO3→Na2CO3:①②;Na2CO3→NaHCO3:。
5.用化学方程式表示钟乳石、石笋的成因:①②。
6.我们使用的自来水中往往含有碳酸氢钙,因此水壶内壁常含有水垢。
写出形成水垢的主要化学方程式,用食醋浸泡,再用水清洗可除之,写出有关的化学方程式。
炭黑 极细的黑色粉末 含碳物质不完全燃烧制造墨、油墨、油漆、鞋油、颜料等,做橡胶制品的填料知识点2:木炭与活性炭的吸附性木炭和活性炭具有疏松多孔的结构,因此具有吸附能力,可以吸附气体或溶液里的色素。
其中管道越多,跟气体或溶液的接触面积越大,吸附能力越强。
吸附过程属于物理变化过程。
活性炭是木炭经过水蒸气高温处理而得到,因此,活性炭具有更大的表面积,它的吸附能力比木炭还要强,防毒面具里的滤毒罐就是利用活性炭来吸附毒气的,制糖工业中也利用活性炭来脱色以制得白糖 知识点3:单质碳的化学性质1 稳定性:常温下化学性质不活泼。
在常温下,碳的化学性质不活泼。
碳受日光照射或与空气、水分接触,都不容易起变化2 可燃性:单质碳在点燃条件下能与氧气反应,而氧气的量充足与否,会影响产物不同(1) C+O 2−−−→点燃CO 2(空气足量)(2) 2C+O 2−−−→点燃2CO(空气不足量)3 还原性:单质碳在高温下,能与某些氧化物反应 (1)2CuO + C2Cu +CO 2↑注意:①碳单质作还原剂一般需要大量的热,属于吸热反应,因此反应条件一般要写高温②在木炭还原氧化铜实验中,操作时注意试管口要略向下倾斜,配制混合物时木炭粉应稍过量些,目的是防止已经还原的铜被氧气重新氧化.在实验结束时要先撤导管,后撤酒精灯,如果先撤酒精灯会使试管的温度降低,导致试管内的压力突然变小,石灰水会倒流入试管,导致试管炸裂.所以实验完毕,一定要先撤出导气管.(2)3C+2Fe 2O 34Fe+3CO 2↑(3)C+CO 22CO知识点4:氧化反应与还原反应氧化反应:物质与氧发生的反应叫氧化反应还原反应:含氧化合物里的氧被夺去的反应叫做还原反应在反应中供给氧的物质叫做氧化剂,物质供给氧的性质叫做氧化性;得氧的物质叫做还原剂,物质夺取氧的性质叫还原性注意:(1)氧化还原反应存在于同一个反应中,对于一个化学反应,它是氧化反应,就一定是还原反应 (2)氧化剂是指能够供给氧的物质,还原剂是指能够得到氧的物质。

碳元素
要点一:碳单质
碳(carbon)在自然界中存在有三种同素异形体──金刚石、石墨、C60。
金刚石的空间结构
2.石墨
①物理性质:石墨乌黑柔软,是世界上最软
3773K。
石墨的层与层之间是以分子间力结合起来的,因此石墨容易沿着与层平行的方向滑动、裂开。
石墨
石墨的立体结构
1
原理:2233
③将二者配成溶液(等浓度),然后向溶液中分别滴入酚酞,看红色的深浅,较深的是碳酸钠原理:二者溶液皆呈碱性,但Na2CO3的碱性比NaHCO3强
称反应后的固体质量,质量不变的是碳酸钠。
原理:2NaHCO3Na2CO3 + H2O + CO2↑
2
要点三:
1.溶洞的形成原理:
在自然界,溶有二氧化碳的雨水,会使石灰石构成的岩层部分溶解,使碳酸钙转变成可溶性的碳酸氢钙
CaCO3+CO2+H2O=Ca(HCO3)2
当受热或压强突然减小时溶解的碳酸氢钙会分解重新变成碳酸钙沉淀
Ca(HCO3)2==== CaCO3↓+CO2↑+H2O
大自然经过长期和多次的重复上述反应。
从而形成各种奇特壮观的溶洞
2.高炉炼铁的原理:
3.木炭燃烧的过程中发生着碳单质、一氧化碳和二氧化碳之间的转化:
C
①②
③
CO ④CO2
①C+O2 = CO2
②2C+O2 = 2CO
③2CO+O2=2CO2
④CO2+C = 2CO
3。

碳有三种同素异形体,即金刚石、石墨和无定形碳。
无定形碳有炭黑、木炭、焦炭、骨炭、活性炭等。
统称黑碳。
这三种同素异形体的物理性质差别很大。
但在氧气里燃烧后的产物都是二氧化碳。
1.金刚石的晶体结构金刚石是典型的原子晶体,在这种晶体中的基本结构粒子是碳原子。
每个碳原子都以sp3杂化轨道与四个碳原子形成共价单键,键长为1.55×10-10 m,键角为109°28′,构成正四面体。
每个碳原子位于正四面体的中心,周围四个碳原子位于四个顶点上,在空间构成连续的、坚固的骨架结构。
因此,可以把整个晶体看成一个巨大的分子。
由于C—C键的键能大(为347 kJ/mol),价电子都参与了共价键的形成,使得晶体中没有自由电子,所以金刚石是自然界中最坚硬的固体,熔点高达3 550 ℃,并且不导电。
2.石墨的晶体结构石墨晶体是属于混合键型的晶体。
石墨中的碳原子用sp2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形蜂巢状的平面层状结构,而每个碳原子还有一个2p轨道,其中有一个2p电子。
这些p轨道又都互相平行,并垂直于碳原子sp2杂化轨道构成的平面,形成了大π键。
因而这些π电子可以在整个碳原子平面上活动,类似金属键的性质。
而平面结构的层与层之间则依靠分子间作用力(范德华力)结合起来,形成石墨晶体.石墨有金属光泽,在层平面方向有很好的导电性质。
由于层间的分子间作用力弱,因此石墨晶体的层与层之间容易滑动,工业上用石墨作固体润滑剂。
3.无定形碳所谓无定形碳是指其内部结构而言。
实际上它们的内部结构并不是真正的无定形体,而是具有和石墨一样结构的晶体,只是由碳原子六角形环状平面形成的层状结构零乱而不规则,晶体形成有缺陷,而且晶粒微小,含有少量杂质。
无定形碳包括:炭黑木炭焦炭活性炭骨炭糖炭无定形碳跟少量砂子、氧化铁催化剂混合,在约3500℃中加热,使产生的碳蒸气凝聚,可得人造石墨。
文案编辑词条B 添加义项?文案,原指放书的桌子,后来指在桌子上写字的人。

碳的常见同素异形体碳的常见同素异形体概述在化学中,同素异形体是指由相同的原子组成但结构不同的分子。
碳作为化学元素,它有许多的同素异形体。
这些同素异形体对于我们理解物质的性质和反应机制都有着重要的意义。
石墨和金刚石石墨和金刚石是最为常见的两种碳同素异形体。
它们都是由纯碳组成,但它们的结构却完全不同。
石墨是一种层状结构,每个层次由一个六元环和一个五元环组成,这些层次之间通过范德华力相互作用而连接在一起。
这使得石墨具有极好的导电性和润滑性。
金刚石则是一种密堆积结构,每个碳原子都与四个邻近原子形成共价键,并且排列成了一个类似于钻石一样的晶格结构。
这使得金刚石具有极高的硬度和强度。
富勒烯富勒烯是另一种非常特殊的碳同素异形体。
它是由数百个碳原子组成一个类似于足球的球形结构,这个球形结构由许多六元环和五元环组成。
富勒烯具有很多奇特的性质,比如说它具有非常好的导电性和导热性,同时也具有很强的力学强度。
碳纳米管碳纳米管是一种由碳原子组成的管状结构。
它们可以分为单壁碳纳米管和多壁碳纳米管两种。
单壁碳纳米管由一个单层富勒烯卷曲而成,而多壁碳纳米管则是由多个富勒烯套在一起形成的。
碳纳米管具有非常好的电学、光学、力学等性质,并且已经在许多领域得到了广泛应用,比如说材料科学、生物医学、电子技术等。
其他同素异形体除了上述几种常见的同素异形体外,还有许多其他类型的同素异形体。
比如说:1. 碳化硅:由碳和硅原子组成。
2. 碳化氢:由碳和氢原子组成。
3. 碲化物:由碲和碳原子组成。
4. 卡宾:一种含有三重键的中间体分子,由碳和氢原子组成。
总结同素异形体是指由相同的原子组成但结构不同的分子。
碳作为化学元素,它有许多的同素异形体。
这些同素异形体对于我们理解物质的性质和反应机制都有着重要的意义。
常见的碳同素异形体包括石墨、金刚石、富勒烯、碳纳米管等。
除此之外,还有许多其他类型的碳同素异形体,它们在不同领域具有不同的应用价值。


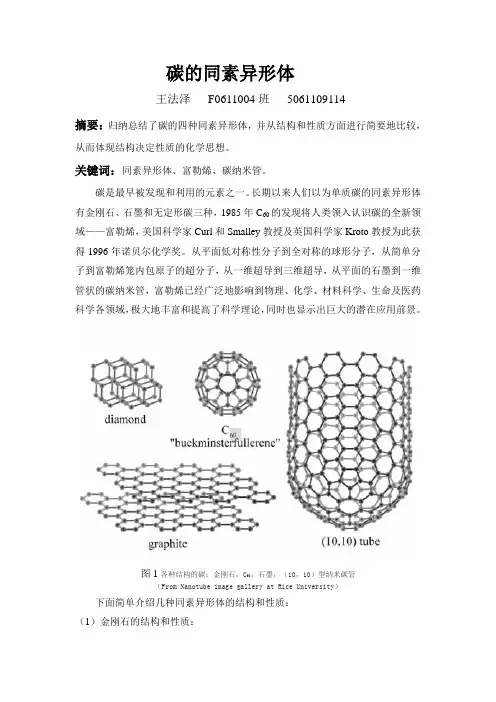
碳的同素异形体王法泽F0611004班5061109114摘要:归纳总结了碳的四种同素异形体,并从结构和性质方面进行简要地比较,从而体现结构决定性质的化学思想。
关键词:同素异形体、富勒烯、碳纳米管。
碳是最早被发现和利用的元素之一。
长期以来人们以为单质碳的同素异形体有金刚石、石墨和无定形碳三种,1985年C60的发现将人类领入认识碳的全新领域——富勒烯,美国科学家Curl和Smalley教授及英国科学家Kroto教授为此获得1996年诺贝尔化学奖。
从平面低对称性分子到全对称的球形分子,从简单分子到富勒烯笼内包原子的超分子,从一维超导到三维超导,从平面的石墨到一维管状的碳纳米管,富勒烯已经广泛地影响到物理、化学、材料科学、生命及医药科学各领域,极大地丰富和提高了科学理论,同时也显示出巨大的潜在应用前景。
图1各种结构的碳:金刚石,C60,石墨,(10,10)型纳米碳管(From Nanotube image gallery at Rice University)下面简单介绍几种同素异形体的结构和性质:(1)金刚石的结构和性质:在金刚石中,C原子以sp3杂化轨道形成四面体的键,每个碳原子均以四个按四面体分布的键与相邻的四个碳原子结合成庞大的分子。
在金刚石中C原子的所有外层电子都参与成键,所以高纯而完整的金刚石晶体是绝缘体。
金刚石的晶体结构除通常见到的立方晶体外还有六方晶体。
由于C—C键贯穿整个晶体,使晶体解离困难,因此金刚石是天然存在最硬的物质。
它的抗压强度高,耐磨性能好,熔点高,而且具有抗腐蚀、抗辐射等优良性能。
(2)石墨的结构和性质:石墨为层型结构,层中每个C原子以sp2杂化轨道与三个相邻的碳原子形成三个等距离的σ键,由此形成C原子的无限平面层。
而各个碳原子垂直于该平面的Pz轨道,彼此相互重叠形成离域π键,使层中C原子间距离变为141.5pm,较C—C单键短,其键级相当于 4/3 。
石墨晶体主要有六方晶系和三方晶系两种对称性。
有关碳的知识
碳(Carbon)是一种非金属元素,化学符号为C,在常温下具有稳定性,不易反应、极低的对人体的毒性,甚至可以以石墨或活性炭的形式安全地摄取,位于元素周期表的第二周期IVA族。
碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳和生物之中。
拉丁语为Carbonium,意为“煤,木炭”。
碳元素结构多样,能够以具有多方面性质的单质形式存在,如晶形碳、无定形碳和过渡碳。
碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。
碳还有多种同素异形体,如金刚石、石墨、石墨烯、富勒烯等,这些同素异形体广泛应用于航空、医疗、石油化工、国防等领域。
碳的同素异形体及其用途碳是一种非常重要的元素,它具有多种同素异形体。
在自然界中,碳最常见的同素异形体就是晶体形态的钻石和石墨。
钻石是一种非常珍贵的宝石,其基本结构是由碳原子通过共价键连接而成的晶体。
钻石具有非常高的硬度和折射率,因此广泛用于首饰和切割工具等领域。
同时,由于钻石优异的导热性能,它还被应用在电子器件散热板、激光器、高压高频器件等方面。
此外,人工合成的钻石,非常适合用于科学研究和工业应用。
石墨是另一种常见的碳同素异形体,其结构是由层状的碳原子通过弱的范德华力相互堆叠而成。
石墨具有良好的导电性和导热性能,因此被广泛应用于电池、润滑剂、石墨电极等领域。
此外,石墨还可以用于制造高强度材料和石墨纤维,在航空航天领域有重要的应用。
除了钻石和石墨,还有一些碳的同素异形体具有特殊的用途。
例如,纳米碳管是由碳原子以螺旋形式组成的结构,具有很高的强度和导电性能。
纳米碳管被广泛应用于纳米电子器件、储能材料、生物传感器等领域,有着广阔的应用前景。
碳纳米颗粒是另一种碳的同素异形体,其尺寸较小,通常在10纳米以下。
碳纳米颗粒具有较大的比表面积和特殊的光学性质,可应用于催化剂、生物医学成像、药物传递和材料强化等领域。
碳化硅是一种由碳和硅组成的陶瓷材料,具有优异的高温稳定性和机械性能。
碳化硅被广泛应用于陶瓷工业、电子器件、高温结构材料等领域,是一种重要的工程材料。
此外,还有一些碳的同素异形体具有特殊的结构和性质,如富勒烯和石墨烯等。
富勒烯是由碳原子以球状结构排列而成的异形体,具有良好的化学活性和光学性质,被广泛应用于催化剂、传感器、生物医学和材料科学等领域。
石墨烯是由单层碳原子以六角形网格形式排列而成的异形体,具有超薄、高强度和优异的导电性能,可用于柔性电子器件、透明导电膜和超级电容器等领域。
总而言之,碳的同素异形体具有丰富的结构和性质,拥有广泛的应用领域。
从钻石和石墨到纳米碳管和石墨烯,碳的同素异形体的研究和应用为各个领域提供了许多新的机会和挑战,有助于推动科学技术的发展和进步。
碳单质同素异形体引言碳是我们生活中非常常见的元素,它存在于各种形态中。
其中最为熟知的要属石墨、金刚石和富勒烯,它们都是碳的同素异形体。
本文将全面地探讨碳的同素异形体。
石墨结构特点石墨是一种层状结构的同素异形体,每个碳原子都和其它三个碳原子形成σ键,构成一个由六角形构成的碳层。
石墨层之间通过范德华力相互作用,层间的结合力较弱。
物理性质1.导电性:石墨具有良好的导电性,因为碳层中存在自由的π电子,可以在层内传导电荷。
2.热稳定性:石墨具有较好的热稳定性,可以在高温下保持结构稳定。
3.机械性能:石墨具有良好的机械性能,具有较高的拉伸强度和刚度。
金刚石结构特点金刚石是一种由碳原子构成的立方晶体结构,每个碳原子与其它四个碳原子形成共价键,构成一个由四面体构成的碳骨架。
金刚石的结构非常坚硬,使其成为自然界中最硬的已知物质。
物理性质1.硬度:金刚石是迄今为止最硬的材料,具有极高的硬度,在矿石加工、切割和磨削等领域具有重要应用。
2.热导性:金刚石具有良好的热导性,可以高效地传导热量。
3.光学性质:金刚石具有良好的光学性质,透明度高,广泛应用于光学器件制造等领域。
富勒烯结构特点富勒烯是由碳原子以球形、管状或碗状等形式排列组成的同素异形体。
最常见的富勒烯结构是C60,即由60个碳原子组成的球状结构,每两个碳原子之间通过共价键相连。
物理性质1.异常稳定性:富勒烯具有较高的化学稳定性,可以在各种环境下稳定存在。
2.导电性:富勒烯具有较好的导电性,具有很高的电子迁移率。
3.光学性质:富勒烯具有丰富的光学性质,广泛应用于光电器件、太阳能电池等领域。
总结碳在不同的结构下表现出截然不同的性质,这就是碳的同素异形体。
石墨具有导电性和机械性能,金刚石具有硬度和热导性,富勒烯则具有异常稳定性和导电性等特点。
这些性质使碳的同素异形体在材料科学、光学、电子学等领域都有广泛的应用。
对碳的同素异形体的深入了解可以帮助我们更好地利用碳这一重要资源。
碳有三种同素异形体,即金刚石、石墨和无定形碳.无定形碳有炭黑、木炭、焦炭、骨炭、活性炭等.统称黑碳.这三种同素异形体的物理性质差别很大.但在氧气里燃烧后的产物都是二氧化碳.
1.金刚石的晶体结构
金刚石是典型的原子晶体,在这种晶体中的基本结构粒子是碳原子.每个碳原子都以sp3杂化轨道与四个碳原子形成共价单键,构成正四面体.每个碳原子位于正四面体的中心,周围四个碳原子位于四个顶点上,在空间构成连续的、坚固的骨架结构.价电子都参与了共价键的形成,使得晶体中没有自由电子,所以金刚石是自然界中最坚硬的固体,熔点高达3 550 ℃,并且不导电.
2.石墨的晶体结构
石墨中的碳原子用sp2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形蜂巢状的平面层状结构,而每个碳原子还有一个2p轨道,其中有一个2p电子.这些p轨道又都互相平行,并垂直于碳原子sp2杂化轨道构成的平面,形成了大π键.因而这些π电子可以在整个碳原子平面上活动,类似金属键的性质.而平面结构的层与层之间则依靠分子间作用力(范德华力)结合起来,形成石墨晶体由于层间的分子间作用力弱,因此石墨晶体的层与层之间容易滑动,工业上用石墨作固体润滑剂.
3.无定形碳
只是由碳原子六角形环状平面形成的层状结构零乱而不规则,晶体形成有缺陷,而且晶粒微小,含有少量杂质.
无定形碳包括:
炭黑木炭焦炭活性炭骨炭糖炭
无定形碳跟少量砂子、氧化铁催化剂混合,在约3500℃中加热,使产生的碳蒸气凝聚,可得人造石墨.。