氯化钠的提纯ppt课件
- 格式:ppt
- 大小:709.00 KB
- 文档页数:33



实验7 氯化钠的提纯一、实验目的1.学习提纯食盐的原理和方法及有关离子的鉴定;2.掌握溶解、过滤、蒸发、浓缩、结晶、干燥等基本操作。
二、实验原理粗食盐中的不溶性杂质(如泥沙等)可通过溶解和过滤的方法除去。
粗食盐中的可溶性杂质主要是Ca2+、Mg2+、K+和2SO-离子等,选择适当的试剂使它4们生成难溶化合物的沉淀而被除去。
SO-:(1)在粗盐溶液中加入过量的BaCl2溶液,除去24Ba2+ +2SO-===BaSO4↓4过滤,除去难溶化合物和BaSO4沉淀。
SO-时加(2)在滤液中加入NaOH和Na2CO3溶液,除去Mg2+, Ca2+ 和沉淀24入的过量Ba2+:Mg2+ + 2OH-===Mg(OH)2↓Ca2+ + 2CO-===CaCO3↓3Ba2+ + 2CO-===BaCO3↓3过滤除去沉淀。
(3)溶液中过量的NaOH和Na2CO3可以用盐酸中和除去。
(4)粗盐中的K+ 和上述的沉淀剂都不起作用。
由于KCl的溶解度大于NaCl 的溶解度,且含量较少,因此在蒸发和浓缩过程中,NaCl先结晶出来,而KCl 则留在溶液中。
三、实验仪器与试剂台秤,烧杯,量筒,普通漏斗,漏斗架,布氏漏斗,吸滤瓶,蒸发皿,石棉网,酒精灯,药匙。
粗食盐,HCl(6mol·L-1),HAc(6mol·L-1),NaOH(6mol·L-1),BaCl2(6mol·L-1),Na2CO3(饱和),(NH4)2C2O4(饱和),镁试剂,滤纸,pH试纸。
四、实验步骤1.粗食盐的提纯①在台秤上称取8.0g粗食盐,放在100mL烧杯中,加入30mL水,搅拌并加热使其溶解。
至溶液沸腾时,在搅拌下逐滴加入1 mol·L-1 BaCl2溶液至沉淀完全(约2mL)。
继续加热5min,使BaSO4的颗粒长大而易于沉淀和过滤。
为了试验沉淀是否完全,可将烧杯从石棉网上取下,待沉淀下降后,取少量上层清液于试管中,滴加几滴6mol·L-1HCl,再加几滴1mol·L-1BaCl2检验。
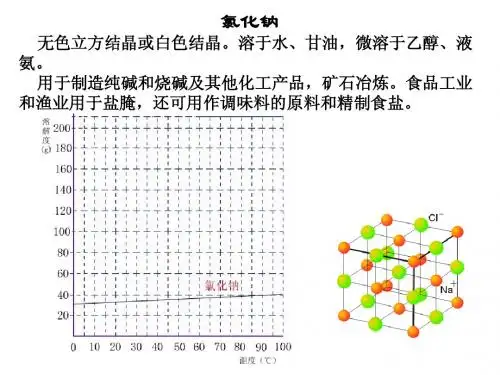

氯化钠的提纯氯化钠的提纯试验目的1.学会用化学方法提纯粗食盐。
2.娴熟台秤和煤气灯的使用。
3.娴熟常压过滤,减压过滤,蒸发浓缩,结晶和干燥等基本操作。
试验原理粗盐中含有泥砂等不溶性杂质及可溶于水的K+、Ca2+、Mg2+和SO42—等离子。
将粗盐溶于水后,用过滤的方法可以除去不溶性杂质。
Ca2+、Mg2+、SO42—等离子需要用化学方法除去。
有关的化学式如下:SO42—(aq)+Ba2+(aq)=BaSO4(s)Ca2+(aq)+CO32—(aq)=CaCO3(s)Ba2+(aq)+CO32—(aq)=BaCO3(s)2Mg2+(aq)+CO32—(aq)+2OH—(aq)=Mg(OH)2·MgCO3(s)仪器、药品及材料仪器:台秤,烧杯(250mL),一般漏斗,布氏漏斗,吸滤瓶,蒸发皿,量筒(10mL,50mL),泥三角,坩埚钳药品:粗食盐,Na2CO3(1.0mol·L—1),NaOH(2.0mol·L—1),(NH4)2C2O4(0.5mol·L—1),HCl(2.0mol·L—1),BaCl2(1.0mol·L—1),镁试剂材料:pH试纸,滤纸试验内容1.粗盐的提纯(1)粗盐的溶解在台秤上称量8.0g粗食盐,放入250mL烧杯中,加30mL去离子水。
加热、搅拌使粗盐溶解。
(2)SO42—离子的除去在煮沸的食盐溶液中,边搅拌边逐滴加入1.0mol·L—1BaCl2溶液(约2mL)。
为了检验沉淀是否完全,可将煤气灯移开,待沉淀下降后,在上层清液中加入1~2滴BaCl2溶液,察看是否有浑浊现象,如无浑浊,说明SO42—已沉淀完全,否则要连续加入BaCl2溶液,直到沉淀完全为止。
然后小火加热5分钟,以使沉淀颗粒长大而便于过滤。
常压过滤,保留溶液,弃去沉淀。
(3)Ca2+、Mg2+、Ba2+等离子的除去滤液中加入2.0mol·L—1NaOH溶液1mL和1.0mol·L—1Na2CO3溶液3mL,加热至沸。

氯化钠的提纯氯化钠的提纯实验目的1.学会用化学方法提纯粗食盐,同时为进一步精制成试剂级纯度的氯化钠提供原料。
2.练习台秤的使用以及加热、溶解、常压过滤、减压过滤、蒸发浓缩、结晶、干燥等基本操作。
3.学习食盐中Ca 2+,Mg 2+, SO 42-的定性检验方法。
实验原理粗食盐中含有泥沙等不溶性杂质及Ca 2+,Mg 2+, K +,SO 42-等可溶性杂质。
将粗食盐溶于水后,用过滤的方法可以除去不溶性杂质。
Ca 2+,Mg 2+, SO 42-等离子可以通过化学方法——加沉淀剂使之转化为难溶沉淀物,再过滤除去。
K + 等其它可溶性杂质含量少,蒸发浓缩后不结晶,仍留在母液中。
有关的离子反应方程式如下:Ba 2++SO 42- ═ BaSO 4(s ) Mg 2++2OH - ═ Mg (OH )2(s ) Ca 2++CO 32- ═ CaCO 3(s ) Ba 2++CO 32- ═ BaCO 3(s )仪器、药品及材料仪器:台秤,烧杯(100ml )2个,普通漏斗,漏斗架,布氏漏斗,吸滤瓶,真空泵,蒸发皿,量筒(10ml 1个,50ml 1个),泥三角,石棉网,三角架,坩埚钳,酒精灯。
药品:HCl 溶液(2 mol ·L -1),NaOH (2 mol ·L -1),BaCL 2(1 mol ·L -1),NaCO 3(1 mol ·L -1),(NH 4)2C 2O 4(0.5 mol ·L -1),粗食盐,镁试剂。
材料:PH 试纸,滤纸。
实验步骤1.粗食盐的提纯(1)粗食盐的称量和溶解在台秤上称取8g 粗食盐,放入100ml 烧杯中,加入30ml 水,加热、搅拌使食盐溶解。
(2)SO 42-离子的除去在煮沸的食盐水溶液中,边搅拌边逐滴加入1 mol ·L -1 BaCL 2溶液(约1ml )。
为检验SO 42-离子是否沉淀完全,可将酒精灯移开,待沉淀下沉后,再在上层清液中滴入1~2滴BaCL 2溶液,观察溶液是否有浑浊现象。




氯化钠的提纯欧阳歌谷(2021.02.01)一、目的与要求(1) 掌握提纯NaCl的原理和方法。
(2) 练习溶解、沉淀、常压过滤、减压过滤、蒸发浓缩、结晶和干燥等基本操作。
(3) 了解盐类溶解度的知识在无机物中的应用和沉淀平衡原理的应用。
(4) 学习在分离提纯物质过程中,定性检验某种物质是否已除去的方法。
二、实验原理化学试剂或医药用的NaCl都是以粗食盐为原料提纯的。
粗食盐中含有泥沙等不溶性杂质及K+、Ca2+、Mg2+、SO42- 等可溶性杂质。
将粗食盐溶于水后,用过滤的方法可以除去不溶性杂质。
Ca2+、Mg2+、SO42-等离子需要用化学方法才能除去,通常是选择适当的沉淀剂,例如Ca(OH)2、BaCl2、Na2CO3等使钙、镁、硫酸根等离子生成难溶物沉淀下来而除去。
因为NaCl的溶解度随温度的变化不大,不能用重结晶的方法纯化。
一般先在食盐溶液中加入稍过量的BaCl2溶液,溶液中的SO42- 便转化为难溶的BaSO4沉淀而除去。
过滤掉BaSO4沉淀之后的溶液,再加入NaOH和Na2CO3溶液,使Ca2+、Mg2+及过量的Ba2+生成沉淀。
有关的离子方程式如下:SO42 +Ba2+== BaSO4 ↓Ca2+ +CO32-== CaCO3 ↓Ba2+ +CO32- == BaCO3 ↓2 Mg2++2OH- +CO32- == Mg2(OH)2CO3↓过量的Na2CO3溶液用HCl将溶液调至微酸性以中和OH-和破坏CO32- 。
OH- +H+== H2OCO32-+2H+== CO2↑ +H2O粗粗食盐中的钾离子和这些沉淀剂不起作用,仍留在溶液中。
但由于KCl溶解度比NaCl大,而且在粗食盐中含量少,在最后的浓缩结晶过程中,绝大部分仍留在母液中而与氯化钠分离,从而达到提纯的目的。
三、仪器与药品台秤,温度计,循环水泵,吸滤瓶,布氏漏斗,普通漏斗,烧杯,蒸发皿,滤纸,pH试纸;粗食盐(工业),HCl (2.0mol·L-1,6.0mol·L-1),NaOH (2.0mol·L-1),BaCl2 (1.0mol·L),Na2CO3(1.0mol·L-1),(NH4)2C2O4(饱和),镁试剂[1](对硝基偶氮间苯二酚),钴亚硝酸钠Na3[Co(NO2)6] (1.0mol·L-1)。
