- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
素养提升
[归纳总结]
1.元素性质的递变规律
原子结构或性质
核外电子的排布
电子层数 最外层电子数
金属性和非金属性
金属性 非金属性
原子半径
单质的氧化性和还原性
氧化性 还原性
同一周期(从左到右) 同一主族(从上到下)
相同
增加
1→2(或8)
相同
减弱
增强
增强
减弱
减小
增大
增强
减弱
减弱
增强
素养提升
原子结构或性质 最高价氧化物对应的 酸性
[解析] 由于第一、二层电子排 布不出现能级交错,由题意可知 A原子的L层已填满,共有8个电 子,可得A的M层上有14个电子, 则A的第三层电子排布为
a的最外层电子排布图为
3s23p63d6,即可得A的核外电子
。
排布式为1s22s22p63s23p63d64s2,
素养提升
例1 某元素A原子的L层比M层少6个电子,它有两种常见的阳离子a和b(其中a的化合价
素养提升
(3)下列对t;A d b.第一电离能:E>D>C>B c.电负性:A>H>G d.最高价氧化物对应的水化物的酸性:B>A>H>G
素养提升 (4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述 不正确的是 b 。 a.L位于元素周c期表中第五周期第ⅠA族, 属于s区元素 b.O位于元素周期表中第七周期第Ⅷ族, 属于ds区元素 c.M的外围电子排布式为6s1,属于ds区元素 d.H所在族的外围电子排布式为ns2np2,属于p区元素
2.原子轨道能量高低规律 (1)同能层:ns<np<nd<nf。 (2)形状相同的原子轨道:1s<2s<3s<4s,2p<3p<4p。 (3)同能级形状相同的原子轨道:2px=2py=2pz。 (4)第六及以上电子层的亚层轨道:ns<(n-2)f<(n-1)d<np。 3.基态原子的核外电子排布规律 (1)能量最低原理 电子在核外的分布,应使该原子体系的能量处于最低状态,即遵循构造原理。
素养提升
(2)泡利原理 一个原子轨道中最多只能容纳两个电子,并且这两个电子的自旋状态必须相反。 (3)洪特规则 当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一 个轨道,而且自旋状态相同。注意洪特规则特例:处于能量相同的原子轨道的 全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空(p0、d0、f0)状态时,具有较低 的能量和较大的稳定性。如Cr的电子排布式为[Ar]3d54s1,Cu的电子排布式为 [Ar]3d104s1。
a的最外层电子排布图为
规则,a的3d轨道处于半充满状
。
态,a比b稳定。
素养提升
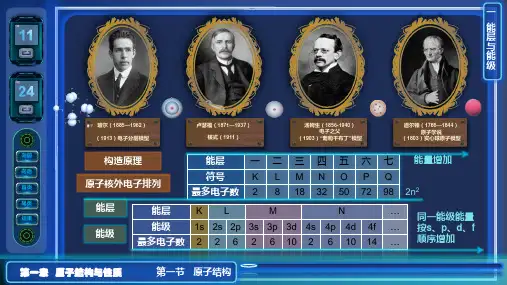
[归纳总结] 能层、能级和原子轨道的关系
1.数量关系 能层(电子层) 能级(原子轨道) 原子轨道数目 可容纳电子数
1
1s
1
2
2
2s,2p
4
8
3
3s,3p,3d
9
18
4
4s,4p,4d,4f
16
32
n
—
n2
2n2
素养提升
素养提升
(2)写出基态时Q元素原子的电子排布式: 1s22s22p63s23p63d104s24p1 。J元素
原子的外围电子排布式: 3d64s 。
2
[解析] Q元素为镓元素,其基
态原子的电子排布式为1s22s2
2p63s23p63d104s24p1;J元素为铁
元素,其外围电子排布式为3d6
4s2。
大于b的化合价)。则:
即A为Fe原子,其两种阳离子为
(1)a的M层比N层多 1 个电子;b的L层比M层少
6 个电子。a的稳定3 性 大 (填“大于”或“小
于”)b的稳定性。
于
Fe3+和Fe2+,阳离子a的电子排布 式为1s22s22p63s23p63d5,阳离子b 的电子排布式为
(2)写出A的电子排布式: 1s22s22p63s23p63d64s2 ; 1s22s22p63s23p63d6,再根据洪特
素养提升
②判断化学键的类型:如果两个成键元素原子间的电负性差值大于1.7,它们 之间通常形成离子键;如果两个成键元素原子间的电负性差值小于1.7,它们 之间通常形成共价键。 ③判断元素价态正负:电负性数值大小与元素原子得失电子能力的关系为 电负性越大的元素越容易得到电子,电负性越小的元素越容易失去电子,即 电负性大的元素显负价,电负性小的元素显正价。
水化物的酸碱性 碱性 气态氢化物的稳定性
同一周期(从左到右) 增强 减弱 增强
(续表) 同一主族(从上到下)
减弱 增强 减弱
第一电离能
增大(但ⅡA族>ⅢA族,ⅤA族>ⅥA族)
减小
电负性
变大
变小
素养提升
2.元素性质递变规律的应用 (1)元素第一电离能的应用 ①用来比较元素的金属性的强弱:I1越小,金属性越强。 ②验证原子核外电子分层排布。 (2)元素的电负性应用 ①判断元素的类型:金属的电负性一般小于1.8,非金属的电负性一般大于1.8, 而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它 们既有金属性又有非金属性。
素养提升 探究点二 元素周期表中元素性质的递变规律及应用 例2 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
[解析] 根据元素周期表的结构 和I的位置,确定I为第四周期第 ⅥB族元素,所以该元素的最高 化合价为+6价,K为铜元素。
试回答下列问题: (1)I的最高化合价为 +6 ,K的元素名称为 铜 。
自我检测
1.下列关于价电子排布为3s23p4的元素的描述正确的是( B ) A.它的元素符号为O B.它的核外电子排布式为1s22s22p63s23p4 C.它的氢化物的电子式为
D.其电子排布图为
自我检测
2.XY是由电负性相差最大的两种主族元素所形成的化合物(放射性元素除 外),下列有关XY及其组成元素的说法中不正确的是( A ) A.X元素的第一电离能远大于其第二电离能 B.Y元素的单质中含有共价键 C.Y元素位于元素周期表的右上角 D.XY一定是离子化合物
本章素养提升
知识网络
素养提升
探究点一 能层、能级和原子轨道的关系
例1 某元素A原子的L层比M层少6个电子,它有两种常见的阳离子a和b(其中a的化合价
大于b的化合价)。则:
(1)a的M层比N层多 1 个电子;b的L层比M层少
6 个电子。a的稳定3 性 大 (填“大于”或“小
于”)b的稳定性。
于
(2)写出A的电子排布式: 1s22s22p63s23p63d64s2 ;