简析使用血球计数板对酵母菌进行计数的若干问题
- 格式:doc
- 大小:91.00 KB
- 文档页数:4


关于血球计数板的使用及问题讨论《培养液中酵母菌种群数量的动态变化》是新课标教材“必修3:稳态与环境”中的学生分组实验,该实验通过探究培养液中酵母菌种群数量的变化,尝试建构种群增长的数学模型并用数学模型解释种群数量的变化,说明制约种群个体数量变化的种群外部环境因素和种群内部因素。
在该实验中,需要测定酵母菌细胞数量。
测定细胞数目的方法有显微镜直接计数法、平板菌落计数法、光电比浊法等,教材采用的是较为简便、快速、直观的显微镜直接计数法。
因此,学会使用血球计数板进行准确计数,是该实验成功与否的关键。
虽然不同版本的教材推荐使用的血球计数板的规格不同,人教版建议使用2mm×2mm×0.1mm方格,苏教版推荐使用1mm×1mm×0.1mm方格,但是血球计数板的使用原理和方法是相同的。
笔者通过近年来对该实验的摸索,对血球计数板的使用和命题方面存在的一些问题进行了分析总结。
一、血球计数板的使用原理显微镜直接计数法是将小量待测样品的悬浮液置于一种特别的具有确定面积和容积的载玻片上(又称计菌器),于显微镜下直接计数,然后推算出含菌数的一种方法。
血球计数板是常用的计菌器之一。
血球计数板是一种专门用于计算较大单细胞微生物的一种仪器,由一块比普通载玻片厚的特制玻片制成的玻片中有四条下凹的槽,构成三个平台。
中间的平台较宽,其中间又被一短横槽隔为两半,每半边上面刻有一个方格网。
方格网上刻有9个大方格,其中只有中间的一个大方格为计数室。
这一大方格的长和宽各为1mm,深度为0.1mm,其容积为0.1mm3,即1mm×1mm×0.1mm方格的计数板;大方格的长和宽各2mm,深度为0.1mm,其容积为0.4mm3,即2mm×2mm×0.1mm方格的计数板。
在血球计数板上,刻有一些符号和数字(见图一),其含义是:XB-K-25为计数板的型号和规格,表示此计数板分25个中格;0.1mm为盖上盖玻片后计数室的高;1/400mm2表示计数室面积是1mm2,分400个小格,每小格面积是1/400 mm2。
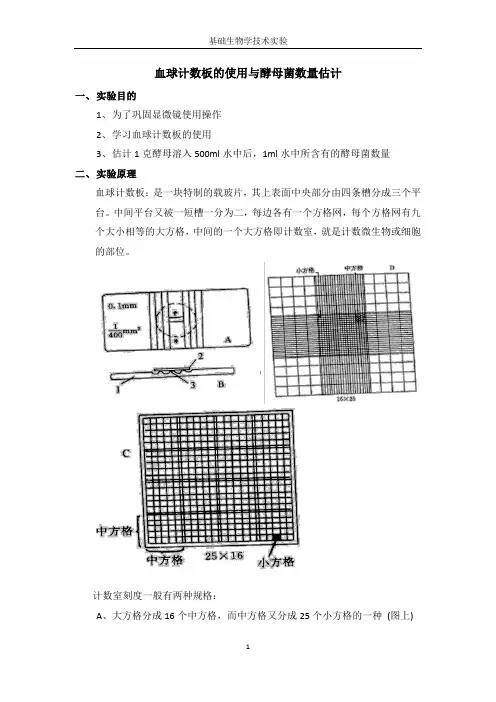
血球计数板的使用与酵母菌数量估计一、实验目的1、为了巩固显微镜使用操作2、学习血球计数板的使用3、估计1克酵母溶入500ml水中后,1ml水中所含有的酵母菌数量二、实验原理血球计数板:是一块特制的载玻片,其上表面中央部分由四条槽分成三个平台。
中间平台又被一短槽一分为二,每边各有一个方格网,每个方格网有九个大小相等的大方格,中间的一个大方格即计数室,就是计数微生物或细胞的部位。
计数室刻度一般有两种规格:A、大方格分成16个中方格,而中方格又分成25个小方格的一种(图上)B、大方格分成25个中方格,而中方格又分成16个小方格的一种(图上)。
但两种规格的计数板均有400个(16×25 或25×16)小方格。
计数室容积一定,将待测标本的均匀悬液放在计数室中并在显微镜下计数,就可算出单位体积内的微生物总数目。
计数室容积为1×1×0.1=0.1mm3=10-4ml计数公式:1ml悬液中的微生物总数(个) = A×B×n×104A为每个中方格中的微生物数平均值,B为稀释倍数,n为每大方格中的中方格数。
三、实验器材1台显微镜、1块血球计数板、500ml的酵母菌溶液、滴管、盖玻片数块、吸水纸。
四、实验步骤(1)称取1克酵母加入500ml的水中,配制成酵母菌使溶液。
(2)镜检、加样前,先要检查计数室内有无污物,若有则需清洗后烘干使用。
(3)加样、血球计数板上盖上清洁干燥的盖玻片,用无菌的细口滴管将稀释的微生物悬液从盖玻片边缘滴一小滴(不宜过多)。
这样通过毛细渗透作用液体可沿缝隙进入计数室,注意要使计数室中不产生气泡并且充盈稀释液。
(4)计数、将计数板置于载物台上静置5分钟左右,先用低倍镜找到计数室,然后换上高倍物镜。
分别计数任意5个中方格内的微生物数(最好选4个角和中央的方格)。
位于格线上的菌体或微生物一般只数上线和右线上的或下线和左线上的。
要计数两个计数室求平均值。



关于酵母菌的计数若干问题解析关于酵母菌的计数若干问题解析酵母菌的计数是近几次高频考点,血细胞计数板的规格和计数方式始终是个难点,需要进行总结。
有的学生担心教材中提到的计数计算,其实,需要搞清楚血细胞计数板的原理。
利用血细胞计数板在显微镜下直接计数,是一种常用的微生物计数法,计得的是活菌体和死菌体的总和。
计数的操作步骤关于计数室每个计数室分为九个大方格,每个大方格有2mm×2mm×0.1mm 或1mm×1mm×0.1mm,浙科版默认第一种,共有400小格。
中央的大方格用于酵母菌的计数。
两种规格的血细胞计数板大方格、中方格和小方格典例解析试题1:将获得的肿瘤细胞培养液稀释100倍后,用血细胞计数板(规格为2mm×2mm×0.1mm)计数,观察到的计数室中细胞分布如图。
问题:培养液中肿瘤细胞的密度是个/mL。
答案:3.6×107解析:通过统计四个角上的总肿瘤细胞数为9+9+10+8=36个(统计按照教材上的要求),计算出大方格的总数为36×4=144个,144/0.4mm3×103mL×100倍=3.6×107个。
(个人认为,此题的肿瘤细胞数目偏少,值得商榷)例题2:酵母菌的计数通常用血球计数板进行,血球计数板每个大方格容积为0.1mm3,由400个小方格组成。
现对某一样液进行检测,如果一个小方格内酵母菌过多,难以计数,应先后再计数。
若多次重复计数后,算得每个小方格中平均有5个酵母菌,则10mL该培养液中酵母菌总数有个。
答案:稀释 2×108(5×400/0.1mm3×103×10mL)计数的操作1.稀释:将酵母菌培养液进行适当的稀释;若菌液不浓,可不必稀释。
2.镜检计数室:在加样前,先对计数板的计数室进行镜检。
若有污物,则需清洗后才能进行计数。
3.加样品:在清洁干燥的血细胞计数板盖上盖玻片,再用无菌细口滴管将稀释的酵母菌液由盖玻片边缘滴入一小滴(将计数室充满即可),让菌液沿缝隙自行渗入计数室。

简析“使用血球计数板对酵母菌进行计数”的若干问题乔静如何正确使用血球计数板对酵母菌种群数量进行计数,是近年来的高考题或模拟题中多次出现相关的试题,而且不仅从如何计算酵母的数量的角度来考查学生,还从操作方法或操作过程中出现的一些问题以及处理方法来考查学生。
而教师在遇到这些问题往往让学生记答案,学生对这些问题仍是感到疑惑。
笔者在近年来的教学实践中,将教师和学生在做该实验和相关命题遇到的一些问题,进行了分析探讨。
1 血球计数板的构造和计数原理虽然不同版本的教材推荐使用的血球计数板的规格不同,人教版建议使用2mmx2mmx0.1mm方格,苏教版推荐使用1mmx1mmx0.1mm方格,但是血球计数板的使用原理和方法是相同的。
以下以1mmx1mmx0.1mm方格的计数板为例分析结构和计数原理。
每个血球计数板上有两个计数室(图1)。
血球计数板上的符号和数字(图1)的含义是:XB-K-25为计数板的型号和规格,表示此计数板中计数室分25个中格;0.1mm 为盖上盖玻片后计数室的高;1/400mm2表示计数室面积是1mm2(计数室边长1mm),分400个小格,每小格面积是1/400mm2(图2),9个大方格中只有中间的有小方格的中央大方格才是计数室。
不要认为9个大方格都是计数室。
计数室通常也有两种规格:一种是16x25型,即大方格内分为16中格,每一中格又分为25小格(图2);另一种是25x16型,即大方格内分为25中格,每一中格又分为16小格。
但是不管计数室是哪一种构造,它们都有一个共同的特点,即每一大方格都是由16x25=25x16=400个小方格组成。
计数时,若计数室是由16个中方格组成,数左上、左下、右上、右下的4个中方格(即100个小方格)的菌数。
如果是由25个中方格组成的计数室,除数上述4个中方格外,还需数中央1个中方格(即80个小格方)的菌数(图3)。
计数时对压在中格四条线上的细胞只计数相邻两边及其夹角上的细胞(一般选左边和上边的线)。

取少量酵母菌液放入血球计数板直接计数,测得的数目是()A、活细胞数B、死细胞数
C、菌落数
D、细胞总数
考点:探究培养液中酵母种群数量的动态变化
专题:
分析:探究培养液中酵母菌种群数量的动态变化实验的原理:
(1)酵母菌可以用液体培养基来培养,培养液中的酵母菌种群的增长情况与培养液中的成分、空间、pH、温度等因素有关,我们可以根据培养液中的酵母菌数量和时间为坐标轴做曲线,从而掌握酵母菌种群数量的变化情况.
(2)利用血球计数板在显微镜下直接计数是一种常用的细胞计数法,这种方法可以直接测定样品中全部的细胞数目,所以一般用于单细胞微生物数量的测定,由于血球计数板上的计数室盖上盖玻片后的容积是一定的,所以可根据在显微镜下观察到的细胞数目来计算单位体积的细胞的总数目.
解答:解:酵母菌液放入血球计数板直接计数,测得的数目是细胞总数,包括死细胞和活细胞.
故选:D.
点评:本题考查了培养液中酵母菌种群数量的变化计数的相关知识,意在考查考生的识记能力和理解所学知识要点,把握知识间内在联系的能力;能运用所学知识,对生物学问题作出准确的判断.。

实验九酵母菌的计数一、实验目的1. 了解酵母菌计数的方法和步骤。
2. 练习从样品中筛选出有效的酵母。
3. 熟练掌握血球计数板的使用方法和计算准确菌落数的技巧。
二、实验原理酵母比细菌大,通常直径在3-5um左右。
因此,酵母计数需要使用高倍显微镜和血球计数板。
血球计数板具有网格状的结构,格子大小为1mm x 1mm,每个格子被分成16个小方格,靠着板子底部的深度为0.1mm。
在这样的板子上,可以计算出每个小方格中的数量,进而计算出酵母菌落数。
三、实验步骤1. 酵母菌培养液制备取一小瓶酵母菌液(1ml/瓶)和50ml的培养基置于培养瓶中,摇晃好进行稀释。
2. 稀释酵母菌液使用吸管和15ml的试管来进行酵母菌液的稀释。
取出大约0.5ml的酵母菌液放入试管中,使用吸管加入5ml的无菌蒸馏水,进行混合。
将10倍的稀释液取出0.5ml,进行第二次稀释。
3. 取样取出10ul的酵母稀释液,加入到血球计数板的中心宫格中。
重复三次。
4. 计数使用高倍显微镜(400×)观察血球计数板,并手动计算每个格子中的酵母菌数量。
计算方法:(每个小方格中酵母菌总数÷ 16) x 10^45. 数据分析计算出平均酵母菌浓度,将结果用来评估样品中酵母菌的含量。
四、实验注意事项1. 所有实验用品都需要在自然环境下进行消毒,并最好使用自动消毒器。
2. 使用高倍显微镜时,需要避免透过培养液的气泡和混沌,以获得清晰的图像。
3. 在计算酵母菌浓度时,需要始终保持准确的记录,并进行计算。
出现微小误差可能会有较大的影响。
4. 进行实验时需要着实考虑消除外因因素。
五、实验数据处理与分析在实验中,首先需要从样品中筛选出有效的酵母,并进行稀释。
稀释后的酵母菌液,需要使用吸管加入到试管中,并定期混合。
取10ul的酵母稀释液,加入到血球计数板的中心宫格中(使用不同液体的试管不同),所得数据如下表:| 每个小方格中的酵母菌数量 ||----------|--------------|| 1 | 9 || 2 | 12 || 3 | 15 || 4 | 13 || 5 | 11 || 6 | 16 || 7 | 12 || 8 | 14 || 9 | 10 || 10 | 12 || 11 | 10 || 12 | 11 || 13 | 9 || 14 | 8 || 15 | 16 || 16 | 18 ||----------|--------------|平均酵母菌浓度:(每个小方格中酵母菌总数÷ 16)X10^4 = (154÷16) X 10^4 = 9.63 X 10^4/ml。

血球计数板使用方法
血球计数板介绍
使用方法
1.视待测菌悬液浓度,加无菌水适当稀释(斜面通常稀释100倍),以每小格的菌数可数为度。
5.计数时若计数区是由16个大方格构成,按对角线方位,数左上、左下、右上、右下的4个大方格(即100小格)的菌数。
假如是25个大方格构成的
计数区,除数上述四个大方格外,还需数中央1个大方格的菌数(即80个小格)。
为了保证计数的准确性,避免重复计数与漏记,在计数时,对沉降在格线上的细胞的统计应有统一的规定。
如菌体位于大方格的双线上,计数时则数上线不数下线,数左线不数右线,以减少误差。
即位于本格上线与左线上的细胞计入本格,本格的下线与右线上的细胞按规定计入相应的格中。
见右图:即本格中计数细胞为3个。
7.测数完毕,取下盖玻片,用水将血球计数板冲洗干净,切勿用硬物洗刷或者抹擦,以免损坏网格刻度。
洗净后自行晾干或者用吹风机吹干,放入盒内储存。
计数公式
细胞数/ml=100小格内细胞个数/100×400×10000×稀释倍数
1、25格×16格的血球计数板计算公式:
细胞数/ml=80小格内细胞个数/80×400×10000×稀释倍数
例1:用血球计数板对培养液中酵母菌进行计数,若计数室为1mm ×1mm×0.1mm方格,由400个小方格构成,假如一个小方格内酵母菌过多,难以计数,应先稀释后再计数。
若多次重复计数后,算得每个小方格中平均有5个酵母菌,则10mL该培养液中酵母菌总数有 5×400×10000×10=2×108 个。

关于“使用血球计数板对酵母菌进行计数”的问题探讨作者:丁傅来源:《中学生物学》2012年第11期摘要:“培养液中酵母菌种群数量的动态变化”是新课标教材“必修3:稳态与环境”中的学生分组实验,需要学生学会使用血球计数板进行准确计数酵母。
通过结合“培养液中酵母菌种群数量的动态变化”这一实验和有关血球计数板的命题的分析,对血球计数板的计数原理和操作方法中遇到一些问题进行探讨。
关键词:血球计数板生物学实验实验操作中图分类号:G633.91文献标识码:B在人教版高中生物教材中,“探究培养液中酵母菌种群数量变化”只作了基本的原则性指导,对一些操作过程的细节,没有作细化阐述,而这些细节都是实验成功的关键所在。
如何正确使用血球计数板对酵母菌种群数量进行计数,是本实验的重点和难点。
根据中学实验条件,用显微镜直接计数法相对容易,只要指导学生掌握血球计数板的正确使用便可。
但学生对血球计数板结构的认识不够明确,教师也讲解不清晰。
而在近年来的高考题或模拟题中多次出现相关的试题,而且不仅从如何计算酵母的数量的角度来考查学生,还从操作方法或操作过程中出现的一些问题以及处理方法来考查学生。
而教师在遇到这些问题往往让学生记答案,学生对这些问题仍是感到疑惑。
笔者在近年来的教学实践中,将教师和学生在做该实验和相关命题遇到的一些问题,进行了分析探讨。
1 血球计数板的构造和计数原理虽然不同版本的教材推荐使用的血球计数板的规格不同,人教版建议使用2mmx2mmx0.1mm方格,苏教版推荐使用1mmx1mmx0.1mm方格,但是血球计数板的使用原理和方法是相同的。
以下以1mmx1mmx0.1mm方格的计数板为例分析结构和计数原理。
每个血球计数板上有两个计数室(图1)。
血球计数板上的符号和数字(图1)的含义是:XB-K-25为计数板的型号和规格,表示此计数板中计数室分25个中格;0.1mm为盖上盖玻片后计数室的高;1/400mm2表示计数室面积是1mm2(计数室边长1mm),分400个小格,每小格面积是1/400mm2(图2),9个大方格中只有中间的有小方格的中央大方格才是计数室。
实验六酵母菌细胞总数的测定实验六酵母菌细胞总数的测定一、实验目的通过实验掌握酵母菌细胞总数的测定方法,了解酵母菌在发酵过程中的生长繁殖情况。
二、实验原理酵母菌是一种单细胞真菌,在适宜的条件下可以迅速生长繁殖。
通过测定酵母菌细胞的总数,可以了解其在发酵过程中的生长情况。
本实验采用血球计数板法进行酵母菌细胞总数的测定。
三、实验步骤1.准备实验材料:血球计数板、显微镜、酵母菌培养液、无菌棉签、离心管、离心机、滴管等。
2.将酵母菌培养液在离心机中离心10分钟,转速为1000转/分钟,弃去上清液,留下沉淀物。
3.用无菌棉签轻轻地将沉淀物涂抹在血球计数板的计数室底部,注意不要将沉淀物压破。
4.将血球计数板放置在显微镜下,找到计数室所在的位置,观察并计数酵母菌细胞的数量。
每个大方格内含有16个小方格,每个小方格内含有16个网格,每个网格内含有16个红细胞和白细胞或霉菌菌落等。
5.统计所有网格内的酵母菌细胞数量,并计算每毫升发酵液中所含的酵母菌细胞数。
公式如下:酵母菌细胞数/mL = (A×B×C×D×10000)/10000×W×V其中,A代表每个大方格内酵母菌细胞数,B代表每个小方格内酵母菌细胞数,C代表每个小方格内红细胞和白细胞或霉菌菌落数,D代表稀释倍数,W代表称取发酵液的质量(g),V代表发酵液的体积(mL)。
6.重复实验三次,求平均值。
四、实验结果与分析1.实验结果:在实验过程中,我们发现血球计数板的使用对于酵母菌细胞总数的测定非常重要。
通过血球计数板的统计和分析,我们得到了每毫升发酵液中酵母菌细胞的数量。
根据实验数据,我们可以得出以下表格:2.结果分析:从实验结果可以看出,三次实验的平均值为4.0×10^7个/mL。
这说明在发酵过程中,酵母菌的数量呈指数增长趋势,增长速度较快。
这也说明了酵母菌在适宜的条件下可以迅速生长繁殖。
同时,实验过程中需要注意无菌操作,避免杂菌污染对实验结果的影响。
个小方格细胞总数 ×400×10000×稀释倍数血球计数板的构造(三)(25×16) 二、血球计数板的使用方法步骤 1.镜检计数室。
在加样前,先对计数板的计数室进行镜检。
若有污物,则需清洗,吹干后才能进行计数; 2.加样品。
将清洁干燥的血球计数板的计数室上加盖专用的盖玻片,用吸管吸取稀释后的酵母菌悬液,滴于盖玻片边缘,让培养液自行缓缓渗入,一次性充满计数室,防止产生气泡,多余培养液可用滤纸吸去; 3.计数。
稍待片刻(约5min),待酵母菌细胞全部沉降到计数室底部后,先在低倍镜下找到计数室所在位置后,再转换高倍镜观察、计数并记录。
三、血球计数板的使用注意事项 《培养液中酵母菌种群数量的动态变化》实验是一个历时较长(7天左右)的实验,事前一定要做好周密的计划,定程序、定时间、定人员。
每天采用抽样检测法使用血球计数板对酵母菌进行计数,在计数时应从以下几方面注意。
1.每天同一时间,各组取出本组的试管,用血球计数板计数酵母菌个数,并作记录,连续观察7天。
2.从试管中吸出培养液进行计数之前,要将试管轻轻震荡几下,这样使酵母菌分布均匀,防止酵母凝聚沉淀,提高计数的代表性和准确性,求得的培养液中的酵母菌数量误差小。
3.如果一个小方格内酵母菌过多,难以数清,应当对培养液进行稀释以便于酵母菌的计数。
具体方法是:摇匀试管,取1mL 酵母菌培养液,加入成倍的无菌水稀释,稀释n 倍后,再用血球计数板计数,所得数值乘以稀释倍数。
以每小方格内含有4—5个酵母细胞为宜。
特别是在培养后期的样液需要稀释后计数。
4.活酵母有芽殖现象,若芽体达到母细胞大小的一半时,即可作为两个菌体计数,若芽体小于母细胞一半时为1个酵母细胞。
5.对于压在方格界线上的酵母菌应当计数同侧相邻两边上的菌体数,一般可采取“数上线不数下线,数左线不数右线”的原则处理,另两边不计数。
计数时,如果使用16格×25格规格的计数室,要按对角线位,取左上、右上、左下、右下4个中格(即100个小格)的酵母菌数;如果规格为25格×16格的计数板,除了取其4个对角方位外,还需再数中央的一个中格(即80个小方格)的酵母菌数。
酵母菌的计数和血球计数板的使用实验报告基础生物学技术实验吴雪薇 121140059 C1组 2013-2-25实验一:酵母菌的计数和血球计数板的使用吴雪薇 121140059一、实验目的1、复习显微镜的使用。
2、学习血球计数板的使用。
3、计数并计算酵母菌的含量。
二、实验原理1、血球计数板被用以对人体内红、白血球进行显微计数之用,也常用于计算一些细菌、真菌、酵母等微生物的数量,是一种常见的生物学工具。
2、血球计数板是一块特制的厚型载玻片,载玻片上有四个槽构成三个平台。
中间的平台较宽,其中间又被一短横槽分隔成两半,每个半边上面各刻有一小方格网,每个方格网共分九个大方格,中央的一大方格作为计数用,称为计数区。
计数区的刻度有两种:一种是计数区分为16个中方格(大方格用三线隔开),而每个中方格又分成25个小方格;另一种是一个计数区分成25个中方格(中方格之间用双线分开),而每个中方格又分成16个小方格。
(本实验使用的是第二种。
)但是不管计数区是哪一种构造,它们都有一个共同特点,计数区边长为1mm,则计数区的面积为即计数区都由400个小方格组成。
lmm2,每个小方格的面积为1/400mm2。
盖上盖玻片后,计数区的高度为0.1mm,所以每个计数区的体积为0.1mm3,每个小方格的体积为1/4000mm3。
3、因此,数出小方格中酵母菌细胞的数量后,计算小方格内酵母菌细胞数的平均值,再乘以25可得每0.1mm3内酵母菌细胞的数量,继而计算出每ml酵母菌细胞数。
4、血细胞计数的误差分别来源于技术误差和固有误差。
其中由于操作人员采血不顺利,器材处理、使用不当,稀释不准确,细胞识别错误等因素所造成的误差属技术误差;而由于仪器(计数板、盖片、吸管等)不够准确与精密带来的误差称仪器误差,由于细胞分布不均匀等因素带来的细胞计数误差属于分布误差或计数域误差。
仪器误差和分布误差统称为固有误差或系统误差。
技术误差和仪器误差可通过规范操作、提高熟练程度和校正仪器而避免或纠正,但细胞分布误差却难于彻底消除。
简析“使用血球计数板对酵母菌进行计数”的若干问题
乔静
如何正确使用血球计数板对酵母菌种群数量进行计数,是近年来的高考题或模拟题中多次出现相关的试题,而且不仅从如何计算酵母的数量的角度来考查学生,还从操作方法或操作过程中出现的一些问题以及处理方法来考查学生。
而教师在遇到这些问题往往让学生记答案,学生对这些问题仍是感到疑惑。
笔者在近年来的教学实践中,将教师和学生在做该实验和相关命题遇到的一些问题,进行了分析探讨。
1 血球计数板的构造和计数原理
虽然不同版本的教材推荐使用的血球计数板的规格不同,人教版建议使用
2mmx2mmx0.1mm方格,苏教版推荐使用1mmx1mmx0.1mm方格,但是血球计数板的使用原理和方法是相同的。
以下以1mmx1mmx0.1mm方格的计数板为例分析结构和计数原理。
每个血球计数板上有两个计数室(图1)。
血球计数板上的符号和数字(图1)的含义是:XB-K-25为计数板的型号和规格,表示此计数板中计数室分25个中格;0.1mm 为盖上盖玻片后计数室的高;1/400mm2表示计数室面积是1mm2(计数室边长1mm),分400个小格,每小格面积是1/400mm2(图2),9个大方格中只有中间的有小方格的中央大方格才是计数室。
不要认为9个大方格都是计数室。
计数室通常也有两种规格:一种是16x25型,即大方格内分为16中格,每一中格又分为25小格(图2);另一种是25x16型,即大方格内分为25中格,每一中格又分为16小格。
但是不管计数室是哪一种构造,它们都有一个共同的特点,即每一大方格都是由16x25=25x16=400个小方格组成。
计数时,若计数室是由16个中方格组成,数左上、左下、右上、右下的4个中方格(即100个小方格)的菌数。
如果是由25个中方格组成的计数室,除数上述4个中
方格外,还需数中央1个中方格(即80个小格方)的菌数(图3)。
计数时对压在中格四条线上的细胞只计数相邻两边及其夹角上的细胞(一般选左边和上边的线)。
以1minx1mmx0.1 mm方格的计数板为例,如果是25个中格的计数室,计数的5个中格菌数共N个,那么1mL培养液中菌数=N/5x25x10000x稀释倍数。
如果是16个中格的计数室,计数的4个中格菌数共N个,那么1mL培养液中菌数=N/4x16x10000x稀释倍数。
2 血球计数板操作方法的注意事项
教师在介绍血球计数板的操作方法时,往往是比较简略的。
学生在操作中因为对操作要求不理解而造成操作不当,或者对操作中出现的异常问题的处理不知如何处理。
而通过分析近几年的有关血球计数板的相关试题,更注重操作方面的考查,而教师在这方面对学生分析阐述得少。
(1)在取样计数前,为什么要将酵母菌培养液进行振荡摇匀?
因为这样使酵母菌分布均匀,防止酵母凝聚沉淀,提高计数的代表性和准确性,减小培养液中的酵母菌数量误差。
(2)为什么要先在计数室上盖上盖玻片,再滴加菌液?
通常滴加菌液时,采用的是“渗入法”:先将盖片盖住计数室,盖片的两端应搭放在计数室两侧的支持柱上。
从计数板中间平台两侧的沟槽内沿盖玻片的下边缘滴入一小滴(不宜过多,一般将滴管口沿盖片边缘与计数平台之间的空隙轻轻靠一靠即可),让菌悬液渗入并充满计数室,勿使气泡产生,并用吸水纸吸去多余菌液。
技巧:用吸水纸吸去多余的培养液时要迅速,保证计数室被培养液充满,以减少误差。
但也可采用“压滴法”:先将适量菌液滴加在计数平台上,再将盖片从一侧压到计数扳上,使盖片搭放在两则支持柱上,将菌液滴压平。
不管用哪种方法,都必须把握3个原则:加入待测菌液后,计数室内不能产生气泡;不能将菌悬液沾到盖玻片表面,以免污染显微镜的高倍镜头;不能将菌液沾到计数平台两侧的支持柱表面。
比较而言,渗入法更容易操作。
(3)如果先滴加菌液,再加盖玻片,容易出现什么误差?怎么处理?
如果先滴加菌液,再加盖玻片(压滴法),容易使菌液沾到计数平台两侧的支持柱表面,在支持柱表面形成一层水膜而使盖片不能完全落在支持柱上。
盖玻片由于液滴的表面张力作用而未能严密的盖到计数板表面上,使计数室内的体积增大,计数结果将偏高。
应将血球计数板和盖玻片洗净、烘干重做。
(4)如果计数室中出现气泡,会出现什么误差?怎么处理?
如果计数室中出现气泡,会使盖玻片下有部分空间没有充满菌液,是待计数的菌液体积减少,导致结果偏小。
应将血球计数板和盖玻片洗净、烘干重做。
也就要重新制片。
为什么不采用在盖玻片一侧滴加菌液,另一侧用吸水纸吸引的“引流法”?这是因为通过引流法,将盖玻片下方的液体可以进行置换,可能会去除部分气泡,但很难除尽气泡。
引出的菌液会带走部分细胞,造成误差。
菌液也容易沾到盖玻片表面,污染显微镜的高倍镜头而看不到目标。
(5)血球计数板应该如何正确清洗?
血球计数板使用结束后,应采用清水浸泡和冲洗的方式清洗,并进行烘干或自然晾干或用吹风机吹干。
不能使用试管刷等硬物进行擦洗。
镜检每个小格中是否存有污物、残菌,如不清洁,需重新清洗直至洁净。
这是因为血球计数板的方格线非常精细、脆弱,当用试管刷擦洗时会造成线条磨损。
也不能用普通的餐巾纸等进行拭擦,可能磨损线条,也会在计数室中留下纸纤维等污物。
要用专用的拭镜纸轻轻擦拭。
另外在使用血球计数板前需要在显微镜下检查,不干净要清洗烘干再使用。
(6)使用显微镜下进行计数,要注意哪些问题?
①血球计数板加样后,需静置片刻再使用显微镜计数。
这是因为计数室中的菌悬液有一定的高度(0.1mm)。
需要让细胞沉降到计数室底部的网格线中,避免细胞分布在不同液层深度,导致计数时被遗漏。
②先在低倍镜下,找到网格,也就是要先找到计数室(有小网格的部分)。
将第一个计数中格移到视野中心,再换高倍镜逐小格观察并计数。
观察时还应安排一个顺序,比如,依次按照左上中格、左下中格、右下中格、右上中格。
若有第五中格时,当计数到右上中格时,先向左移动两个中格,再往下移动两个中格便是最中间的一个中格。
小格的观察顺序最好是从左到右,从上到下逐格进行。
计数时压线的细胞本着计上不计下,计左不计右的原则,以免重复计数。
活酵母有芽殖现象,若芽体达到母细胞大小的一半时,即可作为两个菌体计数;若芽体小于母细胞一半时为一个酵母细胞。
③因为生活酵母细胞的折光率和培养液的折光率相近,所以观察时要减弱光照的强
度,将视野调暗些。
但不能太暗,否则也看不清。
④每个样品计数应重复3次(每次数值不应相差过大,否则应重新操作),取其平均值。
(7)如果细胞数目过多,难以数清,应该采取什么措施?
如果一个小方格内酵母菌过多,难以数清,应该进行稀释,然后再进行计数。
一般样品稀释度要求每小格内约有5~10个菌体为宜。
稀释时要注意:将1mL样液稀释10倍,不是加10mL无菌水,而是加9mL无菌水,即加水稀释后的体积是原来的10倍。
这点不仔细就很容易分析错。
例如将1mL样液稀释100倍,就应该加99mL水。
而不是90mL水。
(8)能不能区分活酵母细胞和死酵母细胞,避免计数出现较大误差?
探究“酵母菌种群数量变化”,理应为培养液中活菌体的数量变化,人教版教材中没有提出活菌和死菌的分开计数问题。
易理解成用总的菌体数作计数结果;苏教版教材中虽建议用台酚蓝染液染色,但没有说明这是对活菌(无色)和死菌(蓝色)的区分,并且是将染液直接滴在血球计数板上,菌液浓度改变,造成误差。
正确的做法应是另外制作装片,通过染色对活菌和死菌加以区分,算出两者比例,进一步换算出总菌体数中的活菌数。
由于台酚蓝染液配制相对复杂,且台酚蓝有一定致癌性,建议用吕氏碱性美蓝(亚甲蓝)染液对酵母菌染色,活的酵母细胞呈无色,死的或代谢衰弱的酵母细胞呈蓝色。