1烷烃的熔沸点比较
- 格式:pdf
- 大小:94.72 KB
- 文档页数:2



高一化学烷烃试题答案及解析1.下列烷烃在光照下与氯气反应,生成3种二氯代烃的是【答案】B【解析】A.CH3CH2CH2CH3生成的二氯代烃的是CHCl2CH2CH2CH3;CH3CCl2CH2CH3;CH2ClCHClCH2CH3; CH2ClCH2CHClCH3;CH2ClCH2CH2CH2Cl;CH3CHClCClCH3,不符合题意,正确;B.两个Cl原子可以都在甲基上,也可以一个在甲基上,另一个在与甲基连接大C原子上两种不同的位置,符合题意,正确;C转移一种位置的H原子,所以二氯代烃只有一种,错误;D.的二氯代烃的是、、、、、、、、,种类多于三种,错误。
【考点】考查有机物同分异构体的种类的判断的知识。
2.(10分)利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。
某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:(1)A中制取C12反应的化学方程式是_____________________________。
(2)D装置中的石棉上吸附着潮湿的KI粉末,其作用是_________________________。
(3)E装置的作用是______________(填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢(4)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(5)将l mol CH4与C12发生取代,测得4种有机取代物的物质的量相等,则消耗的氯气的物质的量是______________。
【答案】(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;(2)除去Cl2,(3)C(4)分液,(5)2.5mol【解析】(1)在A中浓盐酸与MnO2在加热时发生反应制取C12,反应的化学方程式是MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;(2)在制取的氯气中含有水蒸气,可以用浓硫酸来除去;浓硫酸的作用是干燥气体、混合气体、通过观察气泡来控制气体的混合比例,在C装置中氯气与甲烷发生取代反应;在装置D中用的石棉上吸附着潮湿的KI粉末,其作用是反应消耗除去未反应的氯气;(3)在装置E中用来吸收产生的HCl,为了防止倒吸现象的发生,安装了一个倒扣的漏斗,因此E的作用是C。
物质熔点和沸点高低的比较比较物质的熔点和沸点的高低,通常按下列步骤进行,首先比较物质的晶体类型,然后再根据同类晶体中晶体微粒间作用力大小,比较物质熔点和沸点的高低,具体比较如下:一、判断所给物质的晶体类型,然后按晶体的熔点和沸点的高低进行比较,一般来说晶体的熔点和沸点的高低是:原子晶体>离子晶体>分子晶体,例如:晶体硅>氯化钠>干冰。
但并不是所有这三种晶体的熔点和沸点都符合该规律,例如:氧化镁(离子晶体)>晶体硅(原子晶体)。
而金属晶体的熔点和沸点变化太大,例如汞、铷、铯、钾等的熔点和沸点都很低,钨、铼、锇等的熔点和沸点却很高,所以不能和其它晶体进行简单的比较。
例如、(2002年高考上海试题第7小题,)下列有关晶体的叙述中错误的是A离子晶体中,一定存在离子键 B 原子晶体中,只存在共价键C 金属晶体的熔沸点均很高D 稀有气体的原子能形成分子分析:其中选项C中的说法就是错误的,如汞、铷、铯、钾等的熔点和沸点都很低。
A、B、D三者说法都正确,所以应选C。
二、当物质是同类晶体时,则分别按下列方式比较。
1.原子晶体因为构成原子晶体的微粒是原子,微粒间的作用力是共价键,则其晶体的熔点和沸点的高低则由共价键的键能大小决定,而键能大小又由共价键的键长决定,键长越短,而键长可以通过原子半径来比较,键能越大,熔点和沸点就越高。
例如:金刚石>金刚砂>晶体硅。
例如:(2004高考上海试题第10题)有关晶体的下列说法中正确的是()A.晶体中分子间作用力越大,分子越稳定B.原子晶体中共价键越强,熔点越高C.冰熔化时水分子中共价键发生断裂D.氯化钠熔化时离子键未被破坏分析:分子间作用力大小与分子的稳定性无关;原子晶体中共价键越强,原子间作用力越大,熔点就越高,说法正确;冰熔化时只破坏分子之间作用力,分子内共价键不变;而氯化钠熔化时其离子键一定要断裂才能变化成阴阳离子;所以正确选B,而A、C、D三者都错了。
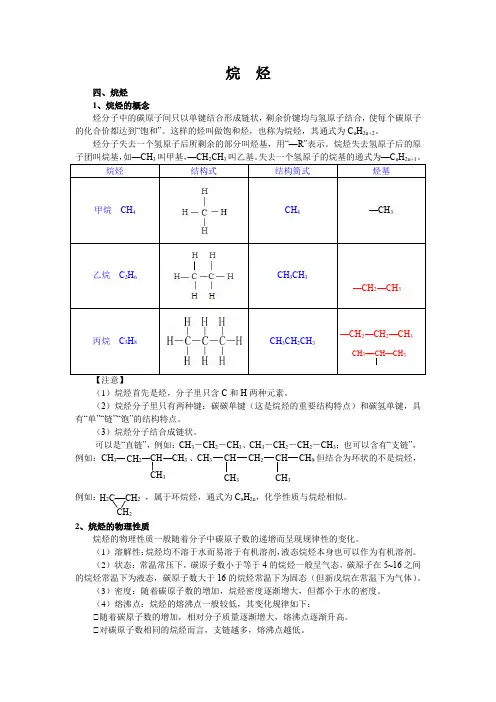
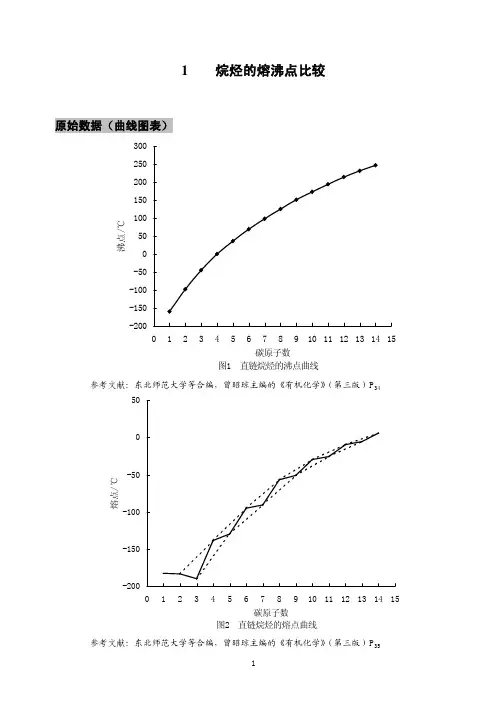
1烷烃的熔沸点比较原始数据(曲线图表)参考文献:东北师范大学等合编,曾昭琼主编的《有机化学》(第三版)P参考文献:东北师范大学等合编,曾昭琼主编的《有机化学》(第三版)P35表1戊烷各异构体的沸点比较名称分子式沸点/℃正戊烷异戊烷新戊烷CH3(CH2)3CH3(CH3)2CHCH2CH3(CH3)3CCH336.1259参考文献:邢其毅等编《基础有机化学》(第二版)P48,高等教育出版社引导学生提出问题1.分析图1和图2,随着碳原子数的增加,直链烷烃的熔点和沸点依次增加,为什么?2.从图2可以看出直链烷烃的熔点表现出什么规律?怎样解释?3.为何随着碳原子数的增加,奇数碳原子烷烃的熔点所构成的曲线与偶数碳原子烷烃的熔点所构成的曲线逐渐接近?4.分析表1,同分异构体的烷烃的沸点,分支越多,沸点越低,为什么?分析原始数据得到的一般结论1.由图1和表1可知,烷烃分子中,碳原子数增多,沸点升高。
每增加一个CH2所引起的沸点升高值随着分子量增加而变得缓和。
同分异构体的烷烃,支链愈多沸点愈低;2.由图2可知,大于C4的烷烃,碳原子数增加,熔点升高,偶数烷烃升高更迅速;同数碳原子烷烃的异构体,熔点主要取决于对称性。
理论解释1.正构烷烃的熔沸点(除C3的熔点以外)随着相对分子质量的增加而升高,这是因为随着相对分子质量的增大,分子间的范德华引力增大;2.分子量较小的乙烷的熔点反而比分子量较大的丙烷高,这是因为,在晶体中分子间的作用力不仅取决于分子的大小,而且取决于晶体中碳链的空间排列情况。
分子对称性高,排列就比较整齐,分子间吸引力就大,熔点也就高。
X衍射实验结果表明,直链烷烃晶体为锯齿形,奇数碳原子齿状链中两端甲基同处在一边,如正戊烷,偶数碳链中两端甲基不在同一边,如正己烷,偶数碳链彼此更为靠近,相互作用力大,故熔点升高值较奇数碳链升高值较大一些;3.在同分异构体的烷烃中,含支链越多的烷烃,相应沸点越低。
这是因为色散力只有在很近的距离内才能有效发挥作用,而且随着距离的增加很快减弱。


有机物的物理性质规律刘春亮有机物的物理性质与化学性质同等重要,且“结构决定性质,性质反映结构”不仅表现在化学性质中,同时也体现在某些物理性质上。
有机物一些物理性质存在着内在规律,如果抓住其中的规律,可以更好地认识有机物。
一、熔沸点有机物微粒间的作用是分子间作用力,分子间的作用力比较小,因此烃的熔沸点比较低。
对于同系物,随着相对分子质量的增加,分子间作用力增大,因此同系物的熔沸点随着相对分子质量的增大而升高。
1. 烃、卤代烃及醛各种烃的同系物、卤代烃及醛的熔沸点随着分子中碳原子数的增加而升高。
如:4CH 、1048362H C H C H C 、、都是烷烃,熔沸点的高低顺序为:10483624H C H C H C CH <<<;846342H C H C H C 、、都是烯烃,熔沸点的高低顺序为:846342H C H C H C <<;再有Cl CH CH Cl CH 233<,CHO CH HCHO 3<等。
同类型的同分异构体之间,主链上碳原子数目越多,烃的熔沸点越高;支链数目越多,空间位置越对称,熔沸点越低。
如4332233323)CH (C CH CHCH )CH (CH )CH (CH >>。
例1:下列物质的沸点按由高到低的顺序排列正确的是( )①3223CH )CH (CH②3323CH )CH (CH ③CH )CH (33④3223CH CHCH )CH ( A. ②④①③B. ④②①③C. ④③②①D. ②④③① 答案:A2. 醇由于分子中含有—OH ,醇分子之间存在氢键,分子间的作用力较一般的分子间作用力强,因此与相对分子质量相近的烃比较,醇的熔沸点高的多,如OH CH CH 23的沸点为78℃,323CH CH CH 的沸点为-42℃,23CH CH CH =的沸点为-48℃。
影响醇的沸点的因素有:(1)分子中—OH 个数的多少:—OH 个数越多,沸点越高。

高中化学物质熔沸点比较规律这是一个关于高中化学中物质熔沸点比较规律的文章,我们将会一步一步回答以下问题:第一步:什么是物质的熔沸点?物质的熔沸点是指物质从固态转变为液态(熔化)或从液态转变为气态(沸腾)时所需要的温度。
熔沸点是物质化学性质的重要指标之一,它与分子内部的相互作用力有关。
第二步:物质的熔沸点受何种因素影响?物质的熔沸点受以下因素的影响:1. 相互作用力:物质分子之间的相互吸引力越强,其熔沸点就越高。
离子键的相互作用力强,导致离子晶体的熔沸点都较高;而共价键和氢键的相互作用力一般较弱,其熔沸点相对较低。
2. 分子量:通常情况下,分子量较大的物质熔沸点较高,因为较大的分子间引力相互作用力也较大。
例如,烷烃分子量越大,熔沸点也越高。
3. 分子形状:对于相同分子量的物质,如果分子形状不同,由于分子间的相互作用力不同,其熔沸点也会不同。
例如,对于同系列的烷烃,分子形状越直链,其熔沸点越高,分子形状越分支,熔沸点越低。
4. 杂质:杂质的存在通常会降低物质的熔沸点。
这是因为杂质干扰了纯净物质分子之间的相互作用,使其熔沸点下降。
第三步:如何通过以上因素解释物质熔沸点的比较规律?根据以上因素,我们可以总结出以下几点规律:1. 同一物质系列中,随着分子量的增加,物质的熔沸点也会随之增加。
例如,烷烃的熔沸点随碳链长度的增加而增加。
2. 同一分子量物质中,分子形状越直链,熔沸点越高;分子形状越分支,熔沸点越低。
这是因为分子形状的不同导致分子间的相互作用力也不同。
3. 离子晶体的熔沸点一般较高,而共价键和氢键的熔沸点相对较低。
这是因为离子晶体具有离子键的相互作用力,而共价键和氢键的相互作用力较弱。
4. 杂质的存在会降低物质的熔沸点,因为杂质干扰了纯净物质分子之间的相互作用。
第四步:实例分析我们可以通过实例来进一步说明物质熔沸点比较规律。
以烷烃为例,我们可以比较甲烷,乙烷和丙烷的熔沸点。
甲烷:CH4,分子量为16 g/mol,为非极性分子。

有机化合物的物理性质规律有机物的物理性质与化学性质同等重要,且“结构决定性质,性质反映结构”不仅表现在化学性质中,同时也体现在某些物理性质上。
有机物一些物理性质存在着内在规律,如果抓住其中的规律,可以更好地认识有机物。
一、熔沸点有机物微粒间的作用是分子间作用力,分子间的作用力比较小,因此烃的熔沸点比较低。
对于同系物,随着相对分子质量的增加,分子间作用力增大,因此同系物的熔沸点随着相对分子质量的增大而升高。
1. 烃、卤代烃及醛各种烃的同系物、卤代烃及醛的熔沸点随着分子中碳原子数的增加而升高。
如:4CH 、1048362H C H C H C 、、都是烷烃,熔沸点的高低顺序为:10483624H C H C H C CH <<<;846342H C H C H C 、、都是烯烃,熔沸点的高低顺序为:846342H C H C H C <<;再有Cl CH CH Cl CH 233<,CHO CH HCHO 3<等。
同类型的同分异构体之间,主链上碳原子数目越多,烃的熔沸点越高;支链数目越多,空间位置越对称,熔沸点越低。
如4332233323)CH (C CH CHCH )CH (CH )CH (CH >>。
例1:下列物质的沸点按由高到低的顺序排列正确的是( )①3223CH )CH (CH②3323CH )CH (CH ③CH )CH (33④3223CH CHCH )CH ( A. ②④①③B. ④②①③C. ④③②①D. ②④③① 答案:A2. 醇由于分子中含有—OH ,醇分子之间存在氢键,分子间的作用力较一般的分子间作用力强,因此与相对分子质量相近的烃比较,醇的熔沸点高的多,如OH CH CH 23的沸点为78℃,323CH CH CH 的沸点为-42℃,23CH CH CH =的沸点为-48℃。
影响醇的沸点的因素有:(1)分子中—OH 个数的多少:—OH 个数越多,沸点越高。

化合物的物理性质《烷烃的物理性质》一. 物质的状态室温下,C1-C4为气体,C5-C16为液体,C17以上是固体。
二.熔点和沸点烷烃的熔点和沸点都很低,并且熔点和沸点随分子量的增加而升高。
但值得注意的是:(1)对同数碳原子的烷烃来说,结构对称的分子熔点高。
因为结构对称的分子在固体晶格中可紧密排列,分子间的色散力作用较大,因而使之熔融就必须提供较多的能量。
(2)含偶数碳原子的正烷烃比奇数碳原子的熔点高。
这主要取决于晶体中碳链的空间排布情况。
X光证明,固体正烷烃的碳链在晶体中伸长为锯齿形,奇数碳原子的链中两端的甲基处在同一边,而偶数碳原子的链中,两端的甲基处在相反的位置,从而使这种碳链比奇数碳链的烷烃可以彼此更为靠近,于是它们之间的色散力就大些。
烷烃的沸点上升比较有规则,每增加一个CH2基,上升20-30℃,越到高级系列上升越慢。
在相同碳原子数的烷烃中,直链的沸点比带支链的高,这是由于在液态下,直链的烃分子易于相互接近,而有侧链的烃分子空间阻碍较大,不易靠近。
三. 比重、溶解度、折光率(略)环烷烃的物理性质在常温常压下环丙烷及环丁烷为气体,环戊烷为液体,高级环烷烃为固体。
环烷烃的熔点较同数碳原子的直链烷烃高,因为环烷烃比直链烷烃在晶格中排列更紧密。
环烷烃的密度为0.688~0.853g•c m-3 。
环烷烃不溶于水。
一些环烷烃的熔点和沸点见表3-2。
表3.2 环烷烃的熔点、沸点、张力能(kJ·mol-1)和每一个-CH2-单元的燃烧热(kJ·mol-1 )《芳烃的物理性质》苯及其同系物大多为液体,故有特殊的香气,但它们的蒸气有毒。
高浓度的苯蒸气作用于中枢神经,引起急性中毒。
长期接触低浓度的苯蒸气能损害造血器官。
因此,应尽量注意少接触苯。
有时可以用甲苯代替苯作溶剂,因少量甲苯在人体中可以与甘氨酸作用被人体中酶催化形成马尿酸(C6H5CONHCH2CO2H)而排出体外,故甲苯毒性相对较小。
第二课时烷烃的性质学习目标导航学习任务1 烷烃的物理性质NO.1自主学习·夯实基础1.相似性烷烃均难溶于水,相对密度均小于1。
2.递变性(随碳原子数n递增)微思考:同分异构体之间最简式、相对分子质量、各元素的百分含量及熔、沸点一定都相同吗?提示:同分异构体之间最简式、相对分子质量、各元素的百分含量都相同,但熔、沸点不同。
NO.2互动探究·提升能力在1.013×105 Pa下,测得某些烷烃的相关物理性质见下表。
异戊烷新戊烷探究1 烷烃熔、沸点的比较问题1:随碳原子数递增,烷烃熔、沸点递变规律是什么?提示:逐渐升高。
问题2:怎样比较碳原子数相同的烷烃的熔、沸点?提示:一般来说,所含支链越多,其熔、沸点越低。
探究2 烷烃的分离提纯问题3:如何分离正戊烷和正己烷的混合物?提示:沸点相差较大,可采用蒸馏法分离。
问题4:正丁烷和水的混合物,如何分离?提示:烷烃难溶于水,且互不相溶,可采用分液法分离。
NO.3应用体验·形成素养1.关于烷烃的下列叙述中正确的是( C )A.烷烃均易溶于水且密度比水小B.随碳原子数递增,烷烃的熔、沸点逐渐降低C.烷烃分子中每个碳原子均形成4个共价键D.分子式相同的烷烃,其熔、沸点相同解析:烷烃均难溶于水,密度比水小,A错误;随碳原子数递增,烷烃的熔、沸点逐渐升高,B错误;烷烃分子中每个碳原子均形成4个共价键,C正确;互为同分异构体的烷烃,其熔、沸点不一定相同,D错误。
2.(2021·湖北黄冈月考)在1.013×105 Pa下,测得某些烷烃的沸点如表。
据表分析,下列选项正确的是( D )异戊烷A.在标准状况下,新戊烷是气体B.在1.013×105 Pa、20 ℃时,戊烷都是液体C.烷烃随碳原子数的增加,沸点降低D.分子式为C5H12的烷烃的同分异构体中,随支链的增加,沸点降低解析:由题表中信息可知,新戊烷的沸点是9.5 ℃,标准状况下是液体,20 ℃时是气体,A、B错误;烷烃随碳原子数的增加,沸点升高,C错误;C5H12的三种同分异构体中,随支链数的增加,沸点降低,D正确。
【课题】【教学目的】1.使学生认识烷烃同系物在组成、结构、化学性质上的共同点及物理性质随分子里碳原子数的递增而变化的规律。
2.使学生初步了解直链烷烃的命名及结构式、结构简式的写法。
【教学重点和难点】1.烷烃的性质。
2.结构简式的写法。
【大纲知识点要求】同系物-B【教学过程】[复习引入]上节课我们学习的甲烷是最简单的有机物。
下面,请同学们来看一下我手里的几个模型。
它们与甲烷有什么相同的地方?有什么不同的地方?[展示]乙烷、丙烷和丁烷的球棍模型。
相同点:只含碳、氢两种元素;每个碳原子以四个单键与其它原子结合。
不同点:碳、氢原子数比甲烷多。
[讲述]在有机化合物里有一系列结构和性质与甲烷相似的烃。
在这些烃分子里,碳原子之间以碳碳单键相结合成链状,碳原子剩余的价键全部与氢原子相结合,这样的结合使每个碳原子的化合价都已充分利用,都达到“饱和”。
这就是我们今天要学习的饱和链烃,又称烷烃。
[板书]一、烷烃的结构和性质1.概念:饱和链烃:碳原子之间以碳碳单键相结合成链状,碳原子剩余的价键全部被氢原子所饱和的烃。
(又称烷烃)[讲述]烷烃的种类很多,含一个碳原子的我们称为甲烷,含两个碳原子的我们称为乙烷,以此类推,含三个碳原子的称为丙烷,含四个碳原子的称为丁烷。
[展示]乙烷、丙烷和丁烷的结构式。
[讲述]在书写烷烃结构式时很麻烦。
在实际书写中,有机物常写结构简式,它既可以表示有机物的结构,同时书写起来也很简单。
我们只需将结构式中的碳碳单键和碳氢单键省略就可书写出结构简式。
比如乙烷就可写成CH3CH3。
[板书]2.结构简式乙烷CH3CH3CH3—CH3丁烷CH3CH2CH2CH3或CH3(CH2)2CH3CH3—CH2—CH2—CH3注:直链中的碳原子(CH2)原子团可以用括号括起来,在右下角标出数字。
[讲述]从球棍模型可以看出,在乙烷、丙烷和丁烷中,相邻两个C—H键之间的夹角是109°28′,碳原子之间并不是结合成直线的链状。
1烷烃的熔沸点比较
原始数据(曲线图表)
参考文献:东北师范大学等合编,曾昭琼主编的《有机化学》(第三版)P
参考文献:东北师范大学等合编,曾昭琼主编的《有机化学》(第三版)P35
表1戊烷各异构体的沸点比较
名称分子式沸点/℃
正戊烷异戊烷新戊烷
CH3(CH2)3CH3
(CH3)2CHCH2CH3
(CH3)3CCH3
36.1
25
9
参考文献:邢其毅等编《基础有机化学》(第二版)P48,高等教育出版社
引导学生提出问题
1.分析图1和图2,随着碳原子数的增加,直链烷烃的熔点和沸点依次增加,为什么?
2.从图2可以看出直链烷烃的熔点表现出什么规律?怎样解释?
3.为何随着碳原子数的增加,奇数碳原子烷烃的熔点所构成的曲线与偶数碳原子烷烃的熔点所构成的曲线逐渐接近?
4.分析表1,同分异构体的烷烃的沸点,分支越多,沸点越低,为什么?
分析原始数据得到的一般结论
1.由图1和表1可知,烷烃分子中,碳原子数增多,沸点升高。
每增加一个CH2所引起的沸点升高值随着分子量增加而变得缓和。
同分异构体的烷烃,支链愈多沸点愈低;
2.由图2可知,大于C4的烷烃,碳原子数增加,熔点升高,偶数烷烃升高更迅速;同数碳原子烷烃的异构体,熔点主要取决于对称性。
理论解释
1.正构烷烃的熔沸点(除C3的熔点以外)随着相对分子质量的增加而升高,这是因为随着相对分子质量的增大,分子间的范德华引力增大;
2.分子量较小的乙烷的熔点反而比分子量较大的丙烷高,这是因为,在晶体中分子间的作用力不仅取决于分子的大小,而且取决于晶体中碳链的空间排列情况。
分子对称性高,排列就比较整齐,分子间吸引力就大,熔点也就高。
X衍射实验结果表明,直链烷烃晶体
为锯齿形,奇数碳原子齿状链中两端甲基同处在一边,如正戊烷,偶数碳链中
两端甲基不在同一边,如正己烷,偶数碳链彼此更为靠近,相互作用力大,故熔点升高值较奇数碳链升高值较大一些;
3.在同分异构体的烷烃中,含支链越多的烷烃,相应沸点越低。
这是因为色散力只有在很近的距离内才能有效发挥作用,而且随着距离的增加很快减弱。
所以烷烃支链增多时空间阻碍增大,分子间靠得不紧密,相距较远,色散力相应减弱,从而使分子间范德华力减小,沸点必然相应降低。
支持结论与理论解释的实例
熔点:
CH3(CH2)4CH3(m.p.69℃)>(CH3)2CHCH2CH2CH3(m.p.60℃)>(CH3)3CCH2CH3(m.p.
49.7℃)。