差热分析
- 格式:docx
- 大小:418.26 KB
- 文档页数:8

差热分析分析差热分析是一种热分析技术,用于测定样品在温度变化过程中吸收或放出的热量。
差热分析主要应用于材料科学、化学、生物医学等领域,常用于确定材料的热稳定性、相变、降解等特性,以及化学反应、生物活性等反应过程的动力学参数。
本文将对差热分析技术的基本原理、数据分析、应用前景等进行详细介绍。
一、基本原理差热分析主要基于热量守恒原理,通过对比样品和参比样品在温度变化过程中的热量差异,得出样品在该温度范围内所吸收或放出的热量。
差热分析一般使用差动热量计,其基本结构由两个热电偶构成,一个接触样品,另一个接触参比样品。
当样品和参比样品接受相同的温度变化时,两侧热电偶所产生的电动势不同,这种电势差称为差动信号,与样品的热量吸收或释放有关。
差热分析实验中,通常以恒定的升温速率对样品和参比样品加热,同时测量两侧热电偶的电动势和温度。
通过对比两侧热电偶的信号,得出样品与参比样品的热量差异,进而确定样品的物理化学性质。
在差热分析过程中,常用的参比样品有空气、金属等。
二、数据分析差热分析实验中,得到的差动信号曲线通常呈现出峰形或谷形。
当样品发生物理化学变化时,其热量吸放会导致差动信号出现峰谷现象,峰表示样品吸收热量,谷表示释放热量。
通过对峰谷的面积、高度、位置等参数的分析,可以确定样品的热力学特性、相变、反应动力学参数等。
常用的数据分析方法包括:1. 峰温和半高宽分析:通过对峰温和半高宽的测量,可以确定样品的相变温度、热稳定性等。
2. 反应级数分析:差热分析可用于研究化学反应中的反应级数、反应机理等。
通过对峰形状的分析,可以确定反应级数以及反应动力学参数。
3. 动力学分析:差热分析可以用于测定反应的激活能、反应速率常数等动力学参数。
三、应用前景总之,随着科学技术的不断进步,差热分析技术将在材料科学、化学、生物医学等多个领域得到广泛应用,为相关研究提供有力的支持。

差动热分析仪热分析是在程序控温条件下,测量物质物理化学性质随温度变化的函数关系的一种技术。
程序控温可采用线性、对数或倒数程序。
热分析法依照所测样品物理性质的不同有以下几种:差热分析法,差示扫描量热法,热重分析法,热膨胀分析及热——力分析法等。
图a. 差动热分析仪整机线路连接图1.电炉2.气氛控制单元3.数据站接口单元4.差动热补偿单元5.差热放大单元6.可控硅加热单元7.微机温控单元图b. 仪器各主要部件2图c. 加热炉组件图d. 电炉(一)差热分析差热分析(differential thermal analysis, DTA)法是在程序控温下,测量物质与参比物之间温度差随温度或时间变化的一种技术。
根据国际热分析协会(international confederation for thermal analysis, ICTA) 规定,DTA曲线放热峰向上,吸热峰向下,灵敏度单位为微伏(μV)。
如图1-1为苦味酸(三硝基苯酚)的DTA曲线。
图1-1 苦味酸在动态空气中的DTA曲线可见,体系在程序控温下,不断加热或冷却降温,物质将按照它固有的运动规律而发生量变或质变,从而产生吸热或放热,根据吸热或放热便可判定物质内在性质的变化。
如:晶型转变、熔化、升华、挥发、还原、分解、脱水或降解等。
差热分析测量原理如图1-2所示。
图1-2 差热分析原理示意图图1-3 仪器工作原理差热分析仪主要由温度控制系统和差热信号测量系统组成,辅之以气氛和冷却水通道,测量结果由记录仪或计算机数据处理系统处理。
1.温度控制系统该系统由程序温度控制单元、控温热电耦及加热炉组成。
程序温度控制单元可编程序模拟复杂的温度曲线,给出毫伏信号。
当控温热电耦的热电势与该毫伏值有偏差时,说明炉温偏离给定值,由偏差信号调整加热炉功率,使炉温很好地跟踪设定值,产生理想的温度曲线。
2.差热信号测量系统该系统由差热传感器、差热放大单元等组成。
差热传感器即样品支架,由一对差接的点状热电耦和四孔氧化铝杆等装配而成,测定时将试样与参比物(常用α-Al2O3)分别放在两只坩埚中,置于样品杆的托盘上,然后使加热炉按一定速度升温(如10℃〃min-1)。

实验一 差热分析一、目的意义差热分析(DTA ,differentialthermal analysis)是研究相平衡与相变的动态方法中的一种,利用差热曲线的数据,工艺上可以确定材料的烧成制度及玻璃的转变与受控结晶等工艺参数,还可以对矿物进行定性、定量分析。
本实验的目的:1.了解差热分析的基本原理及仪器装置;2.学习使用差热分析方祛鉴定未知矿物。
二、基本原理差热分析的基本原理是:在程序控制温度下;将试样与参比物质在相同条件下加热或冷却,测量试样与参比物之间的温差与温度的关系,从而给出材料结构变化的相关信息。
物质在加热过程中,由于脱水,分解或相变等物理化学变化,经常会产生吸热或放热效应。
差热分析就是通过精确测定物质加热(或冷却)过程中伴随物理化学变化的同时产生热效应的大小以及产生热效应时所对应的温度,来达到对物质进行定性和/或定量分析的目的。
差热分析是把试样与参比物质(参比物质在整个实验温度范围内不应该有任何热效应,其导热系数,比热等物理参数尽可能与试样相同,亦称惰性物质或标准物质或中性物质)置于差热电偶的热端所对应的两个样品座内,在同一温度场中加热。
当试样加热过程中产生吸热或放热效应时,试样的温度就会低于或高于参比物质的温度,差热电偶的冷端就会输出相应的差热电势。
如果试样加热过程这中无热效应产生,则差热电势为零。
通过检流计偏转与否来检测差热电势的正负,就可推知是吸热或放热效应。
在与参比物质对应的热电偶的冷端连接上温度指示装置,就可检测出物质发生物理化学变化时所对应的温度.不同的物质,产生热效应的温度范围不同,差热曲线的形状亦不相同(如图16-2所示)。
把试样的差热曲线与相同实验条件下的已知物质的差热曲线作比较,就可以定性地确定试洋的矿物组成。
差热曲线的峰(谷)面积的大小与热效应的大小相对应,根据热效应的大小,可对试样作定量估计。
三.仪器设备与装置差热分析所用的设备主要由加热炉,差热电偶,样品座及差热信号和温度的显示仪表等所组成。


差热分析法(DTA)简介(Differential Thermal Analysis)1.DTA的基本原理差热分析是在程序控制温度下,测量物质与参比物之间的温度差与温度关系的一种技术。
差热分析曲线是描述样品与参比物之间的温差(ΔT)随温度或时间的变化关系。
在DAT试验中,样品温度的变化是由于相转变或反应的吸热或放热效应引起的。
如:相转变,熔化,结晶结构的转变,沸腾,升华,蒸发,脱氢反应,断裂或分解反应,氧化或还原反应,晶格结构的破坏和其它化学反应。
一般说来,相转变、脱氢还原和一些分解反应产生吸热效应;而结晶、氧化和一些分解反应产生放热效应。
差热分析的原理如图Ⅱ-3-1所示。
将试样和参比物分别放入坩埚,置于炉中以一定速率进行程序升温,以表示各自的温度,设试样和参比物(包括容器、温差电偶等)的热容量Cs、Cr不随温度而变。
则它们的升温曲线如图Ⅱ-3-2所示。
若以对t作图,所得DTA曲线如图Ⅱ-3-3所示,在0-a区间,ΔT大体上是一致的,形成DTA曲线的基线。
随着温度的增加,试样产生了热效应(例如相转变),则与参比物间的温差变大,在DTA曲线中表现为峰。
显然,温差越大,峰也越大,试样发生变化的次数多,峰的数目也多,所以各种吸热和放热峰的个数、形状和位置与相应的温度可用来定性地鉴定所研究的物质,而峰面积与热量的变化有关。
图Ⅱ-3-1差热分析的原理图 II-3-1 差热分析的原理图图II-3-2试样和参比物的升温曲线1.参比物;2.试样;3.炉体;4.热电偶(包括吸热转变)图Ⅱ-3-3 DTA吸热转变曲线TA曲线所包围的面积S可用下式表示式中m是反应物的质量,ΔH是反应热,g是仪器的几何形态常数,C是样品的热传导率ΔT是温差,t1是DTA曲线的积分限。
这是一种最简单的表达式,它是通过运用比例或近似常数g和C来说明样品反应热与峰面积的关系。
这里忽略了微分项和样品的温度梯度,并假设峰面积与样品的比热无关,所以它是一个近似关系式。


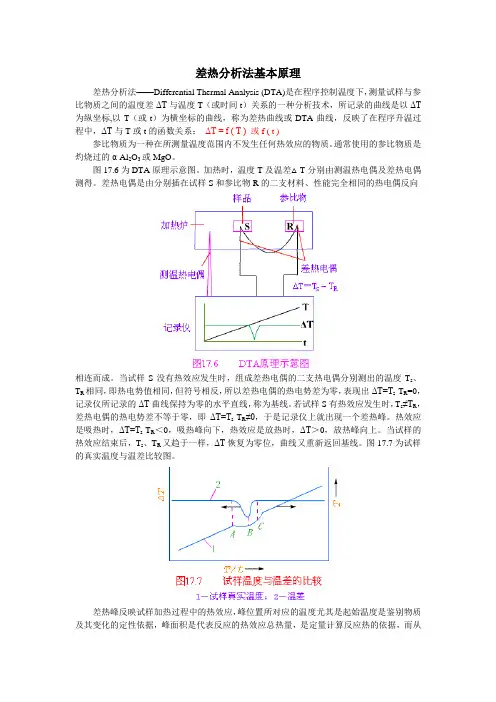
差热分析法基本原理差热分析法——Differential Thermal Analysis (DTA)是在程序控制温度下,测量试样与参比物质之间的温度差ΔT与温度T(或时间t)关系的一种分析技术,所记录的曲线是以ΔT 为纵坐标,以T(或t)为横坐标的曲线,称为差热曲线或DTA曲线,反映了在程序升温过程中,ΔT与T或t的函数关系:ΔT = f ( T ) 或f ( t )参比物质为一种在所测量温度范围内不发生任何热效应的物质。
通常使用的参比物质是灼烧过的α-Al2O3或MgO。
图17.6为DTA原理示意图。
加热时,温度T及温差△T分别由测温热电偶及差热电偶测得。
差热电偶是由分别插在试样S和参比物R的二支材料、性能完全相同的热电偶反向相连而成。
当试样S没有热效应发生时,组成差热电偶的二支热电偶分别测出的温度T s、T R相同,即热电势值相同,但符号相反,所以差热电偶的热电势差为零,表现出ΔT=T s-T R=0,记录仪所记录的ΔT曲线保持为零的水平直线,称为基线。
若试样S有热效应发生时,T s≠T R,差热电偶的热电势差不等于零,即ΔT=T s-T R≠0,于是记录仪上就出现一个差热峰。
热效应是吸热时,ΔT=T s-T R<0,吸热峰向下,热效应是放热时,ΔT>0,放热峰向上。
当试样的热效应结束后,T s、T R又趋于一样,ΔT恢复为零位,曲线又重新返回基线。
图17.7为试样的真实温度与温差比较图。
差热峰反映试样加热过程中的热效应,峰位置所对应的温度尤其是起始温度是鉴别物质及其变化的定性依据,峰面积是代表反应的热效应总热量,是定量计算反应热的依据,而从峰的形状(峰高、峰宽、对称性等)则可求得热反应的动力学参数。
表17.2列出了各种吸热和放热体系的类型,供判断差热峰产生机理时参考。
表17.2 差热分析中吸热和放热体系的主要类型现象(物理的原因)吸热放热现象(化学的原因)吸热放热结晶转变○○化学吸附○熔融○析出○气化○脱水○升华○分解○○吸附○氧化度降低○脱附○氧化(气体中)○吸收○还原(气体中)○氧化还原反应○○固相反应○○影响DTA的因素影响DTA的因素很多,下面讨论几种主要的因素:★升温速度的影响保持均匀的升温速度(ψ)是DTA的重要条件之一,即应:ψ = dT R / dt = 常数若升温速度不均匀(即ψ有波动),则DTA曲线的基线会漂移,影响多种参数测量。

差热分析法差热分析法(Differential Thermal Analysis,DTA)是一种常用的热分析技术,它通过比较样品与参比物的温度差异来研究样品的热性质。
DTA技术在化学、材料科学、地质学等多个领域具有广泛的应用。
DTA的工作原理基于样品和参比物在受热过程中吸收或释放热量的差异。
在实验中,样品和参比物被放置在两个相邻的炉区,受同等程度的升温条件控制。
当样品发生物理或化学变化时,其吸热或放热会导致样品与参比物温度的差异。
这些温度差异会通过一个差温探测器进行检测和记录。
DTA实验中,样品和参比物通常以粉末或粒状形式存在。
粉末样品可在合适的容器中进行测试,而固体样品则需先研磨成粉末以方便测试。
样品和参比物应具有相似的物理和化学性质,以确保实验的准确性和可靠性。
在DTA实验中,通常以升温速率为X轴,差温信号(样品与参比物温度差异)为Y轴来绘制曲线图。
曲线上出现的峰或谷表示样品发生了热事件,如相变、化学反应、放热或吸热过程等。
通过对峰的位置、峰的形状和峰的峰值进行分析,可以获得有关样品的热性质和热行为的信息。
DTA技术广泛应用于材料研究、催化剂研究、岩石和土壤分析、陶瓷研究等领域。
它可以用于研究材料的熔化过程、晶体相变、氧化、还原、析出和溶解等反应。
同时,DTA还可以用来测定热容、热导率、热膨胀系数等热性质参数。
通过结合其他热分析技术,如差热/差热衍生物分析(DTA/DSC)和差热差热衍生物重量分析(DTA/TGA),可以对样品进行更全面和深入的分析。
总之,差热分析法是一种用于研究样品热性质和热行为的重要工具。
它通过比较样品与参比物的温度差异,可以揭示样品发生的热事件和热特性,为材料研究和过程分析提供了有力的支持。


差热分析实验报告一、引言差热分析(Differential Scanning Calorimetry,DSC)是一种重要的热分析技术,通过测量样品在给定条件下对热量的吸放来研究材料的相变行为、热力学性质等。
本实验旨在通过差热分析仪器对一种未知物质进行分析,并对实验结果进行解读。
二、实验方法1. 样品制备:将未知物质按照一定比例与纯净的稀硫酸混合,待完全溶解后制备样品溶液。
2. 取样:将制备好的样品溶液采用准确的容量器取样,放置在差热分析仪器的样品盘中。
3. 实验条件:设置差热分析仪器的升温速率为10℃/min,起始温度为25℃,终止温度为200℃。
4. 实验记录:通过差热分析仪器自带的软件记录样品随温度的热流量变化。
三、实验结果根据差热分析仪器记录得到的曲线,可以观察到多个峰值和谷底。
通过对这些峰值及谷底进行分析和解读,可以推断未知物质的一些性质和相变过程。
1. 峰值A:在实验过程中,峰值A出现在约60℃的位置,表明未知物质经历了一个温度升高的相变过程。
根据峰值A的面积和曲线形状,可以推断该相变过程为吸热反应。
根据实验条件和未知物质的性质,可以初步猜测此相变为溶解过程。
2. 谷底B:在实验过程中,谷底B处于峰值A之后,约在70℃左右。
根据谷底B的位置和曲线形状,可以推断该位置为峰值A相变过程的后继反应或者其他相变的起始点。
根据实验条件和未知物质的性质,可以初步猜测该相变为晶化过程。
3. 峰值C:在实验过程中,峰值C出现在约120℃的位置。
根据峰值C的面积和曲线形状,可以推断该相变为放热反应。
结合前面的分析,初步推测峰值C可能对应着未知物质的固相和液相之间的相变过程。
4. 峰值D:在实验过程中,峰值D出现在约185℃的位置。
根据峰值D的面积和曲线形状,可以推断该相变为放热反应。
结合前面的分析,初步推测峰值D可能对应着未知物质的熔化过程。
四、讨论和结论通过对实验结果的分析和解读,可以初步推测未知物质为一种溶解性较好的固体物质。
简述差热分析,差示扫描量热分析的基本原理差热分析和差示扫描量热分析(DSC)是测量材料的物理性质的一种常用技术。
它们可以测量和分析材料的热量流失,在加热和冷却过程中材料的温度,以及在这两个过程中发生的化学反应。
这些技术也常用于分析材料的物化特性,如熔点,热容量等。
差热分析是一种根据材料在不同温度下的热导率,来测量材料特性的技术。
它通过控制一个样品在不同温度,以及使用固定的快速热流,来直接测量材料的热传导性能。
它的基本原理是,当样品和热源之间的温度差达到一定的值时,样品会吸收热量,加热;同时,温度差值会随着温度的变化而变化。
差示扫描量热分析(DSC)是一种更加精确的测量技术,它可以测量更小的温度变化,以及更小的热量流失。
它将差热分析中的快速热流替换成一致热流,从而得到更精确的测量结果。
它的基本原理是,在一个固定的温度量程内(由上下限确定),控制一个样品在升温或降温过程中,样品吸收或放出热量,从而使得温度变化,从而得到热量流失的精确值。
在差热分析和差示扫描量热分析的应用中,需要使用专业的仪器来测量和控制温度。
这些仪器可以精确地控制温度,使用户可以在短时间内得到精确的测量结果。
差热分析和差示扫描量热分析是材料特性分析中常用的技术,它们可以测量材料的热量流失,温度变化,以及发生的化学反应。
它们通过精确的控制温度,以及使用固定的快速热流或一致热流,来测量材料的热传导性能,以及材料的物理和化学特性。
同时,它们也可以帮助用户轻松地得到精确的测量结果。
总之,差热分析和差示扫描量热分析是研究材料特性常用的技术,它们的基本原理是,在一定温度差达到一定大小时,样品会吸收或放出热量,从而使得温度变化。
同时,这些技术也需要使用专业的仪器,来获得精确的测量结果。
实验报告差热分析实验名称:差热分析实验目的:通过差热分析仪器测量样品在不同温度下发生的热变化,分析样品的热性能。
实验原理:差热分析(Differential Scanning Calorimetry, DSC)是一种通过比较样品和参比物在温度或时间的变化下的热容量或热流变化的方法。
实验步骤:1. 样品制备:选取待测样品和参比物,将其研磨成粉末。
2. 样品称量:将待测样品和参比物称量,按照一定的比例混合均匀。
3. 样品装填:将混合好的样品装填到差热分析仪的装填盘中。
4. 实验参数设置:根据样品的特性,设置差热分析仪的实验参数,如升温速率、温度范围等。
5. 实验测量:启动差热分析仪,按照设置的升温速率升高温度,记录样品和参比物的热流变化,并输出热流图谱和相变峰温度。
6. 数据分析:根据热流图谱和相变峰温度,分析样品的热性能,如热容量、热稳定性、熔点等。
实验注意事项:1. 样品和参比物需要经过干燥,以保证精确测量。
2. 样品和参比物的比例需要严格按照实验要求,以保证实验的准确性。
3. 实验过程中需要避免样品受到外来影响,如氧化、湿度等。
实验结果及分析:实验后,得到样品和参比物的热流图谱和相变峰温度。
通过分析,可以得到样品的热性能,如热容量、热稳定性、熔点等。
例如,通过差热分析仪器测量聚丙烯样品,得到该样品的热流图谱和相变峰温度如下:图1 聚丙烯样品的热流图谱从图中可以看出,聚丙烯样品在160°C左右发生熔化,熔点为160°C。
图2 聚丙烯样品的相变峰温度从图中可以看出,聚丙烯样品的熔点为160°C,热容为28.1 J/g·°C。
基于这些数据,可以分析出聚丙烯样品的热性能。
差热分析(DTA)
差热分析(DTA)是一种热分析技术,可以通过比较样品和参考样品之间的温度差异来揭示样品的热性能信息。
DTA通常被用于材料的热稳定性、相变温度、焓变化、重量变化等方面的研究。
DTA技术的基本原理是利用热电偶,将样品和参考样品置于同一热环境下,在恒定加热速率下,通过比较两个样品表面的温度差异来监测样品和参考样品之间的热流量差异。
当样品和参考样品中的物质发生热反应或相变时,会引起温度差异,从而在DTA曲线上观察到一个突变点或峰值,可以通过对曲线的分析来确定相变温度、焓变化等信息。
DTA技术在材料学、矿物学、化学、生物学等领域都有广泛的应用。
例如,可以通过DTA技术研究陶瓷的烧结温度、合金的相变温度、聚合物的热稳定性和分解温度、药物的热性质、生化反应中的热效应等等。
此外,DTA技术还可以与其他热分析技术如热重分析(TGA)和差热扫描量热分析(DSC)等相结合,进一步深入研究物质的热性能和物化性质。
在进行DTA分析时,需要注意以下几个方面:首先,样品和参考样品的配比应合适,以确保在热分析过程中二者之间的温度差异是合理的。
其次,选取合适的热分析条件如加热速率、加热温度范围等,以使观测到的热反应信号清晰明确。
最后,分析DTA曲线时,需要结合其他测试方法和材料性质了解样品的具体属性,避免出现误判。
总之,差热分析是一种重要的热分析技术,广泛应用于物质性质的研究和测试中。
在今后的研究中,DTA技术还将进一步发展和完善,支持更广泛、更具有实际意义的应用。
摘要:本实验报告阐述了差热分析实验的基本原理、实验及数据处理方法,以三氧化二铝
(Al2O3)作为参照物,分别测量了五水合硫酸铜(CuSO4·5H2O)和锡(Sn)样品的差热曲线并对其进行了分析,最后对实验结果进行了讨论。
关键词:差热曲线三氧化二铝锡五水合硫酸铜
正文
一、引言
差热分析(DTA)是在程序控制下测量物质和参比物之间的温度差与温度(或时间)关系的一种技术。
描述这种关系的曲线称为差热曲线或DTA曲线。
由于试样和参比物之间的温度差主要取决于试样的温度变化,因此就其本质来说,差热分析是一种主要与焓变测定有关并借此了解物质有关性质的技术。
二、实验目的
1、了解差热分析的基本原理和实验基本步骤。
2、测量五水硫酸铜和锡的差热曲线,并简单计算曲线峰的面积。
三、实验原理
1、差热曲线的形成及差热分析的一般特点
物质在加热或冷却过程中会发生物理变化或化学变化,与此同时,往往还伴随吸热或放热现象。
伴随热效应的变化,有晶型转变、沸腾、升华、蒸发、熔融等物理变化,以及氧化还原、分解、脱水和离解等化学变化。
另有一些物理变化,虽无热效应发生但比热容等某些物理性质也会发生改变,这类变化如玻璃化转变等。
物质发生焓变时质量不一定改变,但温度是必定会变化的。
差热分析正是在物质这类性质基础上建立的一种技术。
若将在实验温区内呈热稳定的已知物质(参比物)和试样一起放入加热系统中(图1),并
图1 加热和测定试样与参比物温度的装置示意图
以线性程序温度对它们加热。
在试样没有发生吸热或放热变化且与程序温度间不存在温度滞后时,试样和参比物的温度与线性程序温度是一致的。
若试样发生放热变化,由于热量不可能从试样瞬间导出,于是试样温度偏离线性升温线,且向高温方向移动。
反之,在试样发生吸热变化时,由于试样不可能从环境瞬间吸取足够的热量,从而使试样温度低于程序温度。
只有经历一个传热过程试样才能回复到与程序温度相同的温度。
在试样和参比物的比热容、导热系数和质量等相同的理想情况,用图1装置测得的试样和参比物的温度及它们之间的温度差随时间的变化如图2所示。
图中参比物的温度始终与程序温度一致,试样温度则随吸热和放热过程的发生而偏离程序温度线。
当T s -T R =ΔT 为零时,因中参比物与试样温度一致,两温度线重合,在ΔT 曲线则为一条水平基线。
图2 线性程序升温时试样和参比物的温度及温度差随时间的变化
试样吸热时ΔT<0,在ΔT 曲线上是一个向下的吸热峰。
当试样放热时ΔT>0,在ΔT 曲线上是一个向上的放热峰。
由于是线性升温,通过了T-t 关系可将ΔT -t 图转换成ΔT -T 图。
ΔT - t(或T) 图即是差热曲线,表示试样和参比物之间的温度差随时间或温度变化的关系。
差热曲线直接提供的信息有峰的位置、峰的面积、峰的形状和个数。
由它们不仅可以对物质进行定性和定量分析,而且还可以研究变化过程的动力学。
曲线上峰的起始温度只是实验条件下仪器能够检测到的开始偏离基线的温度。
根据的规定,该起始温度应是峰前缘斜率最大处的切线与外推基线的交点所对应的温度。
若不考虑不同仪器的灵敏度不同等因素,外推起始温度比峰温更接近于热力学平衡温度。
由差热曲线获得的重要信息之一是它的峰面积。
根据经验,峰面积和变化过程的热效应有着直接联系,而热效应的大小又取决于活性物质的质量。
Speil 指出峰面积与相应过程的焓变成正比:
2
1
()t a a p
t s
m H
A Tdt K m H KQ g l D =D =
=D =ò
式中,A 是差热曲线上的峰面积,由实验测得的差热峰直接得到,K 是系数。
在A 和K 值已知后,即能求得待测物质的热效应Q P 和焓变ΔH 。
四、实验仪器
1、计算机一台,差热分析仪一台
2、三氧化二铝(Al 2O 3)样品,五水合硫酸铜(CuSO 4·5H 2O )样品,锡(Sn )样品
五、实验内容
1、启动计算机,打开差热分析程序。
2、将三氧化二铝和五水硫酸铜样品放进炉子,降下炉体,点击开始试验。
3、将温差△T 置零,升温速率设为10℃/min ,程序开始自动测量温度和温差的变化,观察屏幕上的差热曲线,最后保存实验数据。
4、当差热曲线出现3个峰以后,停止实验。
将升温炉升起,取出五水硫酸铜。
5、当炉内温度降至60度左右时,放入锡样品,再将炉子放下,按照前面的步骤开始试验。
6、关闭电源,整理仪器。
六、实验数据及误差分析
1、五水合硫酸铜
(1)差热曲线如图3所示
图3 五水合硫酸铜差热曲线
可以明显看出曲线有三个峰,其中前两个峰交叠在了一起,在计算峰的面积时要分开计算,使用Origin的多峰分析功能拟合为双高斯函数。
如图四:
图4 五水合硫酸铜前两峰拟合
参数如表1:
表1 五水合硫酸铜前两峰拟合参数同样用Gauss函数拟合第三个峰如图5:
图5 五水合硫酸铜第三个峰拟合参数如表2
表2 五水合硫酸铜第三个峰拟合参数
三个峰的特征温度的 切下拟合如图6
图6五水合硫酸铜三个峰切线拟合
读出
123
72.37C 97.64C 251.67C T T T =︒⎧⎪
=︒⎨⎪=︒⎩ 三个峰的面积是表1、表2中的A ,得到
212223599.622781.781257.82A K A K A K
⎧=⎪=⎨⎪=⎩ 由于Speil 公式中系数未知,所以暂时不能求焓变及热效应。
2、锡
锡的差热曲线如图7所示: 锡的峰明显更尖锐。
图7 锡的差热曲线将峰拟合为洛伦兹函数如图8
图8 锡峰的拟合参数如表3所示:
表3 锡峰的拟合参数
做切线求特征温度如图9:
图7 锡的特征温度拟合
读出T 4=247.06℃,峰面积A 4=1112.75K 2
3、焓变计算
查表得ΔH Sn =7.2kJ/mol ,由于实验中用的参照样品三氧化二铝物质的量始终保持不变,所以Speil 公式中的系数K 不变,五水合硫酸铜在脱水过程中的焓变
44CuSO CuSO Sn Sn
A H H A ∆=∆⨯
计算得
123
3.880/17.999/8.139/H kJ mol H kJ mol H kJ mol ∆=⎧⎪
∆=⎨⎪∆=⎩
4、误差分析
根据有关文献,五水硫酸铜加热至102℃先失去2个水分子,到113℃又失去2个水分子,加热到258℃再失去一个水分子。
可以看出,本次试验误差较大,原因如下: (1)双峰重叠导致拟合不精确。
(2)仪器与外界仍有一部分热交换。
(3)样品之前已经失水,部分变质。
七、思考题
1、为什么差热峰有时向上,有时向下?
答:差热峰的方向和两个因素有关,首先,
差热分析中是以参比物还是试样为基准来算差值
(即T S-T R=ΔT还是T R-T S =ΔT);其次,发生的反应本身是吸热还是放热的。
若以参比物为基准,则放热时ΔT<0,峰向上,吸热时ΔT>0,峰向下;而以试样为基准则是吸热时ΔT>0,峰向上,放热时ΔT<0,峰向下。
在本次实验中以试样为基准,由于是吸热反应,因此差热峰向上。
2、克服基线漂移,可以采取哪些措施?
答:(1)要使基线不发生漂移,要求参比物和试样的热性质、质量、密度等完全相同时才能在试样无任何类型能量变化的相应温区内保持=O。
参比物的导热系数受比热容、密度、温度和装填方式等多种因素的影响,这些因素的变化均能引起差热曲线基线的偏移。
即使同一试样用不同参比物实验,引起的基线偏移也不一样。
为减小试样和参比物在热性质上的明显差异造成的基线漂移,可用试样和参比物均匀混合( 即稀释试样)后使用的方法来减小。
用厚约O.5mm的参比物覆盖试样,也可以减小试样和参比物与环境热交换上的差别,从而提高测量结果的可靠性。
我们在实验过程中要求比较慢的升温速率,最好不超过15度/分钟,另外也可以减少试样的用量。
(2)较慢的升温速率,使体系接近平衡条件,基线漂移小。
(3)试样量小,差热曲线出峰明显、分辨率高,基线漂移也小
3、影响峰高度和峰面积的因素有哪些?
答:试样的导热系数增加,峰高下降。
由于试样装填后的导热能力是由颗粒试样和装填空隙中的气体共同决定的,因此,随着试样容重的改变,装填密度的变化,试样的导热系数也将发生改变。
如果粒度改变引起装填空隙减小,而装填空隙中充满的是导热能力较差的空气时,试样的导热能力将随变大而增大。
从而峰高下降,峰面积也下降。
对于有气体参加或有气体产物的反应,因粒度改变而使气体的扩散阻力增大时,这不仅阻碍反应进行,而且还会加大气体产物在试样周围的局部分压,导致分解压加大而使分解困难。
这时,易使峰高下降、峰宽加大。
在线性升温时,较快的升温速率通常导致向高温移动和峰面积增加。
这是因为若仅考虑升温速率,试样在单位时间内发生转变或反应的量随升温速率增大而增加,从而使转变速率增加。
由于差热曲线从峰返回基线的温度是由时间和试样与参比物间的温度差决定的,所以升温速率增加,曲线返回基线时或热效应结束时的温度均向高温方向移动。
参考文献
黄润生等.近代物理实验(第二版).南京大学出版社。